miRNA与肺癌顺铂耐药相关性的研究进展
2018-04-12综述金玉麟时蒙昆审校
陈 力(综述) 金玉麟 王 琳 时蒙昆 詹 成(审校) 时 雨 王 群
(1复旦大学附属中山医院胸外科 上海 200032; 2四川大学华西医院骨科 成都 610041)
肺癌发病率和死亡率均位居恶性肿瘤的首位,严重威胁人类健康。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最主要的类型,占肺癌总数约85%。我国2015年《非小细胞肺癌临床实践指南》显示,以顺铂为基础的化疗方案被推荐用于NSCLC患者。但某些患者对顺铂具有先天耐药性还有更多早期敏感的患者在顺铂治疗过程中逐渐产生耐药性。近年来多项研究表明,miRNA在肺癌顺铂耐药机制中起着重要的作用,影响着顺铂在细胞内转运、细胞周期、上皮细胞-间质细胞转化(epithelial mesenchymal transition,EMT)、细胞凋亡等。我们通过查阅近年来国内外有关miRNA在肺癌顺铂耐药中作用的相关文献(表1),对其研究进展作一综述。
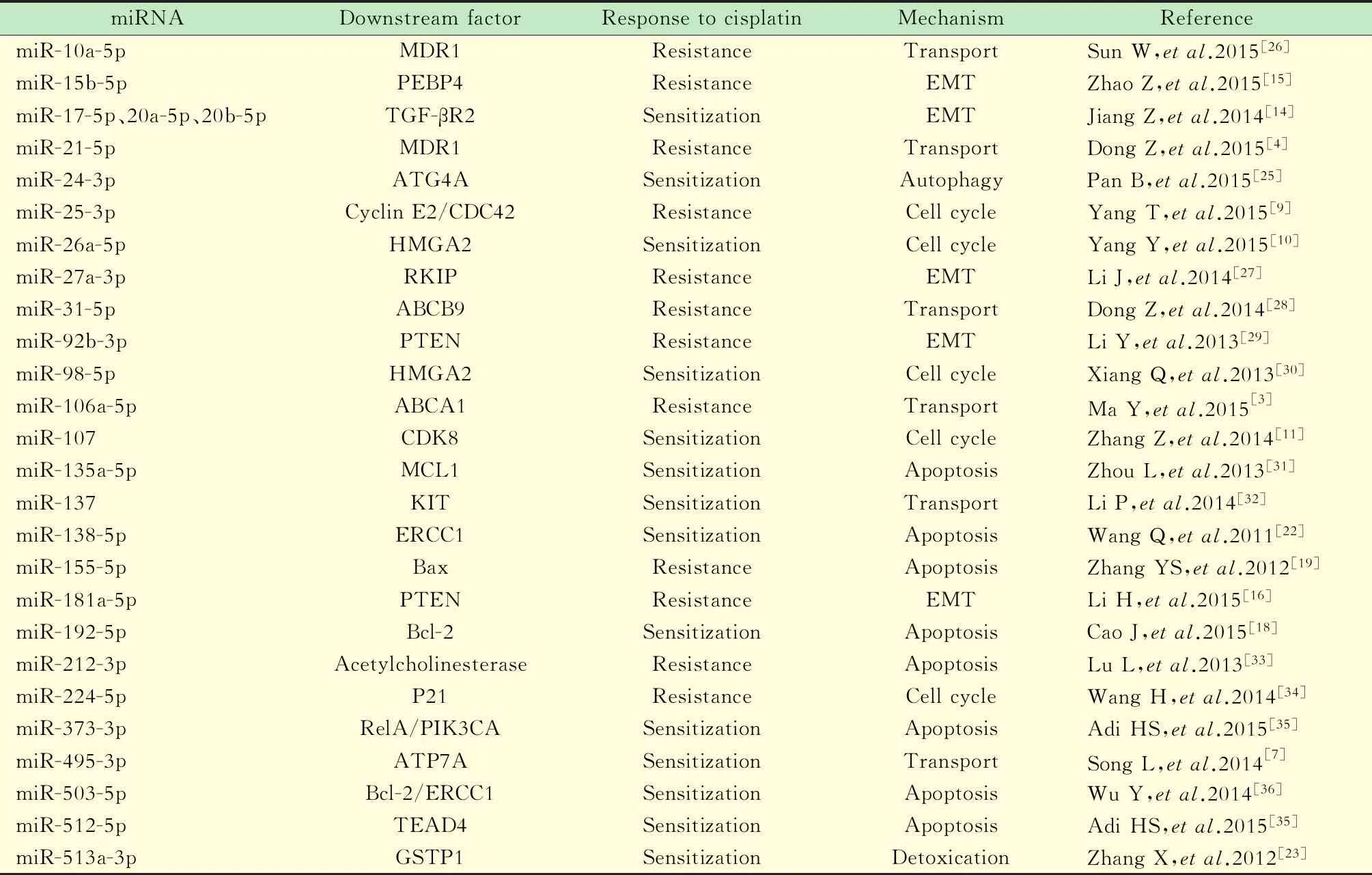
表1 miRNA在肺癌顺铂敏感性的作用Tab 1 Effects of miRNAs in cisplatin resistance of lung cancer
Resistance or sensitization was the response of cisplatin in cells when the miRNA was up-regulated.
顺铂的抗肿瘤作用机制顺铂主要是作用于DNA,与DNA形成加合物,限制DNA的解旋,阻碍DNA的复制,进而抑制癌细胞的分裂,使癌细胞凋亡和坏死。顺铂进入体内,在低氯环境中氯解离,形成水合阳离子,主要与DNA等生物大分子结合形成共价键。DNA上主要的结合位点是A和G的N7,顺铂在理论上可以和这两个位点结合形成链内交联、链间交联、DNA-蛋白质分子间交联,从而使DNA链局部扭结或解旋,阻止DNA聚合酶推进,致使DNA复制、转录失败,造成肿瘤细胞死亡,其中大部分为链内交联,链间交联的形成不足5%,故顺铂抗肿瘤作用是非特异性的[1]。
miRNA在肺癌顺铂耐药中的作用
miRNA对顺铂转运的调节决定顺铂效果的一个关键点是顺铂在细胞内的浓度。细胞大量泵出顺铂,使细胞内顺铂浓度降低,有效作用剂量减少而产生耐药。ABC转运蛋白家族(ATP-binding cassette transporters family)是一组跨膜蛋白,具有ATP结合区域的单向底物转运泵,以主动转运方式完成细胞对顺铂的跨膜转运。Ma等[3]研究发现,在顺铂耐药的A549细胞中,miR-106a-5p的表达量明显高于普通A549细胞,而上调的miR-106a-5p作用于下游因子ABCA1基因,降低ABCA1蛋白的表达量,使得细胞内顺铂的有效浓度降低而诱导顺铂耐药。miR-21-5p在肿瘤的发生发展过程中扮演重要角色,在不同类型肿瘤中的表达均出现明显上升,与肿瘤细胞的侵袭、增殖、血管生成和耐药性等生物学行为相关。研究表明,沉默肺癌细胞的miR-21-5p基因可使多药耐药1(multiple drug resistance 1,MDR1)基因表达产物P-糖蛋白(P-glycoprotein,P-gp)降低,而P-gp在肿瘤细胞中外泵顺铂的作用明确,因此沉默miR-21-5p最终导致肺癌细胞对顺铂的敏感性提高[4]。
铜转运P型三磷酸腺苷ATP7A和ATP7B是一对同源异构体,组织分布不同,是目前公认的促使铂类药物流出细胞的转运蛋白,ATP7A 和ATP7B 蛋白在顺铂耐药的细胞中明显高表达[5-6]。Song等[7]研究发现,miR-495-3p可靶向下调ATP7A,使细胞内顺铂的有效浓度上升,从而致使细胞对顺铂的敏感性增强。
miRNA对细胞周期的调节周期蛋白依赖性蛋白激酶(cyclin-dependent kinases,CDK)是一组丝氨酸/苏氨酸蛋白激酶,和周期蛋白cyclin协同作用,是细胞周期调控中的重要因子。Cyclin E是G1期的周期蛋白,cyclin E与CDK2结合在G1期末发挥作用,促进细胞进入S期。Cyclin E-Cdk2在肿瘤细胞中的表达量常高于正常细胞,可能与其高表达促进肿瘤发生发展相关。miR-25-3p是一个在NSCLC和小细胞肺癌中都高表达的致癌基因。Zhao等[8]在小细胞肺癌细胞和肿瘤组织中发现miR-25-3p表达量增高,在H510A细胞中下调miR-25-3p的表达可以降低肿瘤细胞对顺铂的耐药性,同时降低其生长速度和侵袭能力。究其原因主要是下调miR-25-3p能导致下游因子cdk2和Cyclin E的表达量降低,从而诱导G1期细胞阻滞。另有研究表明,在NSCLC中,miR-25-3p也可以作用于CDC42基因,通过下调miR-25-3p能上调CDC42基因的表达导致G1期细胞阻滞,从而增强肿瘤细胞对顺铂的敏感性[9]。
Yang等[10]在研究顺铂耐药的NSCLC细胞中证实miRNA有抑制细胞周期G1/S期转换的作用。上调miR-26a-5p可以靶向抑制高迁移率族蛋白A2(high mobility group A2,HMGA2),从而抑制转录因子E2F1的活化,减弱E2F1促进细胞周期G1/S转换的功能,从而增强肺癌细胞对顺铂的敏感性。Zhang等[11]通过荧光定量PCR和Western blot分析发现NSCLC组织中miR-107表达与正常组织明显不同。人工合成的miR-107激活剂作用于顺铂耐药A549细胞后,CDK8表达下降,对顺铂的敏感性增加。该研究表明miR-107可以作为NSCLC顺铂化疗的新型调节剂。
miRNA对EMT的调节通过EMT,上皮细胞失去细胞极性以及与基底膜连接等上皮表型,获得了具有较高迁移与侵袭、抗凋亡和降解细胞外基质等能力的间质表型。EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程[12]。EMT的特点是使细胞丧失黏附能力,降低上皮标志物的表达,提高间质性标志物的表达水平,导致细胞对细胞毒药物和凋亡调节产生耐受。EMT是NSCLC细胞对顺铂产生耐药的重要原因之一[13]。转化生长因子β(transforming growth factor β,TGF-β)是EMT最主要的诱导因子之一,在胚胎发育、肿瘤转移和纤维化等不同生物学过程中调节EMT的发生和发展。Jiang等[14]研究发现,在耐顺铂的NSCLC细胞中上调miR-17-5p、miR-20a-5p及miR-20b-5p,能靶向抑制TGF-β信号通路中的TGF-βR2,从而增强肿瘤细胞对顺铂的敏感性并减弱肿瘤细胞的转移和侵袭能力。miR-15b-5p可以在体内外肺腺癌细胞中靶向作用于脂酰乙醇胺结合蛋白4(phosphatidylethanolamine-binding protein 4,PEBP4)基因,下调PEBP4可以调节EMT过程,从而导致顺铂耐药性增强[15]。Li等[16]发现miR-181a-5p在耐药和敏感的A549细胞中表达差异显著,将miR-181a-5p的激活剂和抑制剂作用于顺铂耐药的A549细胞后,细胞的转移能力、侵袭性以及EMT相关基因的表达量明显不同。该研究表明,上调miR-181a-5p将靶向作用于抑癌基因PTEN,使其表达量下降,导致肺腺癌细胞对顺铂耐药性增强。
miRNA对细胞凋亡的调节细胞凋亡是细胞内部有组织的程序性死亡过程,激活细胞膜表面的死亡受体(外源性途径),或通过以线粒体为中心的胞内事件(内源性途径),均可诱导凋亡。目前研究表明,多种机制导致肿瘤细胞对顺铂诱导的细胞内部或外部损伤不敏感,出现凋亡缺陷,此时顺铂不足以激活肿瘤细胞的死亡信号,因而导致肺癌细胞对顺铂的耐药性产生。
在细胞凋亡过程中,Bcl-2家族成员起着至关重要的作用。Bcl-2家族可以分为两大类,一类是抗凋亡的,主要有Bcl-2、Bcl-XL、Bcl-W、Mcl-1、CED9等,另一类是促细胞死亡的,主要有Bax、Bak、Bcl-XS、Bad、Bik、Bid等。Bcl-2蛋白被认为是NSCLC的预后影响因子[17]。Cao等[18]通过利用MTT比色法、实时荧光定量PCR和Western blot研究顺铂耐药的A549细胞的生存能力及miR-192-5p和bcl-2的表达水平时发现,顺铂耐药的A549细胞中miR-192-5p的表达水平明显低于正常细胞,miR-192-5p主要作用于Bcl-2,抑制miR-192-5p使Bcl-2蛋白表达量明显增高,导致细胞凋亡受阻,从而产生耐药性。有研究表明,下调A549细胞中miR-155-5p表达,可导致促凋亡蛋白Bax的表达量增加,导致顺铂诱导的A549细胞的凋亡作用增强,顺铂敏感性增强[19]。还有报道,miR-196a-5p、miR-363-5p通过调节Bcl-2家族蛋白的表达量,调控顺铂诱导的细胞凋亡,从而影响顺铂化疗的作用[20-21]。
核苷酸切除修复(nucleotide excision repair,NER)是清除DNA结合的顺铂加合物和修复DNA损伤的最主要方式。研究表明,切除修复交叉互补基因-1 ( excision repair cross complementing gene 1,ERCC1)由于其较强的损伤识别与修复能力被认为是NER途径的关键因子。研究表明,上调miR-138-5p能显著降低ERCC1的表达量,减弱DNA损伤修复功能,增强顺铂诱导的凋亡作用,导致细胞对顺铂的敏感性增强[22]。
miRNA在肺癌顺铂耐药中的其他作用顺铂进入细胞之后,易与含硫的分子结合,如谷胱甘肽(glutathione,GSH)、金属硫蛋白(metallothionein,MT)等。细胞内富含的大量GSH与顺铂结合后,可使顺铂停留在细胞质而不能进入细胞核与其靶点DNA作用,从而降低顺铂的毒性。GSH不仅可以和顺铂共价结合,这种作用还能被谷胱甘肽-S-转移酶(glutathione-s-transferase,GST)所催化。有研究发现,耐药的A549/DDP细胞中GSTP1的表达水平是正常A549细胞的2.7倍,而miR-513a-3p的表达水平却是正常细胞的34%。该研究表明,GSTP1受miR-513a-3p靶向调控。上调miR-513a-3p能降低GSTP1的表达,从而减弱细胞对顺铂的解毒作用,使顺铂的敏感性增强[23]。因此,在顺铂化疗的肺癌中miRNA对GST及GSH的调控作用是导致顺铂耐药重要途径之一。
此外,当接触化疗药物后,细胞自噬可及时清除细胞内的有害物质,并提供应急的底物和能量为修复损伤赢得时间和条件,从而保护肿瘤细胞免于发生坏死或调亡,以维持肿瘤细胞的持续生存[24]。研究发现,在依托泊苷和顺铂联合化疗的H446耐药细胞中,miR-24-3p的表达量明显降低,而细胞自噬现象更加活跃。进一步研究表明,下调miR-24-3p是通过靶向上调自噬相关基因4A(autophagy associated gene 4A,ATG4A)的表达,导致自噬作用增强,从而降低化疗药物的敏感性[25]。
结语顺铂在抗肿瘤药中属于研发较早、临床应用较成熟的一种药物,但内在的和获得性的耐药性限制了顺铂在临床上的应用。目前miRNA在肺癌顺铂耐药性中的研究尚处于起步阶段。正常情况下,细胞内各种蛋白的水平通过miRNA的精细调节网络维持在平衡状态。miRNA的多态性及异常表达可导致肺癌细胞耐药相关通路的基因表达水平及肿瘤细胞周期发生改变,从而打破原有的平衡,进而改变肺癌细胞对顺铂的敏感性,导致耐药现象。随着对miRNA与肺癌顺铂耐药性的研究不断深入,以期寻求新的治疗策略来克服肺癌顺铂耐药性,对肺癌的临床治疗具有重大的意义。
[1]WANG HF,LIU ZP.Comprehensive mechanism and structure-sensitivity of ethanol oxidation on platinum:new transition-state searching method for resolving the complex reaction network[J].JAmChemSoc,2008,130(33):10996-11004.
[2]FENNELL DA,SUMMERS Y,CADRANEL J,etal.Cisplatin in the modern era:the backbone of first-line chemotherapy for non-small cell lung cancer[J].CancerTreatRev,2016,44:42-50.
[3]MA Y,LI X,CHENG S,etal.MicroRNA-106a confers cisplatin resistance in non-small cell lung cancer A549 cells by targeting adenosine triphosphatase-binding cassette A1[J].MolMedRep,2015,11(1):625-632.
[4]DONG Z,REN L,LIN L,etal.Effect of microRNA-21 on multidrug resistance reversal in A549/DDP human lung cancer cells[J].MolMedRep,2015,11(1):682-690.
[5]ZHANG Y,MAURIZI MR.Mitochondrial ClpP activity is required for cisplatin resistance in human cells[J].BiochimBiophysActa,2016,1862(2):252-264.
[6]CALANDRINI V,ARNESANO F,GALLIANI A,etal.Platination of the copper transporter ATP7A involved in anticancer drug resistance[J].DaltonTrans,2014,43(31):12085-12094.
[7]SONG L,LI Y,LI W,etal.miR-495 enhances the sensitivity of non-small cell lung cancer cells to platinum by modulation of copper-transporting P-type adenosine triphosphatase A (ATP7A)[J].JCellBiochem,2014,115(7):1234-1242.
[8]ZHAO Z,LIU J,WANG C,etal.MicroRNA-25 regulates small cell lung cancer cell development and cell cycle through cyclin E2[J].IntJClinExpPathol,2014,7(11):7726-7734.
[9]YANG T,CHEN T,LI Y,etal.Downregulation of miR-25 modulates non-small cell lung cancer cells by targeting CDC42[J].TumourBiol,2015,36(3):1903-1911.
[10]YANG Y,ZHANG P,ZHAO Y,etal.Decreased MicroRNA-26a expression causes cisplatin resistance in human non-small cell lung cancer[J].CancerBiolTher,2016,3(17):515-525.
[11]ZHANG Z,ZHANG L,YIN ZY,etal.miR-107 regulates cisplatin chemosensitivity of A549 non small cell lung cancer cell line by targeting cyclin dependent kinase 8[J].IntJClinExpPathol,2014,7(10):7236-7241.
[12]CEPPI P,MUDDULURU G,KUMARSWAMY R,etal.Loss of miR-200c expression induces an aggressive,invasive,and chemoresistant phenotype in non-small cell lung cancer[J].MolCancerRes,2010,8(9):1207-1216.
[13]SU HY,LAI H C,LIN YW,etal.Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway[J].IntJCancer,2010,127(3):555-567.
[14]JIANG Z,YIN J,FU W,etal.MiRNA 17 family regulates cisplatin-resistant and metastasis by targeting TGFbetaR2 in NSCLC[J].PLoSOne,2014,9(4):e94639.
[15]ZHAO Z,ZHANG L,YAO Q,etal.miR-15b regulates cisplatin resistance and metastasis by targeting PEBP4 in human lung adenocarcinoma cells[J].CancerGeneTher,2015,22(3):108-114.
[16]LI H,ZHANG P,SUN X,etal.MicroRNA-181a regulates epithelial-mesenchymal transition by targeting PTEN in drug-resistant lung adenocarcinoma cells[J].IntJOncol,2015,47(4):1379-1392.
[17]SCHMIDT L H,GORLICH D,SPIEKER T,etal.Prognostic impact of Bcl-2 depends on tumor histology and expression of MALAT-1 lncRNA in non-small-cell lung cancer[J].JThoracOncol,2014,9(9):1294-1304.
[18]CAO J,HE Y,LIU HQ,etal.MicroRNA 192 regulates chemo-resistance of lung adenocarcinoma for gemcitabine and cisplatin combined therapy by targeting Bcl-2[J].IntJClinExpMed,2015,8(8):12397-12403.
[19]ZANG YS,ZHONG YF,FANG Z,etal.MiR-155 inhibits the sensitivity of lung cancer cells to cisplatin via negative regulation of Apaf-1 expression[J].CancerGeneTher,2012,19(11):773-778.
[20]LI JH,LUO N,ZHONG MZ,etal.Inhibition of microRNA-196a might reverse cisplatin resistance of A549/DDP non-small-cell lung cancer cell line[J].TumourBiol,2016,37(2):2387-2394.
[21]OU Y,ZHAI D,WU N,etal.Downregulation of miR-363 increases drug resistance in cisplatin-treated HepG2 by dysregulating Mcl-1[J].Gene,2015,572(1):116-122.
[22]WANG Q,ZHONG M,LIU W,etal.Alterations of microRNAs in cisplatin-resistant human non-small cell lung cancer cells (A549/DDP)[J].ExpLungRes,2011,37(7):427-434.
[23]ZHANG X,ZHU J,XING R,etal.miR-513a-3p sensitizes human lung adenocarcinoma cells to chemotherapy by targeting GSTP1[J].LungCancer,2012,77(3):488-494.
[24]WU WK,COFFELT SB,CHO CH,etal.The autophagic paradox in cancer therapy[J].Oncogene,2012,31(8):939-953.
[25]PAN B,CHEN Y,SONG H,etal.Mir-24-3p downregulation contributes to VP16-DDP resistance in small-cell lung cancer by targeting ATG4A[J].Oncotarget,2015,6(1):317-331.
[26]SUN W,MA Y,CHEN P,etal.MicroRNA-10a silencing reverses cisplatin resistance in the A549/cisplatin human lung cancer cell line via the transforming growth factor-beta/Smad2/STAT3/STAT5 pathway[J].MolMedRep,2015,11(5):3854-3859.
[27]LI J,WANG Y,SONG Y,etal.miR-27a regulates cisplatin resistance and metastasis by targeting RKIP in human lung adenocarcinoma cells[J].MolCancer,2014,13:193.
[28]DONG Z,ZHONG Z,YANG L,etal.MicroRNA-31 inhibits cisplatin-induced apoptosis in non-small cell lung cancer cells by regulating the drug transporter ABCB9[J].CancerLett,2014,343(2):249-257.
[29]LI Y,LI L,GUAN Y,etal.MiR-92b regulates the cell growth,cisplatin chemosensitivity of A549 non small cell lung cancer cell line and target PTEN[J].BiochemBiophysResCommun,2013,440(4):604-610.
[30]XIANG Q,TANG H,YU J,etal.MicroRNA-98 sensitizes cisplatin-resistant human lung adenocarcinoma cells by up-regulation of HMGA2[J].Pharmazie,2013,68(4):274-281.
[31]ZHOU L,QIU T,XU J,etal.miR-135a/b modulate cisplatin resistance of human lung cancer cell line by targeting MCL1[J].PatholOncolRes,2013,19(4):677-683.
[32]LI P,MA L,ZHANG Y,etal.MicroRNA-137 down-regulates KIT and inhibits small cell lung cancer cell proliferation[J].BiomedPharmacother,2014,68(1):7-12.
[33]LU L,ZHANG X,ZHANG B,etal.Synaptic acetylcholinesterase targeted by microRNA-212 functions as a tumor suppressor in non-small cell lung cancer[J].IntJBiochemCellBiol,2013,45(11):2530-2540.
[34]WANG H,ZHU LJ,YANG YC,etal.MiR-224 promotes the chemoresistance of human lung adenocarcinoma cells to cisplatin via regulating G(1)/S transition and apoptosis by targeting p21(WAF1/CIP1)[J].BrJCancer,2014,111(2):339-354.
[35]ADI HS,BOSSEL BN,AYLON Y,etal.Reactivation of epigenetically silenced miR-512 and miR-373 sensitizes lung cancer cells to cisplatin and restricts tumor growth[J].CellDeathDiffer,2015,22(8):1328-1340.
[36]WU Y,GUO L,LIU J,etal.The reversing and molecular mechanisms of miR-503 on the drug-resistance to cisplatin in A549/DDP cells[J].ZhongguoFeiAiZaZhi,2014,17(1):1-7.
