呋喃唑酮代谢物间接竞争酶联免疫检测方法的研究
2018-04-12史晓亚高丽霞黄登宇
史晓亚, 高丽霞, 黄登宇
1(山西大学 生命科学学院, 山西 太原, 030006) 2(山西大学,食品药品快速检测中心, 山西 太原,030006)3(山西省食品药品监督管理局, 山西 太原,030006)
硝基呋喃类药物是一类人工合成的具有5-硝基呋喃特征环结构的广谱抗菌药,包括呋喃唑酮、呋喃它酮、呋喃妥因和呋喃西林[1-3]。由于其抗菌谱广且不易产生耐药性,故被广泛应用于禽畜水产养殖中[4-7]。呋喃唑酮经动物摄取后被迅速代谢,其产物3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone, AOZ)和细胞膜蛋白结合成稳定的残留物[8],研究表明呋喃唑酮及其代谢产物能使机体诱变进一步致癌,严重影响机体健康[9-10],很多国家禁止使用呋喃唑酮,我国农业部第193号和235号公告中要求呋喃唑酮及其代谢物在动物性食品中不得检出[11-12]。但由于其抗菌效果好,价格低廉,仍被非法使用。
目前对于呋喃唑酮代谢物AOZ的检测方法多为仪器法,如高效液相色谱法[13,14]、液相色谱-质谱联用法[15-17]等,此外还有胶体金免疫层析法[18]、紫外-可见分光光度法[19]、酶免疫分析法[20-22]等。酶免疫分析法属于安全的免疫学方法,该法的技术原理决定了其具有较高的分析灵敏度,常用于动物性食品兽药残留检测中,可用于大量样品的快速筛查[23]。本研究所建立的酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)[24-25]是一种基于抗原抗体特异性结合,再通过酶底物显色从而反应待测物含量的定量或定性的酶免疫分析方法,操作简单、检测速度快、特异性强、不需要昂贵的仪器,能够用于大批量样品的快速筛查,并且为AOZ快速检测试剂盒的进一步优化提供理论基础。
1 实验材料与方法
1.1 材料与仪器
猪肉,市购。
3-氨基-2-恶唑烷酮(AOZ)(99.0%),N,N-二甲基甲酰胺(DMF)(≥99%),N,N’-二环已基碳二亚胺(DCC)(99%),N-羟基琥珀酰亚胺(NHS)(≥97.0%),卵清蛋白(OVA)(≥98%),3-(2-硝基苯亚甲基)-氨基-2-恶唑烷酮(NPAOZ)(99.7%)(美国Sigma公司);AOZ单克隆抗体,辣根过氧化物酶标记羊抗鼠二抗(HRP-IgG)(北京艾旗斯德科技有限公司);KH2PO4(AR),Na2CO3(AR),Na2HPO4·12H2O(AR)(天津市科密欧化学试剂有限公司);NaHCO3(AR)(天津市北辰方正化学试剂厂);吐温-20(AR)(天津市光复化学试剂厂)。
电子天平 BSA224S,pH计(PB-10),德国Sartorius;超纯水机 UPT-I-10T,优普纯科技有限公司;600 MHz核磁共振仪 BRUKER AVANCE III,德国Bruker公司;紫外/可见分光光度计(UV-1600),安徽中科中佳科学仪器有限公司;傅里叶变换红外光谱仪(NICOLET 380),美国Thermo公司;漩涡混匀器 VORTEX GENIUS3,德国IKA公司;恒温培养箱(BSD-100),上海博讯实业有限公司;多功能酶标仪(Infinite M200 PRD),瑞士Tecan公司;离心机(SC-3610),安徽中科中佳科学仪器有限公司。
1.2 实验方法
1.2.1合成半抗原3-(4-羧基苯亚甲基)-氨基-2-恶唑烷酮(3-{[(4-carboxyphenyl) methylene]amino}-2-oxazolidinone,CPAOZ)(图1)
称取40.8 mg(0.4 mmol)AOZ溶到1 mL 1 mol/L的HCl中,漩涡混匀让其快速溶解;称量4-CBA 60 mg(0.4 mmol)溶到1 mL DMF中;将上述两种溶液混合,室温条件搅拌反应2 d, 之后于4 800 r/min离心25 min, 去掉上清液,乙醇洗涤3次,每次洗涤后于8 000 r/min离心1 min,进行烘干并避光保存。
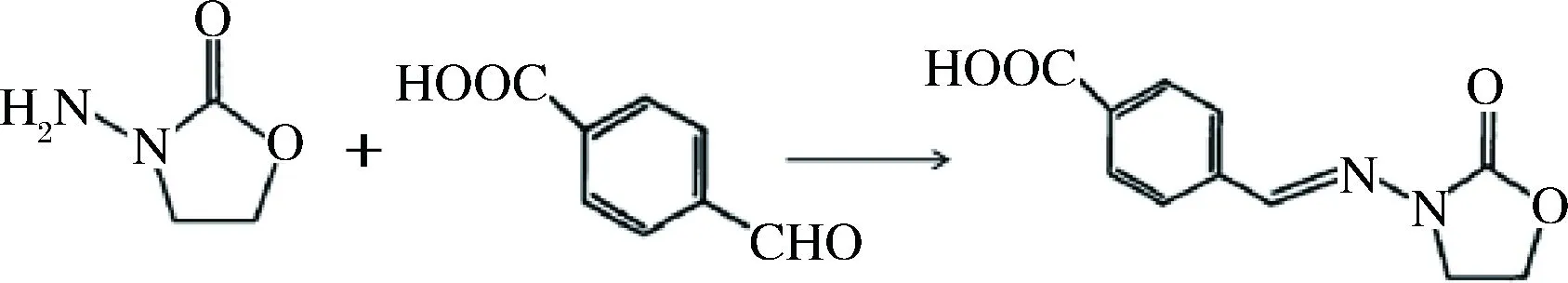
图1 CPAOZ合成示意图Fig.1 The synthesis process of CPAOZ
1.2.2包被原CPAOZ-OVA合成
采用活化酯法:称取5.9 mg (25 μmol) CPAOZ,5.1mg (25 μmol) DCC,2.9 mg (20 μmol) NHS溶到1 mL DMF中,室温下避光反应18 h,定为A液;称量11.3 mg (0.25 μmol) OVA溶到1 m LPBS里,定为B液;把A液和B液混合,室温下搅拌反应3 h,再把此混合液倒入透析袋,并放入PBS缓冲液中于4 ℃透析3 d,每隔8 h换一次透析液,且透析液需提前置于4 ℃冰箱中。透析结束后移取透析袋中的上清液,并于4 ℃保存用于鉴定。
1.2.3AOZ间接竞争ELISA操作步骤
包被原CPAOZ-OVA用CBS稀释一定倍数后,使用酶标板按100 μL/孔将其加入并在4 ℃中包被过夜,用PBST洗液洗板,之后加入200 μL/孔封闭液,37 ℃下进行2 h 封闭;洗板拍干操作同上,按照50 μL/孔的量加NPAOZ溶液和50 μL/孔的单克隆抗体,37 ℃下竞争反应一段时间;洗板拍干操作同上,按100 μL/孔的量加入稀释一定倍数的HRP-IgG,37 ℃下孵育一定时间;洗板拍干操作同上,按100 μL/孔的量加入显色底物液,并立即于室温下避光反应即显色一定时间;按50 μL/孔的量加入H2SO4终止液,使显色反应终止,使用酶标仪测波长为450 nm时的OD值。
1.2.4间接竞争ELISA条件优化
1.2.4.1包被原CPAOZ-OVA和单克隆抗体的稀释倍数组合
采用棋盘法,包被原稀释倍数依次为400, 800, 1 600, 3 200, 6 400, 12 800, 25 600, 51 200;单克隆抗体稀释倍数一次为400,800,1 600,3 200,6 400,12 800。按照2.2.3的步骤操作,测定吸光度值,封闭液设为2%脱脂乳,37 ℃下封闭2 h,不添加NPAOZ,竞争反应0.5 h,酶标二抗HRP-IgG孵育0.5 h,显色时间20 min,每组实验3次重复,求平均值,确定吸光度值为1附近的组合为最优的包被原和单克隆抗体最佳稀释倍数组合。
1.2.4.2优化封闭液浓度、竞争时间、酶标二抗孵育时间、显色反应时间
配制脱脂乳粉质量浓度为5.0、10.0、20.0、30.0 g/L作为封闭液,竞争时间为15、30、60、90 min,HRP-IgG的孵育时间为15、30、45、60 min,显色反应时间10、15、20、25 min,操作步骤同2.2.3,绘标准曲线,计算IC50和ODmax/IC50确定最优参数。
1.2.5方法评价
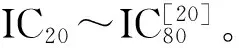
(2)特异性。将NPAOZ的结构类似物AOZ、AHD、SEM、AMOZ及其相应衍生物NPAHD、NPSEM、NPAMOZ、4-CBA及2-NPA各自配制成同2.2.5(1) 中NPAOZ浓度梯度相同的浓度测定, 最后求交叉反应率CR。

(1)
(3)准确度和精密度。对猪肉进行酶免疫法的添加回收试验,每一添加浓度做5个重复,计算批内变异系数(CV);重复检测5个批次,求批间变异系数,同时求添加回收率。同时对同一批空白猪肉采用国标方法进行添加回收试验,与本研究建立的方法的准确度进行比较。 样品前处理操作参照我国标准SN/T 3380—2012[26],同时参照国家标准GB/T 21311—2007及GB/T 200752—2006中的HPLC-MS/MS法[27-28]。

(2)

(3)
2 结果与分析
2.1 半抗原CPAOZ合成鉴定


图2 CPAOZ的红外光谱图Fig.2 The infrared absorbance spectrum of CPAOZ
核磁共振鉴定。进一步确定CPAOZ会否合成成功,对半抗原CPAOZ的核磁共振1H-NMR图谱如图3,13C-NMR图谱图4。
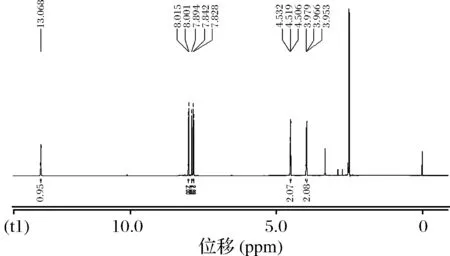
图3 CPAOZ的1H-NMR波谱图Fig.3 The 1H-NMR of CPAOZ
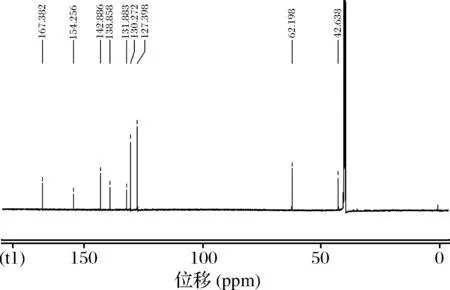
图4 CPAOZ的13C-NMR波谱图Fig.4 The 13C-NMR of CPAOZ
对二者分析如下:1H NMR(600 Hz, DMSO-d6):13.068(s, 1H), 8.015(d, 2H), 7.894(s, 1H), 7.842(d, 2H), 4.519(t, 2H), 3.966(t, 2H);其中,7.894(s, 1H)位置表明合成成功。13C NMR (150 MHz, DMSO-d6) :167.382, 154.256, 142.886, 138.858, 13.883, 130.272, 127.398, 62.198, 42.638,表明半抗原合成成功。
2.2 包被原CPAOZ-OVA的鉴定
在220~400 nm 范围内对CPAOZ、OVA、CAOZ-OVA进行紫外扫描,谱图如图5。其中,CPAOZ的特征吸收峰在292 nm处,OVA吸收峰在279 nm处,CPAOZ-OVA的吸收峰在284 nm处,可见CPAOZ-OVA相对于CPAOZ和OVA的吸收峰发生了明显的偏移,且兼具了后两者的特征吸收,可初步证明包被原CPAOZ-OVA合成成功。
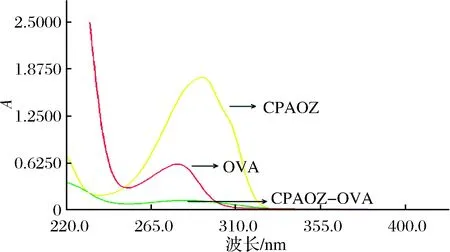
图5 CPAOZ-OVA、CPAOZ、OVA的紫外扫描图Fig.5 The UV spectrum of CPAOZ-OVA, CPAOZ, OVA
2.3 反应条件的优化
2.3.1包被原NPAOZ-OVA和单克隆抗体的最优稀释倍数
包被原NPAOZ-OVA和单克隆抗体按棋盘法组合测得的结果见表1。
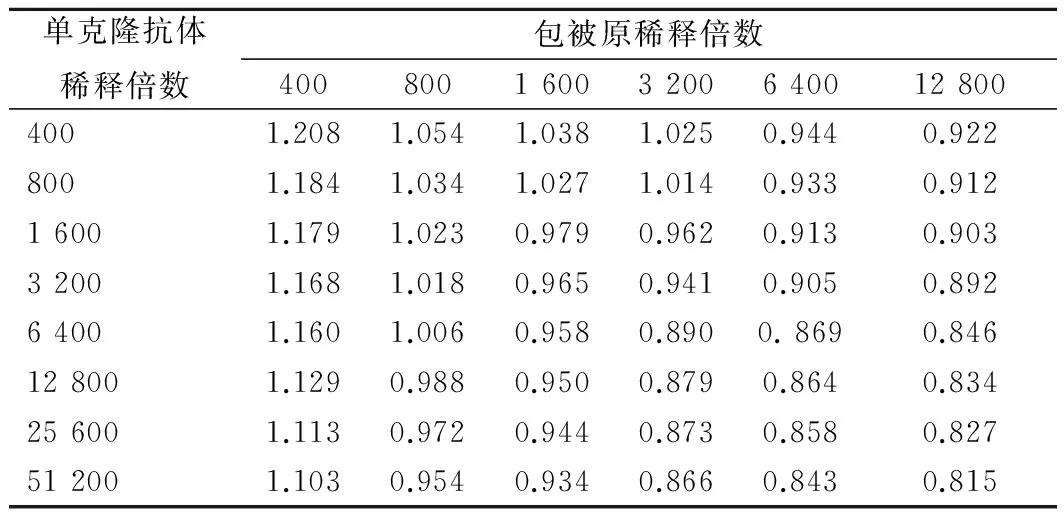
表1 包被原和单克隆抗体棋盘法稀释倍数组合下的OD值Table 1 The OD values of different dilution of coatingantigen and monoclonal antibody by checkerboardmethod combination
当包被原和单克隆抗体稀释倍数各自扩大时,吸光度值表现为降低趋势。在ELISA法中,当OD值接近于1时反应的灵敏度较高。因此确定包被原CPAOZ-OVA和单克隆抗体稀释倍数分别为800倍和6 400倍时为最佳,同时与包被原稀释倍数和单克隆抗体稀释倍数分别为800、3 200时的OD值1.018相比,前者的抗体倍数大点,可节省单克隆抗体的使用成本。故选择包被原CPAOZ-OVA和单克隆抗体稀释倍数分别为800倍和6 400倍。
2.3.2封闭液浓度、竞争时间、HRP-IgG孵育时间和显色时间优化
不同脱脂乳质量浓度下的IC50和ODmax/IC50数据见图6 ,当脱脂乳粉质量浓度为10 g/L时,IC50的值最小,且ODmax/IC50最大;当浓度为20 g/L时,IC50较小且ODmax/IC50较大时灵敏度较高,故选脱脂乳质量浓度为10 g/L为最佳封闭液质量浓度。不同竞争时间、HRP-IgG孵育时间和显色时间的数据见图7~图9,同理可得出竞争时间为60 min、HRP-IgG孵育时间为45 min、显色时间为15 min为最佳条件。

图6 ELISA法脱脂乳粉质量浓度的优化Fig.6 Optimization of skim milk powder concentrationfor ELISA

图7 ELISA法竞争反应时间的优化Fig.7 Optimization of competitive reaction time for ELISA
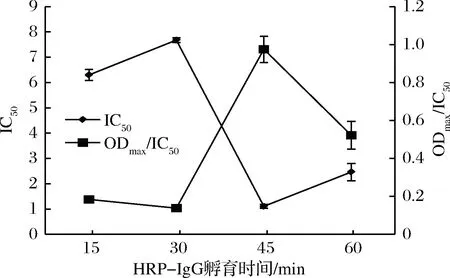
图8 ELISA HRP-IgG孵育时间优化Fig.8 Optimization of HRP-IgG incubating time for ELISA

图9 ELISA底物显色时间的优化Fig.9 Optimization of substrate colouration time for ELISA
2.4 方法学评价
2.4.1灵敏度
按最优条件进行实验,建立的标准曲线见图10,该方法的线性方程是Y=-0.253X+1.336(R2=0.995),半数抑制浓度IC50是2.015 ng/mL,线性范围在0.131~30.911 ng/mL之间。

图10 AOZ标准曲线Fig.10 Standard curve of AOZ
2.4.2特异性
由表2知,本研究中建立的酶联免疫法NPAOZ的其他结构相似物及衍生化试剂2-NPA、4-CBA的CR都小于0.1%,说明AOZ单克隆抗体的特异性较好,检测中不容易出现交叉反应[29]。
2.4.3准确度及精密度
对空白猪肉样品进行添加回收实验,样品经前处理后, 用所建立的ELISA法进行检测, 测定结果见表3.添加回收率在84.8%~90.3%间,批内CV在3.3%~4.1%,批间CV在4.6%~6.7%。HPLC-MS/MS法对应的标准曲线如图11,线性拟合后的方程是Y=42.82X+18.12(R2=0.999)。添加回收率结果见表4,其回收率在84.4%~95.4%,CV在3.0%~10.1%。通过比较表4数据可看到,HPLC-MS/MS法的添加回收率比ELISA法高,表现出仪器检测法的准确度高的优势,但两种方法结果均在85%~115%范围内,表明本实验建立的ELISA法的准确性、精密度和重现性均良好[29], 符合兽药残留检测分析的要求。
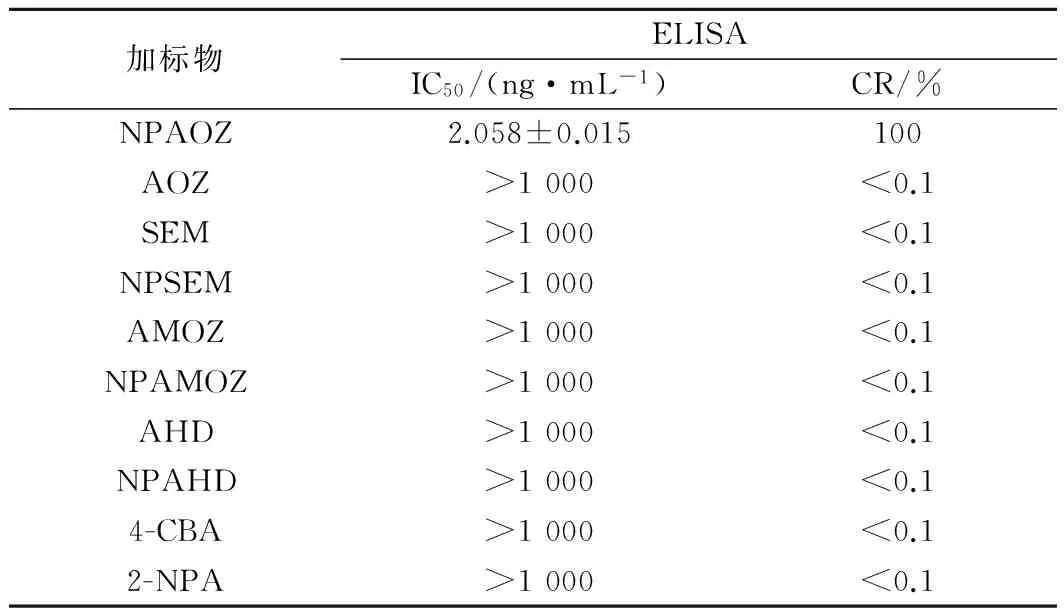
表2 特异性测定结果Table 2 Determination results of specificity

表3 酶免疫法准确度和精密度测定结果Table 3 Results for accuracy and precision forImmunal enzyme methods
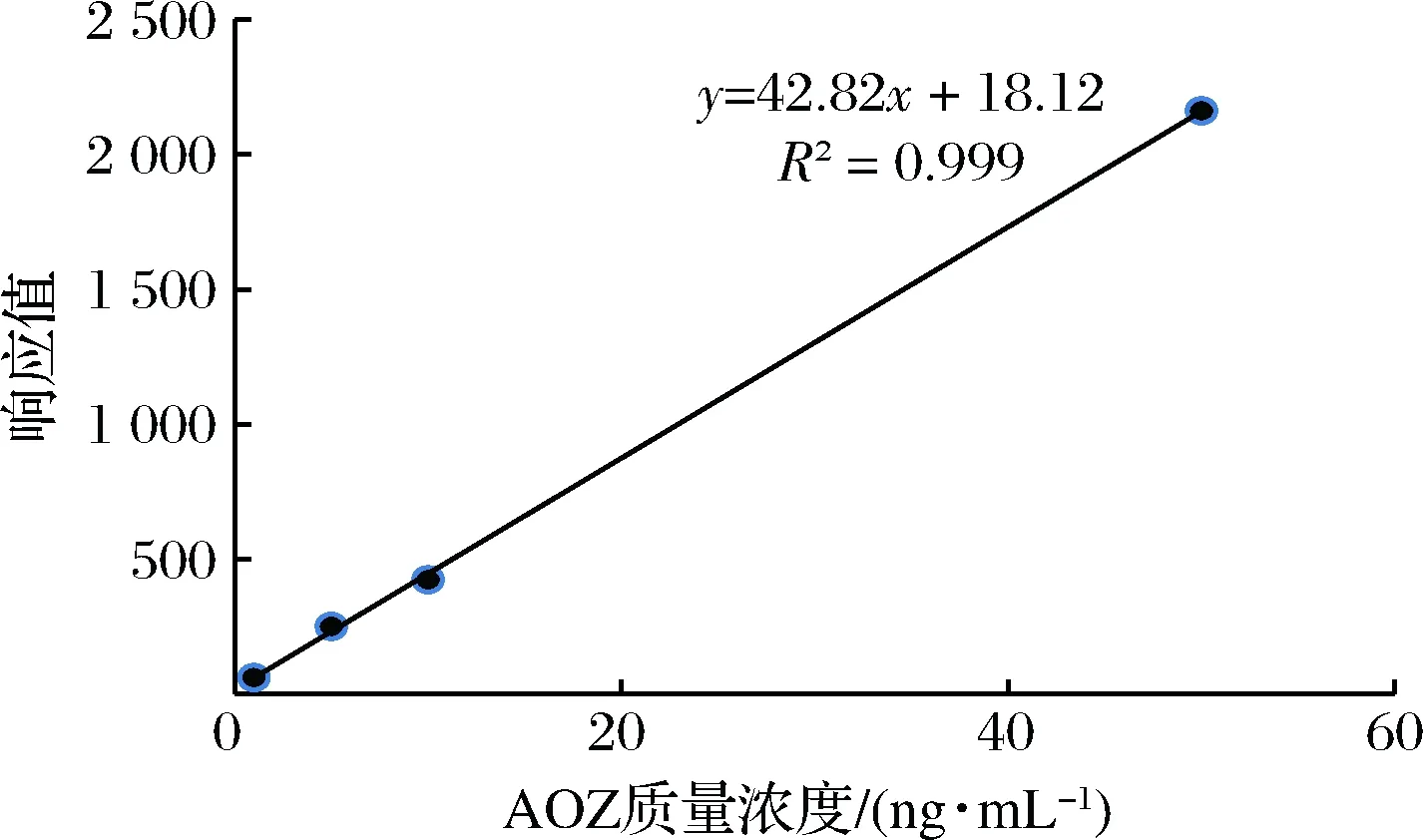
图11 AOZ 高效液相色谱/串联质谱法标准曲线Fig.11 Standard curve of AOZ by HPLC-MS/MS
3 结论
本实验通过活化酯法成功合成了包被原CPAOZ-OVA,并对包被原和单克隆抗体的最佳稀释倍数、反应条件进行优化,最终确定此方法的IC50是2.015 ng/mL,线性范围在0.131~30.911 ng/mL,满足相关限量要求。通过方法学评价得到此方法特异性强,准确性、精密度和重现性均良好。与刘婷婷[30]建立的呋喃唑酮及其代谢物酶联免疫检测方法(间接法IC50为2.0 ng/mL,直接法IC50为2.8 ng/mL,回收率在76%~109%之间)灵敏度相当,准确度有所提高,与闵成军[31]建立的猪肉中呋喃唑酮代谢物残留的酶联免疫检测法(变异系数4.7%~10.3%)相比有显著提高,说明此方法的精密度较好。本研究建立的ELISA法检测限与HPLC-MS/MS比有一定差距,但都符合兽药残留检测分析的要求。可用于动物源性食品中呋喃唑酮代谢物的快速筛查。
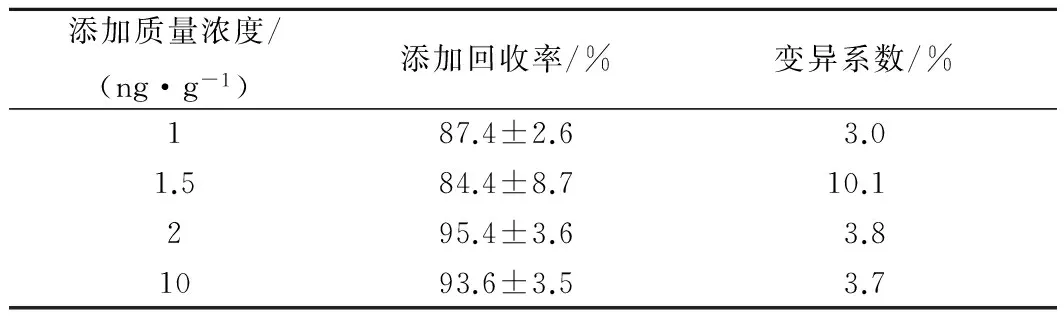
表4 HPLC-MS/MS法准确度测定结果Table 4 The results of accuracy for HPLC-MS/MS
[1]王明明, 许娜, 唐云, 等. 食品中硝基呋喃类药物残留检测方法的研究进展[J]. 中国畜牧兽医, 2016(8):2 202-2 207.
[2]祝伟霞, 刘亚风, 梁炜. 动物性食品中硝基呋喃类药物残留检测研究进展[J]. 动物医学进展, 2010,31(2):99-102.
[3]KONG De-yong, LIANG Bin, YUN Hui, et al. Electrochemical degradation of nitrofurans furazolidone by cathode:Characterization,pathway and antibacterial activity analysis[J]. Chemical Engineering Journal,2015,262:1 244-1 251.
[4]NI Y, WANG P, KOKOT S. Voltammetric investigation of DNA damage induced by nitrofurazone and short-lived nitro-radicals with the use of an electrochemical DNA biosensor[J]. Biosensors & Bioelectronics, 2012,38(1):245-251.
[5]SAMSONOVA J V, DOUGLAS A J, COOPER K M, et al. The identification of potential alternative biomarkers of nitrofurazone abuse in animal derived food products[J]. Food Chem Toxicol, 2008, 46(5):1 548-1 554.
[6]LAURENSEN J J, NOUWS J F. Simultaneous determination of nitrofuran derivatives in various animal substrates by high-performance liquid chromatography[J]. Journal of Chromatography A, 1989, 472(1):321-326.
[7]尹玉云. 硝基呋喃类抗菌素代谢物免疫学快速检测方法的建立[D]. 无锡:江南大学, 2014.
[8]COOPER K M, KENNEDY D G. Stability studies of the metabolites of nitrofuran antibiotics during storage and cooking.[J]. Food Additives & Contaminants, 2007, 24(9):935-942.
[9]蒋原, 丁涛, 沈崇钰, 等. 液相色谱-电喷雾质谱联用检测蜂蜜中四种硝基呋喃类代谢物[J]. 畜牧与兽医, 2005(3):12-15.
[10]BARTEL L C, MONTALTO D M M, CASTRO J A. Nitroreductive metabolic activation of some carcinogenic nitro heterocyclic food contaminants in rat mammary tissue cellular fractions.[J]. Food and Chemical Toxicology, 2009, 47(1):140-144.
[11]农业部第193号公告-4—2002食品动物禁用的兽药及其它化合物清单[S].
[12]农业部第235号公告-12—2002动物性食品中兽药最高残留限量[S].
[13]曹鹏, 耿金培, 尹大路,等. 高效液相色谱法同时测定饲料中的呋喃唑酮、呋喃西林、呋喃妥因、呋喃它酮药物残留量[J]. 山东农业大学学报(自然科学版), 2010, 41(3):424-427.
[14]郝征红, 张炳文, 邓立刚,等. 高效液相色谱法测定水产品中呋喃唑酮残留量的分析研究[J]. 现代食品科技, 2006, 22(1):119-120.
[15]马骏, 罗华明, 张玲茜. 液相色谱串联质谱测定水产品中硝基呋喃类代谢物残留[J]. 浙江农业科学, 2016, 57(4):558-562.
[16]宋利军, 于晖, 程鑫,等. 液相色谱-串联质谱法检测动物性食品中硝基呋喃代谢产物的残留[J]. 中国卫生检验杂志, 2017(3):321-323.
[17]邢丽红, 李兆新, 孙伟红,等. 液相色谱-串联质谱法检测水产品中硝基呋喃类药物的残留量[J]. 食品安全质量检测学报, 2017, 8(4):1 233-1 239.
[18]周克楠, 唐勇, 蓝彩凤, 等. 呋喃唑酮代谢物单克隆抗体及其新型免疫层析检测试纸条的制备[J]. 中国生物制品学杂志, 2014(7):927-931.
[19]廖峰, 高庆军, 林顺全. 分光光度法测定饲料中的呋喃唑酮[J]. 饲料研究, 2003(1):29-30.
[20]任海涛, 沈玉栋, 徐振林, 等. 呋喃唑酮代谢物单克隆抗体制备及酶联免疫吸附分析方法[J]. 分析化学, 2012(5):745-751.
[21]戴尽波, 徐振林, 刘凤银, 等. 化学发光酶免疫分析测定鱼肉中呋喃它酮代谢物方法研究[J]. 分析化学, 2015(6):871-875.
[22]文永佳, 张峰, 杜幸洁, 等. 呋喃唑酮代谢物分子印迹聚合物的合成及其酶联免疫吸附检测方法的建立[J]. 应用化工, 2013(7):1 347-1 350.
[23]王硕. 酶联免疫吸附分析方法[M]. 北京:科学出版社, 2011:38-39.
[24]余华, 严玉宝, 谢晶,等. 酶联免疫分析技术及其在进出口动物产品兽药残留检测中的应用[J]. 中国畜牧兽医, 2010, 37(11):76-79.
[25]徐伟, 程凤科, 孟银,等. 酶联免疫吸附法在兽药残留检测中的应用[J]. 中国家禽, 2013, 35(12):49-50.
[26]国家质量监督检验检疫总局. SN/T 3380—2012 出口动物源食品中硝基呋喃代谢物残留量的测定 酶联免疫吸附法[S]
[27]国家质量监督检验检疫总局 GB/T 21311—2007 动物源性食品中硝基呋喃类药物代谢物残留量检测方法 高效液相色谱/串联质谱法[S]
[28]国家质量监督检验检疫总局GB/T 200752—2006 猪肉、牛肉、猪肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定 液相色谱-串联质谱法[S]
[29]王硕. 酶联免疫吸附分析方法[M]. 北京:科学出版社, 2011:38-39.
[30]刘婷婷. 呋喃唑酮及其代谢物酶联免疫检测方法的研究[D]. 天津:天津科技大学, 2010.
[31]闵成军, 罗晓琴, 汪善良,等. 酶联免疫法检测猪肉中呋喃唑酮代谢物残留[J]. 肉类研究, 2011(12):29-32.
