酵母源葡萄糖耐量因子GTF的纯化及其铬价态分析
2018-04-12许乐李函彤逄晓阳张书文芦晶吕加平刘鹭
许乐,李函彤,逄晓阳,张书文,芦晶,吕加平*,刘鹭*
1(中国农业科学院农产品加工研究所,农业部农产品加工与质量控制重点开放实验室,北京,100193)2(石药集团中奇制药技术(石家庄)有限公司,河北 石家庄,050031)

葡萄糖耐量因子(glucose tolernace factor, GTF)是由微量元素铬、烟酸、甘氨酸、谷氨酸、半胱氨酸等成分组成的小分子蛋白复合物,具有水溶性,在A260有紫外吸收峰[11],不被蛋白酶水解。GTF具有增强胰岛素功能,促进糖代谢和脂代谢,逆转葡萄糖耐受不良,提高糖耐量;保护胰岛素β细胞,提高胰岛素受体数量及其亲和力等功能[12-13]。机体GTF缺乏与Ⅱ型糖尿病的形成有较为密切的关系。我国18岁及以上居民糖尿病患病率约为9.7%。铬缺乏是糖尿病的重要诱因之一。人体只能通过食物来摄取铬。但食物精制加工、高糖饮食、衰老等生理应激都会加剧组织中铬的流失,造成现代人普遍性铬缺乏。即使是营养学家所设计的完全平衡化的营养膳食也不能保证提供50 μg/d铬的摄入量。所以,通过营养强化剂对特定人群进行强化补铬是一条有效途径。目前,我国已将铬(硫酸铬、氯化铬)作为营养强化剂用于特殊膳食用食品的加工(GB14880—2012)。这2种铬属于无机铬。相比于无机三价铬的0.5%~2%吸收率,有机铬的吸收率可达10%~25%,生物来源的GTF、低分子量铬附合物(low-molecular-weight chromium-binding substance, LMWCr)吸收率和生物活性会更高。作为酵母代谢产物的GTF与动物体内铬调素(chromodulin)一样,同属经生物有机转化的金属蛋白,保守性和安全性较高,没有降糖西药的相关副作用,势必成为糖尿病患者的重要保健食品。因此厘清GTF中铬的价态对于未来GTF保健食品的开发以及酵母资源的深度加工有重要的意义。
酵母具有吸附金属的能力。本研究中酵母通过生物吸附和生物转化作用将环境中的无机铬转化为体内铬蛋白复合物质——GTF。NEILE[14]等通过反相层析提取,体外脂肪细胞培养鉴定活性成分,采用31P核磁共振对3个分离组分进行组成和结构分析,发现组分中含有多种有机磷酸盐、无机磷酸盐和聚磷酸盐类物质。王翀[15]利用紫外光谱和红外光谱研究铬在酵母细胞中的赋存形式。本研究在前期氨水提取基础上,优化有机溶剂提取条件,通过联用溶剂提取及分子筛纯化,得到纯度相对较高的GTF样品,旨在获得用于铬价态分析的GTF高纯度样品。由于酵母中GTF含量较少,提取过程步骤较多, GTF损失较高,因此本研究采用灵敏度高的检测技术HPLC-ICP-MS对纯化后的GTF中的铬价态进行分析,以期为安全膳食铬补充剂的筛选提供理论依据。HPLC-ICP-MS联用技术具有检出限低、动态线性范围宽(0 ppb~1 000 ppm)、分析时间短、应用范围广等优点[16-19]。
1 材料与方法
1.1 材料与试剂
啤酒酵母菌YSI-3.7,实验室保藏菌株;三氯化铬,国药集团化学试剂有限公司;氨水(分析纯),北京市化学试剂公司;SuperdexTM75、Sephadex G25,美国GE公司;Bio-WAX Column,日本安捷伦公司;铬(Ⅲ)标准液(1 000 μg/mL),国家钢铁材料测试中心钢铁研究总院;铬(Ⅵ)标准液(1 000 μg/mL), 国家有色金属及电子材料分析测试中心;铬标准液(1 000 μg/mL),中国计量科学院;乙二胺四乙酸(色谱纯),美国Sigma公司。
1.2 仪器与设备
1525型高效液相色谱仪,美国Waters公司;MB-102型恒温金属浴,日本BIOER公司;DRC-e型电感耦合等离子体质谱仪,美国PerkinElmer公司;Bio-WAX色谱柱,美国Agilent公司;3K15冷冻离心机,美国Sigma公司。
1.3 制备富铬酵母菌粉
挑取在1 000 μg/mL的铬浓度平板上长出的YSI-3.7优势菌落,接种于铬含量为500 μg/mL的培养液中发酵44 h,5 000 r/min离心10 min收集菌体,去离子水洗3次,冷冻干燥,制备冻干富铬酵母菌粉。
1.4 氨水提取
将富铬酵母菌粉与0.1 mol/L氨水以质量体积比为1∶10(g∶mL)溶解[20-21],经37 ℃、200 r/min振荡培养箱中振荡培养4 h,于10 000 r/min,4 ℃,离心30 min,收集上清液。参照1.9方法进行消化及火焰原子吸收测定。
1.5 有机溶剂提取
1.5.1有机溶剂对GTF提取效果的影响
冻干富铬酵母菌粉经氨水提取,离心,收集上清液。取10 mL上清液数份,分别加入15 mL的甲醇、乙醇和丙酮,冰浴静置30 min,10 000 r/min离心10 min,分别收集上清液和沉淀。参照1.9方法进行消化及火焰原子吸收,测定上清液、沉淀中的铬含量;采用考马斯亮蓝法测定上清液、沉淀部分的总蛋白。分别计算上清液和沉淀部分的总有机铬量(μg)与总蛋白量(mg)的比值(即铬蛋白比:每毫克蛋白中铬的含量),分析其提取效率。
1.5.2有机溶剂浓度对GTF提取效果的影响
取氨水提取后GTF的上清液(10 mL),加入体积不同的乙醇,使乙醇最终体积分数分别为60%、50%、40%、30%和15%,静置提取,同时设置无乙醇提取组为空白对照,测定上清液中有机铬和蛋白浓度,计算上清液中总有机铬量、总蛋白以及铬蛋白比(μg/mg),确定乙醇最佳作用浓度。
1.5.3有机溶剂作用时间对GTF提取效果的影响
取氨水提取后GTF的上清液,加入30%乙醇沉淀,分别静置15、20、30 min后,于4 ℃、10 000 r/min离心10 min,取上清液。参照1.9方法进行消化及火焰原子吸收,测定上清液中有机铬、蛋白浓度,计算上清液中总有机铬量、总蛋白以及铬蛋白比(μg/mg),确定乙醇最佳作用时间。
1.6 SuperdexTM 75凝胶过滤层析
去离子水溶解GTF冻干菌粉,过0.22 μm膜,采用SuperdexTM75 (1.6 cm × 80 cm)凝胶过滤层析柱进行分离,以0.15 mol/L NaCl和50 mmol/L CH3COONH4混合(pH 6.0)为洗脱液,洗脱速度为0.3 mL/min,每管收集3 mL,各管洗脱液在A254吸收波处进行蛋白吸光值的测定[22],其有机铬含量采用火焰原子吸收法测定[23-25],绘制有机铬、蛋白含量双坐标图谱。收集铬峰洗脱液,参照1.9方法进行消化及火焰原子吸收测定。
1.7 Sephadex G25凝胶过滤层析
将经过SuperdexTM75凝胶过滤层析后的铬峰洗脱液冻干粉用去离子水溶解,0.22 μm膜过滤,上Sephadex G25凝胶过滤层析柱(1.0 cm×80 cm),以去离子水为洗脱液,洗脱速度0.3 mL/min,各管洗脱液在A254吸收波处进行蛋白吸光值的测定,其有机铬含量采用火焰原子吸收法进行测定,绘制有机铬、蛋白含量双坐标图谱,收集铬峰处洗脱液,冷冻干燥备用。
1.8 有机铬的提取
准确称取酵母菌粉0.1 g,溶于0.1 mol/L氨溶液中,在37 ℃、转速为200 r/min的振荡培养箱中培养4 h,5 000 r/min离心10 min,收集上清液,参照1.9方法进行消化及火焰原子吸收测定。
1.9 样品消化及铬测定
将收集的上清液或沉淀置于溶样杯中,加入6 mL质量分数为68%的浓HNO3,160 ℃预加热30 min,待溶液稍凉后,加入0.5 mL质量分数为72%的HClO4和质量分数5%的过硫酸铵溶液5 mL,于微波消解仪中进行样品消解,具体参数设置见表1。消解完毕后,加入1% NH4Cl溶液2.5 mL,其余用去离子水补齐至25 mL。参照 GB/T15555.6—1995方法,采用火焰原子吸收仪对样品中的铬量进行测定。

表1 微波消解仪消化参数表Table 1 Parameters of microwave digestion instrument
1.10 GTF铬价态分析
由于提取、纯化酵母菌中的GTF的步骤较多,极易造成有机铬的损失,且最终得到的纯化物较少,本实验采用ICP-MS和HPLC联用技术分析GTF 中的铬价态。此方法具有接口简单、检出限低、动态线性范围宽(0 ppb~1 000 ppm)、前处理简便、分析时间短及应用范围广等优点。参照Agilent LC-ICP-MS技术手册进行铬价态分析,方法略有改进。
1.10.1高效液相色谱-电感耦合等离子体质谱参数
高效液相色谱参数设置:
色谱柱采用Agilent Bio-WAX Column 5 μm,4.6 mm×50 mm(5190-2488),室温下运行,进样量为30 μL。流动相为0.075 mol/L NH4NO3,流速为0.6 mL/min。
电感耦合等离子体质谱参数设置:
采用玻璃同心雾化器,RF功率1 550 W,采样深度8 mm,载气1.2 L/min,积分时间0.8 s,52Cr,以氦气模式4.5 mL/min,蠕动泵0.3 r/s。
1.10.2标准试剂的配制及标准曲线的绘制
缓冲液:0.075 mol/L HNO3和0.6 mmol/L EDTA,氨水调pH为7.0。
流动相:0.075 mol/L HNO3,氨水调pH至7.0。
铬标准溶液:准确称取0.5 g Cr(Ⅲ)和0.5 g Cr(Ⅵ)溶液,缓冲液稀释至50 g,制成铬混合液M1,之后用流动相将M1配置成0.5、1.0、2.0、5.0、10.0 μg/mL混合标准系列使用液,调pH为7.0,50 ℃水浴加热1 h,参照1.10.1的参数设置进行测定与分析(图1),绘制标准曲线(图2)。
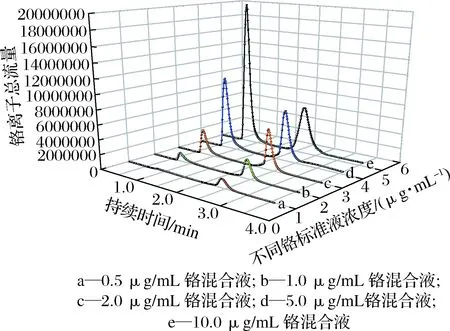
图1 Cr(Ⅲ)和Cr(Ⅵ) 混合标准液HPLC-ICP-MS色谱图Fig.1 Total ion flow diagram of standard chromium solutionof trivalent chromium and hexavalent chromium
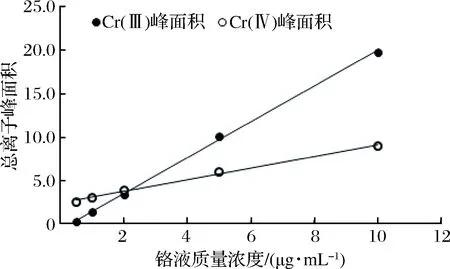
图2 铬标准液中Cr(Ⅲ)和Cr(Ⅵ)峰面积标准曲线Fig.2 Chromium standard solution in peak area of standardcurve of trivalent chromium and hexavalent chromium
1.10.3GTF样品处理
将Sephadex G25层析后收集得到的铬峰洗脱液冻干成粉后,取0.1 g左右样品,用3 mL 0.07 mol/L HCl溶解,37℃水浴振荡1 h,37 ℃静置1 h,用0.22 μm过滤膜过滤,8 000 r/min离心10 min,取1 mL上清液加入1 mL 0.07 mol/L NH3·H2O和8 mL缓冲液,于50 ℃保温加热1 h,使缓冲液中的EDTA和GTF 中的Cr(Ⅲ)络和形成稳定的络合物。取30 μL参照1.10.1的参数设置进行HPLC-ICP-MS 的Cr(Ⅲ)和Cr(Ⅵ)分析。
1.11 数据处理
2 结果与分析
2.1 氨水联用有机溶剂提取GTF
2.1.1有机溶剂的种类对GTF提取效果的影响
文献表明GTF可溶解于氨水、乙醇等有机溶剂[26-27]。同时在蛋白分离纯化过程中,有机溶剂还具有沉淀蛋白的功能。因此本实验在氨水提取的基础上,选择甲醇、乙醇和丙酮3种常见的有机溶剂继续提取GTF,分析上清液和沉淀中的铬绝对值和铬蛋白比,结果如图3、表2所示。甲醇提取后,上清液中有机铬量为61 μg,沉淀物中有机铬量为33 μg;乙醇提取后,其上清液和沉淀物中的有机铬量分别为85 μg和21 μg,上清液中铬量是沉淀物中铬量的4倍多;丙酮提取后,其上清液和沉淀中有机铬量分别为62 μg和23 μg,上清液中铬量也将近是沉淀物总量的3倍。表2显示了不同提取组分中的铬蛋白比。铬蛋白比指每毫克蛋白中的铬含量,在一定程度上可用于衡量GTF提取纯化的效果。其比值越高,表示杂蛋白越少,物质越纯。相较于氨水提取组(对照组),经过有机溶剂提取后,GTF中铬蛋白比值都有所提高。其中乙醇提取的上清液中,铬蛋白比为2.4。相比于氨水提取法的铬蛋白比0.818,提高将近3倍。
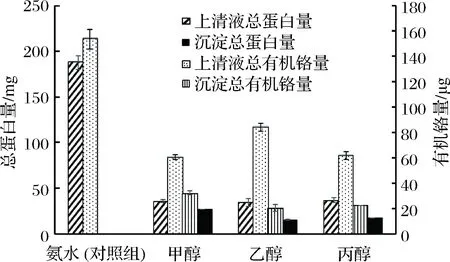
图3 不同有机溶剂提取对提取液中有机铬含量及蛋白含量的影响Fig.3 Effect of organic solvent on exaction of organicchromium content and protein content
2.1.2有机溶剂浓度对GTF提取效果的影响
为确定乙醇最佳作用浓度,本实验选取60%、50%、40%、30%、15%这5个不同浓度的乙醇提取GTF,于0 ℃冰浴静置20 min,结果由图4所示。

表2 不同有机溶剂对提取液中铬蛋白比的影响 单位:μg/mg

图4 不同乙醇体积分数对GTF提取液中有机铬含量及蛋白含量的影响Fig.4 Effect of various ethanol concentration on exactionof organic chromium and protein content
由图可知,其铬蛋白的比值分别为1.077、0.812、0.59、5.015和1.412,对照组铬蛋白比为0.804。乙醇的静置处理有助于GTF的进一步提取。提取倍数分别为对照组的1.34、1.01、6.24、1.76倍。其中30%的乙醇浓度静置处理,GTF的纯度显著提高。因此最终选择30%乙醇进行GTF的提取。铬蛋白比相较于对照组提高了6倍。
2.1.3有机溶剂静置时间对GTF提取效果的影响
为确定乙醇最佳静置时间,本实验选取15、20、30、50 min作用4个时间点,结果如图5所示。随静置时间的延长,上清液中铬的含量和蛋白的含量逐渐增加。静置20 min时,其总铬含量最高,为133.492 μg,铬蛋白比达到5.015;静置30 min时,总铬含量为120.05μg,上清液中溶解蛋白较大,为56.902 mg。总体来看,随着静置时间增长,蛋白溶解增加,铬蛋白比降低。因此综合考虑铬蛋白比及时间,选择静置处理20 min,收集上清液。

图5 静置时间对GTF提取液中有机铬含量及蛋白含量的影响Fig.5 Effect of various precipitation time on the extractionof organic chromium and protein content
2.2 凝胶层析联用纯化GTF
2.2.1SuperdexTM75分子筛层析
有研究报道[28-29],GTF是分子质量为750~1 500 Da的小分子蛋白肽。基于此,选择SuperdexTM75进行粗提液纯化,去除GTF中的大分子蛋白。结果如图6所示。GTF粗提液经SuperdexTM75 层析,得到4个蛋白峰。其中前2个蛋白峰含铬。蛋白峰2的铬的含量明显高于蛋白峰1。分子筛层析是依据蛋白分子质量不同而进行分离。大分子物质首先被洗脱。而GTF为为小分子物质,可知第2个铬峰为目的峰。收集目的峰洗脱液,真空浓缩。

图6 SuperdexTM 75凝胶过滤层析图谱Fig.6 SuperdexTM 75 gel filtration chromatography
2.2.2Sephadex G25分子筛层析
收集SuperdexTM75的铬峰,选择分离范围为1 000~5 000 Da的Sephadex G25进一步分离纯化。 Sephadex G25是经典的葡聚糖和环氧氯丙烷偶联介质,拥有极高的选择性和分辨率,可对较小分子质量的蛋白有很好的分离效果。结果如图7所示。经过凝胶层析分离得到A254蛋白峰1个,铬峰与蛋白峰重合。由此可以得到,富铬酵母粉经氨水和低温低浓度乙醇提取,再经SuperdexTM75和Sephadex G25凝胶过滤层析,可以去除大量杂蛋白,得到GTF。收集铬峰、冻干,进行铬的形态分析。

图7 Sephadex G25凝胶过滤层析图谱Fig.7 Sephadex G25 gel filtration chromatography
2.3 GTF铬价态分析
Cr(Ⅲ)和Cr(Ⅵ)混合标准液色谱图(图1)显示Cr(Ⅲ)出峰范围在第33~97 s;Cr(Ⅵ)在145~209 s时出峰。分别对这2个铬峰进行面积积分,绘制Cr(Ⅲ)和Cr(Ⅵ)的标曲(图2)。对铬峰进行面积积分,得到Cr(Ⅲ)和Cr(Ⅵ)峰面积线性方程分别为:
Cr(Ⅲ):y=20 662 800x-6 518 060
(1)
Cr(Ⅵ):y=6 745 060x+23 662 200
(2)
式中:x为洗脱时间,y为总离子峰面积。根据此方程式可以计算样品中的铬质量浓度。
如图8所示,经过提取纯化的GTF中有且只有1个铬峰,于31 s出峰,90 s左右洗脱完全,出峰范围在Cr(Ⅲ)范围内,由此可见,GTF中存在Cr(Ⅲ),不存在Cr(Ⅵ)。同时,根据Cr(Ⅲ)铬峰面积线性方程,该样品的铬离子浓度为6.21 μg/mL,这与火焰原子吸收测得其有机铬的含量相同,证明实验结果可靠。但从图8中也可看出,在67.227 s时有1个小峰出现,这个小峰与Cr(Ⅲ)的峰极为接近。同时与标液的HPLC-ICP-MS色谱图(图1)相比,该小峰也不属于六价铬的峰。因此猜测可能是由于样品中一部分Cr(Ⅲ)与EDTA络和结构脱离,形成不稳定状态所以造成图中拖尾现象的发生。

图8 GTF纯化样品HPLC-ICP-MS色谱图Fig.8 HPLC-ICP-MS chromatogram of GTF
3 结论
铬(Ⅲ)是人体的基本营养元素之一,主要是通过激活体内铬调素(chromodulin)来协同或增强胰岛素功能而发挥作用,调节糖、脂类等正常代谢。中国居民膳食营养素参考摄入量表规定三价铬的适宜摄入量[AIs(μg)]摄入量为50 μg/d(18~50岁人群)。由于富铬酵母中GTF的铬价态不清,限制了富铬酵母的深度开发及其膳食铬补充剂的开发[30]。
富铬酵母粉经氨水联用乙醇提取,静置20 min,其粗提液的总有机铬量为133.5 μg。相比于氨水提取,铬蛋白比提高了6倍。该粗提液经两级分子筛凝胶层析柱分离,得到1个与铬峰重合的蛋白峰,二者重合性较好。将此分离纯化得到的GTF通过HPLC-ICP-MS联用技术进行铬价态分析。结果显示铬出峰的时间为31 ~90 s,该出峰时间与标准溶液中三价铬的出峰时间一致。本研究结果表明,GTF中的铬是以Cr(Ⅲ)形态存在,无Cr(Ⅵ)存在,为GTF保健食品或膳食铬补充剂的安全开发提供了理论依据。
[1]ANDERSON R A, POLANSKY M M, Bryden N A, et al. Chromium supplementation of human subjects: effects on glucose, insulin and lipid variables[J]. Metabolism, 1983, 32(9): 894-899.
[2]CHRISTIAN G D, KNOBLOCK E C, PURDY W C, et al. A polarographic study of chromium-insulin-mitochondrial interaction[J]. Biochem Biophys Acta, 1963, 66:420-423.
[3]徐晨晨. 微量元素铬对营养代谢调控的研究进展[J]. 家禽科学, 2012 (1): 12-15.
[4]WRIGHT A J, MOWAT D N, MALLARD B A. Dietary intake and micronutrient status of adolescents: effect of vitamin and trace element supplementation on indices of status and performance in tests of verbal and non-verbal intelligence[J]. Canadian Journal of Animal Science, 1994, 74(2): 287-295.
[5]VACCHINA V, CALLE I, SEBY F. Cr(VI) speciation in foods by HPLC-ICP-MS: investigation of Cr(VI)/food interactions by size exclusion and Cr(VI) determination and stability by ion-exchange on-line separations[J]. Analytical and Bioanalytical Chemistry, 2015, 407(13):3 831-3 839.
[6]李登科, 范国樑, 姚鹤鸣, 等. HPLC-ICP-MS联用技术用于烟草中铬的形态分析研究[J]. 中国烟草学报, 2016, 22(2):1-7.
[7]WANG Hua-jian, DU Xia-mei, WANG Meng, et al. Using ion-pair reversed-phase HPLC ICP-MS to simultaneously determine Cr(III) and Cr(VI) in urine of chromate workers[J]. Talanta, 2015, 81(4-5):1 856-1 860.
[8]黎飞, 王扬, 张成, 等. HPLC/ICP-MS法测定水质中Cr(Ⅲ)和Cr(Ⅵ)的研究[J]. 宁波大学学报: 理工版, 2012, 25(3):13-16.
[9]胡玉军, 覃毅磊, 赖毅东. HPLC-ICP-MS测定乳制品中的三价铬和六价铬[J]. 现代食品科技, 2014, 30(4): 301-305.
[10]陈东, 王晓伟, 赵榕, 等. 高效液相色谱-电感耦合等离子体质谱法同时测定双份饭样品中Cr(Ⅲ)和Cr(Ⅵ)[J].分析化学, 2015, 43(12):1 901-1 905.
[11]ZETIC V G, STEHIK-TOMAS V, GRBA S, et al. Chromium uptake bySaccharomycescerevisiaeand isolation of glucose tolerance factor from yeast biomass[J]. Journal of Biosciences, 2001, 26(2):217-223.
[12]鲁照玲, 胡红云, 姚洪. HPLC-ICP-MS对环境水样中Cr(Ⅲ)和Cr(Ⅵ)分析研究[J]. 环境科学与技术, 2012, 35(12): 230-233.
[13]徐敏, 王斌, 柳映青, 等. 纺织品中萃取Cr(Ⅲ)和Cr(Ⅵ)的HPLC-ICP-MS测定法[J]. 印染, 2014(9): 43-46.
[14]EDENS N K, REAVE L A, BERGANA M S, et al. Yeast extract stimulates glucose metabolism and inhibits lipolysis in rat adipocytesinvitro[J]. Nutritionr, 2002, 132:1 141-1 148.
[15]王翀.啤酒酵母对重金属Cr(Ⅲ)生物转化及生物吸附的研究[D]. 西安:西北大学, 2005.
[16]陈光, 林立, 钱聪, 等. 离子色谱-电感耦合等离子体质谱联用测定饮用水中的三价铬和六价铬[J]. 农业机械, 2012(4):127-130.
[17]胥佳佳, 冯鑫, 汤静, 等. 超声辅助提取-高效液相色谱-电感耦合等离子体质谱法测定香菇中6种形态砷化合物[J]. 食品科学, 2016, 37(24): 216-221.
[18]李静, 王雨, 陈华宝, 等. 牛奶中三价铬和六价铬的同时提取和检测方法[J]. 食品科学, 2010, 31(10): 250-253.
[19]付俊鹤, 余明华, 许武桥, 等. 铬的生物学功能及富铬酵母的应用[J]. 微量元素与健康研究, 2011, 28(1): 66-68.
[20]ANDERSON R A, POLANSKY M M, ROGINSKI E E, et al. Factors affecting the retention and extraction of yeast chromium[J]. Journal of Agricultural and Food Chemistry, 1978, 26(4): 858-861.
[21]LIU Lu, LV Jia-ping, ULUKO Hankie. Purification and characterization of chromium-binding substances from high-chromium yeast[J]. Journal of Agricultural and Food Chemistry, 2013, 61(38):1 279-1 287.
[22]YAMAMOTO A, WADA O, ONO T. Isolation of a biologically active low-molecular-mass chromium compound from rabbit liver[J]. Biochemical and Biophysical Research Communications, 1987, 165(3): 627-631.
[23]SOARES, M E, VIEIRA E, BASTOS M D. Chromium speciation analysis in bread samples[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 1 366-1 370.
[24]HAYLOCK S J, BUCKLEY P D, BLACKWELL L F. Separation of biologically active chromium-containing complexes from yeast extracts and other sources of glucose tolerance factor (GTF) activity[J]. Journal of Inorganic Biochemistry, 1983, 18(3): 195-211.
[25]HOLDSWORTH E S, Neville E. Effects of extracts of high-and low-chromium brewer's yeast on metabolism of glucose by hepatocytes from rats fed on high-or low-Cr diets[J]. British Journal of Nutrition, 1990, 63(3): 623-630.
[26]LIU Lu, KONG Fan-hua, ZHANG Shu-wen, et al. Response to comment on purification and characterization of chromium-binding substance from high-chromium yeast[J]. Journal of Agricultural and Food Chemistry, 2013, 61(38): 9 282-9 284.
[27]张新华. 酵母葡萄糖耐量因子调控VHG乙醇发酵及GTF结构初步研究[D]. 福州: 华侨大学, 2014.
[28]VINCENT J B. Comment on purification and characterization of chromium-binding substances from high-chromium yeast[J]. Journal of Agricultural and Food Chemistry, 2013, 61(38): 9 280-9 281.
[29]孔凡华, 周志江, 张书文, 等. 酵母菌葡萄糖耐量因子的纯化[J]. 食品科学, 2014, 35(21):1-4.
[30]中国营养学会编著. 中国居民膳食指南[M]. 西藏:西藏人民出版社, 2011:215-219.
