左旋龙脑对人脐静脉内皮细胞氯通道和细胞容积的影响
2018-04-12梁协稠陈湛如许经逵封洁珠伍嘉宝徐剑英谭秋婵陈丽新王立伟
梁协稠,陈湛如,许经逵,封洁珠,伍嘉宝,徐剑英,高 宏,谭秋婵,陈丽新,王立伟
(暨南大学医学院 1.生理学系、2.药理学系,广东 广州 510632;3.广东省计划生育科学技术研究所,广东 广州 510600;4.暨南大学医学院临床医学系,广东 广州 510632 )
龙脑(冰片)是龙脑香科常绿乔木植物龙脑香树脂的加工品,或龙脑香的树干经蒸馏冷却而得的结晶,具有广泛的药理学作用,如开窍醒神、清热止痛等。龙脑可提高血脑屏障及黏膜的通透性[1-3],明显促进细胞对药物的转运和吸收,增加透皮性吸收作用,是理想的透皮促进剂[ 4- 5]。
血脑屏障由毛细血管内皮细胞、周细胞和星形胶质细胞构成,其中血管内皮细胞是其主要结构。龙脑可能通过调节血管内皮细胞的缝隙链接,从而提高血脑屏障通透性,促进药物通过血脑屏障[6],但龙脑提高血脑屏障通透性和促进细胞对药物吸收的机制尚未见阐明。人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)因其干细胞潜能特性,被广泛应用于血管内皮细胞实验,常用于建立血脑屏障模型[7]。人体细胞内分布最广的阴离子通道是氯离子通道,其参与多种细胞的生理活动调节。氯通道是细胞容积调节的重要通道。ClC-3是ClC氯通道家族中的一员,是调节细胞容量的主要参与者[8-9]。本实验室前期研究发现,ClC-3氯通道是鼻咽癌细胞容积激活性氯通道的分子基础之一,参与调节鼻咽癌细胞容积调节[8-11]。龙脑可以激活低分化鼻咽癌细胞容积敏感性氯通道,导致细胞容积缩小[10-11]。龙脑是否可以作用于血管内皮细胞氯通道,减小内皮细胞容积,从而调节血管内皮细胞的缝隙链接,提高血脑屏障通透性,有待研究。本实验拟利用膜片钳技术、细胞动态成像研究左旋龙脑对HUVECs细胞氯通道的激活作用,siRNA干扰技术探讨左旋龙脑激活HUVECs氯通道的分子机制,为进一步探讨氯通道在血脑屏障中的作用提供实验基础。
1 材料
1.1细胞株本研究所用人脐静脉内皮细胞株(HUVECs)由中山大学药理教研室惠赠。
1.2药物与试剂左旋龙脑(L-borneol)购自Macklin公司,纯度≥98%,用DMSO配制成20 mmol·L-1的储存液,实验时用细胞外等渗灌流液稀释成20 nmol·L-1的工作液。4,4′-diisothiocyanostibibene-2,2′-disulfonic acid(DIDS)、5-nitro-2-(3-phenlpropylamino)benzoic acid(NPPB)均购于Sigma公司;DIDS溶解于DMSO中,配制成浓度为100 mmol·L-1的储存液,实验时稀释成100 μmol·L-1的工作液;NPPB用甲醇配制成100 mmol·L-1储存液,实验时稀释至100 μmol·L-1工作液。ClC-3 siRNA购自上海吉马制药技术有限公司,根据说明书用DEPE水配制成20 nmol·L-1储存液,-20℃冻存。
1.3仪器PB-10 pH计(德国Sartorius公司);Micro-Osmometer 渗透压计(德国Loser公司);微电极拉制器PC-10(日本Narishige公司);EPC-7膜片钳放大器(德国HEKA公司);CED 1401数据采集器(英国Cambridge)。
2 方法
2.1细胞培养HUVEC细胞用含10%胎牛血清、1×105U·L-1青霉素和100 mg·L-1链霉素的DMEM培养液,在37℃、饱和湿度、5% CO2细胞培养箱内培养。间隔48 h用含0.02% EDTA的0.25%胰酶消化传代。
2.2膜片钳实验
2.2.1电极内液、灌流液的配制等渗灌流液(isotonic solution, ISO)含(mmol·L-1): NaCl 70, MgCl20.5, CaCl22, HEPES 10,D-mannitol 140;配制好的ISO用Tris碱调pH值至7.4,渗透压为300 mOsmol·L-1。电极内液含(mmol·L-1):N-methyl-d-glucamine chloride (NMDG-Cl) 70, MgCl21.2, EGTA 1, HEPES 10, D-mannitol 140, ATP 2。
2.2.2全细胞膜片钳记录常规消化HUVEC,吹打配制成单细胞悬液,滴加于直径22 mm圆形玻片,静置10 min,然后贴于灌流槽内进行实验。用微电极拉制器PC-10拉制玻璃微电极。用EPC-7膜片钳放大器在全细胞电压钳制模式下记录全细胞电流,钳制细胞在0 mV、± 40 mV、± 80 mV循环往复,脉冲波宽200 ms,间隔4 s。用CED 1401采集电流和电压信号,用EPC软件(CED, Cambridge Electronic Design, UK)记录并分析实验数据。在等渗灌流下,记录稳定的基础电流2~5 min,加入20 nmol·L-1左旋龙脑,待电流达到稳定峰值,加入100 μmol·L-1NPPB或100 μmol·L-1DIDS阻断电流,并计算抑制率=[(Cmax-Ciso)-(Cbloc-Ciso)]/(Cmax-Ciso)×100%,其中Ciso是等渗溶液中的基础电流值,Cmax是激活电流最大值,Cbloc是加入阻断剂后的最大效应时的电流值。
2.3siRNA干扰ClC-3基因的表达对照组无序siRNA(NC siRNA)正义链序列5′-UUCUCCGAACGUGUCACGUTT-3′,反义链序列5′-ACGUGACACGUUCGGAGAATT-3′; ClC-3 siRNA 正义链序列5′-CAAUGGAUUUCCUGUCAUATT-3′,反义链序列5′-UAUGACAGGAAAUCCAUUGTA-3′。常规消化细胞种于6孔板中,24 h后进行siRNA转染。用无血清、无抗生素的DMEM稀释Mate(1 ∶20)和20 mol·L-1siRNA(1 ∶20),静置10 min。每孔加入200 μL稀释液和1.8 mL无双抗DMEM。培养箱孵育48 h后,提取蛋白进行Western blot分析;或消化细胞贴片进行膜片钳记录,分析用20 nmol·L-1左旋龙脑灌流后电流特性改变。
2.4细胞动态成像分析如同膜片钳实验处理细胞,细胞贴于玻片上,置于灌流槽中,在倒置荧光显微镜上,用Image Pro Plus 6.3软件设置好动态拍摄,每1 min拍1幅图像。实验设对照组、左旋龙脑组、氯通道阻断剂+左旋龙脑组。用Scion Image图像分析软件处理图像,细胞容积:V=4/3×π×(S/π)3/2;用公式:Vst=Vt/Viso×100% 进行细胞容积标准化;其中Vt作为龙脑作用后的体积,Viso为ISO作用下的平均体积;细胞容积缩小率:V%=(Viso-Vmin)/Viso×100%,Vmin为左旋龙脑处理后细胞的最小容积。

3 结果
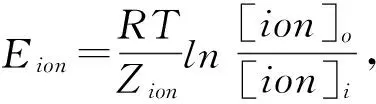
3.2氯通道阻断剂NPPB和DIDS抑制左旋龙脑激活的氯电流20 nmol·L-1左旋龙脑激活HUVECs电流,待其稳定后,分别加入100 μmol·L-1氯通道阻断剂NPPB或100 μmol·L-1氯通道阻断剂DIDS。如Fig 2所示,±80 mV电压钳制下,NPPB使激活的外向、内向电流分别从(78.63±8.3)pA/pF下降到(18.23±2.83)pA/pF、(-53.18±5.48)pA/pF下降到(-13.14±2.50)pA/pF(P<0.01),外向、内向电流抑制率分别为(95.57±2.57)%、(94.58±2.13)%(P=0.78)。而灌流DIDS工作液后,外向、内向电流分别从(80.36±6.67)pA/pF下降到(16.38±2.68)pA/pF、(-66.66±5.92)pA/pF下降到(-19.35±4.21)pA/pF(P<0.01),外向、内向电流抑制率分别为(97.28±6.36)%、(85.74±7.46)%(P=0.27)。NPPB和DIDS对外向、内向电流的抑制率没有统计学差异。以上结果进一步证实了左旋龙脑激活HUVECS的氯通道。
3.3siRNA干扰ClC-3基因表达对左旋龙脑激活氯电流的抑制作用在HUVECs与ClC-3 siRNA共培养48 h后,收集细胞进行Western blot检测。如Fig 3所示, ClC-3氯通道蛋白表达被ClC-3 siRNA明显沉默,与空白对照组(P=0.018)和NC siRNA组(P=0.028)相比,差异有统计学意义。
±80 mV电压钳制下,NC siRNA组HUVECs在20 nmol·L-1左旋龙脑溶液灌流后,外向、内向电流密度分别激活至(69.95±10.05)pA/pF、(-52.50±8.73)pA/pF(Fig 4A、4C、4E),与空白对照组相比差异无统计学意义(P=0.993)。ClC-3 siRNA组
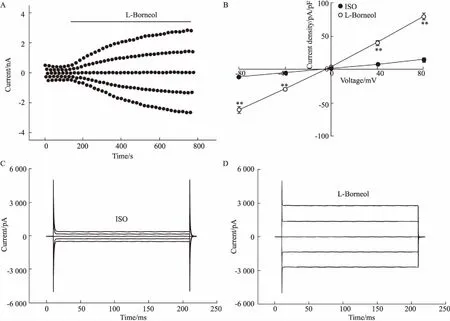
Fig 1 L-borneol induced chloride currents in HUVECs (±s)
A: The typical time course of 20 nmol·L-1L-borneol induced currents in HUVECs; B: The current-voltage relationships of L-borneol initiated currents (n=9); C: Traces of Cisoin Cl-free ISO; D: Traces of L-borneol activated current.**P<0.01vsISO.
HUVECs在左旋龙脑溶液灌流后,外向、内向电流密度仅为(27.03±3.89)pA/pF、(-24.85±2.23)pA/pF(Fig 4B、4D、4E),与空白对照组相比差异有统计学意义(P<0.01),与NC siRNA组相比差异有统计学意义(P=0.011)。进一步提示了左旋龙脑激活的氯电流可能由ClC-3氯通道蛋白介导。
3.4左旋龙脑对HUVEC容积影响如Fig 5A所示,灌流ISO 60 min,HUVECs细胞容积仅小幅波动。细胞外灌流20 nmol·L-1左旋龙脑溶液60 min时,HUVECs细胞容积减小(14.38±1.58)%(P<0.01)。胞外灌流100 μmol·L-1NPPB 可以阻断左旋龙脑诱导的细胞容积减小,细胞容积仅减小(4.51±1.34)%,明显小于左旋龙脑所引起细胞容积减小(P<0.01)。表明左旋龙脑可诱导细胞容积减小,阻断氯通道可以抑制左旋龙脑诱导的细胞容积减小。
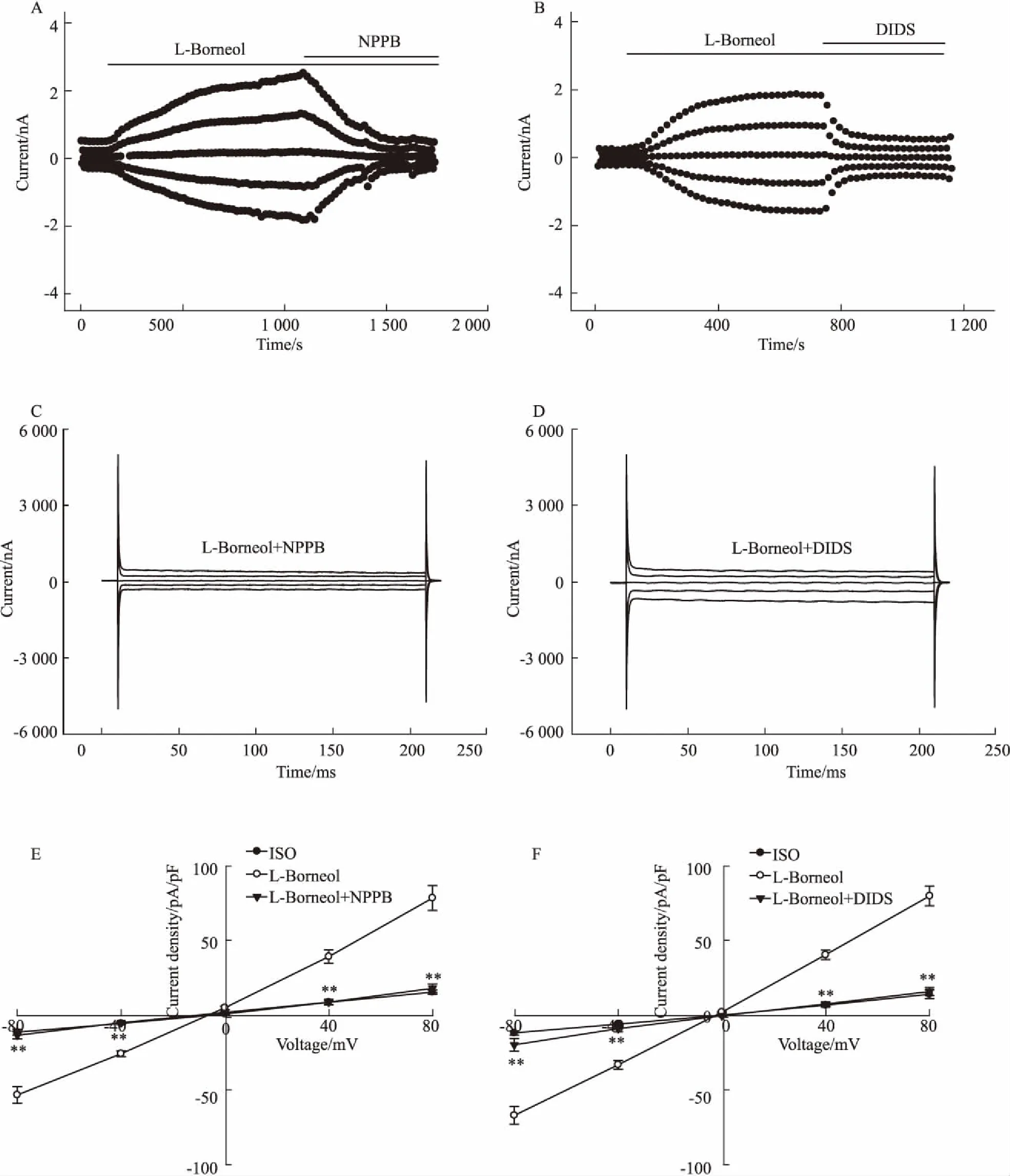
Fig 2 Inhibition of L-borneol induced current by NPPB and DIDS (±s)
A: The typical time course of 20 nmol·L-1L-borneol induced currents which inhibited by NPPB; B: The typical time course of 20 nmol·L-1L-borneol activated currents that suppressed by DIDS; C: Traces of L-borneol activated current suppressed by NPPB; D: Traces of activated-current suppressed by DIDS; E: The current-voltage relationships of L-borneol initiated currents and NPPB inhibited currents (n=4); F: The current-voltage relationships of L-borneol initiated currents and currents inhibited by DIDS (n=5).**P<0.01vsL-borneol.
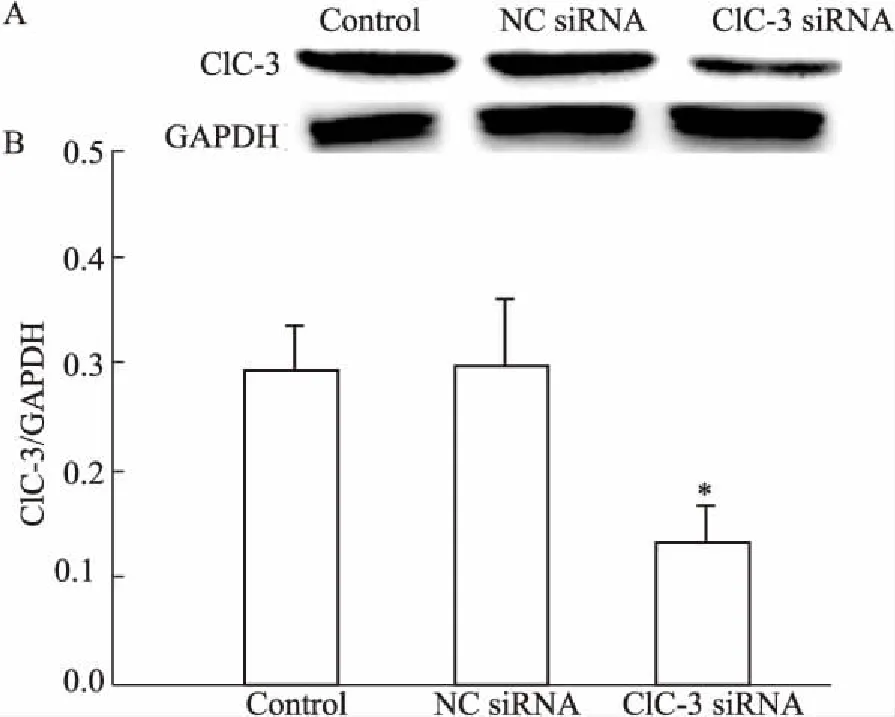
Fig 3 ClC-3 siRNA knockdowned ClC-3 protein expression in HUVECs (±s, n=3)
A: ClC-3 protein expression detected with Western blot; B: The relative intensity of ClC-3 protein expression in different treatment.*P<0.05vscontrol group.
4 讨论
左旋龙脑能明显提高丹酚酸B的小肠吸收[3],促进依文思蓝和顺铂透过血脑屏障进入脑组织和胶质瘤组织[4],可以提高栀子苷的皮肤黏膜吸收[5]。龙脑因其引药上行,促使药物跨血脑屏障转运,及其引药旁行,促使药物转运和吸收。临床上,龙脑多用于心脑血管疾病防治药物的辅剂,如复方丹参滴丸、麝香保心丸、川冰喷雾剂、通窍胶囊等[12]。近年来,龙脑的作用引起研究者的关注,其中研究较多的是龙脑增加生物膜屏障通透性作用。有研究认为,龙脑开放血脑屏障机制在于抑制了P-gp的活性[13],也有报道认为,龙脑是通过开放细胞间紧密连接、增加细胞吞饮小泡数量,从而提高屏障通透性[6]。


A: The time course of 20 nmol·L-1L-borneol activated currents inhibited by NPPB in HUVECs treated with negative control siRNA (NC siRNA); B: The time course of L-borneol induced currents in HUVECs treated with ClC-3 siRNA; C: Traces of current recording in HUVECs treated with NC siRNA; D: Traces of current recording in HUVECs treated with ClC-3 siRNA; E: The current-voltage relationships of ClC-3 siRNA group, negative siRNA group and blank control group.**P<0.01vsblank control group.
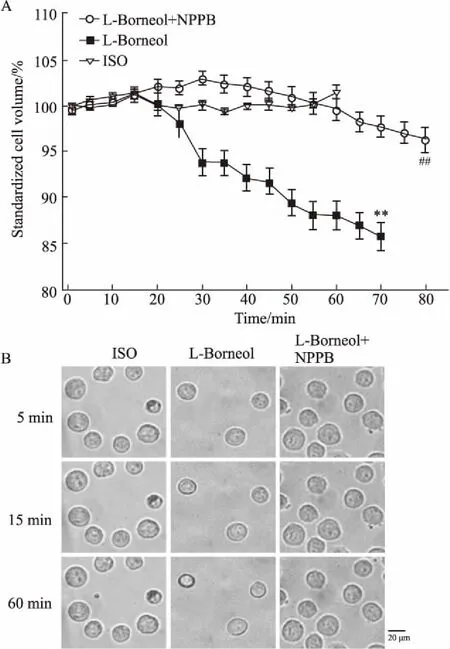
Fig 5 Chloride channels blocker inhibited cell volume changes induced by L-borneol (±s)
A: The cell volume changes of HUVECs in ISO bath (n=32), L-borneol (n=38) and L-borneol + NPPB (n=28) solution bath.**P<0.01vsISO;##P<0.01vsL-borneol; B: The cell images of different treatment at different time points.
氯通道参与多种细胞的生理活动调节,其中容积敏感性氯通道ClC-3是ClC氯通道家族中十分重要的一员,并在细胞容积、物质转运中起重要作用[8-9]。本实验室前期对龙脑的研究显示,龙脑可以激活鼻咽癌细胞CNE-2Z细胞氯电流,氯通道是龙脑促进阿霉素跨CNE-2Z细胞膜转运和促进阿霉素、罗丹明跨血脑屏障的作用靶点[14],而氯通道ClC-3在其中起重要作用。本实验使用全细胞膜片钳技术观察到左旋龙脑可以开放HUVEC氯通道,明显激活HUVEC氯电流。为进一步探讨左旋龙脑激活HUVECs氯电流的分子机制,采用siRNA技术下调HUVECs细胞ClC-3氯通道蛋白的表达后,发现左旋龙脑激活HUVECs的氯电流较正常HUVECs激活的电流明显减小,提示ClC-3氯通道可能是龙脑激活氯通道的主要分子基础。
氯通道参与维持细胞容积和内环境稳定。本实验室前期研究结果显示,当用低渗溶液灌流细胞时,细胞肿胀引起氯通道开放,触发调节性细胞容积回缩,从而维持细胞容积。当用抗肿瘤等药物灌流细胞时,细胞容积发生容积凋亡性缩小[15]。本研究发现,左旋龙脑对HUVEC细胞容积减小作用明显,结合其对HUVEC氯通道开放作用,表明左旋龙脑大量开放氯通道,使Cl-和水外流诱发HUVEC细胞容积减小。细胞容积是缝隙连接通道的调控因素,细胞皱缩时,可探测到缝隙连接通道的开放。因此,左旋龙脑很可能通过激活氯通道,触发细胞容积减小,开放缝隙连接,从而增加生物屏障通透性。这为进一步探讨氯通道在左旋龙脑提高血脑屏障通透性和促进细胞吸收药物中的作用提供了实验基础。
参考文献:
[1]Chen Z Z, Lu Y, Du S Y. Influence of borneol and muscone on geniposide transport through MDCK and MDCK-MDR1 cells as blood-brain barrierinvitromodel[J].IntJPharm, 2013,456(1):73-9.
[2]Yu B, Ruan M, Dong X. The mechanism of the opening of the blood-brain barrier by borneol: a pharmacodynamics and pharmacokinectics combination study[J].JEthnopharmacol, 2013,150(3):1096-108.
[3]雷玲,白筱璐,余悦. 三种冰片促肠吸收的比较研究[J]. 中药药理与临床, 2015,31(6):84-7.
[3]Lei L, Bai X L, Yu Y. Comparative study on intestinal absorption of three kinds of borneol[J].PharmacolClinChinMaterMed, 2015,31(6): 84-7.
[4]曹鎏. 左旋龙脑与双氢青蒿素对胶质瘤化疗的增敏作用研究[D]. 重庆:第三军医大学, 2014.
[4]Cao L. The research for sensitization effect of L-borneol and dihyroartemisinin on glioma chemotherapy[D]. Chongqing:the Third Military Medical University, 2014.
[5]陆洋,杜守颖,姚宗玲. 天然冰片、合成冰片对栀子提取物黏膜促渗作用研究[J]. 中国中药杂志, 2009,34(10):1207-10.
[5]Lu Y, Du S Y, Yao Z L. Study on natural borneol and synthetic borneol affecting mucosa permeability of gardenia extract[J].ChinaJChinMaterMed, 2009,34(10): 1207-10.
[6]葛朝莉,韩漫夫,白润涛. 冰片促进血脑屏障开放的超微结构研究[J]. 中西医结合心脑血管病杂志, 2008,6(10):1183-5.
[6]Ge Z L, Han M F, Bai R T. Effect of borneol on the ultrastructure of promoting blood brain barrier open[J].ChinJIntegrMedCardio-CerebrovascularDis, 2008,6(10):1183-5.
[7]楼屹. 体外血脑屏障建立及抗生素体外血脑屏障透过研究[D]. 杭州: 浙江大学, 2015.
[7]Lou Y. Research of establishinginvitroblood-brain barrier and antibiotics’ permeability ofinvitroblood-brain barrier[D]. Hangzhou: Zhejiang University, 2015.
[8]Chen L X, Zhu L Y, Jacob T J, Wang L W. Roles of volume-activated Cl-currenets and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells [J].CellProlif, 2007,40(2): 253-67.
[9]Zhang H, Li H, Chen L, et al. The AQP-3 water channel and the ClC-3 chloride channel coordinate the hypotonicity-induced swelling volume in nasopharyngeal carcinoma cells [J].IntJBiochemCellBiol, 2014,57: 96-107.
[10] 孟龙,王海波,邓志钦. 冰片对鼻咽癌细胞容积敏感性氯通道的激活作用 [J]. 中国药理学通报, 2014,30(12):1671-6.
[10] Meng L, Wang H B, Deng Z Q. Borneol activated volume-sensitive chloride channels in poorly differentiated nasopharyngeal carcinoma cells [J].ChinPharmacolBull, 2014,30(12):1671-6.
[11] 刘梅,罗海,王立伟. 氯通道在阿霉素诱导鼻咽癌细胞凋亡中的作用[J]. 中国药理学通报, 2015,31(9): 1249-53.
[11] Liu M, Luo H, Wang L W. Roles of chloride channels in apoptosis induced by adriamycin in nasopharyngeal carcinoma cells [J].ChinPharmacolBull, 2015,31(9): 1249-53.
[12] 季帅,张军平,吕仕超. 基于心脑同治学说探讨冰片的临床运用[J]. 中医杂志, 2013,54(2):114-6.
[12] Ji S, Zhang J P, Lyu S C. Clinical application of borneol based on the theory of simultaneous [J].TraditChinMed, 2013,54(2):114-6.
[13] 任赵燕. 冰片对血脑屏障及P-糖蛋白影响的研究[D].济南:山东中医药大学, 2016.
[13] Ren Z Y. Research on the impact of borneol on blood brain barrier and P-glycoprotein[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2016.
[14] 伍嘉宝. 氯通道在冰片促进阿霉素及罗丹明跨血脑屏障中的作用[D]. 广州:暨南大学, 2016.
[14] Wu J B. The role of chloride channels in the enhanced transport of adriamycin and rhodamine across the blood brain barrier induced by borneol[D]. Guangzhou: Jinan University, 2016.
[15] Mao J, Yuan J, Wang L, et al. Tamoxifen inhibits migration of estrogen receptor-negative hepatocellular carcinoma cells by blocking the swelling-activated chloride current [J].JCellPhysiol, 2013,228(5):991-1001.
