康复新液缓解三硝基苯磺酸致大鼠溃疡性结肠炎及其机制研究
2018-04-12张汉超王朋川耿福能马秀英张成桂
张汉超,王朋川,刘 衡,3,耿福能,马秀英,何 苗,3,张成桂,3,李 玥,3
(1. 云南省昆虫生物医药研发重点实验室;2. 药用特种昆虫开发国家地方联合工程研究中心;3. 中国西南药用昆虫及蛛形类资源开发利用协同创新中心,云南 大理 671000;4. 四川好医生药业集团,四川 成都 610000)
溃疡性结肠炎(ulcerative colitis, UC)属炎症性肠病之一,临床表现为腹痛腹泻、里急后重、黏液脓血便等,其发病机制尚未明了[1]。目前,临床上治疗UC主要以水杨酸制剂和糖皮质激素为主,代表药物有美沙拉嗪和柳氮磺胺吡啶等,但是毒副作用较大,无法长期用于治疗。研究表明,免疫失衡在UC发病过程中起重要作用,过度活化的效应细胞产生的抗体、细胞因子、炎症介质等引起组织破坏和炎性病变[2]。2,4,6-三硝基苯磺酸(2,4,6- trinitrobenzene sulfonic acid, TNBS)是一种半抗原物质,能与动物肠道黏膜组织中的蛋白质结合形成完全抗原,导致肠道免疫反应及炎症的发生。近年来研究发现,美洲大蠊(Periplanetaamericana)在调节机体免疫力、修复肠道黏膜损伤、抗炎镇痛[3]等方面有明显的作用,且以美洲大蠊研制的康复新液,在临床上采用保留灌肠治疗UC已取得了明显的疗效,也有研究探索了康复新液治疗Th2型UC的可能机制[4]。本实验用TNBS诱导SD大鼠UC模型,考察康复新液的疗效及作用机制,为康复新液用于UC临床治疗提供实验依据。
1 材料
1.1实验动物健康SPF级♂ SD大鼠(200±10)g,由湖南斯莱克景达实验动物有限公司提供,实验单位使用许可证编号:SYXK(滇)-2011-0004,许可证号:SCXK(湘)-2011-003。
1.2药物与试剂TNBS,Sigma公司,批号:SLBP0889V;康复新液,四川好医生攀西药业有限责任公司,批号:160519;柳氮磺吡啶(SASP)肠溶片,上海信宜天平药业有限公司,批号:H31020557;大鼠白细胞介素-4(interleukin-4,IL-4)ELISA试剂盒,欣博盛生物科技有限公司,批号:R150929-002a;隐血试剂盒、大鼠白细胞介素-17(interleukin-17,IL-17)、髓过氧化物酶(myeloperoxidase,MPO)、表皮生长因子(epidermal growth factor,EGF)试剂盒、转化生长因子-1(transforming growth factor-1,TGF-β1)试剂盒,南京建成生物工程研究所;生理盐水(NS),贵州天地药业有限责任公司;水合氯醛,上海国药集团化学试剂有限公司;无水乙醇、甲醛溶液,天津市福晨化学试剂厂。
1.3仪器2010酶标仪,奥地利安图斯公司;BI-2000医学图像分析系统,成都泰盟科技有限公司;AL204-IC型电子分析天平,瑞士梅特勒-托利多仪器有限公司;HWS24恒温水浴锅,上海一恒科学仪器有限公司;HC-3018R高速离心机,安徽中科中佳科学仪器有限公司;先行者CP214电子天平,上海奥豪斯仪器有限公司。
1.4受试药的配制将康复新液用冷冻干燥机干燥成黏稠状浸膏,用生理盐水配制成浓度分别为167、83.5、41.75 g·L-1的高、中、低剂量溶液,按大鼠体重15 mL·kg-1给药。
2 方法
2.1动物模型的制备取60只♂ SD大鼠,根据Morris等[5]描述的方法,复制TNBS诱导的UC模型。大鼠禁食不禁水24 h,用10 g·L-1水合氯醛溶液按3.0 mL·kg-1麻醉大鼠,用直径2 mm的聚乙烯管于直肠内约8 cm处,按75 mg·kg-1灌入TNBS-乙醇溶液(乙醇终体积分数为0.3),注入后,大鼠倒置使溶液保留10 s,待清醒后正常喂养。另取10只大鼠作为正常组(normal),采取与模型复制相同操作,但灌肠用生理盐水。
2.2动物分组、给药及DAI评分造模后d 7(以造模当日为d 0计),参考Hamamoto等[6]标准,将大鼠进行疾病活动指数(disease activity index,DAI)评分(以0~3分为极轻度炎症、4~6分轻度炎症、7~9分为中度炎症、10~12分为重度炎症),按炎症严重程度分层随机分为模型组(model,NS),SASP组(0.3 g·kg-1)和康复新液高、中、低剂量组(KFX 2.50、1.25、0.62 g·kg-1)。分组次日(d 8)开始给药,除正常组和模型组给予生理盐水灌肠,其余各药物组给予相应的药物灌肠,每天1次,连续给药14 d,于造模后d 1、4、7、10、14、21进行DAI评分。
2.3血清IL-4、IL-17含量的检测末次给药后次日(d 22),用质量分数为10 g·L-1的水合氯醛麻醉大鼠,腹主动脉取血,4℃静置凝固后,3 000 r·min-1离心10 min,取上层血清,用试剂盒检测IL-4、IL-17含量。
2.4脏器指数、结肠长宽及CMDI的测定解剖取胸腺、肝脏、脾脏、肺脏、肾脏等脏器,称量质量,计算脏器指数(脏器指数=各脏器质量/体质量×100%)。沿肠系膜缘剪开肠腔,生理盐水冲洗粪便,观察肠壁,称量湿质量。采集结肠照片,参照标准[7]进行结肠黏膜损伤指数(colonmucosa damage index,CMDI)评分。
2.5结肠组织MPO、EGF和TGF-β1含量的检测切取病变严重区域结肠组织0.15 g,按1 ∶9(W/V)生理盐水匀浆,3 500 r·min-1离心10 min,取上清液,用试剂盒检测上清液中MPO、EGF、TGF-β1的含量。
2.6结肠组织HS评分剩余结肠用40 g·L-1甲醛固定,制作病理切片,并参照标准[8]进行病理组织学(histopathological score,HS)评分。

3 结果
3.1康复新液对UC大鼠DAI评分的影响实验期间,正常组大鼠反应灵活,进食正常,无腹泻及血便,大便呈球形或条形,未出现异常情况。其余大鼠自造模后d 1均出现不同程度的厌食、懒动、体重下降、大便隐血或血便。d 7进行分组后的各组大鼠DAI评分组间差异无统计学意义,说明各造模组大鼠炎症程度具有一致性,而与正常组比较差异均有显著性(P<0.01)。给药前期,模型组大鼠(生理盐水灌肠)血便、腹泻加重,体重下降明显,后期有所缓解,粪便逐渐转为松散,并且体重有回升的趋势。末次给药结束后(d 21),模型组大鼠DAI评分仍明显高于正常组(P<0.01),经SASP和康复新液治疗的大鼠症状恢复较快,SASP组和康复新液各剂量组DAI评分明显低于模型对照组(P<0.01)。不同时间点大鼠的DAI分值见Tab 1。
3.2康复新液对UC大鼠脏器指数、结肠长宽及

Tab 1 Effect of Kangfuxin liquid on DAI score of UC rats (±s, n=10)
*P<0.05,**P<0.01vsnormal;##P<0.01vsmodel;ΔP<0.05vsSASP

Tab 2 Effect of Kangfuxin liquid on colon and CMDI score of UC rats (±s, n=10)
*P<0.05,**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel
CMDI评分的影响末次给药次日(造模后d 22),正常组、模型组与各给药组在肝脏指数、脾脏指数和胸腺指数上并无显著性差异。正常组大鼠肉眼观察结肠黏膜无明显水肿、糜烂和溃疡形成。模型组大鼠肠壁可见明显的充血和水肿,结肠明显缩短(P<0.05或P<0.01);沿肠系膜纵向剖开可见肠壁黏膜有散在的溃疡点和糜烂,病变主要累及远端结肠,CMDI评分升高(P<0.01)。SASP组和康复新液各剂量组大鼠肠黏膜病变较模型对照组明显好转,结肠指数均明显降低(P<0.01)。见Tab 2。
3.3康复新液对UC大鼠血清IL-4和IL-17含量的影响如Fig 1所示,与正常组比较,模型组大鼠血清IL-4含量明显降低(P<0.01)、IL-17含量明显升高(P<0.05)。与模型组比较,SASP组和康复新液各剂量组大鼠血清IL-4含量均不同程度升高(P<0.05或P<0.01),而康复新液高剂量组IL-17含量明显降低(P<0.05)。
3.4康复新液对UC大鼠结肠组织MPO、EGF和TGF-β1含量的影响如Fig 2所示,与正常组比较,模型组大鼠结肠MPO含量明显升高(P<0.01),EGF和TGF-β1含量明显降低(P<0.01)。与模型组比较,SASP组及康复新液中、高剂量组大鼠结肠MPO含量明显降低(P<0.01),EGF和TGF-β1含量不同程度升高(P<0.05或P<0.01)。
3.5康复新液对UC大鼠结肠组织HS评分的影响显微镜下观察结肠组织病理切片,正常对照组黏膜上皮完整,可见杯形细胞,隐窝形态正常,炎细胞浸润不明显;其余各造模组大鼠结肠黏膜上皮可见不同程度的破损、杯状细胞和隐窝大量丢失,黏膜层和黏膜肌层炎性细胞大量浸润,并伴有明显水肿(Fig 3)。模型组HS评分明显高于正常组(P<0.01),SASP组和康复新液各剂量组HS评分均较模型组不同程度降低(P<0.05或P<0.01),且康复新液高剂量组与SASP组效果相当。
4 讨论
溃疡性结肠炎病因和发病机制尚不明确,可能由遗传、环境、免疫等多因素相互作用导致。CD4+T细胞根据其功能分为Th1和Th2亚群,Th1细胞促进机体免疫反应,促进炎症发生,Th2则降低机体的免疫反应,T细胞的分化由Th1/Th2细胞因子诱导,Th1与Th2细胞平衡状态的破坏会导致免疫功能紊乱[9]。TNBS诱导SD大鼠的UC模型具有重复性好、造模时间短、炎症维持时间长等特点,并以引起Th1介导的反应为主,其组织学改变的许多特点与人类相似,被广泛用于结肠炎的药物研究[10]。

Fig 1 Changes of serum levels of IL-4 and IL-17 in rats (n=10)
*P<0.05,**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel;ΔP<0.05vsSASP
IL-4为Th2细胞因子,可诱导T细胞向Th2型分化,是抑制炎症反应和维持肠道免疫平衡的抗炎因子[11]。TGF-β1是一种具有较强抗炎作用的多效细胞因子,其主要作用是抑制炎症反应、调节细胞生长、增强免疫等[12]。本实验中,模型组血清IL-4含量、结肠组织TGF-β1明显低于正常组,提示TNBS诱导Th1型UC可能是因为该模型中Th2细胞因子IL-4的减少,导致Th1/Th2失衡。而康复新液可以使IL-4、TGF-β1水平升高,提示康复新液可调节抑炎因子的表达,使机体免疫功能重新恢复平衡状态。
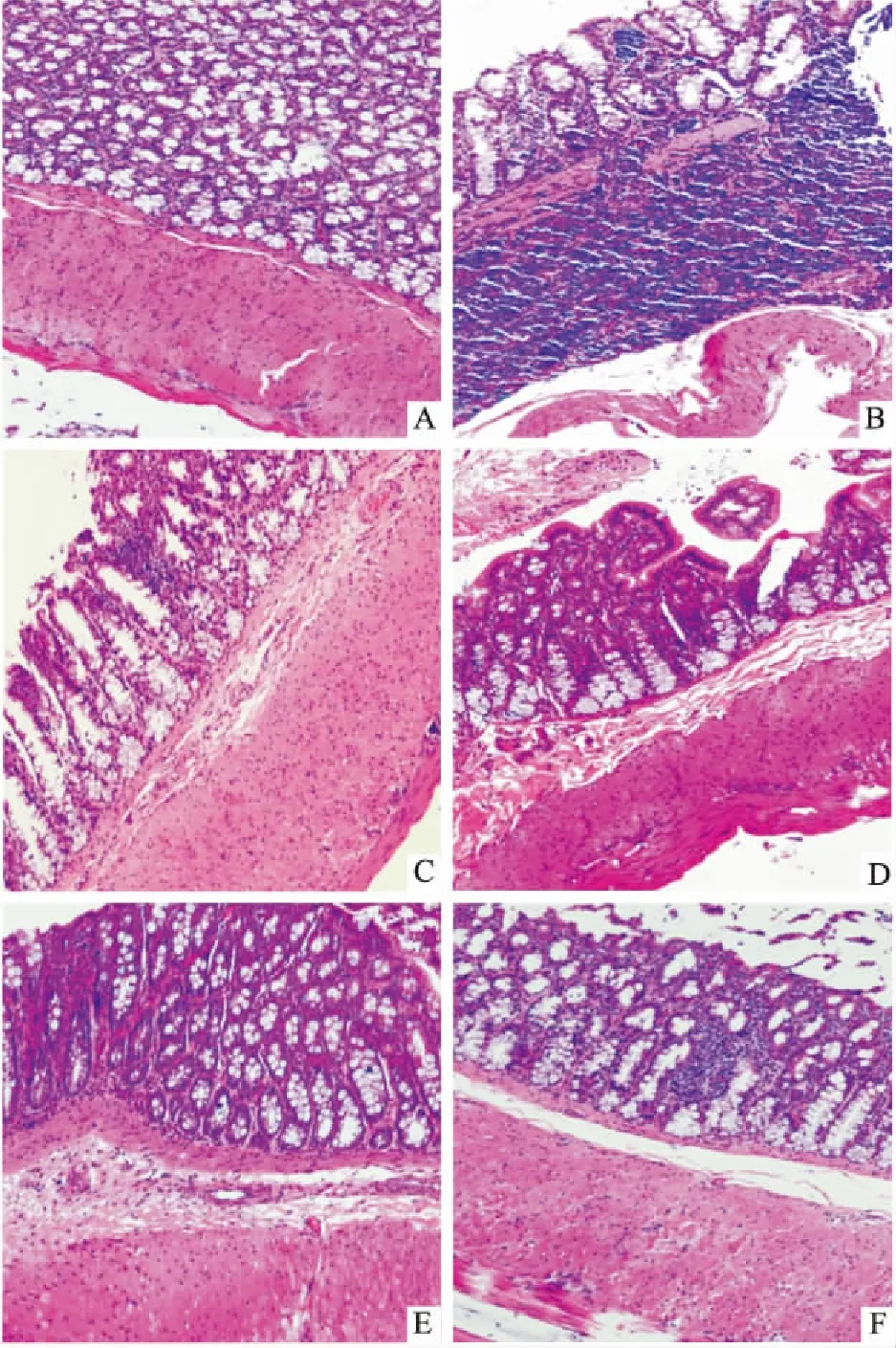
Fig 3 Representative HE-stained colon sections(×100)
A: Normal; B: Model; C: SASP; D: KFX-low; E: KFX-medium; F: KFX-high
IL-17由Th17细胞分泌,具有较强激活嗜中性粒细胞能力,诱导炎症的发生和组织损伤[13]。MPO由中性粒细胞分泌,其活性是中性粒细胞浸润的重要指标,也能间接反映肠道炎症活动程度,并可促进炎症部位细胞损伤[14]。本实验模型组中IL-17、MPO的表达明显升高,肠黏膜有大量炎性细胞浸润。而康复新液给药能明显下调IL-17、MPO含量,改善黏膜病理结构,提示康复新液可抑制中性粒细胞浸润、抑制炎症因子释放,从而限制炎症的发生和发展。
EGF具有诱导细胞分化、刺激组织生长修复、维持上皮细胞新陈代谢等重要功能[15]。实验结果发现,模型组EGF含量低于正常组,药物组均较模型组明显升高,提示康复新液可促进病变部位修复。
综上所述,康复新液对大鼠UC炎症有缓解作用,通过调节促炎因子与抑炎因子使到达平衡,抑制机体炎症,改善结肠组织病理变化,促进肠黏膜修复。
(致谢:大理大学昆虫生物医药研究院部分硕士研究生、教师及大理州第一人民医院病理科戴莉萍老师、陈莹老师曾参与承担本课题工作,谨此致谢。)
参考文献:
[1]闫惠俊, 龙致贤, 常章富, 等. 中医药治疗溃疡性结肠炎研究进展[J]. 中成药, 2001,23(9): 683-7.
[1]Yan H J, Long Z X, Chang Z F, et al. Development in study of ulcerative colitis cured by traditional Chinese medicine[J].ChinTraditPatentMed, 2001,23(9): 683-7.
[2]魏永凯, 李辉, 李贵轲,等. 溃疡性结肠炎炎症介质与免疫应答的研究[J]. 广州化工, 2016,44(9): 10-2,18.
[2]Wei Y K, Li H, Li G K, et al. Relationship between immunity and inflammation in ulcerative coliti[J].GuangzhouChemInd, 2016,44(9): 10-2,18.
[3]Luo T S, Gao M T, Ma F F, et al. Research advances in pharmacological action and clinical application of Periplaneta americana.[J].AgricSciTechnol, 2012,13(4) : 888-92.
[4]潘庚, 朱桢. 康复新液保留灌肠治疗溃疡性结肠炎[J]. 临床荟萃, 2011,26(14):1258-9.
[4]Pan G, Zhu Z. Kangfuxin retention enema in treatment of ulcerative colitis[J].ClinFocus, 2011,26(14): 1258-9.
[5]Morris G P, Beck P L, Herridge M S, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology, 1989,96(3):795-803.
[6]Hamamoto N, Maemura K, Hirata I, et al. Inhibition of dextran sulphate sodium (DSS)-induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-1 (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1))[J].ClinExpImmunol, 1999,117(3):462-8.
[7]布图雅, 孙勤暖, 广布加甫·藏登,等. 蒙药尼如哈优化剂对溃疡性结肠炎相关癌小鼠的一般情况和结肠组织病变的影响[J]. 中成药, 2015,37(4):883-7.
[7]Butuya, Sun Q N, Guangbujiafu Z, et al. The general situation of the Mongolian medicine and the influence of the colon tissue lesion in the mice with ulcerative colitis[J].ChinTraditPatentMed, 2015,37(4):883-7.
[8]魏永凯, 耿福能, 赵微,等. 美沙拉嗪、柳氮磺胺吡啶对葡聚糖硫酸钠诱导的Balb/c小鼠急性溃疡性结肠炎的治疗和免疫影响[J]. 中国医院药学杂志, 2016,36(14):1190-5.
[8]Wei Y K, Geng F N, Zhao W, et al. Therapeutic effects and immunization of mesalazine and SASP on active ulcerative colitis model of Balb/c mice induced by DSS[J].ChinHospPharmJ, 2016,36(14):1190-5.
[9]刘莉, 王志鹏, 梅其炳,等. 大黄多糖对TNBS诱导的大鼠结肠炎CD4+T细胞的影响[J]. 中国药理通讯, 2003,20(1): 41.
[9]Liu L, Wang Z P, Mei Q B, et al. Effect of rhubarb polysaccharide on CD4+T cells in TNBS-induced colitis rats [J].ChinPharmacol, 2003,20(1): 41.
[10] 周长玉, 王江滨, 王立英. Th1/Th2介导免疫反应在TNBS诱导炎症性肠病动物模型中的作用探讨[J]. 中国实验诊断学, 2007,11(12):1684-6.
[10] Zhou C Y, Wang J B, Wang L Y. The role of Th1/Th2 mediated immune response in TNBS induced inflammatory bowel disease model[J].ChinJLabDiagn, 2007,11(12): 1684-6.
[11] 郭艳娥, 霍丽娟. 康复新联合5-ASA对溃疡性结肠炎大鼠结肠黏膜IFN-γ、IL-4和IL-12表达的影响[J]. 中华临床医师杂志:电子版, 2013,7(21): 9638-41.
[11] Guo Y E, Huo L J. Effects of combined therapy with Kangfuxin and 5-ASA on the expression of IFN-γ, IL-4, IL-12 in rats with ulcerative colitis[J].ChinJClin(ElectronicEd), 2013,7(21): 9638-41.
[12] 赵海梅, 刘端勇, 汤菲,等. 四神丸对小鼠溃疡性结肠炎结肠黏膜修复的保护性机制研究[J]. 中成药, 2009,31(12):1935-7.
[12] Zhao H M, Liu R Y, Tang F, et al. Study on protective mechanism of the mucosal repair of ulcerative colitis in mice[J].ChinTraditPatentMed, 2009,31(12):1935-7.
[13] 施沛青, 朱书, 钱友存. IL-17的信号传导及功能研究[J]. 中国细胞生物学学报, 2011,33(4): 345-57.
[13] Shi P Q, Zhu S, Qian Y C. IL-17 signaling and function[J].ChinJCellBiol, 2011,33(4): 345-57.
[14] 孙阿宁, 任改艳, 邓超,等. 牡荆素减轻小鼠溃疡性结肠炎的药效作用及机制研究[J]. 中国药理学通报, 2014,30(12): 1677-81.
[14] Sun A N, Ren G Y, Deng C, et al. Effects and mechanisms of vitexin against ulcerative colitis in mice[J].ChinPharmacolBull, 2014,30(12): 1677-81.
[15] 杜伟. 兰茵凤扬化浊解毒方对溃疡性结肠炎大鼠ITF、EGF及MAPK/ERK表达的实验研究[D]. 石家庄:河北医科大学, 2015.
[15] Du W. Effect of Lanyinfengyang Huazhuojiedu decoction in the concent of ITF, EGF and MAPK/ERK expression on ulcerative colitis model rats[D]. Shijiazhuang: Hebei Medical University, 2015.
