糖尿病高糖高脂对四氯化碳诱导的大鼠肝纤维化的作用研究
2018-04-12左龙泉汪应红
左龙泉,王 欢,汪应红,黄 艳
(安徽医科大学药学院基础与临床药理学教研室,安徽 合肥 230032)
糖尿病是继肿瘤、心血管疾病后医学界的三大疑难病之一,严重危害人类的生命安全与健康。有报道指出,在世界范围内,大约有3.4亿人患有糖尿病[1],而我国是糖尿病第一大国。肝脏是糖代谢的主要场所,有报道称糖尿病可增加肝硬化[2]、肝损伤[3]、肝癌[4]等一系列肝脏疾病的发生。肝纤维化是机体对慢性损伤的修复反应,是多种慢性肝病发展至肝硬化的必经阶段。有研究表明,高血糖能加剧肝脏相关疾病的进展。在慢性丙型肝炎患者中,高血糖是纤维化进展的一项独立的协同因素,伴随着更高的促纤维化效应[5]。在酒精诱导的肝脏疾病中,高血糖也作为一项很重要的促纤维化因子[6]。深入研究糖尿病相关肝纤维化的发病特点和发病机制,将有助于对糖尿病促发的肝纤维化的预防与治疗,具有重要临床意义。但目前能较好模拟人体高血糖并发/高发肝纤维化相关的实验动物模型尚缺,严重阻碍了机制等相关研究进展。为进一步探讨糖尿病对肝纤维化发生发展的影响,实验采用高脂喂养结合链脲佐菌素(streptozotocin,STZ)诱导糖尿病大鼠模型[7],四氯化碳(carbon tetrachloride,CCl4)诱导肝纤维化大鼠模型,观察糖尿病对CCl4诱导的大鼠化学性肝损伤/肝纤维化的作用。
1 材料与方法
1.1 材料
1.1.1实验动物与饲料♂ Spague-Dawlay(SD)大鼠,SPF级,体质量(100~140) g,购自安徽医科大学实验动物中心。基础饲料及高脂饲料,由安徽医科大学实验动物中心提供,高脂饲料配方为:59%基础饲料、20%蔗糖、10%猪油、10%蛋黄粉、1%胆固醇。蛋黄粉购自亳州市红日实业有限责任公司。
1.1.2试剂CCl4(灿头西陇化工厂有限公司);安稳血糖试纸条(长沙三诺生物传感技术有限公司);STZ(美国Sigma公司);天冬氨酸转氨酶(aminotransferase,ALT)、丙氨酸转氨酶(aspartate transaminase, AST)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TCH)测试盒(南京建成生物工程研究所);细胞组织裂解液RIPA、蛋白酶抑制剂PMSF(上海碧云天公司);抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、I型胶原(Collagen I)、β-actin抗体(北京博奥森生物技术有限公司)。
1.1.3仪器安稳型血糖仪(长沙三诺生物传感技术有限公司);Western blot设备(美国Bio-Rad公司);ABI9700型PCR仪(美国ABI公司);3-16K高速离心机(美国Sigma公司);荧光倒置显微镜(日本Olympus公司);FA2004 型电子天平(上海精天天平厂)。
1.1 方法
1.2.1药物的配制柠檬酸缓冲液(pH 4.2~4.4):称取一定量柠檬酸和柠檬酸三钠,分别配制100 mL的0.1 mol·L-1的溶液;取柠檬酸溶液50 mL,加入柠檬酸三钠溶液(约60 mL),测定pH,混合均匀后4℃保存备用。STZ溶液的配制:避光称取一定量的STZ,加入柠檬酸缓冲液(pH 4.2~4.4),配制成1%的STZ柠檬酸盐缓冲液。CCl4油溶液的制备,四氯化碳 ∶橄榄油溶液=2 ∶3。
1.2.2动物分组与模型建立实验动物随机分为糖尿病组(n=45)、肝纤维化组(n=15)、对照组(n=15)。适应性饲养1周后,糖尿病大鼠用高脂饲料喂养6周,对照组和肝纤维化组用基础饲料喂养。6周后,糖尿病大鼠隔夜禁食12 h,腹腔注射0.1 mmol·L-1的STZ(45 mg·kg-1)柠檬酸盐缓冲液,肝纤维化组和对照组注射等体积柠檬酸盐缓冲液。72 h后尾尖采血测定空腹血糖,若空腹血糖≥7 mmol·L-1入糖尿病组[8]。继续喂养4周监测血糖,待血糖稳定后(模型确定成功),随机抽取糖尿病大鼠20只和肝纤维化组大鼠皮下注射40% CCl4植物油溶液,首剂4 mL·kg-1,以后2 mL·kg-1,2次/周,共8周。对照组皮下注射等体积植物油溶液,在最后一次注射CCl4植物油溶液72 h后,隔夜禁食处死。实验期间糖尿病大鼠维持高脂饲料喂养,对照组和肝纤维化组用基础饲料喂养。每2周定期称量大鼠体重及尾尖采血测定大鼠血糖,记录大鼠体重及血糖变化。
1.2.3葡萄糖耐量实验(OGTT)注射STZ 72 h后,对糖尿病大鼠进行OGTT检测(实验前禁食8 h),灌胃给予大鼠葡萄糖(2 g·kg-1),在0、0.5、1、2 h分别采尾静脉血,测定血糖水平。
1.2.4HE染色在大鼠肝脏右叶相同位置取组织,用10%甲醛溶液固定48 h后,石蜡包埋,切片,HE染色,光镜下观察染色结果并拍照,分析和评价大鼠肝损伤和纤维化程度。
1.2.5血清学指标检测大鼠麻醉后剖腹,腹主动脉取血,4℃、3 500×g,离心15 min,取上层血清按测试盒说明书测定TG、TCH、AST、ALT。
1.2.6Western blot检测蛋白表达取大鼠肝组织50 mg于匀浆器中剪碎,加入1 mL RIPA蛋白裂解液(含PMSF),冰上充分研磨至均匀混悬液后,转移至1.5 mL的EP管中,4℃、12 000 r·min-1离心30 min,收集上清。用定量仪对蛋白样品定量,调整浓度后,加入5×蛋白上样缓冲液,100℃煮10 min使蛋白变性。每孔加15 μL总蛋白,进行SDS-PAGE电泳,采用湿转法将蛋白转移至PVDF膜上,膜用5%脱脂奶粉(TBST配制)在室温下封闭3 h,用TBST清洗后,一抗4℃孵育过夜。次日,取出PVDF膜用TBST清洗后,与相应二抗室温孵育1 h,ECL发光试剂盒显影,以β-actin为内参,Image J 软件分析条带的灰度值。
1.2.7q-PCR检测基因表达取大鼠肝组织30 mg于匀浆器中剪碎,加入1 mL TRIzol裂解液,冰上充分研磨至均匀混悬液后,转移至1.5 mL的EP管中,加入0.2 mL的氯仿,颠倒混匀,4℃、12 000 r·min-1离心15 min;转上层水相至另一EP管中,加等体积异丙醇,颠倒混匀后于-20℃助沉1 h;取出,4℃、12 000 r·min-1离心15 min,弃上清,加入预冷的75%乙醇;4℃、7 500 r·min-1离心5 min后,弃去上清,干燥5 min,加入适量的无酶水;逆转录前,RNA用定量仪测定浓度,采用10 μL逆转录反应体系,根据逆转录试剂盒说明书操作。q-PCR反应,将cDNA用无酶水稀释10倍,上、下游引物各稀释10倍后,按10 μL体系将反应物加至q-PCR 96孔反应板中,每组至少3个复孔,冰上操作,引物序列见Tab 1。

2 结果
2.1大鼠的一般情况对照组大鼠精神状态良好、活动自如、皮毛正常无明显脱落;肝纤维化组大鼠精神状态一般,不喜运动,伴有毛发脱落;糖尿病组大鼠精神状态较差,行动迟缓,皮毛粗糙;糖尿病合并肝纤维化双模型组大鼠精神差,反应迟钝,皮毛凌乱无色泽,易脱落。高脂加STZ建立糖尿病模型成模率很高,45只大鼠共有42只成功,实验结束时,糖尿病及双模型组共有5只大鼠死亡,正常组和肝纤维化组无死亡,实验数据取每组10只进行统计学分析。
2.2注射STZ后大鼠的血糖变化注射STZ 72 h后,对大鼠进行OGTT检测。Tab 2 OGTT结果显示,糖尿病大鼠空腹血糖(0 h)和2 h血糖均升高。
2.3各组大鼠空腹血糖动态监测在初步确定糖尿病模型成功后,监测4周空腹血糖,观察模型的稳定性。Tab 3结果显示,与对照组相比,糖尿病组大鼠血糖明显升高。4~12周纤维化和双模型组CCl4造模,动态观察各组大鼠血糖,结果显示,与对照组各时间段相比,糖尿病组空腹血糖稳定升高(P<0.01),肝纤维化组无明显变化,糖尿病合并肝纤维化组空腹血糖明显升高(P<0.01);与单纯糖尿病组相比,糖尿病合并肝纤维化组空腹血糖无明显变化。
2.4各组大鼠体重动态变化在适应性喂养1周,糖尿病组高脂喂养6周,其它组普通饲料喂养6周后,各组大鼠体重增加明显,但各组之间无差异。随后,每2周定期测定大鼠体重,Tab 4结果显示,正常组大鼠体重逐渐升高,糖尿病组与双模型组大鼠体重降低,肝纤维组在未造模前,体重逐渐升高,造模后缓慢降低;与对照组各时间段相比,糖尿病大鼠从STZ注射后4周开始,大鼠体重明显降低(P<0.05或P<0.01),肝纤维化组0~12周体重均无明显变化,糖尿病合并肝纤维化组大鼠体重明显降低(P<0.01);与糖尿病组各时间段相比,糖尿病合并肝纤维化组体重无明显变化;与肝纤维化组各时间段相比,糖尿病合并肝纤维化组体重明显降低(P<0.01)。
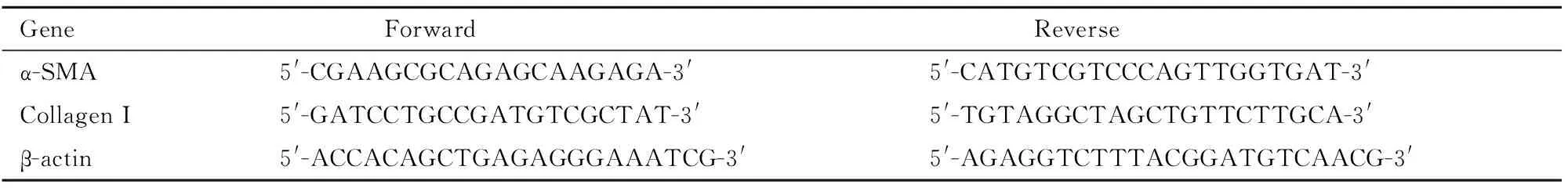
Tab 1 Primer sequences

Tab 2 OGTT levels of STZ-induced rats(±s,n=10)
**P<0.01vscontrol group

Tab 3 The dynamic changes of blood glucose(±s, n=10)
**P<0.01vscontrol group;##P<0.01vsliver fibrosis group

Tab 4 The body weight of each group rats(±s, n=10)
*P<0.05,**P<0.01vscontrol group;##P<0.01vsliver fibrosis group
2.5各组大鼠肝组织病理学检查如Fig 1 HE染色所示,对照组大鼠肝细胞排列整齐,肝组织结构完整;糖尿病组肝脏结构轻度破坏,有炎性坏死、脂肪变性;肝纤维化组肝组织结构破坏较严重,细胞出现广泛脂肪变性、炎性坏死,以汇管区及中央静脉周围较重,且有胶原纤维沉积;糖尿病合并肝纤维化双模型组肝组织结构破坏严重,肝细胞严重脂肪变性、炎性坏死,纤维结缔组织增生形成纤维条索,伸入肝实质内。
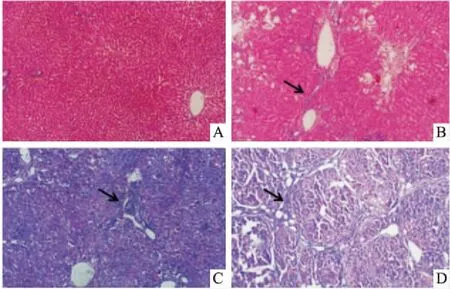
Fig 1 HE staining of rat liver tissues(×200)
A: Control group; B: Diabetes group; C: Liver fibrosis group; D: Double models group.
2.6血清TG和TCH的变化如Fig 2所示,与对照组相比,糖尿病组大鼠TCH及TG值升高(P<0.01),肝纤维化组无明显差异;与糖尿病和肝纤维化组相比,双模型组大鼠TCH及TG值均明显升高,差异具有显著性(P<0.01)。

Fig 2 TG and TCH levels of each group
**P<0.01vscontrol group;##P<0.01vsdiabetes group;△△P<0.01vsliver fibrosis group
2.7血清AST和ALT的变化如Fig 3所示,与对照组相比,糖尿病大鼠和肝纤维化组大鼠AST和ALT值均升高(P<0.01);与糖尿病组和肝纤维化组相比,双模型组大鼠AST和ALT值升高,差异均有统计学意义(P<0.05,P<0.01)。
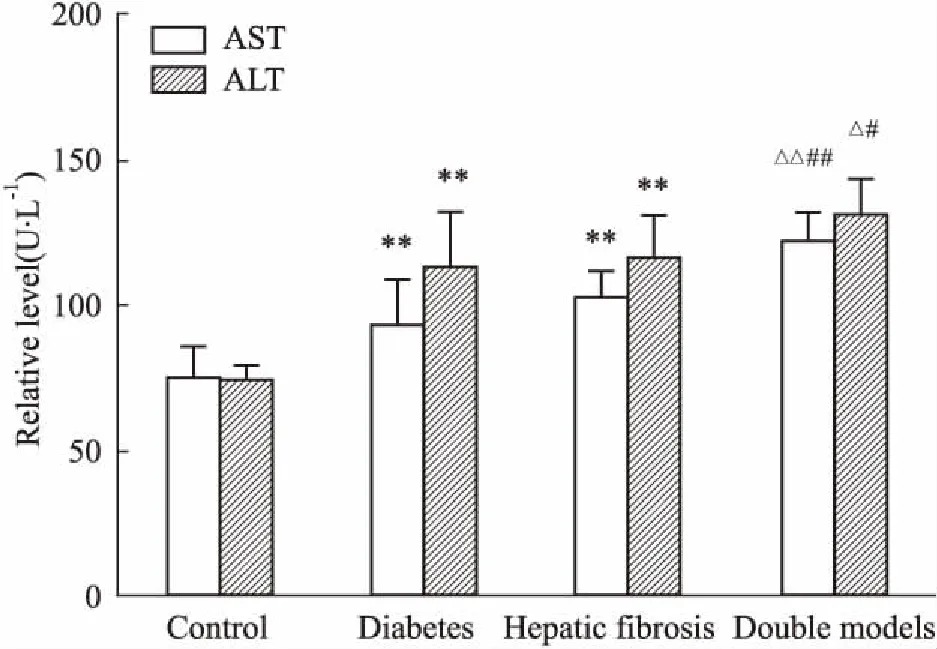
Fig 3 The AST and ALT levels of each groups
**P<0.01vscontrol group;#P<0.05,##P<0.01vsdiabetes group;△P<0.05,△△P<0.01vsliver fibrosis group
2.8α-SMA和CollagenI的蛋白表达如Fig 4所示,与对照组相比,3组大鼠α-SMA和Collagen I的蛋白表达均增加(P<0.05,P<0.01),糖尿病合并肝纤维化双模型组与单纯糖尿病和肝纤维化组相比,差异均有统计学意义(P<0.01)。
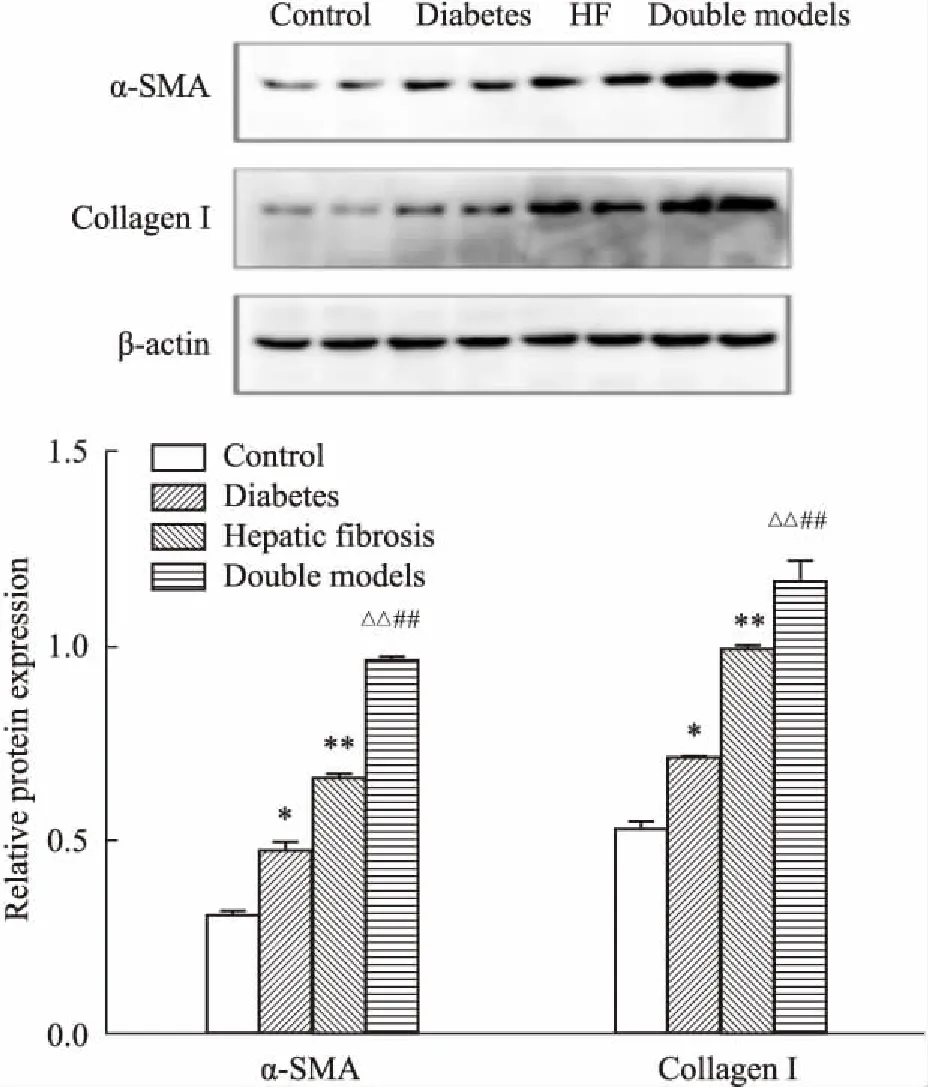
Fig 4 Expression of α-SMA and collagen I
*P<0.05,**P<0.01vscontrol group;##P<0.01vsdiabetes group;△△P<0.01vsliver fibrosis group
2.9α-SMA和CollagenI的基因表达如Fig 5所示,与对照组相比,3组大鼠α-SMA、Collagen I mRNA表达均增加(P<0.01),增加最明显的是糖尿病合并肝纤维化双模型组,与单纯糖尿病和肝纤维化组相比,差异有统计学意义(P<0.01)。
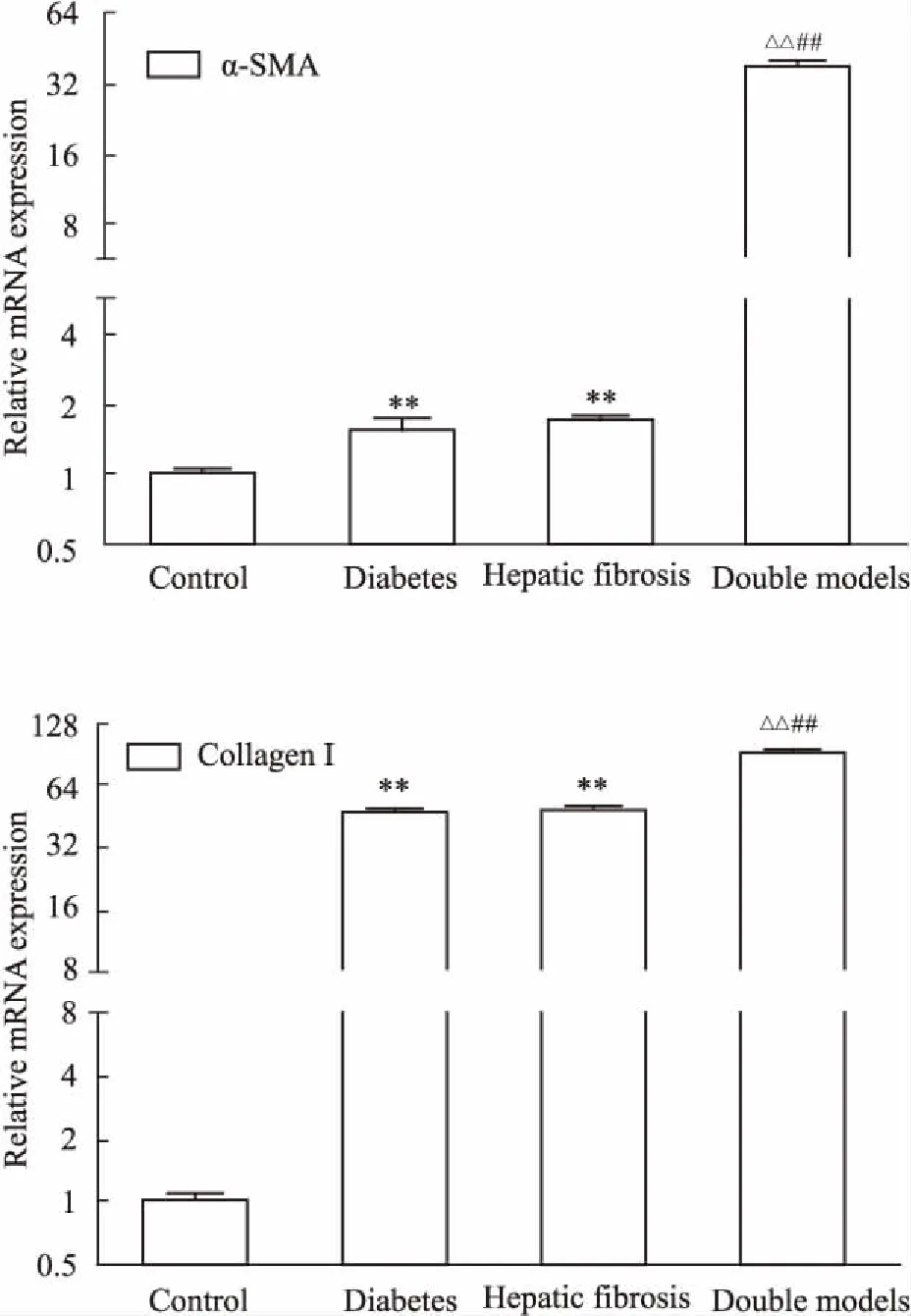
Fig 5 Expression of α-SMA and collagen I
**P<0.01vscontrol group;##P<0.01vsdiabetes group;△△P<0.01vsliver fibrosis group
3 讨论
肝纤维化是肝脏对自身多次创伤修复的结果,可由多种因子引起的慢性疾病,其本质是以α-SMA、Collagen I等为主要成分的细胞外基质(extracellular matrix, ECM)的过度沉积[9]。糖尿病是一类慢性的、具有破坏性和与年龄相关的代谢性疾病[10],其对肝脏的正常功能有着一定的影响,可增加一系列肝脏疾病的发生,如肝癌、肝硬化等[2-4]。研究表明,高血糖对肾脏、神经、血管的纤维化形成均有明显的促进作用[8]。近期有报道指出,体外高糖培养可以刺激肝星状细胞的增殖和胶原的生成[8,11],诱导肝星状细胞炎症因子释放[12]。
STZ是一种广谱抗生素,其对动物的胰岛β细胞有着高度选择性毒性作用,因此可作为糖尿病模型的工具药使用来诱导糖尿病[13-15]。本实验采用高脂喂养后腹腔注射STZ的方法,制备类似于人体的2型糖尿病大鼠模型。OGTT检测确定糖尿病模型成功。定期检测血糖和体重。结果显示,大鼠在注射STZ造模后,空腹血糖稳定升高,体重明显降低,表明模型稳定,造模成功。临床上糖尿病患者多伴有血清学指标TG和TCH的升高,本实验结果显示,与对照组相比,糖尿病组大鼠TG和TCH值均升高,亦提示糖尿病大鼠模型构建成功。HE结果显示,糖尿病组大鼠肝组织出现一定的损伤并有炎症和脂肪变性,提示糖尿病与肝脏疾病的发生有着密切联系,而糖尿病合并肝纤维化模型大鼠与单纯肝纤维化组相比,大鼠肝组织损坏更严重,肝纤维化程度明显加深,提示糖尿病本身可加重CCl4化学性肝损伤致肝纤维化的进程。
AST和ALT是常用检测肝功能的血清转氨酶指标,血液中AST和ALT水平升高,提示肝脏受损或损坏。本实验中AST和ALT检测结果显示,与对照组相比,糖尿病大鼠和肝纤维化组大鼠AST和ALT值均升高,与糖尿病组和肝纤维化组相比,双模型组大鼠AST和ALT值升高更明显,差异有统计学意义,提示糖尿病组和肝纤维化组大鼠均有不同程度的肝损伤,且糖尿病本身可加重CCl4诱导的肝损伤程度。α-SMA和Collagen I 是肝纤维化中ECM的主要成分,肝组织中ECM的生成和降解直接影响肝纤维化的生成。各组大鼠α-SMA和Collagen I的表达结果显示,与对照组相比,糖尿病组大鼠α-SMA、Collagen I mRNA及蛋白表达均增加,且有统计学差异,糖尿病合并肝纤维化双模型组升高的更明显,与单纯糖尿病和肝纤维化组相比有统计学差异。提示糖尿病高糖高脂状态可能通过影响ECM的生成和(或)降解,参与肝纤维化的发生、发展,但具体机制如何,有待于进一步的实验验证。
综上所述,糖尿病本身可诱发肝损伤,尚可加剧CCl4诱导的肝纤维化的病变,其机制可能与影响ECM的生成和(或)降解有关,为临床上防治糖尿病相关性肝纤维化提供了新的思路。
参考文献:
[1]Guo R,Wu Z,Jiang J, et al. New mechanism of lipotoxicity in diabetic cardiomyopathy: deficiency of endogenous H2S production and ER stress[J].MechAgeingDev, 2017,162:46-52.
[2]Katsura E, Ichikawa T, Taura N, et al. Elevated fasting plasma glucose before liver transplantation is associated with lower post transplant survival[J].MedSciMonit, 2016,22:4707-15.
[3]Davis T M, Peters K E, Bruce D G, Davis W A. Prevalence, incidence, and prognosis of hepatobiliary disease in community-based patients with type 2 diabetes: the fremantle diabetes study[J].ClinEndocrinolMetab, 2012,97(5):1581-8.
[4]El-Serag H B,Tran T,Everhart J E. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma[J].Gastroenterology, 2004,126:460-8.
[5]Ratziu V,Munteanu M,Charlotte F, et al. Fibrogenic impact of high serum glucose in chronic hepatitis C [J].Hepatology, 2003,39(6):1049-55.
[6]Raynard B,Balian A,Fallik D, et al. Risk factors of fibrosis in alcohol-induced liver disease[J].Hepatology,2002,35(3):635-8.
[7]郭啸华, 刘志红, 李恒, 等. 实验2型糖尿病大鼠模型的建立[J]. 肾脏病与透析肾移植杂志, 2000,9(4):351-5.
[7]Guo X H, Lu Z H, Li H, et al. A novel rat model of type 2 diabetes mellitus[J].NephrolDialyTransplant, 2000,9(4):351-5.
[8]王欢, 汪应红, 田远耀, 等. 酸敏感离子通道1a对高糖环境下肝纤维化的作用研究[J]. 中国药理学通报, 2016,32(3):384-9.
[8]Wang H, Wang Y H, Tian Y Y, et al. Effect of ASIC1a on liver fibrosis under high glucose[J].ChinPharmacolBull, 2016,32(3):384-9.
[9]Li X,Wang Y,Wang H, et al. Endoplasmic reticulum stress is the crossroads of autophagy, inflammation, and apoptosis signaling pathways and participates in liver fibrosis[J].InflammRes, 2015,64(1):1-7.
[10] Zhang X, Liu S, Zhang G, et al. Bariatric surgery ameliorates diabetic cardiac dysfunction by inhibiting ER stress in a diabetic rat model[J].ObesSurg, 2017,27(5):1324-34.
[11] Sugimoto R, Enjoji M, Kohjima M, et al. High glucose stimulates liver stellate cells to proliferate and to produce collagen through free radical production and activation of mitogen-activated protein kinase[J].LiverInt, 2005,25(5):1018-26.
[12] 史海涛, 董蕾, 刘亚萍, 等. 高糖环境对肝星状细胞 TLR4表达及脂多糖诱导的炎症因子表达的影响[J]. 南方医科大学学报, 2013,33(3):386-90.
[12] Shi H, Dong L, Liu Y, et al. Effect of high glucose on toll-like receptor 4 expression and LPS-induced proinflammatory cytokine production in liver stellate cells in vitro[J].JSouthMedUniv, 2013,33(3):386-90.
[13] 沈亚非, 徐炎成. 链服佐菌素导实验性糖尿病大鼠模型建立的研究[J]. 实用诊断与治疗杂志, 2005,19(2):79-80.
[13] Shen Y F, Xu Y C. Study on experimental diabetes animal model in rats induced by streptozotocin[J].JChinPracticalDiagnosisTher, 2005,19(2):79-80.
[14] Rackietan N, Rackietan M L, Nadkarni M R. Studies on diabetogenic action of streptozotozin[J].CancerChemotherRep,1963,29(29):91-8.
[15] 黄波, 刘学政, 庞东渤. 不同途径注射链脲佐菌素致大鼠糖尿病模型的研究[J]. 锦州医学院学报, 2003,24(1):19-21.
[15] Huang B, Liu X Z, Pang D B. Study on diabetic model in rats induced by streotozotocin in different ways[J].JinzhouMedColl, 2003,24(1):19-21.
