秀丽隐杆线虫模型在肌肉萎缩症研究中的应用
2018-04-12马淑梅
马淑梅,刘 莉
(上海医药工业研究院药理评价研究中心,上海医药工业研究院创新药物与制药工艺国家重点实验室,上海市生物物质成药性评价专业技术服务平台,上海 200437)
肌肉萎缩症是一种慢性进行性疾病,其病因为编码特定肌细胞蛋白的基因发生突变,目前已知至少21种单基因突变可导致肌肉萎缩[1]。杜氏肌肉萎缩(Duchenne muscular dystrophy, DMD)是最为常见的类型,是一种X染色体隐性遗传疾病,每年大约有1/3 500的男性新生儿罹患此病[2]。
患者会出现肌细胞坏死和肌无力致无法活动等症状,目前只能通过物理方法和甾体类激素进行姑息治疗。在临床前研究中,可用的肌肉萎缩动物模型有小鼠、犬等,秀丽隐杆线虫以通体透明、生命周期短、基因与人类基因具有高度同源性等优势得到研发人员的关注。目前线虫在神经系统疾病、衰老、真菌感染等领域药物的研发中得到广泛应用[3-4]。本文就秀丽隐杆线虫在肌肉萎缩研究中的应用进行总结。
1 肌肉萎缩秀丽隐杆线虫模型
线虫是一种个体小、生活周期短、容易繁殖后代、体细胞数目固定且特定细胞位置固定的简单动物。1963年,Brenner[5]首次提出应用线虫进行神经系统发育研究,1974年,他通过EMS诱变获得300多个线虫突变体,开始用线虫进行分子和发育生物学的研究。2000年,Gieseler等[6]为了寻找通过错误表达可以抑制肌肉萎缩表型的基因,首次建立了肌肉萎缩线虫模型。此后,许多研究人员利用线虫进行肌肉萎缩研究。
1.1可用于肌肉萎缩研究的秀丽隐杆线虫模型基因突变株线虫基因组中含有人类抗肌萎缩蛋白类似基因dys-1,dys-1基因突变线虫伴有运动能力下降、头部过度弯曲等行为学改变,但不会出现肌细胞结构破坏等肌肉萎缩症状[7]。研究表明,只缺失抗肌肉萎缩蛋白基因的mdx小鼠仅表现出轻微的肌肉萎缩症状,而同时缺失抗肌萎缩蛋白基因和生肌因子基因MyoD的小鼠会表现出类似人类肌肉萎缩的严重症状[8],而线虫中与小鼠生肌因子基因MyoD对应的基因为hlh-1。Gieseler等[6]首次建立线虫肌肉萎缩模型dys-1(cx18);hlh-1(cc561)突变株,该品系线虫可呈现时间依赖的肌肉萎缩,表现出与人类肌肉萎缩比较接近的症状,可用于抗肌肉萎缩药物的筛选。胞内钙离子水平的增加会通过激活炎症反应,促进肌肉萎缩的进程[9]。egl-19是线虫肌肉细胞中主要的电压门控钙通道,Mariol等[10]构建了dys-1;egl-19双突变的线虫,结果发现,egl-19基因功能获得性突变的dys-1线虫突变株随着年龄的增加会出现过度收缩、头部过度弯曲以及运动不协调等肌肉萎缩症状,dys-1(cx18);egl-19(ad695)线虫突变株的体壁肌细胞会发生明显变化,从而导致肌肉萎缩。unc-9基因编码线虫体壁细胞间隙连接蛋白,UNC-9蛋白表达于肌细胞臂和细胞间连接部位,是间隙连接的重要组成成分。线虫体壁肌细胞通过间隙连接进行电紧张偶合,UNC-9蛋白缺失,使得肌细胞不能接受来自神经细胞的信号,因此,unc-9基因突变的线虫几近瘫痪[11]。
1.2应用秀丽隐杆线虫突变株进行肌肉萎缩研究的相关实验爬行是线虫在琼脂培养皿上的主要运动方式,因此许多研究者用爬行实验来检测线虫神经肌肉系统的完整性,但线虫模型在爬行实验中仅表现出不明显的肌肉萎缩疾病表型,因此,爬行实验阻碍了线虫模型在部分神经肌肉紊乱研究中的应用。由于线虫在土壤基质中大部分时间都在挖掘,研究人员[12]将线虫溶液注入琼脂预填充的10 mL塑料移液管距一端1 cm处,用保鲜蜡膜封闭,塑料移液管的另一端放置诱引剂丁二酮,用照相机拍摄线虫挖掘过程,计数每组到达距离诱引剂4 cm处的线虫数目,以判断不同线虫突变株的挖掘能力,进行挖掘实验,同时,以头弯曲频率、速率、回旋率、欧米伽弯曲等指标来评价线虫在肌肉萎缩研究中的运动情况。结果发现,挖掘实验中线虫可以很好地模拟人类肌肉萎缩表型。线虫在液体培养基中的主要运动方式为游行[13],游行与爬行具有不同的运动特征,或可应用线虫游泳实验进行抗肌肉萎缩药物筛选。此外,旋转细胞培养系统可以用于模拟微重力对细胞功能的影响相关研究。因此,有研究者应用旋转细胞培养系统模拟太空飞行微重力环境对线虫体壁肌结构和功能的影响,以探索太空飞行微重力所致肌肉萎缩的发病机制[14]。
1.3利用秀丽隐杆线虫进行抗肌萎缩药物筛选研究2004年,Gaud等[15]应用dys-1(cx18);hlh-1(cc561)线虫突变株筛选了约100个化合物对肌肉萎缩的治疗作用,考察药物作用后线虫的运动学变化和肌细胞退化情况。化合物溶液与培养基混合至终浓度为1 g·L-1或者最大溶解度,使成年dys-1(cx18);hlh-1(cc561)线虫突变株在含化合物的培养基上产卵过夜,之后将成虫移除,虫卵在15℃、食物充足情况下培养7 d,化合物通过表皮渗透和摄食进入线虫体内,这种给药方法可以使线虫持续暴露于化合物。固定并透化线虫,与罗丹明-鬼笔环肽共孵育以对线虫体壁肌细胞进行染色,显微镜下计数染色异常的肌细胞。结果发现,强的松能降低40%抗肌萎缩蛋白缺陷的肌细胞的退化。该研究表明,线虫可以作为筛选抗肌肉萎缩化合物的工具。
之后,又有研究人员Carre-Pierrat等[16-17]利用线虫肌萎缩模型研究神经激素5-羟色胺及其激动剂以及1 000多个已批准上市的化合物进行筛选。结果发现,10 mmol·L-15-羟色胺处理的线虫活动能力有所改善,体壁肌细胞的退化明显降低,剂量效应实验发现,2.5 mmol·L-15-羟色胺仍具有延缓肌肉萎缩进展的作用。应用5-羟色胺激动剂以及5-羟色胺重摄取蛋白抑制剂得到相似的结果。另外,醋甲唑胺0.5 g·L-1和双氯非那胺0.1 g·L-1能明显改善线虫的运动能力并减少肌细胞的退化。进一步机制研究发现,醋甲唑胺或双氯非那胺通过与线虫醋酸酐酶CAH-4相互作用改善肌肉萎缩进展,该结果在mdx小鼠模型中得到验证。这表明肌肉萎缩线虫模型联合mdx小鼠模型验证策略可用于筛选有效的抗肌肉萎缩药物。
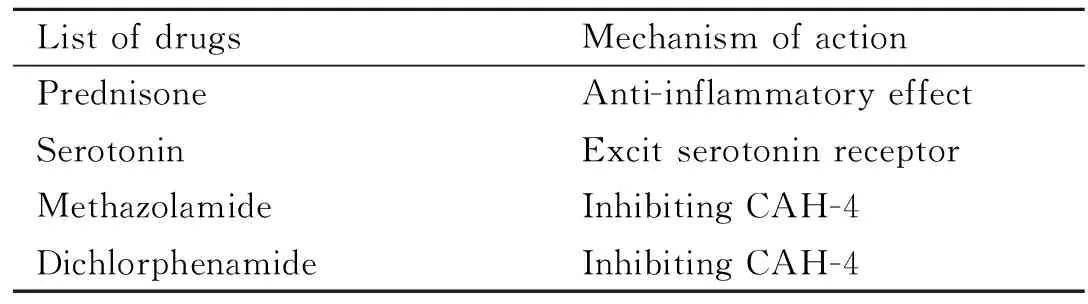
Tab 1 Screening of anti-muscular atrophy drugs using C.elegans
本实验室应用dys-1(cx18);hlh-1(cc561)线虫突变株对数个具有抗氧化活性的中药提取物进行筛选,部分中药提取物可明显改善线虫的运动能力,接下来将考察这些提取物对线虫肌细胞数目及健康情况的影响,并进一步研究其作用机制。
1.4利用秀丽隐杆线虫对肌肉萎缩发病机制相关信号通路的研究Oh等[18]发现,抗肌萎缩蛋白缺失并不直接导致肌细胞的死亡,而是使肌细胞内蛋白质稳态遭到破坏,dys-1线虫突变株肌细胞的存活或者死亡决定于年龄依赖的细胞微环境。因此,提供一个持续更新的细胞微环境可能成为防止抗肌萎缩蛋白功能缺失的肌细胞死亡的一种途径。研究表明[19],IGF信号降低可通过daf-16提高应激耐受,延迟固有蛋白聚集,延长寿命。Oh等先后构建了肌细胞表达GFP的daf-2(e1370);dys-1和daf-2(e1370);daf-16(mu86);dys-1线虫突变株,得到IGF受体表达下调的线虫株,评估该线虫株肌细胞的健康情况并检测其寿命。结果发现,daf-2(e1370);dys-1线虫突变株肌细胞内未见聚集的GFP信号,daf-2(e1370);dys-1线虫突变株寿命与daf-2(e1370)线虫寿命相当,而daf-2(e1370);daf-16(mu86);dys-1线虫突变株肌细胞出现聚集的GFP信号,并且细胞核数量减少,这表明抑制IGF信号对线虫肌细胞的保护作用依赖于daf-16。抑制IGF信号通路能够减少daf-16依赖的dys-1基因突变线虫肌肉细胞的死亡。这提示,抑制IGF信号通路的化合物可能具有治疗肌肉萎缩的潜力。Lecroisey等[20]发现斑联蛋白ZYX-1参与抗肌萎缩蛋白依赖的线虫肌肉萎缩,通过构建过表达ZYX-1的dys-1(cx-18);hlh-1(cc561)线虫突变株和ZYX-1功能缺失的dys-1(cx-18);hlh-1(cc561);zyx-1(gk190)线虫突变株,应用罗丹明-鬼笔环肽染色计数线虫肌细胞发现,过表达ZYX-1的线虫和ZYX-1功能缺失的线虫肌细胞损伤数目分别降低35%和60%,这表明ZYX-1促进dys-1(cx-18);hlh-1(cc561)线虫突变株肌细胞退化。Catoire等[21]研究发现,突变的多聚丙氨酸结合蛋白1(PABPN1)导致成年线虫发生肌肉萎缩,去乙酰化酶Sir2、转录因子Foxo、AMPK共同调节PABPN1的毒性,因此,抑制Sir2或AMPK可能成为治疗肌肉萎缩的新策略。
2 肌肉萎缩小鼠模型和犬模型
2.1mdx小鼠模型抗肌萎缩蛋白,编码基因长度2.2 Mb,由79个主要外显子和6个可变第一外显子组成。mdx小鼠有5种不同的突变类型[22],每一种突变模型都会造成骨骼肌细胞中表达功能异常的抗肌萎缩蛋白。mdx小鼠的骨骼肌细胞大约在3周龄时开始出现退化,大约7周龄时出现大面积的肌肉坏死,同时伴有肌肉退化和再生。然而,与患者相比,mdx小鼠的肌萎缩症状较轻。mdx小鼠不出现明显的坏死和关节挛缩,并且随着时间推移仅部分骨骼肌纤维被脂肪细胞取代。DMD患者的肌腱连接严重受损,而mdx小鼠中仅出现轻微改变。另外,在mdx小鼠中,神经肌肉突触中突触折叠的缺失对突触传递没有影响,而对于患者来说具有重大影响。由于mdx小鼠的寿命比正常小鼠仅缩短约20%,因此不能用mdx小鼠模型来进行不同治疗策略延长寿命的试验。
2.2mdx:utrn-/-小鼠模型导致mdx小鼠肌肉萎缩症状轻微的原因可能有:小鼠比人小并且弱,因此在传递肌力时对抗肌萎缩蛋白的依赖较人类小;与DMD患者相比,mdx小鼠中卫星细胞较好的保持了其再生能力;在mdx小鼠中同源蛋白有效地补偿了抗肌萎缩蛋白的缺失。基于此,研究人员制备了抗肌萎缩蛋白和抗肌萎缩蛋白相关蛋白双缺失的严重肌萎缩模型[23]。
抗肌萎缩蛋白相关蛋白(utrophin),分子质量376 ku,是抗肌萎缩蛋白同系物。抗肌萎缩蛋白相关蛋白是由全长的异构体组成,这两个异构体具有不同的启动子,并且其N端起始外显子不同。抗肌萎缩蛋白相关蛋白A表达于横纹肌、脉络膜丛、软脑膜和肾小球。抗肌萎缩蛋白相关蛋白B表达于血管。在胚胎发育期,抗肌萎缩蛋白相关蛋白A贯穿于整个肌纤维膜,在产后发育阶段,抗肌萎缩蛋白相关蛋白A仅存在于神经肌肉和肌腱连接处。在mdx小鼠模型中,抗肌萎缩蛋白相关蛋白A的表达增加,并且在肌纤维膜上可见低水平的抗肌萎缩蛋白相关蛋白A表达。抗肌萎缩蛋白相关蛋白通过维持肌动蛋白骨架和肌纤维膜上DGC的相互作用,功能性地补偿了mdx小鼠抗肌萎缩蛋白缺失。抗肌萎缩蛋白相关蛋白表达水平越高,则患者必须借助轮椅的时间越推后。目前,研究人员正在寻找可以提高肌纤维膜抗肌萎缩蛋白相关蛋白表达的药物来治疗肌肉萎缩症。
mdx:utrn-/-小鼠比野生型小鼠小,严重驼背,随着年龄的增加行动力下降。运动系统会出现炎症反应,大量的骨骼肌纤维被纤维组织取代从而导致挛缩。肌肉部位也变成脂肪组织。与野生型小鼠和mdx小鼠相比,其骨骼肌较小较弱,并且在肌肉收缩时易被损伤。其神经肌肉连接不完整,突触后折叠明显减少。在肌腱连接处,终端肌小节很少与肌腱直接连接。mdx:utrn-/-小鼠会出现严重的心肌病变。20周龄内死亡。mdx:utrn-/-小鼠的病理程度和寿命与DMD患者较为相似,因此,成为检测肌肉萎缩症治疗方法的一种较为适合的模型。
2.3肌肉萎缩犬模型犬类X连锁肌肉萎缩症模型有金猎犬(golden retriever, GRMD)、罗特韦尔犬和德国短毛犬模型。其中,GRMD犬在日本被培育成比格犬,称为cxmdj。cxmdj与GRMD犬具有相同的点突变和相似的表型。最常用的模型为GRMD犬模型[24]。
犬类X连锁肌肉萎缩症模型与DMD病理过程相似。选择性肌肉退化的早期,新生GRMD犬的死亡率很高。渡过新生儿期的犬会出现肌纤维再生和大面积炎症反应,一些肌肉部位出现高浓度的结晶钙并且呈透明状。大约2月龄时,肌纤维被纤维组织和脂肪细胞取代。6月龄出现明显地关节挛缩,运动能力严重受损,肌肉萎缩、变弱且已被收缩损伤。GRMD犬会出现心肌病变和呼吸窘迫而死亡。与其他哺乳动物比较,cxmdj;犬具有与人类免疫系统类似的免疫系统,可对外源性物质做出类似人类的免疫反应[25]。但是由于人类肌萎缩的病理过程在犬类模型中没有合适的功能性治疗效应评价指标,且价格昂贵,易于死亡,因此应用于抗肌萎缩药物的筛选仍面临较大挑战。
3 小结
肌肉萎缩症是严重危害人类健康的疾病,目前尚无有效的治疗方法,寻找一种经济、快速的药物筛选方法对肌肉萎缩症的治疗至关重要。mdx小鼠和犬类X连锁肌肉萎缩症模型各具优势,但成本较高。秀丽隐杆线虫作为整体动物模型,克服了细胞筛选对样品的限制,同时,以突变体或者转基因技术建立的线虫疾病模型都具有明确的分子基础,一旦化合物的活性被确定,相关的分子机制即可阐明。因此,秀丽隐杆线虫在抗肌萎缩药物毒性评价以及药物筛选方面具有不可替代的作用,具有广阔的应用前景。
参考文献:
[1]McNally E M, MacLeod H. Therapy insight: cardiovascular complications associated with muscular dystrophies[J].NatClinPractCardiovascMed,2005,2(6):301-8.
[2]Woodman K G,Coles C A,Lamandé S R, et al. Nutraceuticals and their potential to treat duchenne muscular dystrophy: separating the credible from the conjecture[J].Nutrients,2016,8(11):E713.
[3]史秋佳,杨剑萍,陈缵光. 秀丽隐杆线虫作为抗感染药物筛选模型的研究进展[J].中国药理学通报,2013,29(10):1333-7.
[3]Shi Q J,Yang J P,Chen Z G. Recent progress of Caenorhabditis elegans: as host model and tool for antimicrobial drug screening[J].ChinPharmacolBull, 2013,29(10): 1333-7.
[4]郑喜,李国红,王芯,等. 昆明山海棠内生真菌ThF-11化学成分抗菌杀线虫作用的研究[J].中国药理学通报,2014,30(12):1709-13.
[4]Zheng X,Li G H, Wang X. Antibacterial and nematicidal activity of endophyte ThF-11 of Tripterygium hypoglaucum (Levl.)Hutch[J].ChinPharmacolBull, 2014,30(12):1709-13.
[5]Brenner S. The genetics of Caenorhabditis elegans[J].Genetics, 1974,77(1):71-94.
[6]Gieseler K,Grisoni K,Ségalat L. Genetic suppression of phenotypes arising from mutations in dystrophin-related genes in Caenorhabditis elegans[J].CurrBiol,2000,10(18):1092-7.
[7]Bessou C,Giugia J B,Franks C J , et al. Mutations in the Caenorhabditis elegans dystrophin-like gene dys-1 lead to hyperactivity and suggest a link with cholinergic transmission[J].Neurogenetics,1998,2(1):61-72.
[8]Megeney L A,Kablar B,Garrett K , et al. MyoD is required for myogenic stem cell function in adult skeletal muscle[J].GenesDev,1996,10(10):1173-83.
[9]Miyatake S,Shimizu-Motohashi Y,Takeda S,et al. Anti-inflammatory drugs for Duchenne muscular dystrophy: focus on skeletal muscle-releasing factors[J].DrugDesDevelTher,2016,10:2745-58.
[10] Mariol M C,Ségalat L. Muscular degeneration in the absence of dystrophin is a calcium-dependent process[J].CurrBiol,2001,11(21):1691-4.
[11] Chen B,Liu Q,Ge Q,et al. UNC-1 regulates gap junctions important to locomotion in C. elegans[J].CurrBiol, 2007,17(15):1334-9.
[12] Beron C,Vidal-Gadea A G,Cohn J,et al. The burrowing behavior of the nematode Caenorhabditis elegans: a new assay for the study of neuromuscular disorders[J].GenesBrainBehav,2015,14(4):357-68.
[13] Pierce-Shimomura J T,Chen B L,Mun J J,et al. Genetic analysis of crawling and swimming locomotory patterns in C. elegans[J].ProcNatlAcadSci,2008,105(52):20982-7.
[14] 王驰,桑晨,杨春,等. 模拟微重力下秀丽隐杆线虫的力学感知和肌萎缩的发生机制[J].生物化学与生物物理进展, 2008,35(11):1298-304.
[14] Wang C,Sang C,Yang C,et al. Mechanisms of muscular atrophy and gravisensing after simulated microgravity in caenorhabditis elegans: parallel control to spaceflight research in C. elegans[J].ProgBiochemBiophys,2008,35(11): 1298-304.
[15] Gaud A,Simon J M,Witzel T,et al. Prednisone reduces muscle degeneration in dystrophin-deficient Caenorhabditis elegans[J].NeuromusculDisord, 2004,14(6):365-70.
[16] Carre-Pierrat M,Mariol M C,Chambonnier L,et al. Blocking of striated muscle degeneration by serotonin in C . elegans[J].JMuscleResCellMotil,2006,27(3-4):253-8.
[17] Giacomotto J,Pertl C,Borrel C,et al. Evaluation of the therapeutic potential of carbonic anhydrase inhibitors in two animal models of dystrophin deficient muscular dystrophy[J].HumMolGenet, 2009,18(21):4089-101.
[18] Oh K H,Kim H. Reduced IGF signaling prevents muscle cell death in a Caenorhabditis elegans model of muscular dystrophy[J].ProcNatlAcadSci,2013,110(47):19024-9.
[19] Lin K,Hsin H,Libina N,et al. Regulation of the Caenorhabditis elegans longevity protein DAF-16 by insulin/IGF-1 and germline signaling[J].NatGenet,2001,28(2):139-45.
[20] Lecroisey C,Brouilly N,Qadota H,et al. ZYX-1, the unique zyxin protein of Caenorhabditis elegans, is involved in dystrophin-dependent muscle degeneration[J].MolBiolCell,2013,24(8):1232-49.
[21] Catoire H,Pasco M Y,Abu-Baker A,et al. Sirtuin inhibition protects from the polyalanine muscular dystrophy protein PABPN1[J].HumMolGenet, 2008,17(14):2108-17.
[22] Im W B,Phelps S F,Copen E H,et al. Differential expression of dystrophin isoforms in strains of mdx mice with different mutations[J].HumMolGenet, 1996,5(8):1149-53.
[23] Deconinck A E,Rafael J A,Skinner J A,et al.Utrophin-dystrophin-deficient mice as a model for Duchenne muscular dystrophy[J].Cell,1997,90(4):717-27.
[24] Valentine B A,Winand N J,Pradhan D,et al. Canine X-linked muscular dystrophy as an animal model of Duchenne muscular dystrophy: a review[J].AmJMedGenet, 1992,42(3):352-6.
[25] Bretag A H. Stem cell treatment of dystrophic dogs[J].Nature,2007,450(7173):E23-5.
