鬼箭羽醇提物对四氯化碳诱导小鼠肝纤维化模型的作用
2018-04-12刘向东黄德斌
万 星,郭 琼,刘向东,黄德斌
(湖北民族学院1. 医学院、2. 附属民大医院西药科、3. 附属民大医院重症医学科,湖北 恩施 445000)
肝纤维化(hepatic fibrosis, HF)是肝脏对各种慢性刺激(如病毒感染、药物诱导、自身免疫等)进行损伤修复反应时,以胶原为主的细胞外基质在肝内大量沉积的病理过程,是所有慢性肝病共同的病理基础,是各种慢性肝病向肝硬化发展的必经阶段[1-2]。目前,临床并无特异性治疗药物,因此,了解HF的发生发展机制,寻找有效的预防或治疗HF的药物具有重大意义。鬼箭羽(Euonymusalatus,EA)为卫矛科植物卫矛的具翅状物枝条或翅状附属物,具有破血通经、解毒消肿之功效,主要化学成分有生物碱、黄酮类、甾体、三萜等,具有降血糖、抗肿瘤、调节免疫、抗炎、抗氧化作用[3-5],其中,醇提物显示出抗菌、抗炎、抗氧化作用[4-5]。HF依赖肝星状细胞(hepatic stellate cell, HSC)的活化增殖,且Herrmann等[6]认为,HSC的活化分3阶段,前炎症阶段、炎症阶段和后炎症阶段。以炎症为切入点,结合目前多数报道鬼箭羽醇提物为抗炎部位,我们初次探究了鬼箭羽醇提物对四氯化碳(carbon tetrachloride,CCl4)诱导小鼠肝纤维化的作用及机制。
1 材料
1.1实验动物C57BL/6小鼠,♂,体质量(17±3) g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK京2016-0011。
1.2药品与试剂鬼箭羽中药购于湖北恩施宏升大药房(产地:湖北);CCl4(国药集团化学试剂有限公司,临用前溶于橄榄油);ALT、AST试剂盒(南京建成生物工程研究所);TNF-α ELISA试剂盒(美国BD公司);鼠源α-SMA、CollagenⅠ一抗(英国Abcam公司);β-actin一抗、山羊抗兔二抗(武汉博士德生物工程有限公司);BCA试剂盒、ECL化学发光剂(美国Thermo公司);其他化学试剂为国产分析纯。
2 方法
2.1鬼箭羽醇提物的制备称取一定量鬼箭羽中药材,粉碎,采用10倍量60%的乙醇冷凝回流2次,每次2 h,旋转蒸发成浸膏状后,冷冻干燥成粉末,室温保存,临用时溶于双蒸水。
2.2动物分组、造模及给药为了初步确定药靶在疾病发生的上游还是下游,并结合文献将HSC的活化分3阶段,初次实验时,将药物组分为前期用药组和后期用药组,根据文献报道[5,7]和本次研究的预实验,每组设低、中、高3个剂量(L:2 g·kg-1,M:4 g·kg-1,H:8 g·kg-1),80只动物适应性喂养1周后,随机分8组:正常组(normal)、CCl4模型组(model)、鬼箭羽醇提物低剂量前期组(EAE-L)、中剂量前期组(EAE-M)、高剂量前期组(EAE-H)、鬼箭羽醇提物低剂量后期组(EAL-L)、鬼箭羽醇提物中剂量后期组(EAL-M)、鬼箭羽醇提物高剂量后期组(EAL-H)。模型组小鼠腹腔注射含25% CCl4的橄榄油溶液1.6 mL·kg-1,每周2次,共30 d 9次;EAE组在造模同时,仅1~15 d连续灌胃药物;EAL组在造模同时,仅16~30 d连续灌胃药物;正常组全程灌胃等体积的生理盐水。所有小鼠30 d后禁食不禁水,24 h后处死,按要求保留标本。
2.3血清学指标检测小鼠眼球采血后,静置分离血清,按试剂盒说明书测谷丙转氨酶(ALT)、谷草转氨酶(AST),ELISA法测肿瘤坏死因子-α(TNF-α)水平。
2.4肝脏外观形态观察及肝指数测定小鼠称重,眼球采血后,颈椎脱臼处死,取肝脏,用高倍相机在同背景、同视野下,拍摄肝脏外观。用生理盐水冲洗肝脏,滤纸吸干,称肝脏重量,计算肝指数。肝指数/%=肝重(g)/体重(g)×100%。
2.5HE染色肝脏用10%甲醛固定24 h,HE染色时,石蜡切片于二甲苯脱蜡3次,过梯度乙醇各5 min,水洗1 min,苏木精染色5 min,水洗1 min,1%盐酸乙醇分化,流水冲洗2 min,伊红染2 s,入乙醇脱水2 min,二甲苯透明、封固、镜检。
2.6Masson染色常规脱水包埋,切片脱蜡至水,Harris苏木精染色10 min,流水稍洗,1%盐酸乙醇分化,流水冲洗2 min,丽春红酸性品红染液染5 min,流水稍洗,磷钼酸溶液5 min,苯胺蓝复染5 min,1%冰醋酸处理1 min,95%乙醇多次脱水,二甲苯透明,中性树胶封固。
2.7免疫组织化学检测α-SMA、CollagenⅠ表达石蜡切片脱蜡至水,高温高压修复2 min,冷却至室温,转入TBS缓冲液冲洗3次,每次5 min,3%双氧水阻断内源性过氧化物酶室温20 min,TBS冲洗3次,每次5 min,10%山羊血清孵育20 min,一抗(α-SMA 1 ∶150,CollagenⅠ 1 ∶600)4℃孵育过夜,次日复温后,TBS冲洗3次,每次5 min;每张切片滴50 μL二抗,室温孵育30 min,TBS冲洗3次,每次5 min,DAB显色,流水冲洗,苏木精复染2 min,水洗,1%盐酸乙醇分化2 s,温水返蓝,梯度乙醇脱水干燥,二甲苯透明,封片。
2.8Westernblot检测α-SMA、CollagenⅠ蛋白表达称取肝脏组织100 mg,加1 mL RIPA裂解液匀浆破碎组织,再超声破碎(超声时间3 s,间隔10 s,超声10次),冰上裂解30 min后,4℃、12 000 r·min-1离心20 min,取上清,BCA法测蛋白浓度后,加5×上样缓冲液,100 ℃变性5 min,-20 ℃保存。配制10%的分离胶,电泳,电转移,5%脱脂奶粉封闭1 h,一抗(α-SMA 1 ∶3 000,CollagenⅠ 1 ∶1 000)4 ℃孵育过夜,洗脱,孵二抗(1 ∶80 000),90 min,洗脱,曝光。

3 结果
3.1EA对肝脏形态和肝指数的影响如Fig 1所示,正常组肝脏呈分布均匀红褐色,包膜光滑;CCl4组表面弥漫明显的大小不一的塌陷区,边缘泛白;鬼箭羽醇提物组减少肝脏表面塌陷区的数量和程度,其中,前期给药组形态改善较后期给药组好。Tab 1结果显示,模型组肝指数高于正常组(P<0.05),EAE-M、EAE-L、EAL-L 3组较模型组肝指数降低(P<0.05),同剂量的药物,前期和后期给药组间无差异。

Tab1 Effect of EA on liver index (±s, n=10)
*P<0.05vsnormal;#P<0.05vsmodel
3.2EA对CCl4诱导的肝纤维化小鼠血清ALT、AST的影响如Fig 2所示,与正常组相比,模型组ALT、AST活性明显升高(P<0.01),EA醇提物量效依赖地降低其表达,其中,EAE-L对ALT和AST的作用优于EAL-L(P<0.05),EAE-M和EAL-M,EAE-H和EAL-H比较,对ALT、AST影响,差异无统计学意义(P>0.05)。
3.3EA对CCl4诱导的肝纤维化小鼠病理形态学的影响Fig 3的HE染色显示,正常组小鼠肝细胞结构正常;CCl4组肝小叶被破坏,肝细胞不同程度的水肿、结构紊乱、明显肿胀变形,有点状、片状坏死及炎性细胞浸润;鬼箭羽醇提物前期给药组较CCl4组,损伤量效依赖地减轻,肝索排列较整齐,肝小叶基本恢复正常,炎性因子减少,水肿无改变;鬼箭羽醇提物后期给药组较CCl4组,肝小叶破坏和炎性因子浸润仍然存在,仅表现为破坏程度和数量减少。Masson染色显示,正常组肝小叶结构正常;CCl4组肝索紊乱,肝细胞水肿,大量胶原沉积,在汇管区之间、汇管区与中央静脉之间形成纤维间隔,分离原来肝小叶,形成假小叶;鬼箭羽醇提物组仍见坏死以及胶原沉积,肝小叶被破坏,其损伤较CCl4组呈量效依赖地减轻,且低、中剂量鬼箭羽前期给药组胶原沉积量降低程度明显优于后期给药组。
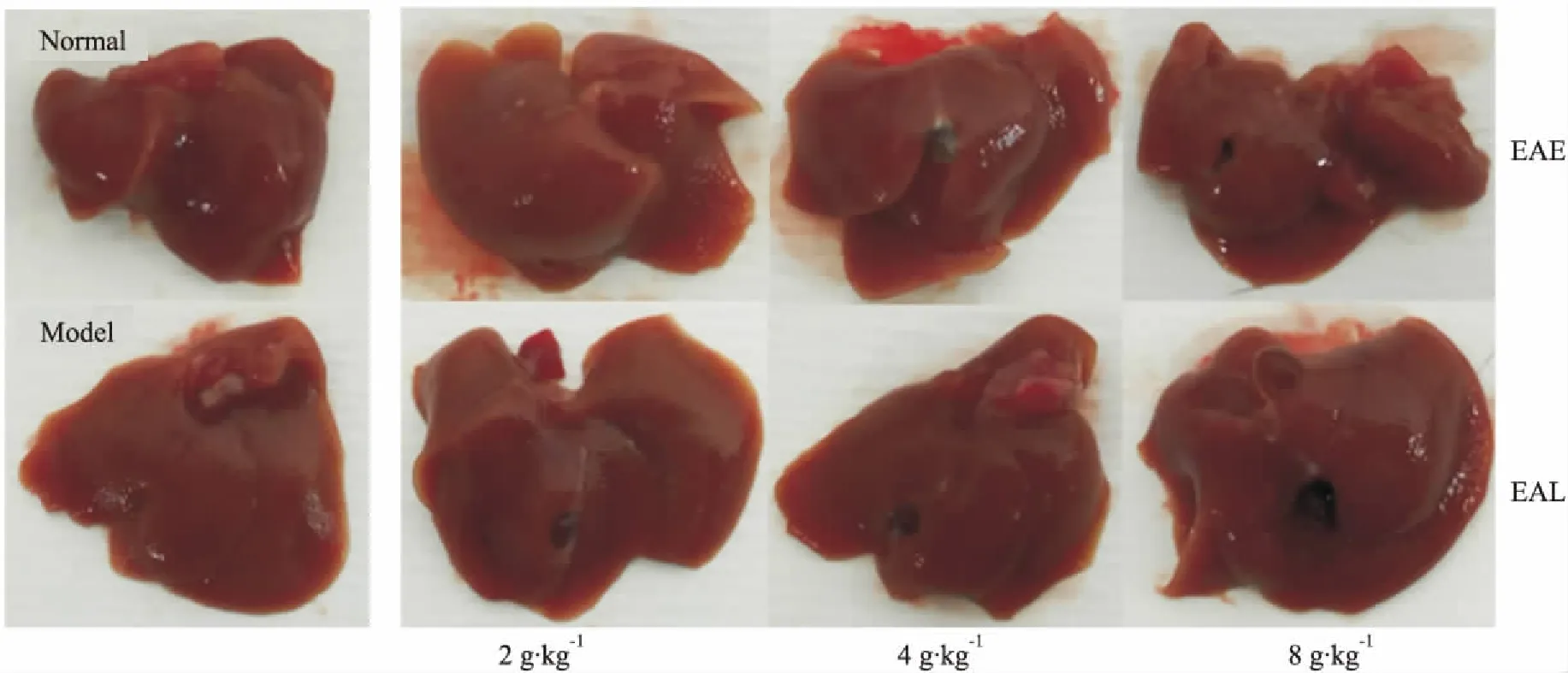
Fig 1 Effect of EA on liver morphology
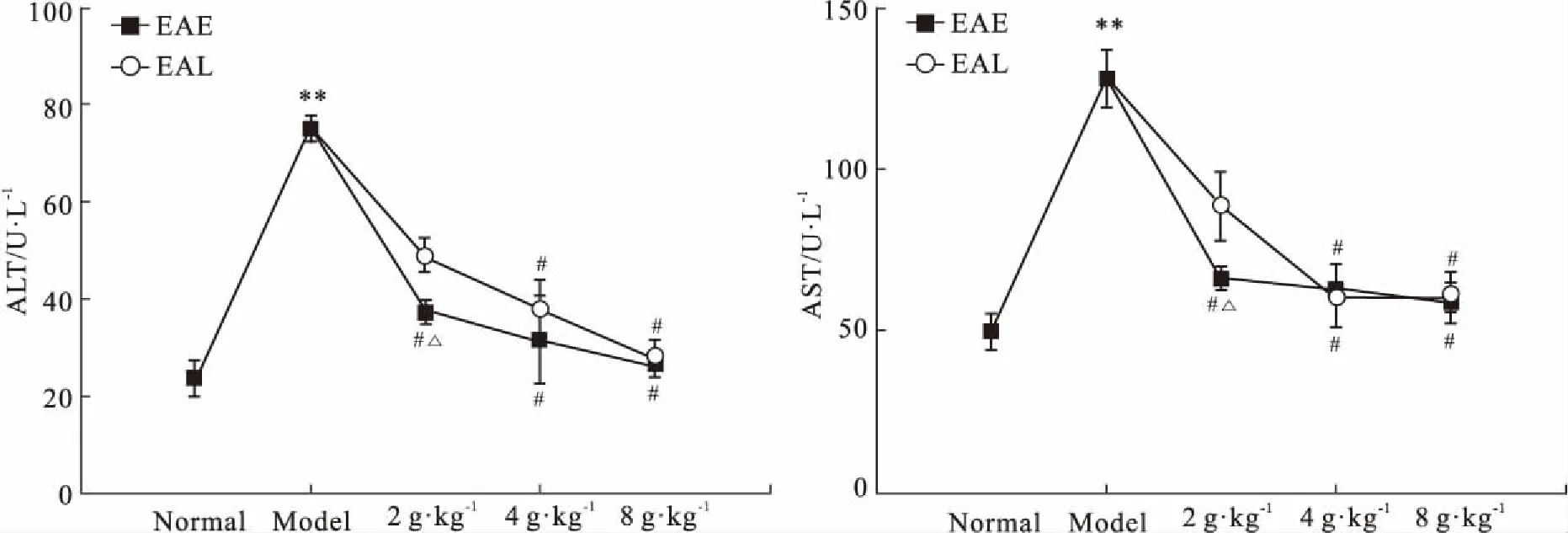
Fig 2 Effect of EA on activities of ALT, AST(±s, n=10)
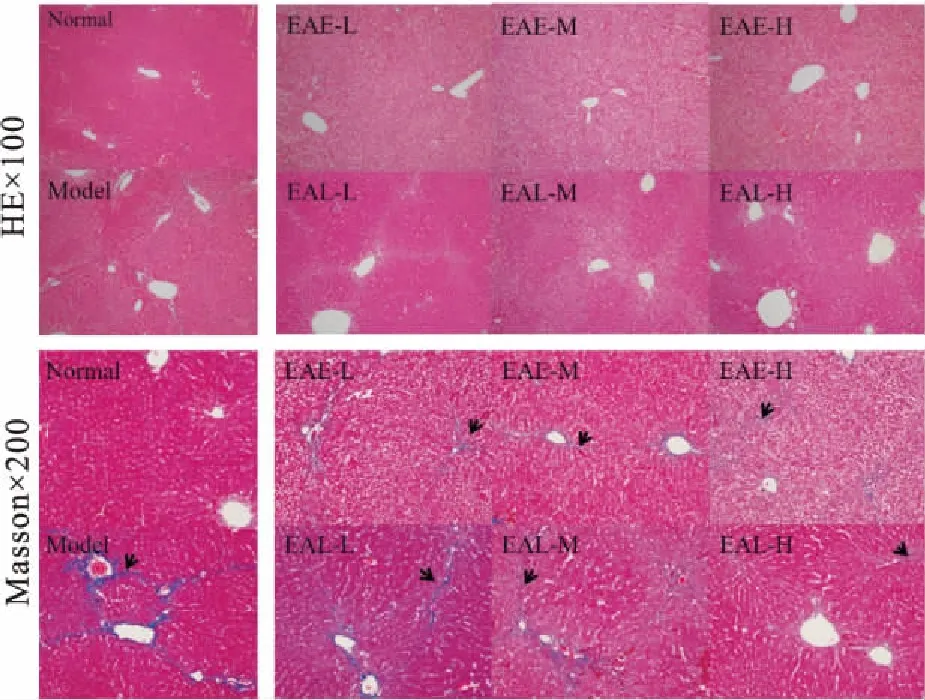
Fig 3 Effect of EA on morphology by HE and Masson
3.4EA对小鼠肝组织α-SMA表达的影响α-平滑肌肌动蛋白(α-SMA)是HSC活化的标志物。Fig 4的免疫组化结果显示,与正常组比较,模型组α-SMA升高,EA量效依赖地降低了其表达,同一剂量EAE效果优于EAL。Fig 5的Western blot结果亦提示,模型组α-SMA增高(P<0.05),EA醇提物能降低其表达(P<0.05),且同剂量药物(4 g·kg-1)在前期给药降低效果明显(P<0.05)。
3.5EA对小鼠肝组织CollagenⅠ表达的影响肝纤维化是以CollagenⅠ为主的肝脏细胞外基质过度沉积的结果。Fig 6的免疫组化显示,与正常组比较,模型组CollagenⅠ明显升高,EA组量效依赖地降低了其表达。Fig 7的Western blot结果亦提示,模型组CollagenⅠ增高(P<0.01),EA醇提物能降低其表达(P<0.05),且同剂量药物(4 g·kg-1)在前期给药降低效果明显(P<0.05)。

Fig 4 Effect of EA on α-SMA expression by IHC

Fig 6 Effect of EA on Collagen Ⅰ expression by IHC

Fig 5 Effect of EA on α-SMA expression by Western blot (±s, n=10)
**P<0.01vsnormal;#P<0.05vsmodel;△P<0.05vsEA ethanol extracts group of 4 g·kg-1of later stage
3.6EA对小鼠血清TNF-α水平的影响如Fig 8所示,模型组较正常组TNF-α明显升高(P<0.01),EA醇提物呈量效依赖性地降低其表达(P<0.05),同剂量前期给药和后期给药组间无明显差异(P>0.05)。
4 讨论
鬼箭羽史载《神农本草经》,又名卫矛、神箭、六月凌、八树等,为传统中药,全世界有卫矛属植物220种,我国约有110种,广泛分布于我国各地[8]。其味甘、涩,无毒,性微寒而坚阴清热,具有破血通经、解毒消肿、杀虫之功效[3]。近年临床用于治疗糖尿病、高血脂症、动脉硬化、类风湿性关节炎效果明显,民间使用鬼箭羽治疗糖尿病取得较好成果[9],在韩国和日本多用于抗肿瘤[10]。鬼箭羽化学成分复杂,目前国内外报道有黄酮和黄酮苷、强心苷、五环三萜、甾体、有机酸等化合物[11]。据报道,鬼箭羽水提物可降血糖、降血脂[12],咖啡酸抗肿瘤[13],鬼箭羽醇提物具有抗菌、抗炎、抗氧化[4-5]等药理功效。

Fig 7 Effect of EA on Collagen Ⅰ expression by
**P<0.01vsnormal;#P<0.05vsmodel;△P<0.05vsEA ethanol extracts group of 4 g·kg-1of later stage
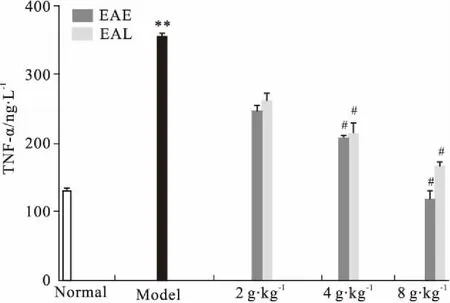
Fig 8 Effect of EA on TNF-α level
**P<0.01vsnormal;#P<0.05vsmodel
CCl4是一种选择性肝毒性物质,在肝内通过肝微粒体细胞色素酶P450氧化酶激活后,产生三氯甲基自由基,可引发活性氧自由基的产生和脂质过氧化反应,损伤肝细胞,导致狄氏间隙内HSC活化,释放Ⅳ型胶原酶降解Ⅳ型胶原,并合成大量Ⅰ型胶原取代Ⅳ型胶原,促使肝纤维化。HSC活化是纤维化发生的中心环节,而临床上无论病毒感染、药物作用,还是自身免疫,最终都会经过HSC活化发展成纤维化,若药物对此经典模型有作用,将有较大临床意义。本实验中,鬼箭羽醇提物量效依赖降低肝指数,降低ALT、AST活性,减少致纤维化因子CollagenⅠ分泌和HSC活化标志物[14]α-SMA的生成,显示出良好的抗肝损伤和阻止纤维化的功能。
根据课题组前期报道,鬼箭羽醇提物有抗炎、抗菌功效[4-5],本实验中HE染色的结果显示,鬼箭羽醇提物减少炎症细胞的浸润,结合HSC激活可能与Kuffer细胞、内皮细胞和肝细胞分泌的一些细胞因子,如TNF-α、TGF-β等有关[15],实验初步选取了其中一个激活因子TNF-α进行探讨。实验结果显示,CCl4组较正常组TNF-α分泌增多,鬼箭羽醇提物明显降低其表达,有趣的是,前期给药和后期给药作用差异无统计学意义。因此推测,TNF-α分泌贯穿发病全过程,鬼箭羽醇提物所含不同单体在纤维化发病信号通路上作用阶段不同,且TNF-α介导的信号通路可能是一环路,导致不同单体在不同阶段对TNF-α都有抑制作用,使得造模前期给药和后期给药作用差异无统计学意义。
时效实验中,多数指标显示鬼箭羽醇提物前期给药组抗纤维化的能力要明显优于后期组,一方面提示临床越早发现,越早干预为佳;另一方面,课题组推测鬼箭羽醇提物抗纤维化的药靶可能是纤维化发病机制的上游蛋白。确切的抗纤维化作用及众多有趣的发现,使我们对鬼箭羽醇提物发挥药效的具体成份、靶点及作用机制非常感兴趣,并将在后期做进一步研究。
(致谢:本实验在湖北民族学院医学实验中心和附属民大医院风湿免疫省重点实验室完成,感谢支持。)
参考文献:
[1]Bosserhoff A, Hellerbrand C. Obesity and fatty liver are ‘grease’ for the machinery of hepatic fibrosis[J].DigDis, 2011,29(4):377-83.
[2]禤传凤,罗伟生,陈国忠,等. 中药活性成分干预肝纤维化分子信号通路的研究进展[J].中国药理学通报,2017,33(12):1638-41.
[2]Xuan C F, Luo W S, Chen G Z, et al. Study of active ingredients of Chinese medicine interfering with molecular signaling pathway of liver fibrosis[J].ChinPharmacolBull,2017,33(12):1638-41.
[3]周丽霞,王继革,张娜娜.鬼箭羽药效学研究概况[J].中医临床研究,2016,12(8):134-6.
[3]Zhou L X, Wang J G, Zhang N N. Research progress on pharmacodynamics of Euonymus alatus[J].ClinJChinMed,2016,12(8):134-6.
[4]黄德斌.鬼箭羽70%醇提取物对速发型和迟发型变态反应抑制作用的实验研究[J].中国药理学通报,2003,19(6):686-8.
[4]Huang D B. An experimental research on inhibition of immediate and delayed type hypersensitivity by the 70% ethanolic extract from Euonymus alatus[J].ChinPharmacolBull,2003,19(6):686-8.
[5]谷树珍.鬼箭羽醇提物的抑菌、抗炎作用研究[J]. 湖北民族学院学报(医学版),2006,23(1):17-9.
[5]Gu S Z. An experimental research on bacteria-inhibiting and anti-inflammation effects of ethanolic extract from Euonymus alatus[J].JHubeiInstituteNationalities(MedEd),2006,23(1):17-9.
[6]Herrmann J, Gressner A M, Weiskirchen R. Immortal hepatic stellate cell lines: useful tools to study hepatic stellate cell biology and function[J]?JCellMolMed,2007,11(4):704-22.
[7]赵成国. 鬼箭羽醇提物抗心肌缺血的实验研究[D]. 哈尔滨:黑龙江中医药大学,2007.
[7]Zhao C G. The experimental studies on anti-myocardial ischemia effects of EAB-extraction[D]. Haerbin: Heilongiang University of Chinese Medicine,2007.
[8]江苏新医学院. 中药大词典[M].上海:上海科学技术出版社,1986:1695.
[8]Jiangsu New Medical College. Great Dictionary of Chinese Medicine[M].Shanghai: Shanghai Scientific and Technical Publishers,1986:1695.
[9]郎素梅,朱丹妮,余伯阳,等.中药鬼箭羽降糖有效部位的药效学和化学研究[J]. 中国药科大学学报,2003,34(2):128-32.
[9]Lang S M,Zhu D N,Yu B Y,et al. Hypoglycemic effects of extracts and constituents from Euonymus alatus[J].JChinPharmUniv,2003,34(2):128-32.
[10] Cha B Y, Park C J, Lee D G, et al. Inhibitory effect of methanol extract of Euonymus alatus on matrix metalloproteina-se-9[J].JEthnopharmacol,2003,85(1):163-7.
[11] 方振峰,李占林,王宇,等.鬼箭羽的化学成分研究[J]. 中草药,2007,38(6):810-2.
[11] Fang Z F, Li Z L, Wang Y, et al. Chemical constituents from wing twigs of Euonymus alatus[J].ChinTraditHerbDrugs,2007,38(6):810-2.
[12] 夏卫军,程海波,张莉.鬼箭羽治疗2型糖尿病实验研究[J].陕西中医,2001,22(8):505-7.
[12] Xia W J, Cheng H B, Zhang L. The research on Euonymus alatus treating type 2 diabete[J].ShanxiChinMed,2001,22(8):505-7.
[13] Chung T W, Moon S K, Chang Y C, et al. Novel and therapeutic effect of caffeic acid and caffeic acid phenethyl ester on hepatocarcinoma cells: complete regression of hepatoma growth and metastasis by dual mechanism[J].FASEBJ,2008,18(14):1670-81.
[14] Desmouliere A, Tuchweber B, Gabbiani G. Role of the myofibroblast differentiation during liver fibrosis[J].JHepatol, 1995,22(2 Suppl):61-4.
[15] Canbay A, Feldstein A E, Higuchi H, et al. Kupffer cell engulfment of apoptotic bodies stimulates death ligand and cytokine expression[J].Hepatology, 2003,38(5):1188-98.
