原发性高血压合并高尿酸血症的核磁共振代谢组学研究
2018-04-12,,,
,,,
原发性高血压及高尿酸血症均为危害人民健康的常见疾病。据统计,目前我国的高血压病人约有2亿人,大概占全球高血压总人数的20%[1],其中原发性高血压占高血压的90%以上。尿酸是人体嘌呤代谢的终产物,高尿酸血症(hyperuricemia,HUA)是机体嘌呤代谢紊乱的结果。我国高尿酸血症的发病率呈逐渐升高趋势,根据近年各项调查研究显示,目前约有高尿酸血症病人1.2亿人,近年来逐渐呈现年轻化趋势[2]。心血管流行病学调查表明,血尿酸是高血压发病的独立危险因素,血尿酸每增加59.5 μmol/L,高血压相对增加25%的发病风险[3]。
代谢组学是继基因组学和蛋白质组学之后发展起来的一门新学科,作为“后基因组学”时期发展迅速的“组学”技术之一,与基因组学、蛋白质组学共同构成系统生物学(systems biology)的主体[4]。代谢组学通过检测和量化生物体代谢随时间变化的规律,发现与疾病密切相关的异常代谢途径和生物标记物,为进一步阐明疾病的发病机制提供证据。
目前代谢组学方法因其在疾病诊断及发病机制中的巨大潜力,已广泛应用于医学领域,成为阐释生命奥秘和解释病机的新手段。核磁共振技术特别是氢谱核磁共振代谢组学(1H-NMR)因其对含氢代谢物的普适性成为代谢组学主要的分析工具[5]。
高血压及高尿酸血症作为代谢性疾病,利用代谢组学方法对其代谢产物进行分析,得出血清代谢轮廓的变化,一次性获得较完整的代谢信息,从整体上了解疾病的发病机制。
1 资料与方法
1.1研究对象依照《中国高血压防治指南2010》[1]和《2011年无症状高尿酸血症合并心血管疾病诊治建议中国专家共识》[2]的诊断标准,选取2014年5月—2014年11月青岛市海慈医疗集团干部保健科及青岛市北区瑞良康社区卫生服务站的体检人员30名。根据体检结果分为3组,单纯高尿酸血症组(A组)12例,年龄51.52岁±9.68岁;原发性高血压合并高尿酸血症组(B组)11例,年龄52.63岁±10.75岁;健康对照组(C组)7名,年龄41.65岁±10.26岁。高尿酸血症组排除高血压、高脂血症、糖尿病等其他慢性非传染性疾病。
1.2仪器与试剂高分辨核磁共振波谱仪:Bruker AVANCEⅢ 600 MHz、重水(D2O,99.9%氘代)、磷酸氢二钾(K2HPO4·3H2O)和磷酸二氢钠(NaH2PO4·2H2O)、核磁管由中科院青岛生物能源与过程研究所提供。多功能管架自动平衡离心机、冰柜、乙二胺四乙酸(EDTA)抗凝管、试管架等均由青岛市海慈医疗集团检验科提供。
1.3方法
1.3.1血清样本采集所有研究对象釆血前要求空腹8 h,抽取清晨肘静脉血3 mL,置入EDTA抗凝管中,经4 000 r/min离心10 min,之后取上清约0.6 mL,将其置于-80 ℃的冰柜中保存。
1.3.2样品配制采用D2O配制生理盐水缓冲液(K2HPO4/NaH2PO4,45 mmol/L,pH=7.4)。使用微量移液注射器取200 μL血清与等量缓冲液混合,震荡混匀后将混合液移至核磁管中待检。
1.3.31H-NMR实验核磁实验脉冲为CPMUPR1D,采集血浆样品的数据,扫描128次,空扫16次,配备5 mm HCN三共振超低温探头,实验温度298 K。
1.3.4数据预处理使用Mest Re Nova软件(V7.0)对所有一维1H NMR谱图的FID信号进行傅立叶变换,所有谱图在进行傅立叶变换时均乘以增宽因子为1 Hz的指数窗函数以提高信噪比,之后进行相位、基线校正和谱峰对齐。谱图采用α-葡萄糖低场处的双峰定标(δ 5.23)。利用相关软件将核磁共振谱图进行积分,去掉残余水峰信号(5.19 ppm~4.50 ppm),尿素(6.00 ppm~5.50 ppm)及外源EDTA及其与离子络合信号(2.55 ppm~2.74 ppm,3.05 ppm~3.31 ppm,3.61 ppm~3.66 ppm),其余区间在10.0 ppm~10.5 ppm的信号,以积分间距为0.005 ppm进行积分,将积分后的数据归一化后进行多变量数据统计分析。
1.4数据分析使用SIMCA-P+(V11.0,Umetrics AB,Umea,Sweden)软件对归一化后(PCA)的数据进行模式识别多变量数据分析,主成分分析使用中心化换算(mean center scaling)的数据标准化方式。使用SIMCA-P+软件对归一化后的数据进行偏最小二乘法(PLS)发现NMR数据(X变量)和其他变量(Y变量,分组信息)之间的相关关系。偏最小二乘法-判别分析(PLS-DA)使用自适换算(unit variance scaling)的数据标准化方式。PLS-DA对模型的质量用交叉验证法进行检验,并用交叉验证后得到的R2X和Q2(分别代表模型可解释的变量和模型的可预测度)对模型有效性进行评判。在此之后,通过排列试验随机多次(n=200)改变分类变量y的排列顺序得到相应不同的随机Q2值对模型有效性做进一步的检验。
2 结 果
2.11H-NMR谱图选择各组中具有代表性谱图,根据一维谱图并结合公共数据库(HMDB)对采集到的核磁共振信号进行归属。详见图1。图中, Keys:3-HB:3-Hydroxybutyrate;Val:Valine;Leu:Leucine;Ile:Isoleucine;Lys:Lysine;Arg:Arginine;Glu:Glutamate;Gln:Glutamine;Pyr:Pyruvate。
2.2PCA结果
2.2.1总体PCA分析(见图2)R2X=84.3%,Q2=0.800。

δ0.50~5.6和δ5.6~9.0(纵向放大512倍)
图1各组代表性样品的1H 600 MHz核磁共振图谱
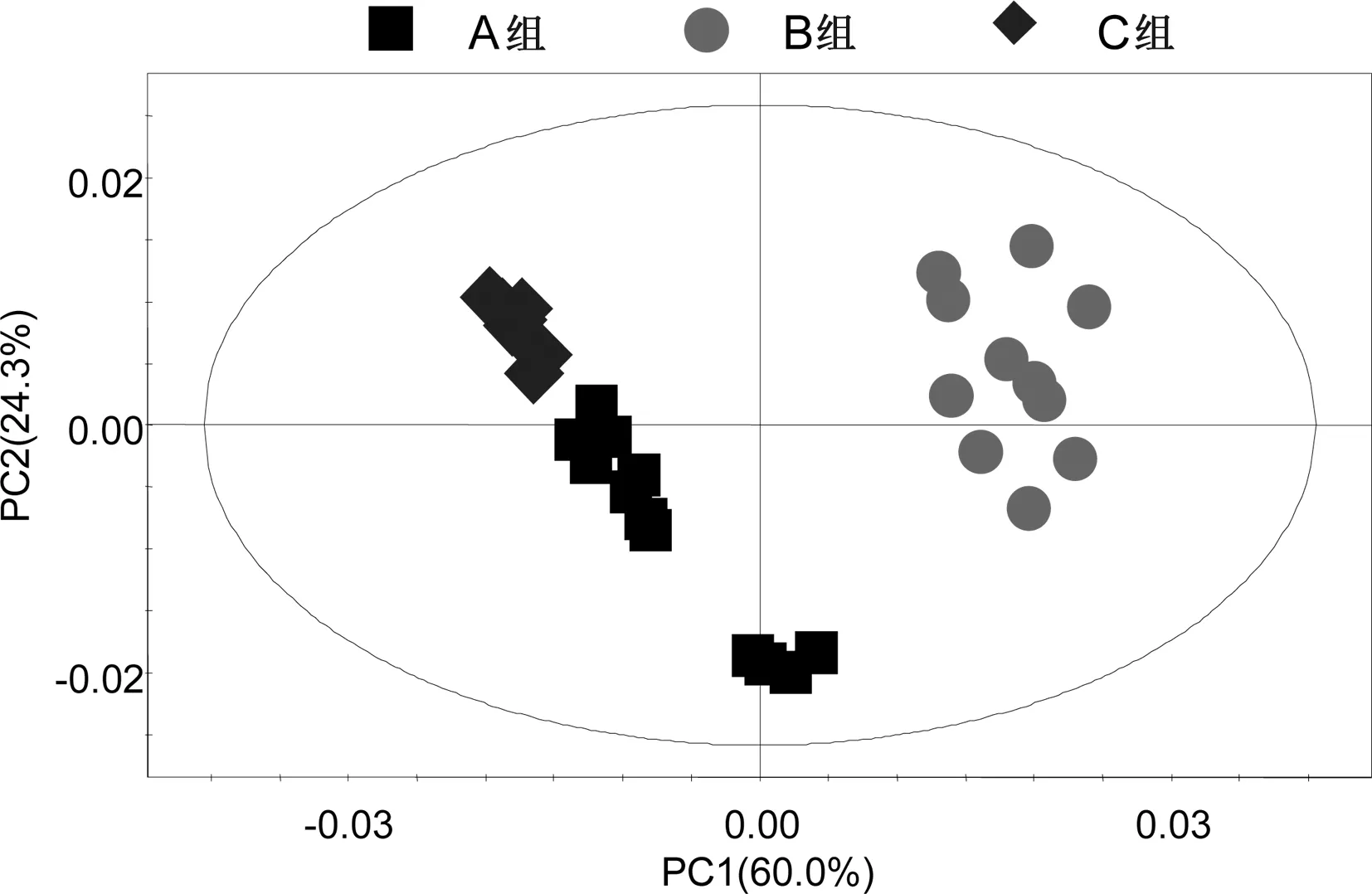
图2所有样本的2D PCA得分图
2.2.2A组与B组的PCA分析(见图3)R2X=82.9%,Q2=0.777。
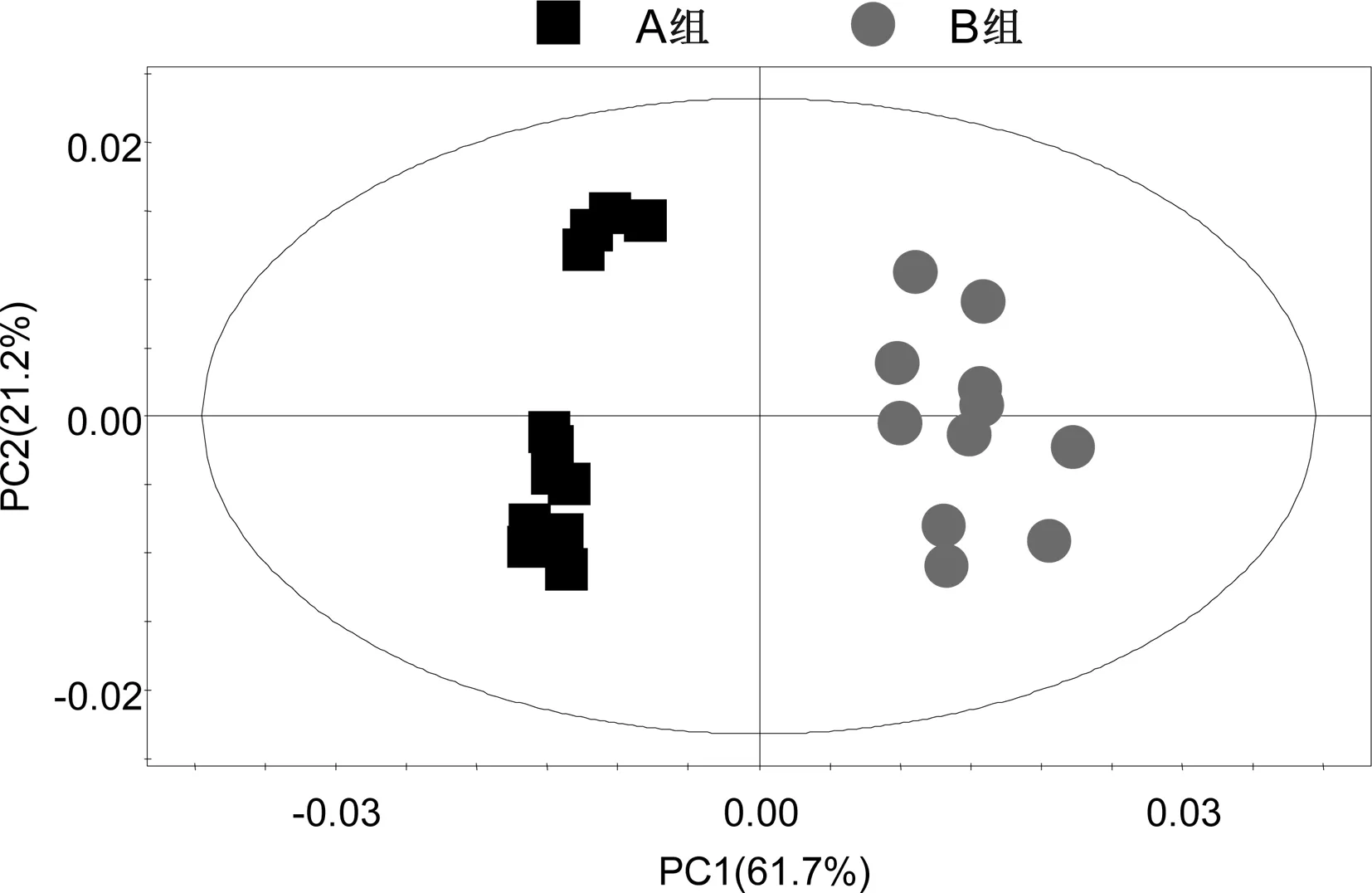
图3 A组与B组的PCA得分图
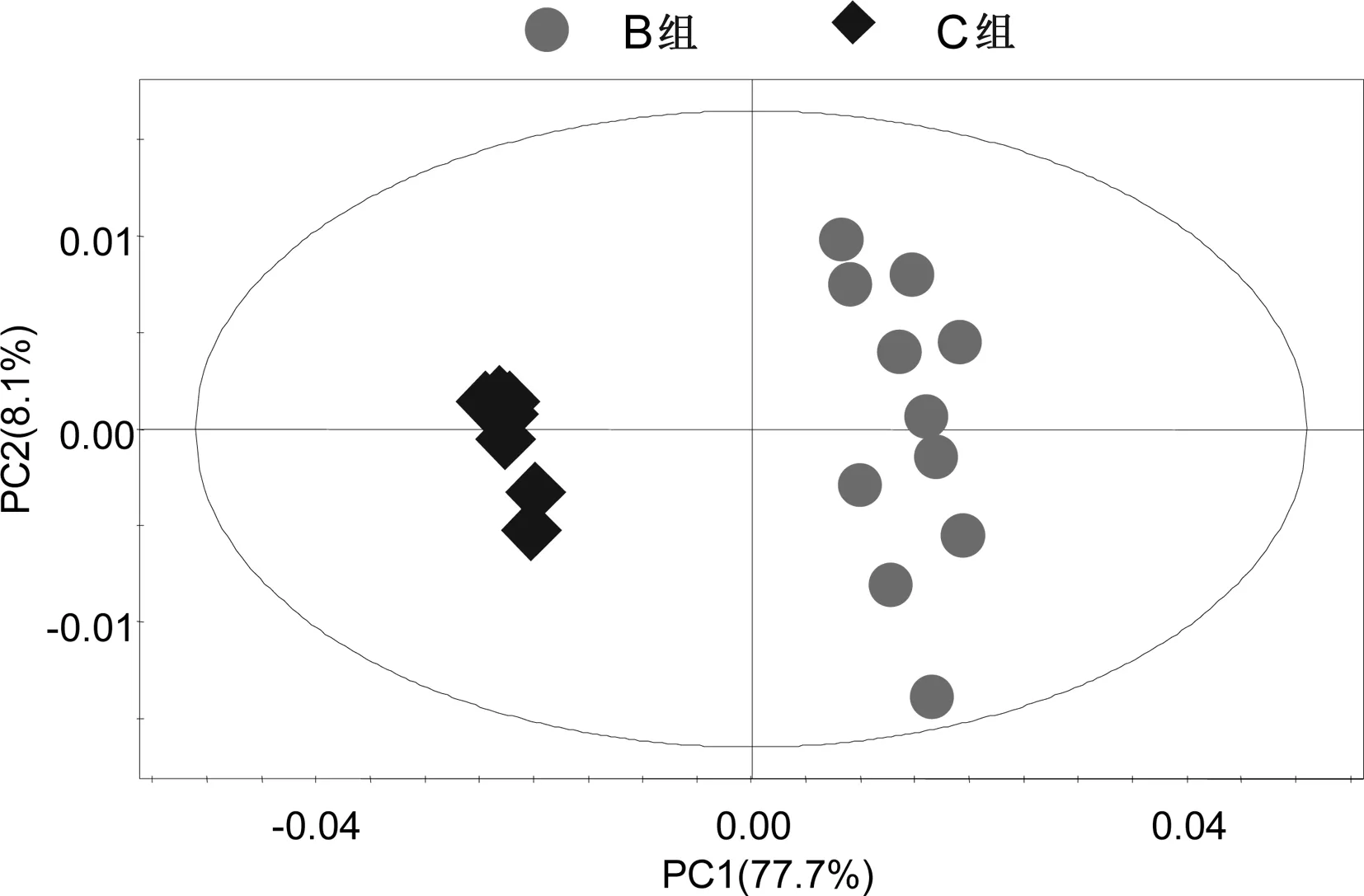
图4B组与C组的PCA得分图
2.2.3B组与C组的PCA分析(见图4)R2X=85.8%,Q2=0.753。
2.2.4A组与C组的PCA分析(见图5)R2X=83.3%,Q2=0.769。
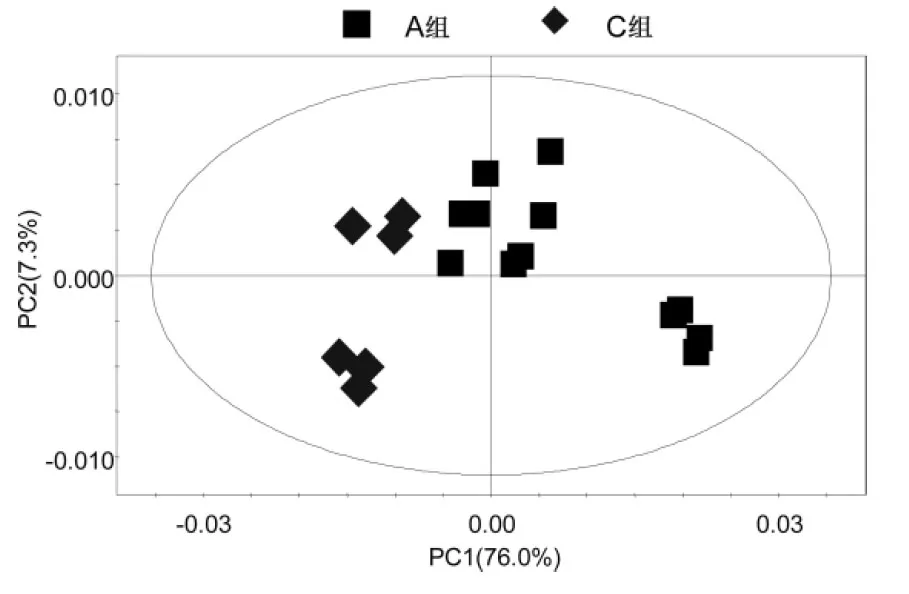
图5 A组与C组的PCA得分图
2.3PLS-DA及模型验证
2.3.1A组与B组的PLS-DA分析(见图6)R2X=33.3%,R2Y=0.900,Q2=0.719,截距:R2(0,0.666),Q2(0.0,-0.276)。
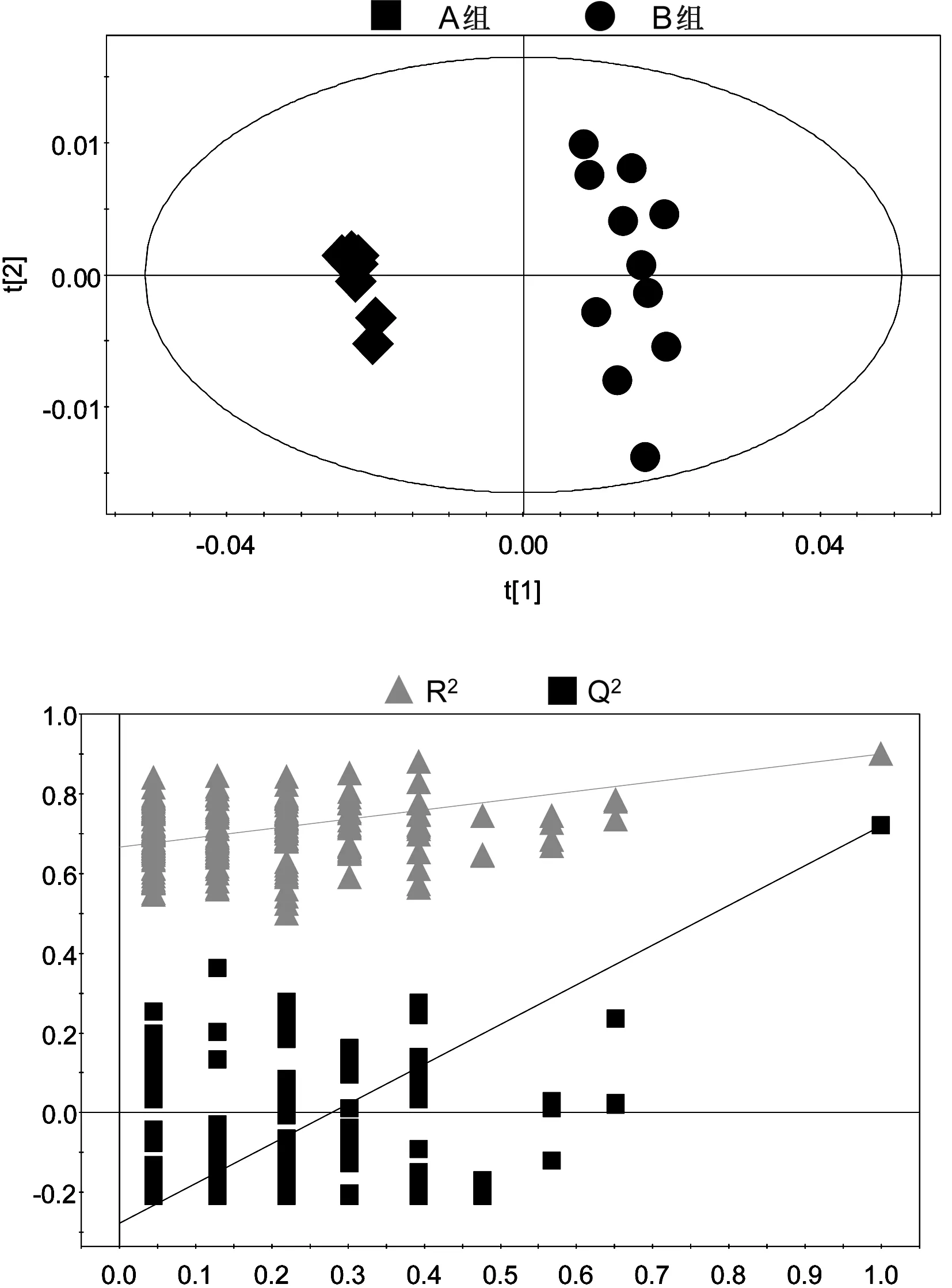
图6A组与B组的PLS-DA得分图与排列试验验证结果
2.3.2B组与C组的PLS-DA分析(见图7)R2X=40.7%,R2Y=0.993,Q2=0.961,截距:R2(0.0,0.621),Q2(0.0,-0.245)。
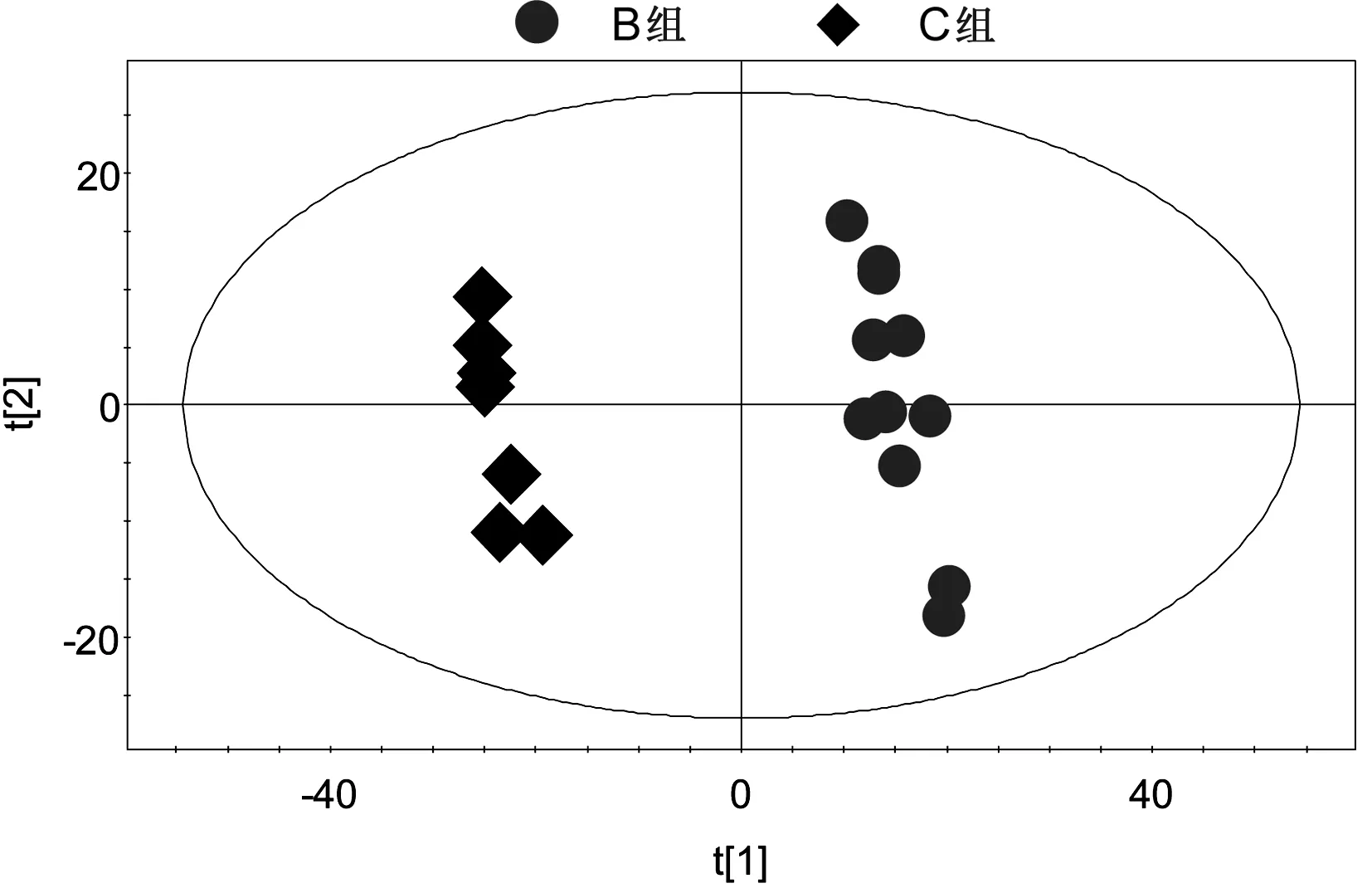
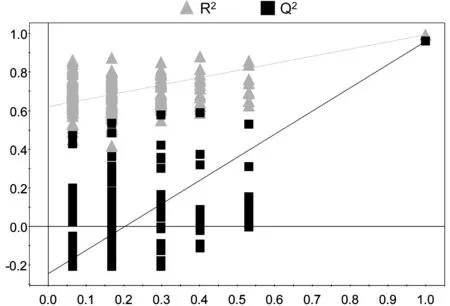
图7B组与C组的PLS-DA得分图与排列试验验证结果
2.3.3A组与C组的PLS-DA分析(见图8)R2X=33.7%,R2Y=0.958,Q2=0.801,截距:R2=(0,0.679),Q2=(0,-0.316)。
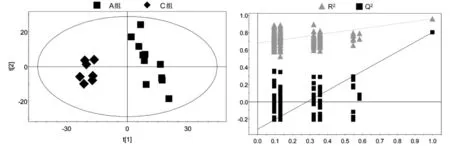
图8 A组与C组的PLS-DA得分图与排列试验验证结果
2.4正交偏最小二乘法-判别分析(OPLS-DA)对PLS-DA模型进行正交信号矫正,使用SIMCA-P+软件进行正交偏最小二乘法-判别分析(OPLS-DA),寻找对分组贡献较大的谱峰信号及其相应代谢物。OPLS-DA使用自适换算的数据标准化方式。
2.4.1A组与B组的OPLS-DA分析(见图9)
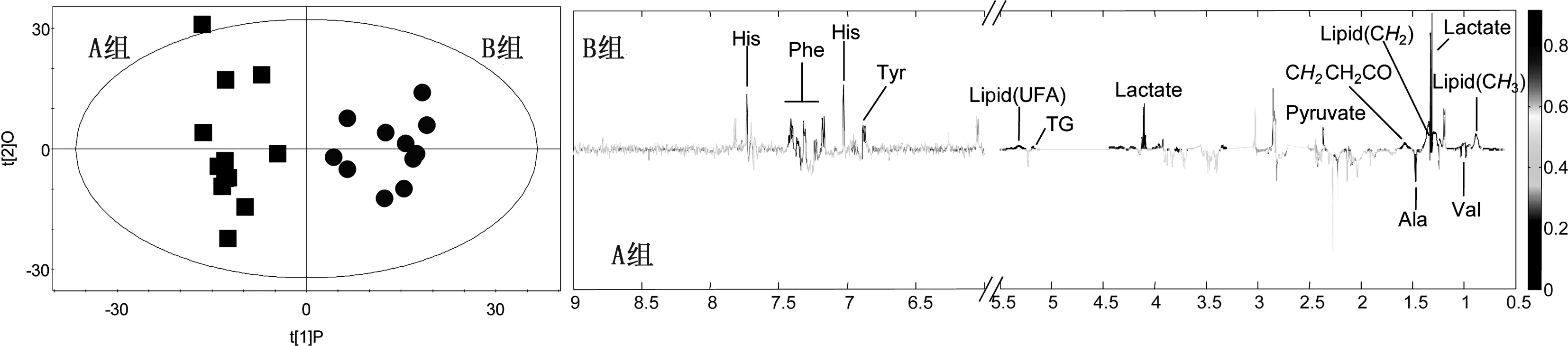
图9A组与B组的OPLS-DA得分图与相关系数负载图
2.4.2B组与C组的OPLS-DA分析(见图10)
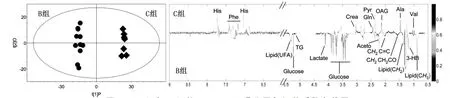
图10 B组与C组的OPLS-DA得分图与相关系数负载图
2.4.3A组与C组的OPLS-DA分析(见图11)
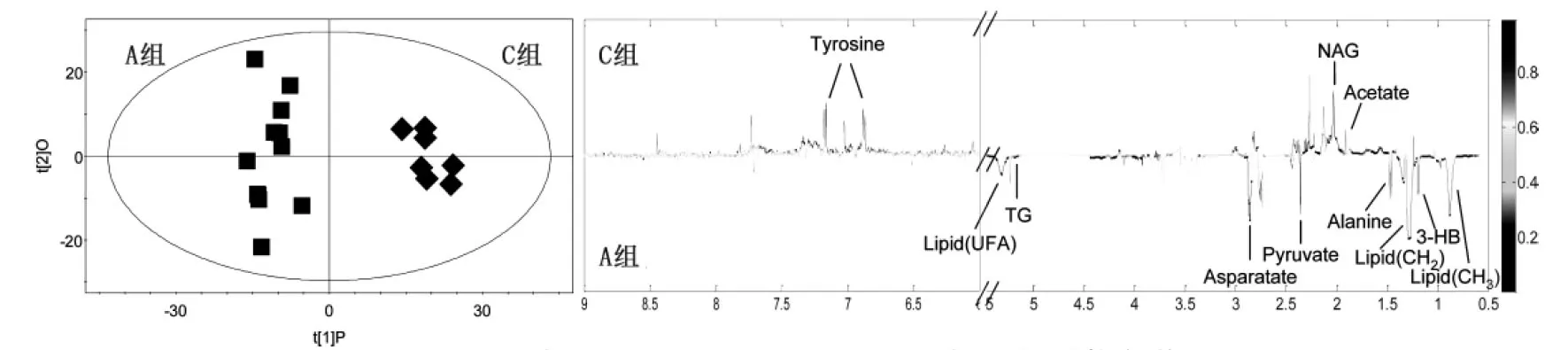
图11 A组与C组的OPLS-DA得分图与相关系数负载图
2.5差异代谢物的筛选及鉴定通过分析各代谢物相应的相关系数,对有统计学意义的代谢物进行进一步归纳,之后与相应的相关系数临界值表进行比较,得到引起组间差异的代谢物。将A、B、C 3组间有统计学意义的代谢物进行鉴定,并将其相应的相关系数进行归纳。根据P<0.05确定相关系数,│r│>0.707作为临界值,小于此系数忽略不计。详见表1~表3。

表1 A组与B组之间对分组贡献较大的显著性差异谱峰信号和相应代谢物及其相关系数

表2 B组与C组之间对分组贡献较大的显著性差异谱峰信号和相应代谢物及其相关系数
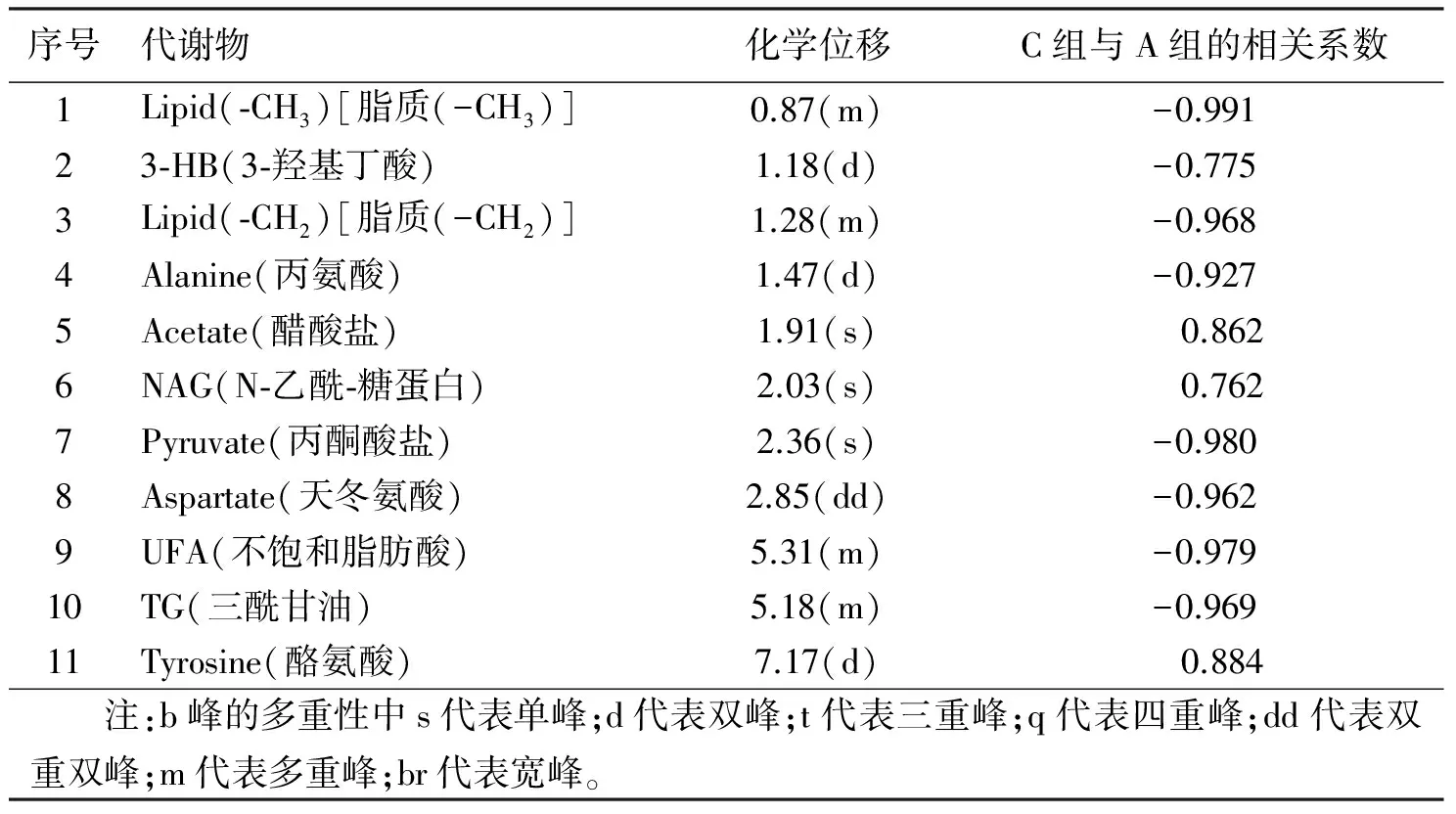
表3 A组与C组之间对分组贡献较大的显著性差异谱峰信号和相应代谢物及其相关系数
3 讨 论
本研究从1H-NMR谱图中看出,3组代谢物多为葡萄糖、氨基酸、脂类等小分子物质,选取的A组典型样本中的小分子物质主要为:组氨酸、酪氨酸、α-葡萄糖、β-葡萄糖、三酰甘油、肌酸、O-乙酰-糖蛋白、醋酸盐、赖氨酸、脂质(-CH2)、3-羟基丁酸;B组典型样本中的小分子物质为:甲酸、脱氧胞苷、胞苷、不饱和脂肪酸、乳酸、天冬氨酸、N-乙酰-糖蛋白、谷氨酰胺、CH2C=C、精氨酸、脂质(-CH3);C组典型样本中的小分子物质为:苯丙氨酸、延胡索酸盐、尿素氮、丙酮酸盐、乙酰乙酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸。
所有组别的PCA得分图显示,3组样本之间的聚类现象明显,说明3组之间的代谢差异有统计学意义。C组样本点的分布相对集中,反映C组个体之间的差异较小。A组与B组之间的样品分布相对分散,反映A组与B组样本之间的个体差异相对较大。之后分别对A组与B组,B组与C组,A组与C组样本之间的代谢物进行PCA两两分析。A组与B组,B组与C组,A组与C组的PCA得分图显示,以模型的可解释指标R2X和可预测指标Q2提示,所建立的数学模型比较可靠,组间的聚类现象比较明显,说明A组与B组,B组与C组,A组与C组之间代谢物差异显著。
A组与B组,B组与C组,A组与C组的PLS-DA得分图和排列试验验证结果,以模型的可解释指标R2X和可预测指标Q2,并结合排列试验验证结果共同提示,所建立的数学模型较可靠,说明组间代谢组差异比较显著。对PLS-DA模型进行正交信号矫正,通过OPLS-DA寻找对分组贡献较大的谱峰信号及其相应代谢物。这些代谢物涉及的代谢途径主要与脂类代谢、氨基酸代谢和糖代谢相关。
3.1脂类代谢异常脂质(-CH3)、脂质(-CH2)、CH2CH2CO、不饱和脂肪酸、三酰甘油属于脂类代谢途径产物。有研究显示:三酰甘油水平升高与慢性肾炎发生发展有密切关系[3]。有报道三酰甘油含量升高可能成为冠心病发生发展变化的独立危险因素[6]。
酮体是脂肪分解的产物,糖代谢障碍和脂肪不完全氧化时酮体在体内积聚使血酮升高。乙酰乙酸是酮体的组成部分,3-羟基丁酸等酮体水平升高,表明脂肪酸氧化的增强。
不饱和脂类水平的提高可能与脂蛋白脂肪酶活力降低有关,还可能与炎症过程有关,如一些聚-不饱和脂肪酸是炎症介质(如白细胞三烯和前列腺素)的前体。
差异代谢物筛选结果显示,原发性高血压合并高尿酸血症病人的脂质(-CH3)、脂质(-CH2)、CH2CH2CO、不饱和脂肪酸、三酰甘油含量较单纯高尿酸血症组高;原发性高血压合并高尿酸血症较健康对照组脂质(-CH3)、脂质(-CH2)、CH2CH2CO、CH2C=C、不饱和脂肪酸、三酰甘油含量偏高;高尿酸血症组较健康对照组脂质(-CH3)、脂质(-CH2)、不饱和脂肪酸、三酰甘油含量偏高。
原发性高血压合并高尿酸血症病人较单纯高尿酸血症病人、原发性高血压合并高尿酸血症病人较健康人、单纯高尿酸血症病人较健康人的脂代谢紊乱更严重。
3.2氨基酸代谢异常缬氨酸、丙氨酸、组氨酸、苯丙氨酸、酪氨酸、天冬氨酸、谷氨酰胺属于氨基酸代谢途径产物。缬氨酸属于支链氨基酸,反映机体合成代谢的重要因素。丙氨酸在肌肉组织浓度最高,是主要的能量来源,是淋巴细胞再生与免疫系统的重要氨基酸,是一种抑制性神经递质。当支链氨基酸缺乏时,血浆丙氨酸浓度降低。组氨酸经过一定途径转化为酮戊二酸,再经糖异生途径生成糖或转变成甘油。酮戊二酸是三羧酸循环的中间产物,其代谢受α-酮戊二酸脱氧酵活性的影响,因此,当机体处于病理状态时,酶的活性降低,产物含量减少。
苯丙氨酸和酪氨酸结构相似,均属于芳香族氨基酸。苯丙氨酸在体内经苯丙氨酸羟化酶催化生成酪氨酸,之后再生成一系列代谢产物,一般认为苯丙氨酸轻度增高对机体无特殊影响。酪氨酸进一步代谢涉及某些神经递质、激素及黑色素合成,在清除自由基、延缓疲劳等方面均有积极作用。天冬氨酸是赖氨酸、苏氨酸合成的物质之一,具有降低氧消耗作用,对心肌有保护作用。天冬氨酸参与鸟氨酸循环,可降低血液氮和二氧化碳含量,具有增强肝脏功能、消除疲劳的作用,本研究高尿酸血症病人较健康对照人含量增多,可能是一种应激情况下的反应。谷氨酰胺参与丙氨酸、天冬氨酸和谷氨酸代谢途径,谷氨酰胺是体内重要抗氧化剂谷胱甘肽的前体[7]。
N-乙酞-糖蛋白如血清淀粉样蛋白(apoSAA)和C-反应蛋白(CRP)是炎症标记物和急性期反应物蛋白[4]。原发性高血压合并高尿酸血症病人较单纯高尿酸血症病人酪氨酸、组氨酸、苯丙氨酸含量升高,缬氨酸、丙氨酸含量降低。原发性高血压合并高尿酸血症病人较健康人缬氨酸、丙氨酸、O-乙酰-糖蛋白、组氨酸、苯丙氨酸含量降低。单纯高尿酸血症病人较健康人N-乙酰-糖蛋白、酪氨酸含量降低,丙氨酸、天冬氨酸含量升高。说明原发性高血压合并高尿酸血症病人与单纯高尿酸血症病人均存在氨基酸代谢紊乱,提示氨基酸代谢紊乱可能参与高血压合并高尿酸血症的发生。
有学者通过研究发现,血浆游离氨基酸失衡与高血压发生存在一定关系,通过与正常人比较,发现苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、色氨酸升高,它们属于必需氨基酸;非必需氨基酸中,精氨酸、丙氨酸升高,而牛磺酸氨酸、甘氨酸、丝氨酸、谷氨酸、氨酸、羟脯氨酸则低于正常人[5],得出的结论与本研究发现的代谢谱结果相近,但氨基酸变化情况不同,可能与本研究样本量小有关,需要进一步研究分析,得出全面可靠的结论。
3.3糖类代谢异常在糖代谢方面,乳酸是糖酵解产物,其代谢异常是能量代谢紊乱的标志。正常生理状态下,细胞内的糖分解速度较慢,产生的丙酮酸和还原型烟酰胺腺嘌呤二核苷酸(NADH)较少,当人处于缺氧或剧烈运动时,细胞供氧不足,线粒体内丙酮酸和NADH的氧化分解过程。缺氧是引起乳酸增加的重要原因。
肌酸是一种自然存在体内的一种含氮有机酸,可辅助为肌肉和神经细胞提供能量。肌酸-磷酸肌酸系统是细胞能量运输的关键[8],肌酸水平下降认为是能量代谢紊乱的标志。
丙氨酸具有协助葡萄糖代谢,改善低血糖,维持血糖的正常水平,达到改善身体能量的作用,丙氨酸偏低说明体内糖异生的途径受到限制。
醋酸盐参与糖酵解/糖异生,醋酸盐的主要代谢方式是三羧酸循环,醋酸盐在三羧酸循环中的氧化作用提供机体代谢所需要的ATP,还能利用氢离子使机体的pH保持稳定减少碳酸氢盐的消耗,含量升高表明可能存在丙酮酸代谢、三羧酸循环等代谢障碍[9]。
丙酮酸盐是糖酵解的产物,是糖类代谢物和脂类代谢物进入三羧酸循环的媒介物,调节三羧酸循环水平,三羧酸循环是有氧代谢的主要途径,丙酮酸盐含量升高阻碍有氧呼吸的正常进行[9]。
本研究显示,与高尿酸血症病人比较,原发性高血压合并高尿酸血症病人的乳酸含量病人偏高,丙氨酸含量偏低,说明原发性高血压合并高尿酸血症病人能量代谢障碍较单纯高尿酸血症严重。在糖代谢方面,原发性高血压合并高尿酸血症病人较健康人乳酸、葡萄糖含量偏高,肌酸偏低;高尿酸血症病人较健康人的丙氨酸、丙酮酸盐含量升高,醋酸盐含量降低,说明能量代谢紊乱参与高血压合并高尿酸血症、高尿酸血症的发生。
综上所述,利用1H-NMR代谢组学方法可区分高血压合并高尿酸血症病人、高尿酸血症病人和健康人,高血压合并高尿酸血症的脂类代谢紊乱、氨基酸代谢紊乱、糖代谢紊乱较单纯高尿酸血症更严重。通过对内源性代谢产物比较和分析,可知高血压合并高尿酸血症这一与代谢有关疾病的发生与脂类代谢、氨基酸代谢、糖代谢、能量代谢等多种通路的异常相关,这是机体多个系统功能改变共同造成的结果。
本研究对高血压合并高尿酸血症、单纯高尿酸血症的代谢标志物进行初步探索,获得一些潜在的标志物,今后研究还需进一步运用代谢物靶标分析、代谢物浓度的统计分析,并适当扩大样本量,进行标志物确认。代谢组学作为一种新型辅助手段,对研究疾病发生发展的病理生理过程及寻找疾病新的生物标志物有广阔的研究和应用前景。
参考文献:
[1] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):701-743.
[2] 中国医师协会心血管内科医师分会.无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J].中国临床医生,2011,39(2):73-77.
[3] 武尚文,曹彤,李伟,等.血脂异常与慢性肾脏疾病进展的关系[J].山东医药,2010,50(17):64-65.
[4] Bell JD,Brown JC,Nicholson JK,et al.Assignment of resonances for “acute-phase” glycoproteins in high resolution proton NMR spectra of human blood plasma[J].FEBS Letters,1987,215(2):311-315.
[5] 刘春兰,刘勇,曲卫,等.血浆游离氨基酸的水平变化与高血压病的相关性[J].实用医药杂志,2002,19(12):926-928.
[6] 张原力,游凯,方圻,等.脂餐后血清三酰甘油代谢异常作为冠心病独立危险因素的探讨[J].中华心血管病杂志,1998,26(2):9-13.
[7] Houdijk AP,Rijnsburger ER,Jansen J,et al.Randomised trial of glutamine-enriched enteral nutrition on infectious morbidity in patients with multiple trauma[J].Lancet,1998,352(9130):772-776.
[8] Sun YJ,Wang HP,Liang YJ,et al.An NMR-based metabonomic investigation of the subacute effects of melamine in rats[J].Journal of Proteome Research,2012,11(4):2544-2550.
[9] Italiano JE,Bergmeier W,Tiwari S,et al.Mechanisms and implications of platelet discoid shape[J].Blood,2003,101(12):4789-4796.
