生物合成D-丙氨酸研究进展
2022-01-13何广正徐书景鞠建松
陈 哲, 何广正, 徐书景, 鞠建松
(河北师范大学 生命科学学院,河北 石家庄 050024)
随着科学技术的不断发展,科研人员发现D-氨基酸在植物、动物、微生物中发挥着特定的生物学功能[1-2],如在哺乳动物中,D-丝氨酸(D-serine)作为N-甲基-D-天冬氨酸(NMDA)受体的共同激动剂,与大脑的学习以及记忆相关[3-4].D-天冬氨酸(D-aspartic acid)在内分泌中发挥着重要作用,它可以调节合成激素以及促进分泌精子[5].作为非天然氨基酸,D-丙氨酸(D-alanine)是参与构成细菌细胞壁肽聚糖层的重要成分之一,主要以D-丙氨酰-D-丙氨酸的形式参与构建细菌细胞壁的肽聚糖层[6-8].敲除嗜水气单胞菌中的丙氨酸消旋酶基因后,当培养基中含有D-丙氨酸时,基因缺失菌生长良好;当限制供给D-丙氨酸后,缺失菌则呈现细胞壁穿孔、内容物渗漏现象,这说明D-丙氨酸与维持细菌细胞壁结构的完整性存在密切联系[9].D-丙氨酸在芽孢杆菌孢子萌发方面发挥着一定的调节功能,Chesnokova等[10]研究发现,在孢子形成后期,D-丙氨酸发挥着抑制孢子过早萌发的作用.
此外,D-丙氨酸作为一种重要的手性中间体,在食品、化妆品、生理医学和制药等方面应用广泛,是亟需开发的新品种之一[2,11].在食品方面,D-丙氨酸主要作为食品的增味剂和调味剂,可以改善人工甜味剂的味感及有机酸的酸味等[12-13];在化妆品方面,D-丙氨酸不仅具有抑菌作用,是自然保湿因子(natural moisturizing factor,NMF)的主要成分,还是角质层保持水分的重要角色[14];在生理医学方面,D-丙氨酸可以使体内氨基酸氧化酶在肿瘤细胞质中异位表达,阻止体内脂质氧化损伤,消除细胞毒素,可以作为一种治疗癌症的药物[1,15-16];在制药方面,D-丙氨酸既是合成维生素B6和抗生素virginiamycin系列药物的原料,本身也具有镇痛作用[17-19].
目前,已有许多关于D-丙氨酸制备的文献报道.然而,随着人们对绿色可持续发展理念的认识不断深入,开发低成本无污染的生产工艺逐渐成为亟待解决的问题.为此,介绍了D-丙氨酸的生产方法,分析了各种方法的优缺点,为合理优化D-丙氨酸的合成工艺提出新的思路.
1 D-丙氨酸的理化性质
D-丙氨酸(D-alanine)的结构简式为CH3CH(NH2)COOH,分子式为C3H7NO2,结构式如图1所示.D-丙氨酸的结晶态呈无色、可溶于水、微溶于乙醇、不溶于乙醚等有机溶剂,熔点为297 ℃.
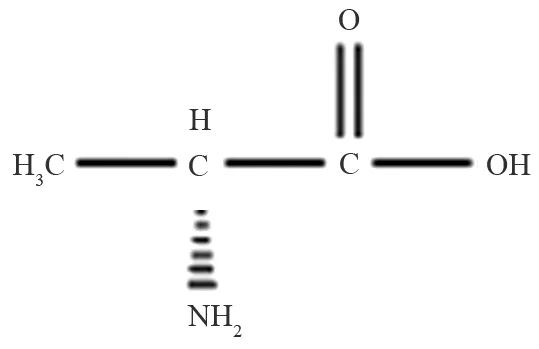
图1 D-丙氨酸结构式Fig.1 The Sketch of D-alanine
2 D-丙氨酸的制备方法
制备D-丙氨酸的方法主要有化学合成法[17]、微生物发酵法[20-21]和生物酶法[22-23].
2.1 化学合成法
化学合成法包括手性拆分法和不对称合成法[17].手性拆分法是先通过化学合成法合成DL-丙氨酸的混合物,再利用光学方法拆分DL-丙氨酸,最后得到D-丙氨酸,其可分为物理拆分法、化学拆分法和酶拆分法3种[13,24].不对称合成法是指直接采用化学合成法合成D-丙氨酸[25-26].
2.1.1 手性拆分法
1) 物理拆分法.包括对映选择性结晶法、色谱拆分法、膜拆分法[27-28].对映选择性结晶法又称诱导结晶法,是指向含有DL-氨基酸饱和溶液中加入有光学活性的化学试剂,具有与该化学试剂光学活性相同的晶体将会优先析出.
庞秀言等[28]采用了混合晶体接种法,根据α-丙氨酸的立体特异性,向DL-丙氨酸混合溶液中加入了L-丙氨酸,进行冷却、恒温结晶,饱和溶液中的L-丙氨酸析出.
一些高分子金属络合物具有手性配体,可以作为手性固定相,进行手性配体交换色谱,这种方法叫做色谱拆分法,也称手性固定相拆分法.在DL-丙氨酸中加入光学活性剂N-三氟乙酰基正丁烷,利用硅胶毛细管分离出D-丙氨酸[17,29].
膜拆分法的原理类似于色谱拆分法,它依赖于氨基酸消旋体与溶液中的阳离子,以及与手性固定相形成复合物的稳定性差异[27].
2) 化学拆分法.是指外消旋氨基酸和手性拆分试剂(如酒石酸、樟脑、磺酸等)作用,形成各自的氨基酸盐,然后利用其物理性质或化学性质的差异将它们分离,最后将拆分剂去除,从而得到不同的异构体[17,27].反应原理为
DL-丙氨酸 + 手性拆分剂 →L-丙氨酸盐 /D-丙氨酸盐.
蒋立建等[30]将DL-丙氨酸与拆分剂L-酒石酸溶于甲酸、乙酸或丙酸等有机酸中,加热搅拌,再冷却至室温,得到结晶固体,随后将结晶溶于甲醇、乙醇或丙醇等醇溶液中,以三乙胺、氨水或碳酸铵等碱中和,终产物D-丙氨酸的收率为70 %,光学纯度为98.5 %.
3) 酶拆分法.由于酶具有特异性及专一性的特点,可以只催化其中一种消旋体进行反应,而对另一种消旋体几乎不起作用,该反应大都在温和的条件下进行.王晓平等[31]利用固定化米曲氨基酰化酶拆分乙酰化DL-丙氨酸,在pH 7.0,50 ℃条件下,D-丙氨酸和L-丙氨酸的回收率分别为83.5 %和90 %,纯度均为光谱纯.刘鹏刚等[32]利用固定化含氨基酰化酶的大肠杆菌拆分乙酰化DL-丙氨酸,在50 ℃,pH 7.5条件下反应6 h,D-丙氨酸的产率为87.2 %,光学纯度为98 %.
氨基酸氧化酶也可用于拆分DL-丙氨酸.氨基酸氧化酶按照底物特异性可分为L-氨基酸氧化酶(L-amino acid oxidase,LAAO,EC 1.4.3.2)和D-氨基酸氧化酶(D-amino acid oxidase,DAAO,EC 1.4.3.3),属于黄素蛋白酶类,可氧化L-氨基酸或D-氨基酸生成相应的酮酸、过氧化氢和氨.因此,利用LAAO可催化DL-氨基酸混合物中的L-对映体氧化脱氨,保留D-对映体,从而实现DL-氨基酸的拆分(图2)[33].Singh等[34]利用Aspergillusfumigatus来源的LAAO对DL-丙氨酸实现了完全拆分(D-丙氨酸为100 %),受底物特异性的影响,该酶对于DL-酪氨酸和DL-苯丙氨酸的拆分能力下降,拆分率分别为84.1 %和80.2 %,对DL-天冬氨酸则无法拆分.

图2 LAAO氧化反应方程Fig.2 The Sketch of Oxidization by L-amino Acid Oxidase
2.1.2 不对称合成法
1) Kagan-Corey合成法.由Kagan等提出,随后经Corey等改进,用于化学合成D-丙氨酸的方法[27].该方法将前体α-酮酸与手性试剂二氢吲哚衍生物结合生成环状中间体亚联氨基内酯,通过选择性还原亚氨基,产生α-氨基酸手性碳,随后经氢解反应生成D-丙氨酸,终产物光学纯度可达96 %.
2) 铑(Ⅱ)络合催化法.此方法采用Wilkinson催化剂,即铑(Ⅰ)络合物Rh(Ph3P)3Cl,以含有双键的氨基酸衍生物作为反应底物,通过主体选择性还原反应合成D-丙氨酸,反应产物光学转化率最高可达91 %[17,35].
3) Evans合成法.Evans等将非手性的羧酸与光学手性试剂缩合,所生成的中间产物在碱性条件下经烯醇化反应与手性试剂络合生成D-丙氨酸[17,27].此反应存在立体效应制约,而且反应产物立体构型单一.
4) Oguri合成法.Oguri等将甘氨酸与手性试剂2-羟蒎烯-3-酮反应形成希夫碱,甘氨酸中活化的α-氢与碘甲烷(MeI)通过烷基化反应产生D-丙氨酸,反应收率为52 %,光学纯度达83 %[27].
由于不对称合成反应所需的手性试剂或金属络合物的价格昂贵,且存在着反应机制复杂、生产时间较长和立体效应制约等诸多不足,限制了这些方法的进一步推广和应用.
2.2 微生物发酵法
微生物发酵法即通过筛选生产菌株或构建突变株,采用发酵法生产获得D-丙氨酸.方序等[36]通过诱变育种筛选获得一株DL-丙氨酸的高产菌株-钝齿棒状杆菌P1412,经过发酵条件优化,产物DL-丙氨酸最终浓度可达51 mg/mL,产率为35.5 %.Smith等[37]构建了敲除影响丙氨酸合成途径的关键酶(丙酮酸甲酸裂解酶、磷酸烯醇丙酮酸合成酶、丙酮酸氧化酶、乳酸脱氢酶等)基因的大肠杆菌,以之为宿主导入含有球形芽孢杆菌丙氨酸脱氢酶的表达载体pTrc99A-alaD,通过流加法厌氧发酵23 h,产物DL-丙氨酸达88 g/L,其合成途径如图3所示.张学礼等[38]以大肠杆菌XZ-A26为出发菌株,敲除其自身的乳酸脱氢酶、丙酮酸甲酸裂解酶、乙醇脱氢酶、富马酸还原酶、丙氨酸消旋酶、甲基乙二醛合成酶等基因,并将枯草芽孢杆菌168来源的L-丙氨酸脱氢酶基因和丙氨酸消旋酶基因整合至宿主染色体上,构建获得工程菌株大肠杆菌XZ-A30,在添加有葡萄糖等糖类原料的发酵培养基中厌氧发酵40~60 h,产物DL-丙氨酸产量达114.6 g/L(D-丙氨酸与L-丙氨酸比例约为1∶1).

虚线表示由异源丙氨酸脱氢酶转换介导.符号“×”表示通路的关键酶被敲除.图3 大肠杆菌中丙氨酸的生物合成途径Fig.3 The Biosynthetic Pathway of Alanine by Escherichia coli
可以看出,微生物发酵法的生产工艺比较简单,有较大的发展潜力,但菌种筛选和改造比较困难,培养时间较长,反应能耗高,且反应产物拆分技术亟待突破.
2.3 生物酶法
2.3.1 海因酶法
海因酶(hydantoinase,EC 3.5.2.2)也称为乙内酰脲酶,属于酰胺水解酶,特异催化裂解海因、5′-单取代海因及其衍生物中的环酰胺键[39-40].根据其功能划分,该酶可分为D-海因酶、L-海因酶、羧甲基海因酶、尿囊素酶等,其中,D-海因酶以5′-单取代海因或二氢尿嘧啶为底物,将之转化为氨甲酰类氨基酸,最终生成D-氨基酸,是生产D-氨基酸的关键性酶[41].Tosa等通过加热使DL-丙氨酸、氰酸钾和水反应生成N-氨甲酰基-DL-丙氨酸,在氢氧化钾的作用下环化形成DL-5-取代海因,经海因酶催化产生氨甲酰基-D-丙氨酸,以重氮法去除氨甲酰基获得D-丙氨酸[17].此法所得产物D-丙氨酸的光学活性较高,但反应中所需的大量亚硝酸盐对环境、设备及人员等危害较大.
2.3.2D-氨基酸转氨酶法
D-氨基酸转氨酶(D-amino acid transaminase,DAAT,EC 2.6.1.21)也称为D-丙氨酸转氨酶,能可逆催化D-氨基酸(D-脯氨酸、D-缬氨酸、D-色氨酸、D-半胱氨酸和D-丝氨酸除外)与丙酮酸之间发生氨基转移从而产生D-丙氨酸[42-43].D-氨基酸转氨酶普遍存在于微生物和植物中,在D-氨基酸的合成代谢和氨基转移方面有重要作用.张卫卫等[19]利用天冬氨酸消旋酶催化L-天冬氨酸(50 g/L)形成DL-天冬氨酸,D-天冬氨酸经D-氨基酸转氨酶催化转氨基生成D-丙氨酸(15.73 g/L),产率约为31.5 %,对映体过量值(ee)为98 %.
2.3.3D-氨基酸脱氢酶法
D-氨基酸脱氢酶可以通过还原氨化反应将酮酸和铵盐转化为D-氨基酸,然而,该酶在自然界中极为少见.Gao等[44]从嗜热共生杆菌(Symbiobacteriumthermophilum)中得到了一个新型的meso-二氨基庚二酸脱氢酶(meso-diaminopimelate dehydrogenase,EC 1.4.1.16),该酶是首个具有D-氨基酸脱氢酶催化功能的天然酶,能将底物丙酮酸胺化还原为D-丙氨酸,其比活力为2.87 U/mg,转化率为68 %,ee值为99 %[45].随后,Li等[46]将meso-二氨基庚二酸脱氢酶和甲酸脱氢酶(formate dehydrogenase,FDH,EC 1.17.1.9)以共固定化的方式优化其生物转化条件,提高了双酶的重复利用次数(反应20批次后,D-丙氨酸的转化效率为75.7 %).尽管此法所得D-丙氨酸转化率稍低,但为酶法合成D-丙氨酸提供了新思路.
2.3.4 丙氨酸消旋酶法
丙氨酸消旋酶(alanine racemase,ALR,EC 5.1.1.1)是磷酸吡哆醛依赖性酶,可以催化L-丙氨酸转变为D-丙氨酸,催化形成D-丙氨酸,该方法反应条件温和,且收率可高达95 %[47].
1997年,Galkin等[48-49]就介绍了采用4种酶联合催化生成D-氨基酸的方法(图4):利用丙氨酸脱氢酶(alanine dehydrogenase,ALDH,EC 1.4.1.1)、ALR和DAAT偶联将底物丙酮酸和氨逐步转化为D-氨基酸,辅以甲酸脱氢酶(FDH)催化甲酸脱氢生成NADH,为丙氨酸脱氢酶提供辅因子NADH.这种多酶偶联的方法既可满足绿色生产的需求,又可较大限度降低生产成本,但由于微生物酶普遍催化活性低、稳定性差,此方法没有得到广泛应用.

图4 酶偶联法合成 D-氨基酸Fig.4 Synthesis of D-amino Acids by Coupling of Four Enzymes
本实验室前期从假坚强芽孢杆菌(BacillusPseudofirmus)中获得了一种具有较高催化活性的丙氨酸消旋酶,参照Galkin等[48-49]的研究思路,以葡萄糖脱氢酶替代甲酸脱氢酶参与辅因子NADH再生,构建了葡萄糖脱氢酶、丙氨酸脱氢酶和丙氨酸消旋酶三基因共表达载体,经优化后,D/L-丙氨酸的产量分别为 51.9 g/L·d和56.4 g/L·d,可以看出,利用这种方法催化合成D-丙氨酸具有较高的合成效率[50].不过,由于反应产物中L-丙氨酸和D-丙氨酸的性质极为相似,将二者拆分从而获得纯净单体的工艺路线较为复杂.
3 D-丙氨酸合成技术的展望
D-丙氨酸不仅在细菌细胞壁合成、孢子萌发方面有重要作用,在食品添加剂、化妆品和医药等行业也有着较大的应用潜力.因此,开发一种高效、低成本的D-丙氨酸合成方法受到广大科研工作者的关注.从表1可以看出,3种合成方法各有优缺点,不过,从可持续发展的理念来看,具有反应条件温和、低污染等优点的生物酶法显然具有更大的发展空间.特别是随着近年来酶蛋白定向进化技术的飞速发展,合理改造酶蛋白以满足生产实际的需求正逐渐梦想成真.

表1 D-丙氨酸合成技术的优缺点Tab.1 Advantages and Disadvantages of D-alanine Synthesis Technology
以丙氨酸消旋酶法为例,由于丙氨酸消旋酶的反应平衡常数Keq(L/D)大都为1.0[51],意味着该酶所参与的催化反应为可逆平衡反应,那么,如果能够提高Keq(L/D),必将打破反应平衡从而使反应向生成D-丙氨酸方向进行.近期,本实验室通过定点突变技术分别获得了Keq(L/D)为2.6和3.95的丙氨酸消旋酶突变体[52-53],这说明通过定向进化技术有望获得反应平衡常数大幅提升的突变体酶蛋白.目前,本实验室正以假坚强芽孢杆菌中具有较高催化活性的丙氨酸消旋酶为研究对象,以其活性中心周边氨基酸位点为靶点,采用迭代饱和突变技术构建突变体文库,从中筛选Keq(L/D)显著提升的突变体,为生物合成D-丙氨酸提供理想的酶蛋白.
