时间分辨荧光免疫层析法检测大米中黄曲霉毒素B1的不确定度分析
2018-04-11张一平董曼佳熊晓辉严艺琳张东升
袁 毅,张一平,董曼佳,熊晓辉,严艺琳,张东升
(1.贵州省粮油产品质量监督检验站,贵州 贵阳 550001;2.江苏省苏微微生物研究有限公司, 江苏 无锡 214063;3.南京工业大学 食品与轻工学院,江苏 南京 211800)
黄曲霉毒素(aflatoxin,AFT)是由黄曲霉和寄生曲霉等真菌产生的一类有毒次生代谢物[1],基本结构为二呋喃环和香豆素 (氧杂萘邻酮)[2]。依据其化学结构不同,主要有20余种衍生物[3],其中,黄曲霉毒素B1的毒性和致癌性最强[4],1993年被世界卫生组织(WHO)的癌症研究机构列为 Ⅰ 类致癌物[5]。欧盟在1999年颁布的《EC No.1525/98号法令》规定,直接提供人类食用的食物及组成食品的组分中,黄曲霉毒素 B1含量不得大于2 μg/kg[6]。我国国家标准GB 2761—2017中规定,黄曲霉毒素B1允许量标准为玉米、花生仁、花生油不得超过20 μg/kg,大米及其他食用油不得超过10 μg/kg,其他粮食、豆类、发酵食品不得超过5 μg/kg,婴幼儿食品不得超过0.5 μg/kg[7]。
时间分辨荧光免疫层析法(TRFIA法)是利用抗原与抗体免疫反应的高度特异性以及纳米稀土元素作为荧光标记示踪物的高度灵敏性而建立起来的一种微量物质检测技术,具有简便、快速、高灵敏的特点[8-10]。目前国内已研发出专门针对真菌毒素的TRFIA技术及其检测卡(或试纸条),用于毒素含量的现场实时检测[11-13],并已将TRFIA法测定饲料中黄曲霉毒素B1列为农业行业标准[14]。
目前,关于真菌毒素检测不确定度的评定主要集中于酶联免疫吸附法(ELISA)[15-16]和高效液相色谱(HPLC)法[17-18],未见关于TRFIA法的文章。为了推动TRFIA技术在食品、饲料检测中的应用,对其测量不确定度进行评定是非常必需的。本文中,笔者采用TRFIA法测定大米中黄曲霉毒素 B1含量,根据CNAS-GL06:2006《化学分析中不确定度的评估指南》中提供的方法[19],对结果进行包括不确定度来源及其量化和评定在内的分析,旨在指导检测人员关注TRFIA法检测的关键环节,提高检测结果的准确性和可靠性。
1 材料与方法
1.1 材料和试剂
样品随机抽样自市售大米。
黄曲霉毒素B1时间分辨荧光免疫层析卡(简称检测卡),江苏省苏微微生物研究有限公司。
甲醇、蔗糖、吐温-20、Na2HPO4·12H2O、NaH2PO4·2H2O,国药集团上海生化试剂公司(均为分析纯)。黄曲霉毒素B1标准溶液、牛血清白蛋白(BSA),美国Sigma公司(纯度均大于98%)。0.2 mol/L Na2HPO4缓冲液(71.63 g的Na2HPO4·12H2O,用水溶解并定容到1 L)。0.2 mol/L NaH2PO4缓冲液(31.20 g的NaH2PO4·2H2O,用水溶解并定容到1 L)。pH7.2、0.1 mol/L的磷酸缓冲液PB(取0.2 mol/L Na2HPO4缓冲液360 mL, 0.2 mol/L NaH2PO4缓冲液140 mL,用水定容至1 L)。1.5 g蔗糖、0.2 g牛血清白蛋白、2.5 g吐温-20,溶解于100 mL PB中,制成样品稀释液。
以上实验用水均符合GB/T 6682—2008中一级水的要求[20]。
1.2 仪器设备和计量器具
PL203型电子分析天平(分度值0.01 g、最大量程210 g),梅特勒-托利多(上海);DFY-500型摇摆式高速中药粉碎机,温岭市林大机械有限公司;GKC214型恒温水浴锅(温控范围为室温~100 ℃,水温波动≤0.5 ℃,温差≤1 ℃),上海苏达实验仪器有限公司;MX-F型振荡器,北京大龙实验室;SW-2型时间分辨荧光分析仪(激发波长(365±5) nm、检测波长(615±5) nm),在0.00~1.00比值(T/C除以T0/C0)范围内的荧光强度重复性为0.5%,江苏省苏微微生物研究有限公司。
50 mL玻璃量筒(最大容量允差±0.5 mL)、100 mL玻璃量筒(最大容量允差±1.0 mL),BOMEX公司;200 μL微量移液器(最大容量允差±1.2 μL)、1 000 μL微量移液器(最大容量允差±5.0 μL),Thermo公司。
1.3 提取方法
将样品粉碎至全部通过0.9 mm分样筛,充分混合均匀。
准确称取粉碎后的样品5.00 g于250 mL三角瓶中,加入50 mL 70%(体积分数)甲醇溶液,摇床振荡提取20 min,经定性滤纸和布氏漏斗过滤,收集滤液。取100 μL的该滤液与600 μL室温下的样品稀释液,经振荡器混合,即得待测试样。
1.4 测定步骤
平衡:将检测卡从冷藏状态(2~8 ℃)取出,放置室温平衡15 min。
测定:准确移取100 μL待测试样,加到检测卡的试样孔中;室温下反应10 min后,将其放入时间分辨荧光分析仪中;选择激发波长365 nm、检测波长615 nm,点击仪器主界面“测量”菜单中“样品及时测量”按钮,检测T线荧光强度与C线荧光强度,由仪器读出T/C值(T线与C线荧光强度比值)。
1.5 数据计算
1.5.1标准曲线制备
1)准确吸取黄曲霉毒素B1标准溶液于10 mL容量瓶中,甲醇定容,配制成5 ng/mL的标准储备液,准确移取标准储备液,用10%甲醇+90%样品稀释液定容,配制成质量浓度为0、0.01、0.02、0.05、0.1、0.2和0.5 ng/mL的黄曲霉毒素B1标准工作溶液。
2)由低浓度到高浓度,分别取标准工作溶液100 μL加至检测卡的试样孔中,于25 ℃恒温水浴锅中反应10 min后,将其放入时间分辨荧光分析仪中,在激发波长365 nm、检测波长615 nm条件下,检测T线荧光强度与C线荧光强度,由仪器读出T/C值。
3)以标准工作溶液的浓度对数值(lgXi)为横坐标,以各浓度标准工作溶液的T/C值与0 ng/mL标准液的T0/C0值的比值(Yi)为纵坐标,绘制标准曲线。
1.5.2试样中毒素浓度的计算
按照“1.4测定步骤”测得试样的T/C值,再除以0 ng/mL标准液的T0/C0值;根据所得比值,从标准曲线上查出试样中黄曲霉毒素B1的浓度对数值lgX样,求反对数计算出试样中黄曲霉毒素B1的浓度值X样(ng/mL)。
1.6 数学模型
样品中黄曲霉毒素B1含量(C)的计算公式为
(1)
式中:C—样品中黄曲霉毒素B1含量,μg/kg;X样—试样中黄曲霉毒素B1的质量浓度,ng/mL;V—提取液的体积,50 mL;n—稀释倍数,n=7;m—样品取样的质量,5 g;f—回收率校正因子, 1.005 9。
1.7 不确定度分量的来源
测定步骤主要包括样品称量、毒素萃取、滤液稀释、检测卡平衡、免疫层析反应、荧光强度读数、标准曲线制备和数据处理等过程,这一系列过程都会引入误差。
但在实际测定中,如标准曲线制备、萃取、平衡、反应等操作引入的不确定度是难以量化的。因此,结合实际工作可以采用标准曲线拟合、回收率校正因子、重复性等方法来对这些步骤的不确定度进行评定,即指A类评定,主要有①标准曲线拟合引入的不确定度Ux;②回收率校正因子的不确定度Ur;③重复性检测引入的不确定度Uc。
对于称量、量取、稀释、加样、反应时间、读数和数据处理等引入的不确定度,可以通过天平、量筒、微量移液器和时间分辨荧光分析仪等的误差以及线性相关系数来评定,属B类评定,主要有①样品称量引入的不确定度Um;②样品提取引入的不确定度Us;③TRFIA实验操作过程引入的不确定度Up;④时间分辨荧光分析仪读数引入的不确定度Ui;⑤数据处理引入的不确定度Ud。
2 结果与讨论
2.1 不确定度分量的量化和评定
2.1.1标准曲线拟合引入的不确定度
按照“1.5.1标准曲线制备”的描述,对质量浓度分别为0、0.01、0.02、0.05、0.1、0.2和0.5 ng/mL共7个黄曲霉毒素B1标准工作溶液,各做2次平行测定,测定结果见表1。
以标准工作溶液各浓度对数值(lgXi)为横坐标,以标准工作溶液各浓度(T/C)/(T0/C0)平均值(Yi)为纵坐标,绘制标准曲线(限于篇幅,文中未列出)。根据表1,拟合得标准曲线回归方程为:Yi=-0.525lgXi-0.111 4,r=0.993 6。
标准曲线的标准偏差SR和计算见式(2)。
(2)
式中:lgXi、Yi分别为表1中第3列和第7列的各项数据;n为标准工作溶液的测定总次数,n=7×2(7个标准质量浓度,每个浓度测2次)。
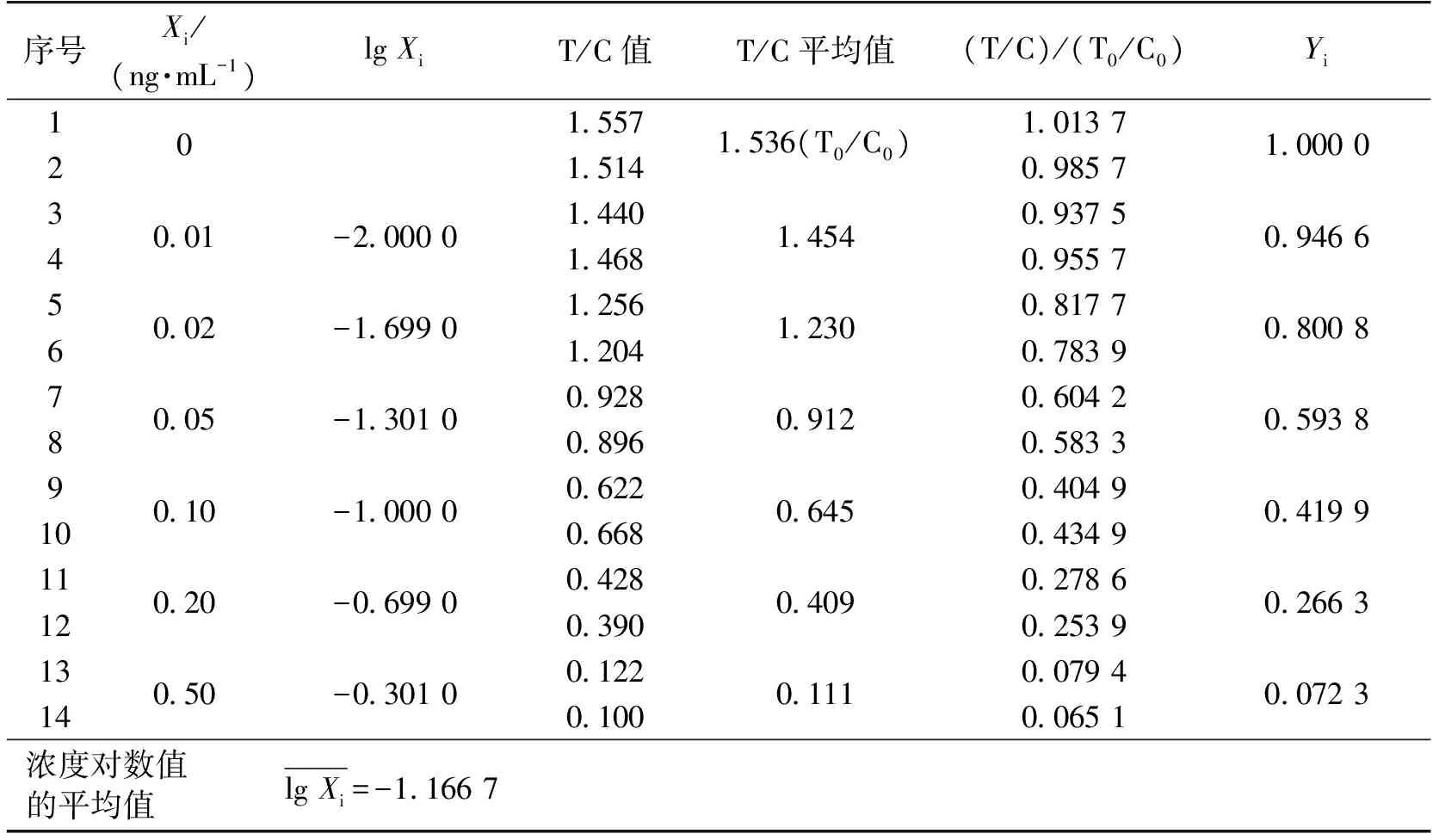
表1 系列标准工作溶液的T/C值和Yi值(n=14)
标准曲线拟合引入的关于浓度对数值(lgX样)的标准不确定度U(lgX)的计算方法:称取同一粉碎后的样品10份,然后按照“1.3 提取方法”制备成10份待测试样液,采用“1.4测定步骤”进行测定,每份样平行测定2次,测定结果见表2。

表2 试样液测定结果(p=20)
标准曲线拟合引入的关于浓度值的相对标准不确定度Ux相对的计算方法如下。
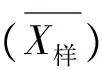
(3)
式中:p为试样液的测定总次数,p=10×2(10份待测试样液,每份样测2次);n为标准工作溶液的测定总次数,n=7×2(7个标准质量浓度,每个浓度测2次)。
鉴于这两点原因,本文中,笔者参照微生物计数测量的不确定度评估文献[21-22],通过计算真实浓度值(X真)的取值区间而求出关于浓度值的标准不确定度Ux,再计算出相对标准不确定度。
试样的真实浓度对数值范围lgX真=lgX样±0.008 110=lg0.075 23±0.008 110=-1.123 61±0.008 110
求反对数计算出试样的真实浓度值区间X真=10(-1.123 61±0.008 110)=0.073 838~0.076 648 (ng/mL)
Ux=±(0.076 648-0.073 838)/2=±0.001 405 (ng/mL)
则标准曲线拟合引入的相对标准不确定度Ux相对的计算公式为
(4)
2.1.2回收率校正因子的不确定度
称取同一粉碎后的样品3份,按5、10和20 μg/kg 3个不同浓度水平加入黄曲霉毒素B1标准品,然后立即按照“1.3 提取方法”制备成3份待测试样液,采用“1.4测定步骤”进行测定,每份样平行测定3次,根据测定结果计算回收率,见表3。
根据表3的结果,按照贝塞尔公式计算样本回收率的标准偏差,见式(5)。
%
(5)
式中:Xi为表3中第2列的各项数据;n为试样液的测定总次数,n=3×3(3份试样液,每份测3次)。
回收率校正因子的标准不确定度Ur的计算公式为
%
(6)
则回收率校正因子的相对标准不确定度Ur相对的计算公式为

(7)
2.1.3重复性检测引入的不确定度
称取同一粉碎后的样品10份,然后按照“1.3 提取方法”制备成10份待测试样液,采用“1.4测定步骤”进行测定,每份样平行测定2次,测定结果见表4。
根据表4的结果,按照贝塞尔公式计算样本重复性检测的标准偏差,见式(8)。
(8)

重复性检测引入的标准不确定度Uc,计算见式(9)。
(9)
则重复性检测引入的相对标准不确定度Uc相对,计算见式(10)。
(10)
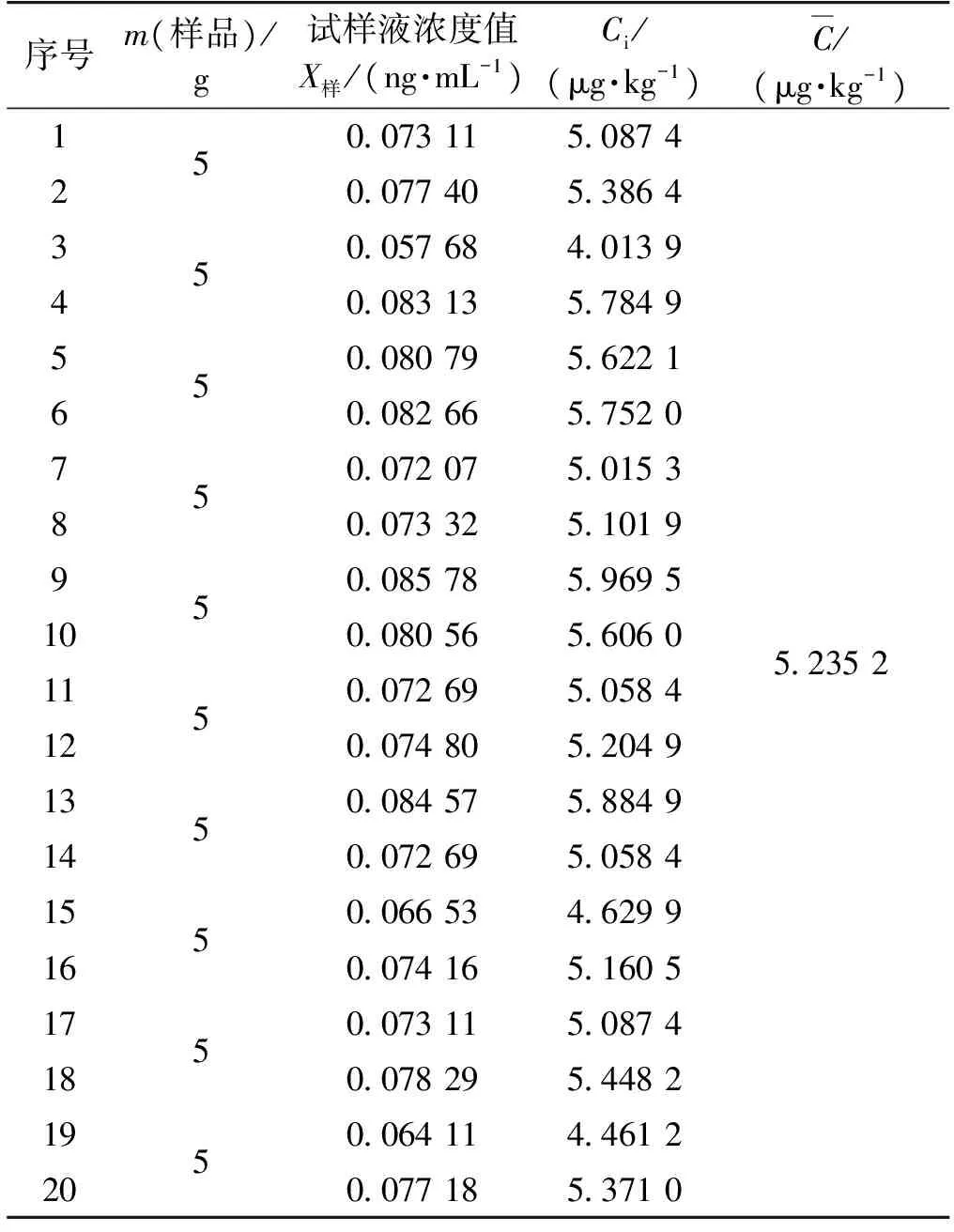
表4 样品重复测定结果(n=20)
2.1.4样品称量引入的不确定度

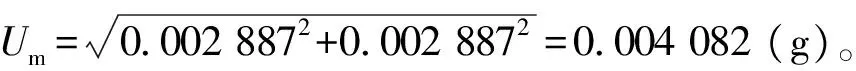
为了计算方便,设样品实际称质量为5.00 g,则样品称量引入的相对标准不确定度
Um相对=Um/5.00=0.004 082/5.00=0.000 816 4
2.1.5样品提取引入的不确定度
1)甲醇纯度的相对标准不确定度计算
配制70%甲醇溶液引入的相对标准不确定度计算方法如下。

2)量取70%甲醇溶液引入的相对标准不确定度计算


量取70%甲醇溶液引入的相对标准不确定度为
3)滤液稀释引入的相对标准不确定度计算

则样品稀释引入的相对标准不确定度为
将以上四项合成,则样品提取引入的相对标准不确定度为
2.1.6TRFIA实验操作过程引入的不确定度
1)微量移液器加样引入的相对标准不确定度计算

Up1相对=0.692 8/100=0.006 928
2)反应时间的相对标准不确定度计算

Up2相对=2.886 8/(10×60)=0.004 811
将以上两项合成,则TRFIA实验操作过程引入的相对标准不确定度为
2.1.7时间分辨荧光分析仪读数引入的不确定度
根据仪器检定证书提供,SW-2型时间分辨荧光分析仪在0.00~1.00比值(T/C除以T0/C0)范围内的荧光强度重复性为0.5%,则仪器读数引入的相对标准不确定度为
Ui相对=0.005
2.1.8数据处理引入的不确定度
本文中,笔者通过制备标准曲线图形来读取和计算大米样品中的黄曲霉毒素B1含量,在这个过程中必然带来数据处理上的不确定度,该不确定度可以通过线性相关系数来反映。
鉴于所测定的大米样品中黄曲霉毒素B1含量总是在一段标准曲线内(0~0.5 ng/mL)呈线性关系,则该段区间内曲线的线性相关系数就表征了该含量值的不确定度。根据实验过程中经验数据,r=0.993 6,则数据处理引入的近似相对标准不确定度为
Ud相对=0.006 4
2.2 合成不确定度
将从2.1.1~2.1.8各个不确定度分量及其评定结果,汇总列于表5中。

表5 不确定度分量及其评定结果汇总
由表5可知,本文采用TRFIA法测定大米中黄曲霉毒素B1含量,其中标准曲线拟合与重复性检测带来的相对标准不确定度分别为20.82%和23.27%,总占比为44.09%。吴彬等[23]采用ELISA法测定月饼中黄曲霉毒素B1含量,而张施敬等[24]采用ELISA法测定花生油中黄曲霉毒素B1含量,标准曲线拟合与重复性检测带来的相对标准不确定度总占比分别达到了56.09%和80.35%。不确定度均主要来源于标准曲线拟合与重复性检测,原因可能是TRFIA法与ELISA法都基于抗原与抗体的特异性免疫反应,对于免疫检测不可能100%完全重复,在不确定度分量的影响力方面表现出共同的特征。
因各不确定度分量相互独立,故将表5中的相对标准不确定度进行合成,则得到TRFIA法测定大米中黄曲霉毒素B1含量的相对标准合成不确定度为
2.3 总不确定度(扩展不确定度)
按国际惯例,取置信概率为95%,包含因子k=2,则TRFIA法测定大米中黄曲霉毒素B1含量的相对标准总不确定度为
张施敬等[24]采用ELISA法测定花生油中黄曲霉毒素B1含量以及吴彬等[23]采用ELISA法测定月饼中黄曲霉毒素B1含量,相对标准总不确定度分别为5.33%和3.62%。本文采用TRFIA法测定大米中黄曲霉毒素B1含量,相对标准总不确定度略高于前两篇文献。分析原因,除了与测定样品、测定条件、测定步骤和仪器读数不同有关外,TRFIA法与ELISA最大的区别在于,前者为样本在层析膜上流动的免疫检测,因此流速对测试的结果影响很大,有可能通过A类不确定度和B类不确定度的分量表现出来。
2.4 测量不确定度报告
TRFIA法测定大米中黄曲霉毒素B1含量的结果表示为
C=5.235 2(1±0.074 06)μg/kg,或C=(5.235 2±0.387 7)μg/kg,置信概率p=95%。
3 结论
本文中,笔者通过各种不确定度分量的分析,采用TRFIA法测定大米中的黄曲霉毒素B1含量,其不确定度主要来源于标准曲线拟合、重复性检测与样品提取,分别占比20.82%、23.27%和19.35%;次要来源是回收率校正因子、TRFIA实验操作、时间分辨荧光分析仪读数和数据处理,分别占比13.53%、9.40%、5.57%和7.13%;而样品称量导致的不确定度可以忽略不计。因此,在实际检测工作中,应首先制备一条准确且稳定的标准曲线,并适当增加平行样的测定次数;此外,提取过程中还需注意溶液配制、量取和稀释等操作的准确度,这些关键环节对提高TRFIA法的准确性和可靠性都具有非常重要的指导作用。
本文采用TRFIA法测定大米中黄曲霉毒素B1的结果为(5.235 2±0.387 7)μg/kg,即有95%的可能性在4.847 5~5.622 9 μg/kg范围内。根据国家标准GB 2761—2017中规定[7],稻谷、糙米、大米中黄曲霉毒素B1含量标准应小于10 μg/kg,被测大米可判断为合格样品。对测定结果给出了一个较准确的波动范围,尤其在检测结果接近标准规定临界值时,可以降低误判风险。
总之,TRFIA法适用于现场实时监控和大批量样品的分级筛选,在大米质量检验中具有良好的应用前景。本文所建立的不确定度评定方法可用于TRFIA法测定大米中黄曲霉毒素B1含量结果的评定。
参考文献:
[1]WILKINSON J R,KALE S P,BHATNAGAR D,et al.Expression profiling of non-aflatoxigenicAspergillusparasiticusmutants obtained by 5-azacytosine treatment of serial mycelial transfer[J].Toxins,2011,3(8):932-948.
[2]毕水莲,黄思敏.免疫法快速检测食品中黄曲霉毒素的研究进展[J].食品安全质量检测学报,2015,6(9):3530-3535.
[3]李少晖,任丹丹,谢云峰,等.食品中黄曲霉毒素检测方法研究进展[J].食品安全质量检测学报,2015,6(4):1107-1115.
[4]罗小虎,王韧,王莉,等.黄曲霉毒素检测方法研究进展[J].粮食与饲料工业,2013(10):54-58.
[5]林怡,黎乐群,彭涛.黄曲霉毒素B1代谢及致肝癌机制的研究进展[J].中国现代医药杂志,2007,9(12):131-133.
[6]陈建民,张雪辉,杨美华等.黄曲霉毒素检测方法研究进展[J].中国中药杂志,2005,30(24):1890-1894.
[7]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中真菌毒素限量 非书资料:GB 2761—2017[S].北京:中国标准出版社,2017:3.
[8]王泽洲,吴俊清,张永宁,等.时间分辨荧光免疫分析技术的研究进展[J].四川畜牧兽医,2015(7):34-37.
[9]HU X F,YAO J J,WANG F Y,et al.Eu3+labeled IgG based time resolved fluoroimmunoassay for highly sensitive detection of aflatoxin B1 in feed[J].J Sci Food Agric,2018,98(2):674-680.
[10]TANG X Q,LI P W,ZHANG Q,et al.Time-resolved fluorescence immunochromatographic assay developed using two idiotypic nanobodies for rapid,quantitative,and simultaneous detection of aflatoxin and zearalenone in maize and its products[J].Anal Chem,2017,89(21):11520-11528.
[11]MAJDINASAB M,SHEIKH-ZEINODDIN M,SOLEIMANIAN-ZAD S,et al.A reliable and sensitive time-resolved fluorescent immunochromatographic assay (TRFICA) for ochratoxin A in agro-products[J].Food Control,2015,47:126-134.
[12]张兆威,李培武,张奇,等.农产品中黄曲霉毒素的时间分辨荧光免疫层析快速检测技术研究[J].中国农业科学,2014,47(18):3668-3674.
[13]李静,李培武,张奇,等.时间分辨荧光免疫层析试纸条在油料饼粕黄曲霉毒素B1检测中的应用[J].中国油料作物学报,2014,36(2):256-262.
[14]中华人民共和国农业部.农业行业标准 饲料中黄曲霉毒素B1的测定 时间分辨荧光免疫层析法 非书资料:NY/T 2548—2014[S].北京:中国标准出版社,2014:3.
[15]王海华.酶联免疫吸附法测定花生油中黄曲霉毒素B1不确定度的评定[J].食品安全质量检测学报,2015,6(5):1889-1894.
[16]杨富春,陈丹萍,黎敏华.酶联免疫吸附法测定食用油中黄曲霉毒素B1的不确定度评估[J].轻工科技,2017(6):26-27.
[17]朱云,蒋澄刚,徐琳娜.高效液相色谱法测定稻谷中黄曲霉毒素B1的不确定度评定[J].粮食科技与经济,2016,41(6):43-44.
[18]白福军,窦鑫鑫,胡连荣,等.高效液相色谱法测定黄曲霉毒素B1的不确定度评定[J].粮食科技与经济,2013,38(5):27-28.
[19]中国合格评定国家认可委员会.化学分析中不确定度的评估指南 非书资料:CNAS-GL06[S/OL].[2018-01-06].http://www.cnas.org.cn/images/rkgf/sysrk/rkzn/2015/06/04/C6EE50C69BFIF94F68BAC0261459.pdf.
[20]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.分析实验室用水规格和试验方法 非书资料:GB/T 6682—2008[S].北京:中国标准出版社,2008:5.
[21]郑萍等.化妆品菌落总数指标测量不确定度的评定[J].中国卫生检验杂志,2015,25(22):3866-3877.
[22]赵玲,王邱,王冰,等.饮料中霉菌和酵母计数检验结果的不确定度评估[J].食品安全质量检测学报,2016,7(12):4749-4752.
[23]吴彬,范安妮,张施敬,等.ELISA法测定月饼中黄曲霉毒素B1含量的不确定度分析[J].广东化工,2016,43(12):250-251.
[24]张施敬,佘之蕴,李姣,等.ELISA法测定花生油中黄曲霉毒素B1含量的不确定度分析[J].广东化工,2014,41(11):224-225.
