多枝状胶体金免疫层析试纸条定量检测猪尿中沙丁胺醇
2018-04-11吴雨豪刘文娟武燕华周耀锋熊勇华
吴雨豪,刘文娟,武燕华,周耀锋,熊勇华
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047; 2.江西中德生物工程有限公司,江西 南昌 330029)
沙丁胺醇(salbutamol,SAL)是一种人工合成的肾上β受体激动剂,可加速动物生长、改善脂肪型动物肉与脂肪的比例[1-3],因此常被用作盐酸克伦特罗的替代品添加于动物饲料中[4-6]。沙丁胺醇在动物体内的残留具有与盐酸克伦特罗相同的危害性[7-9]。人食用含有沙丁胺醇的动物组织后会出现肌肉颤动、肌痛、头痛甚至恶心及呕吐等中毒症状[10-13]。目前,世界上许多国家禁止使用沙丁胺醇作为饲料添加剂,并且建立了严格的饲料和家畜尿、血和肝中沙丁胺醇监控方法[14-15]。
沙丁胺醇常用的检测方法包括仪器确证法以及免疫学筛查法两大类[16],仪器法因需借助昂贵的仪器设备以及熟练的操作人员,因此在基层单位的使用受到极大的限制[17],而以胶体金为标记探针的免疫层析试纸条方法因具有检测速度快、操作简单、价格便宜及适合现场检测等优势,在基层单位得到了广泛推广和应用[18]。但是现有的胶体金免疫层析试纸条检测沙丁胺醇的灵敏度通常介于3~5 ng/mL,且无法实现定量检测,因此无法满足国家限量标准的要求[19]。提高标记探针的检测灵敏度是提高免疫层析方法检测灵敏度的一种常用手段,现有胶体金免疫层析试纸条通常采用20~40 nm球状胶体金为显色探针[20]。多枝状的胶体金(金纳米花)由于表面等离子体共振效应,在相同的粒径下具有比球形胶体金更高的摩尔消光系数[21];同时,本实验室成员前期研究发现大粒径胶体金可有效地提高竞争免疫层析方法的检测灵敏度[22]。
因此,本实验中,笔者采用种子生长法合成了粒径为65 nm的多枝状胶体金(金纳米花,AuNFs),并以此为新型探针来建立检测猪尿样中沙丁胺醇的免疫层析试纸条新方法,以期达到快速、定量检测沙丁胺醇的目的。
1 材料与方法
1.1 仪器与试剂
XYZ3000型点膜仪、自动切条仪,金标生物科技公司;电热恒温鼓风干燥箱、紫外可见光分光光度计,上海福玛实验设备有限公司;JEOL JEM 2100型高分辨率透射电镜,日本电子株式会社。
硝酸纤维素膜(NC膜)、样品垫、吸水纸及PVC底板,美国Millipore公司;金标探针复溶液、SAL标准品、鼠抗SAL单克隆抗体、BSA-SAL检测抗原、羊抗鼠二抗、沙丁胺醇ELISA试剂盒,中德无锡伯尔生物技术有限公司;牛血清白蛋白、PEG20000、柠檬酸三钠、对苯二酚、氯金酸,Sigma公司。
1.2 胶体金种子溶液的制备
金种子的合成参照文献[23]报道的方法实施。将100 mL氯金酸溶液(0.1 mg/mL)加热至沸腾,在快速搅拌的条件下迅速加入2.7 mL柠檬酸三钠溶液(10 mg/mL),继续加热搅拌10 min后,室温下冷却即可获得酒红色的金种子溶液。
1.3 AuNFs的合成
AuNFs采用对苯二酚还原法合成[24],具体步骤如下:将100 mL超纯水加热至50 ℃,然后依次加入2.67 mL金种子溶液,1.2 mL氯金酸溶液(10 mg/mL)以及2.64 mL柠檬酸三钠溶液(10 mg/mL),温度维持在50 ℃,然后迅速加入24 mL对苯二酚缓冲液(30 mmol/L),溶液搅拌冷却至室温。4 000g离心AuNFs溶液15 min,弃上清,沉淀重悬于100 mL柠檬酸三钠(0.2 mg/mL)溶液,并置于4 ℃保存备用。
1.4 AuNFs探针(AuNF-Abs)的制备
取5 mL AuNFs溶液于洁净小烧杯中,置于磁力搅拌器缓慢匀速搅拌,0.1 mol/L K2CO3调节溶液pH至6.5,加入鼠抗SAL单克隆抗体,室温搅拌反应60 min后加入500 μL PEG20000溶液(10 mg/mL)反应30 min,然后加入500 μL BSA溶液(100 mg/mL)继续反应30 min。标记了抗体的AuNFs探针,5 000g离心15 min,沉淀用1 mL复溶液重悬,4 ℃保存待用。
1.5 制备AuNFs试纸条及试纸条免疫动力学分析
将BSA-SAL检测抗原(0.8 mg/mL)和羊抗鼠二抗(1.5 mg/mL)分别喷涂于NC膜上为试纸条检测线(T线)与质控线(C线),并置于37 ℃恒温干燥12 h。将预处理好的NC膜、样品垫以及吸水纸依次整齐粘贴在PVC底板上,切成4 mm宽的试纸条,装入自封袋,并放置于干燥箱中保存待用。将含SAL质量浓度分别为0、0.125、0.25以及0.5 ng/mL 的猪尿样品98 μL与2 μL AuNF-Abs孵育5 min,然后分别加至试纸条加样孔,胶体金读卡仪每隔30 s读取试纸条T/C比值(T线与C线荧光强度比值),连续监控25 min,每个浓度重复3 次试验。以反应时间为横坐标,T/C比值为纵坐标绘制试纸条免疫动力学曲线,确定试纸条定量检测的最佳时间。
1.6 定量检测SAL的标准曲线
将SAL标准品分别添加至经液相色谱-质谱(LC-MS)方法确定为SAL阴性的猪尿样品中,配制SAL质量浓度为0~3 ng/mL的SAL标准溶液。取以上SAL标准溶液98 μL与2 μL AuNFs探针混合孵育5 min,加入试纸条点样孔,室温反应12 min。胶体金试纸条读取仪读取试纸条T/C比值,每个标准溶液重复检测3次。当SAL浓度为0时,试纸条T/C比值定义为B0,以SAL浓度对数为横坐标,(B/B0)×100为纵坐标,绘制检测猪尿中SAL含量的定量标准曲线。
1.7 AuNFs免疫层析试纸条性能评价
AuNFs免疫层析试纸条检测SAL的特异性评价方法如下:将加标克伦特罗、莱克多巴胺、氯丙那林、班布特罗、妥布特罗、溴布特罗、喷布特罗、特布他林以及马布特罗的猪尿样品(1 ng/mL),SAL阴性以及阳性(0.5 ng/mL)猪尿样品加至试纸条加样孔,读取仪读取试纸条T/C比值以评价AuNFs免疫层析试纸条与以上9种SAL结构类似物的交叉反应率。
AuNFs试纸条检测猪尿中SAL的准确性以及精密度通过批内以及批间加标回收实验进行评价,具体方案如下:取SAL阴性猪尿样品,分别添加SAL至终质量浓度为0.05、0.15以及0.5 ng/mL,每个样品重复检测5次,计算SAL加标回收率及相对标准偏差(RSD),以评价试纸条的批内稳定性;随后每隔5 d连续检测3次,计算加标样品的回收率与相对标准偏差以评价试纸条的批间稳定性。
2 结果与讨论
2.1 AuNFs的表征
采用金种子生长法合成获得了蓝色的AuNFs溶液。考察AuNFs形态以及AuNF-Abs紫外吸收图谱,结果见图1~2。由图1~2可知:金纳米颗粒表面形貌呈现明显的多枝状分布,但颗粒的粒径分布均匀,平均粒径为65 nm。动态光散射结果显示AuNFs平均水化粒径为68 nm。紫外可见光光谱分析表明AuNFs溶液等离子共振的最大吸收峰为612 nm,而AuNF-Abs等离子共振吸收峰红移至620 nm(图1),表明抗体成功地标记至AuNFs表面。
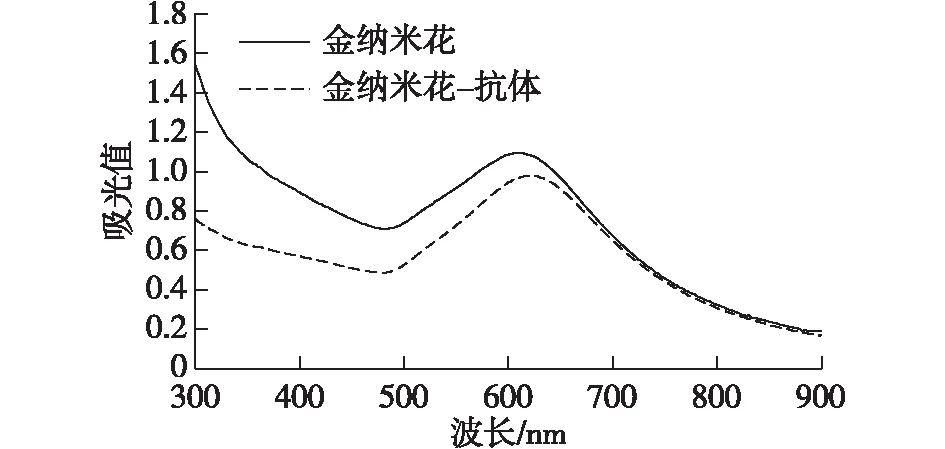
图1 AuNFs以及AuNF-Abs紫外吸收图谱Fig.1 UV-vis spectra of AuNFs and AuNF-Abs
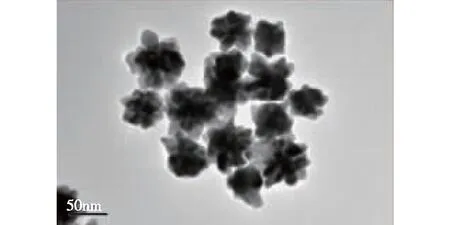
图2 AuNFs透射电镜Fig.2 TEM image of AuNFs
2.2 AuNFs免疫层析试纸条定量检测SAL的原理
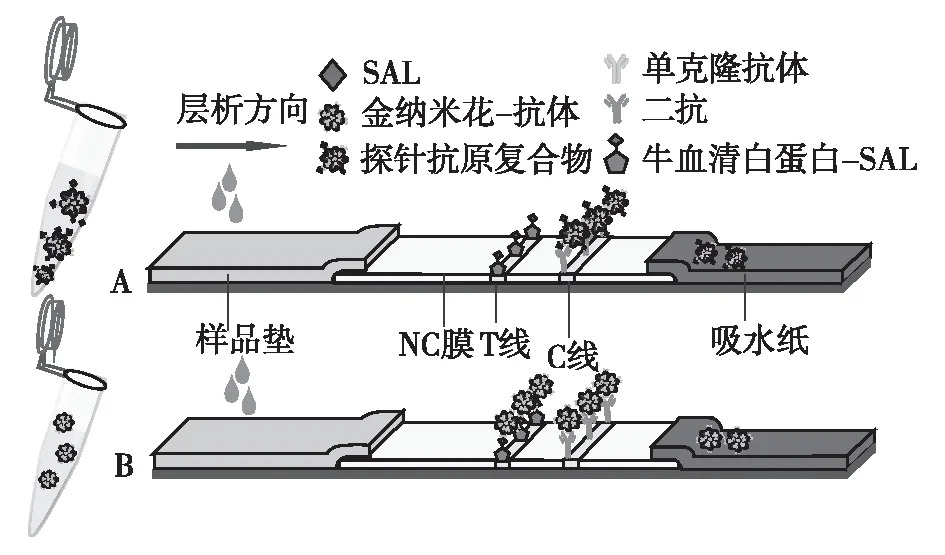
A为阳性,B为阴性图3 AuNFs免疫层析试纸条定量检测SAL的原理Fig.3 Schematic diagram of AuNFs-based strip for SAL detection
图3为AuNFs试纸条定量检测SAL的原理图。由图3可知:当样品中不含SAL时,AuNFs-Abs泳动至NC膜T线区域,AuNFs表面结合抗体与T线抗原结合,未被结合的AuNFs探针进一步被C线的二抗捕获,试纸条T、C线分别显示蓝色条带;当样品中含有SAL时,标记在AuNFs表面的抗SAL单克隆抗体首先与样品溶液中SAL特异性结合形成免疫复合物,从而抑制了AuNFs探针与T线抗原结合,T线颜色变弱,未被T线捕获的AuNFs-Abs被C线区域二抗捕获,C线颜色增强,此时试纸条T/C比值与溶液SAL浓度对数呈反比。若试纸条C线不显色,表明试纸条失效。
2.3 AuNFs最佳标记pH的优化
胶体金溶液的pH极大地影响着抗体标记效率以及抗体活性。为了获得最佳标记效率以及金标探针最佳活性,用0.1 mol/L的K2CO3分别将AuNFs溶液pH调节至6.0、6.5、7.0、7.5以及8.0,然后加入抗体制备AuNF-Abs探针。将获得的AuNF-Abs与阴性猪尿样品混合,试纸条检测AuNF-Abs。通过读取仪记录试纸条T、C线吸光值以及T/C比值评价抗体偶联过程中溶液pH对抗体偶联效率的影响,结果见图4。由图4可知:当溶液pH为6.5时,试纸条T线显色最强,T/C比值亦最高,因此,抗体标记AuNFs的最佳pH为6.5。
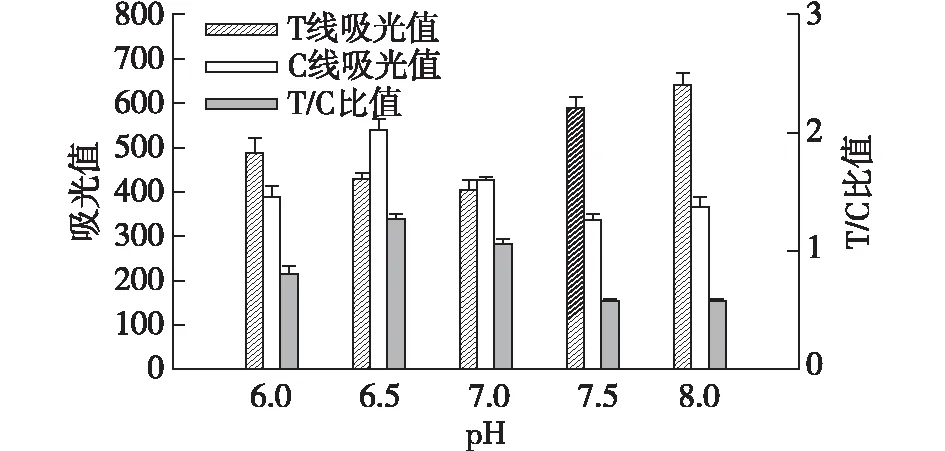
图4 溶液pH对抗体标记效率的影响Fig.4 Effects of solution pH on labeling efficiency of antibodies on the surface of AuNFs
2.4 优化AuNFs试纸条制备工艺
在试纸条制备过程中,抗体标记数量、AuNF-Abs用量以及T线喷涂BSA-SAL浓度是影响试纸条检测灵敏度的主要因素。为了获得检测SAL最高灵敏度,采用“三因素三水平”正交试验对以上三因素进行了优化,其中试纸条C线二抗喷涂质量浓度为1.5 mg/mL,结果见表1。由表1可知:当T线喷涂BSA-SAL偶联物质量浓度为0.6 mg/mL、抗体标记质量浓度为2 μg/mL、AuNF-Abs用量0.75 μL时,试纸条检测SAL(0.25 ng/mL)加标尿样,竞争抑制率最高(76.02%),但该条件下试纸条检测SAL阴性尿样T线显色偏弱,吸光值仅为248.6;而当T线喷涂BSA-SAL偶联物质量浓度为0.8 mg/mL、抗体标记质量浓度为1.25 μg/mL、AuNF-Abs用量2 μL时(第8组),试纸条T、C线显示明显的蓝色条带,吸光值分别达到482.7及418.4,竞争抑制率亦达到73.13%,因此选择该条件为最佳实验条件。
2.5 确定AuNFs试纸条定量检测SAL的判读时间
免疫层析试纸条T、C线的颜色累积是抗原、抗体免疫动力学反应的结果。试纸条T线显色深浅不仅与待测物浓度有关,而且与检测环境温度、试纸条的加工差异以及样品基质效应等均有关,而T/C比值法可有效地消除以上内在因素的干扰,减少试纸条定量检测误差率。为了获得试纸条定量分析最佳时间,本实验记录了不同SAL检测浓度下,试纸条T/C比值与免疫反应时间的动力学变化过程,以T/C比值达到稳定的时间确认为试纸条最佳判定时间,结果见图5。由图5可知:当样品中SAL浓度为0时,试纸条T/C比值在加样后12 min趋于稳定;而当样品中含有SAL时,试纸条T/C比值在5 min之内即可趋于稳定,因此AuNFs试纸条检测SAL的最佳定量时间确定为加样后12 min。
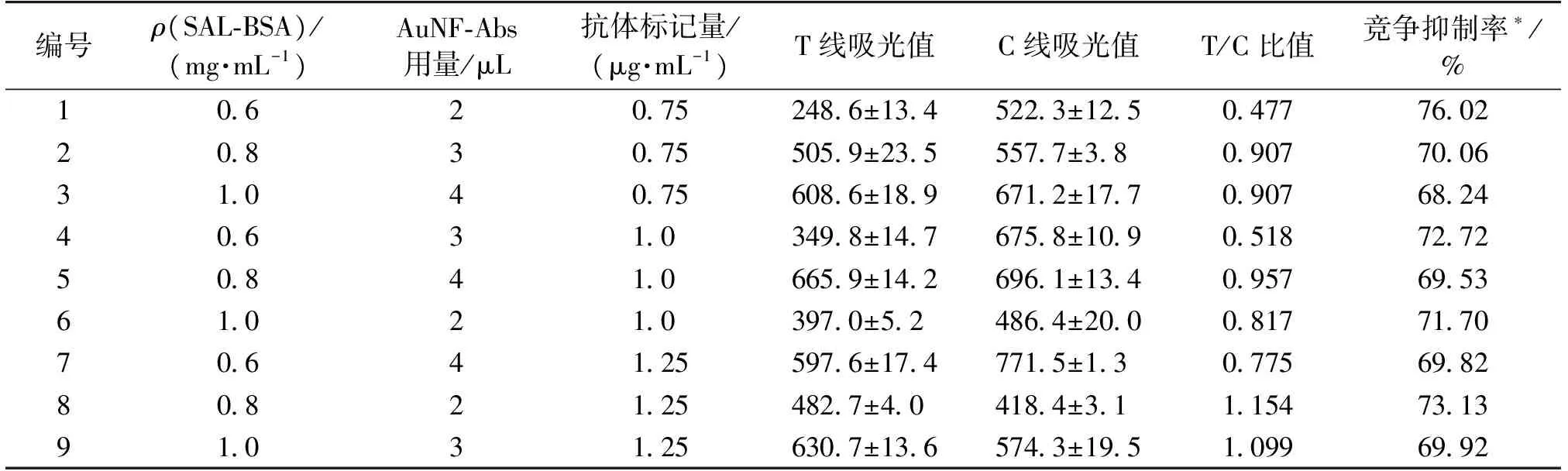
表1 正交试验优化T线BSA-SAL全抗原浓度、AuNFs探针用量及AuNFs抗体标记浓度
注:*竞争抑制率是基于0.25 ng/mL阳性添加实验所得。
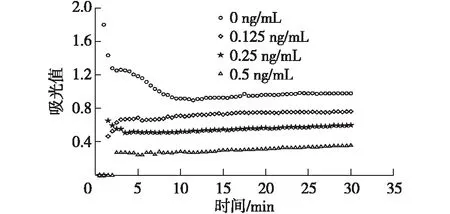
图5 AuNFs试纸条检测SAL的T/C免疫动力学曲线Fig.5 Kinetic reaction curves of T/C ratio against immunoreaction time based on AuNF-based strip for SAL detection
2.6 定量检测SAL的标准曲线
图6为AuNFs免疫层析试纸条检测猪尿中SAL的标准曲线。由图6可看出,随着猪尿中SAL浓度的增高,试纸条B/B0值逐渐降低。当SAL质量浓度在0.05~1.0 ng/mL时,试纸条B/B0值与SAL浓度对数具有较好的线性关系(R2=0.995),其线性回归方程为y=-21.4lnx+10.407,半数抑制率浓度(IC50)达到0.143 ng/mL(n=5)。
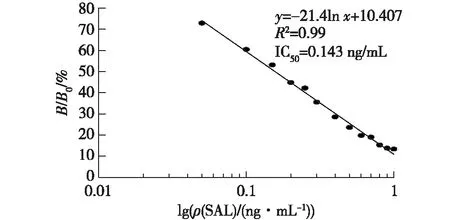
图6 AuNFs试纸条定量检测SAL标准曲线Fig.6 Calibration curve of AuNF-based strip for SAL quantitative detection
2.7 AuNFs试纸条检测性能的评价
检测9种与沙丁胺醇结构类似的β肾上腺素兴奋剂加标尿样(包括克伦特罗、莱克多巴胺、氯丙那林、班布特罗、妥布特罗、溴布特罗、喷布特罗、特布他林以及马布特罗),评价AuNFs免疫层析试纸条的特异性,结果见图7。从图7结果可知:笔者制备的AuNFs免疫层析试纸条与以上9种β肾上腺素无明显交叉反应,表明该试纸条具有良好的特异性。在不含SAL的猪尿样品中添加高(0.5 ng/mL)、中(0.15 ng/mL)、低(0.05 ng/mL)质量浓度的SAL,AuNFs试纸条检测,以试纸条批间、批内的加标回收率及相对标准偏差(RSD)评价试纸条定量检测SAL的准确性与精密度,结果见表2。由表2可知,试纸条检测不同浓度SAL的批内回收率为101.53%~110.68%,批间回收率为98.86%~110.5%,RSD均小于10%,表明AuNFs免疫层析试纸条定量检测猪尿中SAL具有良好的回收率及准确度。为了进一步评价AuNFs试纸条的实用性,用AuNFs试纸条检测了20份经LC/MS/MS确证为SAL阴性的猪尿样品,AuNFs试纸条检测实际猪尿样品的最低检测灵敏度定义为0.027 ng/mL(检测结果的平均值加上3倍的标准偏差);同时将该试纸条与商业化的ELISA试剂盒同时检测50份猪尿样品中的SAL含量,两种方法检测结果进行相关性评估,结果见图8。由图8可知,AuNFs试纸条与商业化的ELISA试剂盒检测结果相关性方程为y=0.894 3x+0.081 2(R2=0.954 9),以上结果表明两种方法具有较好的一致性。
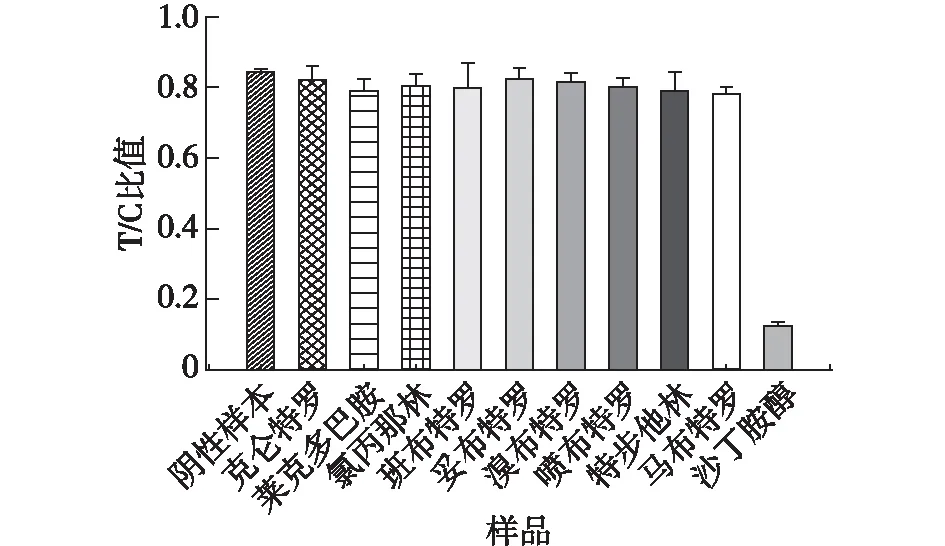
图7 AuNF试纸条的特异性评价Fig.7 Specificity experiment of AuNF-based strip
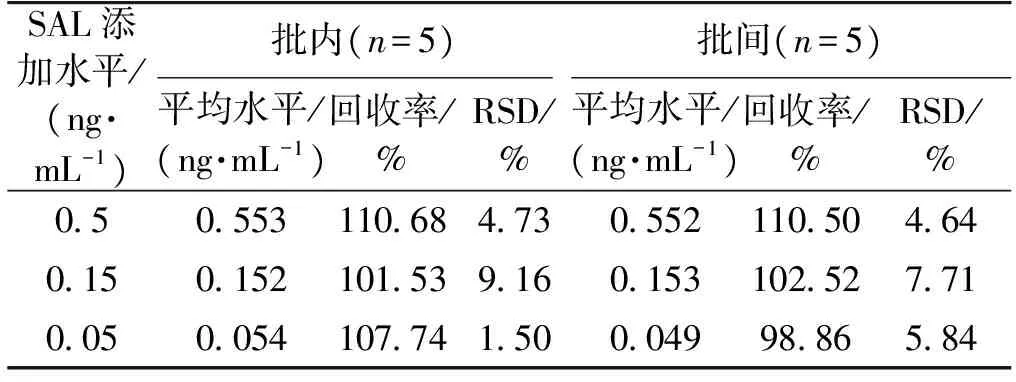
SAL添加水平/(ng·mL-1)批内(n=5)批间(n=5)平均水平/(ng·mL-1)回收率/%RSD/%平均水平/(ng·mL-1)回收率/%RSD/%0505531106847305521105046401501521015391601531025277100500541077415000499886584
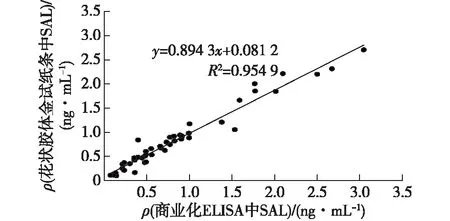
图8 AuNFs试纸条及ELISA试剂盒检测猪尿中 SAL的方法学比较Fig.8 Methodology comparison of AuNFs-based strip (y-axis) and ELISA(x-axis) for the detection of 50 SAL spiked swine urine samples
3 结论
本研究以65 nmAuNFs为新型探针,成功地建立了免疫层析法快速定量检测猪尿中SAL的新方法,该方法检测SAL的IC50值达到0.143 ng/mL,检测猪尿样品的最低检测限为0.027 ng/mL。相比于实验室常用的ELISA检测方法,该方法仅需一台便携式读取仪,17 min内即可实现猪尿中SAL的高灵敏定量检测,且不需复杂的操作以及专业的操作人员,适于 SAL的现场快速筛查检测。
参考文献:
[1]栗艳.“瘦肉精”的危害及防治[J].中国畜牧兽医文摘,2011,27(4):175.
[2]CHAI C,LIU G,LI F,et al.Towards the development of a portable sensor based on a molecularly imprinted membrane for the rapid determination of salbutamol in pig urine[J].Anal Chim Acta,2010,675(2):185-190.
[3]王凤美,何京橙,张鸿伟,等.超高效液相色谱-串联质谱法检测动物血浆中克伦特罗、莱克多巴胺、沙丁胺醇[J].食品安全质量检测学报,2015,6(12):5024-5028.
[4]陈新谦,金有豫,汤光.新编药物学[M].16版.北京:人民卫生出版社,2007:436.
[5]ADAM A,ONG H,SONDAG D,et al.Radioimmunoassay for albuterol using a monoclonal antibody:application for direct quantification in horse urine[J].J Immunoassay,1990,11(3):329-345.
[6]CARTER W J,LYNCH M E.Comparison of the effects of salbutamol and clenbuterol on skeletal muscle mass and carcass composition in senescent rats[J].Metabolism,1994,43(9):1119-1125.
[7]刘宣兵,庞玉芳,侯玉泽,等.沙丁胺醇的毒副作用及其残留检测[J].上海畜牧兽医通讯,2008(4):83-85.
[9]吴时清,陈茹,林志雄,等.应用竞争酶联免疫吸附技术检测港澳活猪中克伦特罗残留[J].检验检疫科学,1999,9(4):17-18.
[10]邱阳生,杨根海,何方洋.β-兴奋剂沙丁胺醇及其检测技术研究进展[J].动物医学进展,2002,23(4):50-52.
[11]毕玉香.瘦肉精的残留危害及监控对策[J].畜牧兽医科技信息,2009,4(6):136.
[12]戴华,袁智能,黄志强,等.饲料中盐酸克伦特罗、沙丁胺醇高效液相色谱测定[J].分析测试学报,2003,22(3):57-60.
[13]管健,王立媛,吴平谷,等.同位素作内标气质联机测定动物源食品中4种β2-兴奋剂的含量[J].中国卫生检验杂志,2007,17(12):2194-2196.
[14]韩京朋,吴小平,邱检萍,等.动物尿液中沙丁胺醇残留检测试纸条的研制[J].黑龙江畜牧兽医,2014(4):174-176.
[15]MAZHARS H R A,CHRYSTYN H.New HPLC assay for urinary salbutamol concentrations in samples collected post-inhalation[J].J Pharm Biomed Anal,2009,50(2):175-182.
[16]郭伟,杨丽君,时文春,等.高效液相色谱-串联质谱测定猪肉中3种β-受体激动剂残留量[J].分析试验室,2010,29(4):91-98.
[17]YEE K C,LOWE E,JACOBSON G.Determination of albuterol enantiomers in animal tissue matrices by LC-MS/MS:application in therapeutic myoanabolic studies[J].Chromatographia,2011,74(3/4):355-358.
[18]吴巧丽,叶春生.胶体金免疫层析技术快速检测沙丁胺醇残留[J].现代食品科技,2012(11):1595-1599.
[19]刘冰,王玲玲,童贝,等.沙丁胺醇免疫层析试纸条的应用研究[J].食品研究与开发,2016,37(18):124-128.
[20]CUI X,XING Q,XIONG Y,et al.Establishing of a method combined immunomagnetic separation with colloidal gold lateral flow assay and its application in rapid detection ofEscherichiacoliO157:H7[J].Chin J Anal Chem,2013,41(12):1812-1816.
[21]JI Y,REN M,LI Y,et al.Detection of aflatoxin B1with immunochromatographic test strips:enhanced signal sensitivity using gold nanoflowers[J].Talanta,2015,142:206-212.
[22]LI J,DUAN H,XU P,et al.Effect of different-sized spherical gold nanoparticles grown layer by layer on the sensitivity of an immunochromatographic assay[J].RSC Adv,2016,6(31):26178-26185.
[23]LI C,LUO W,XU H,et al.Development of an immunochromatographic assay for rapid and quantitative detection of clenbuterol in swine urine[J].Food Control,2013,34(2):725-732.
[24]XU P,LI J,HUANG X,et al.Effect of the tip length of multi-branched AuNFs on the detection performance of immunochromatographic assays[J].Anal Methods,2016,8(16):3316-3324.
