拟黑多刺蚁5-HT2A受体基因cDNA的克隆及表达
2018-04-10奚耕思
杨 森,谭 娥,奚耕思
(1陕西师范大学 生命科学学院, 陕西 西安 710119;2咸阳师范学院 体育学院,陕西 咸阳712000)
5-羟色胺(5-hydroxytryptamine,5-HT)是一种单氨类的神经递质,又名血清素,能调节脊椎动物和无脊椎动物的多种生理功能及行为[1]。在动物及人的中枢神经系统中,5-HT参与调节睡眠、体温、痛觉、情绪和学习记忆等过程。当人体内的5-HT功能失调时,会引发多种精神疾病,如焦虑症、抑郁症、自闭症等[2-3]。5-HT对昆虫的取食、昼夜节律、好斗、记忆、群居和散居等行为也具有调节作用[4]。
5-HT通过受体实现对动物和人类生理功能的调节作用。目前已从脊椎动物体内克隆得到14个5-HT受体亚型,分为7类,即5-HT1R~5-HT7R,除5-HT3R属于配体门控离子通道受体外,其他的均属于G蛋白偶联受体(G protein-coupled receptors,GPCR)。目前,从昆虫体内克隆得到的5-HT受体基因主要属于5-HT1、5-HT2、5-HT7受体基因。从黑腹果蝇体内克隆得到的5-HT1A、5-HT1B、5-HT2A、5-HT2B、5-HT7受体基因分别与哺乳类的5-HT1A、5-HT1B、5-HT2A、5-HT2B、5-HT7受体基因同源[5]。哺乳动物的5-HT2A受体属于5-HT2受体家族成员之一,这个家族成员中除5-HT2A受体亚型外,还包括5-HT2B和 5-HT2C受体亚型,这3个受体亚型在分子结构、药理学及信号转导路径方面很相似[6]。人体的5-HT2A受体定位于13号染色体的q14~21区,编码471个氨基酸[7],与大鼠的5-HT2A受体同源性为87%[6]。通常情况下,5-HT2A受体与Gq/11偶联,从而激活磷脂酶C,使三磷酸肌醇含量增加,而细胞质中三磷酸肌醇可以作为第二信使,调节内质网Ca2+的释放[7]。哺乳类的5-HT2A受体较多分布于中枢神经系统的前脑区,特别是皮质区、尾状核、伏核、嗅球及海马[8-10],其与平滑肌收缩、血小板聚集、激素调控、神经递质释放、性行为控制、睡眠、运动行为、精神疾病发生密切相关[7]。
第一个5-HT2A受体是从大鼠的脑部克隆得到的[11],迄今为止5-HT2A受体已经从人类[12-13]、小鼠[14]、仓鼠[15]、猪[12,16]和猕猴[12,16]体内克隆得到。5-HT2A受体已在昆虫黑腹果蝇(Drosophilamelanopgaster)、意大利蜜蜂(Apismellifera)、黄斑黑蟋蟀(Gryllusbimaculatus)体内克隆得到[4]。研究发现,5-HT2A受体主要分布在昆虫的中枢神经系统、咽下腺、唾液腺、中肠,对于调控昆虫的进攻行为、表皮形成、昼夜节律及提高胞内Ca2+浓度具有重要作用[4]。
拟黑多刺蚁(PolyrhachisvicinaRoger)属于节肢动物门昆虫纲膜翅目蚁科多刺蚁属,是一类营群居的杂食性社会昆虫,广泛分布于我国东南部。拟黑多刺蚁属于完全变态性昆虫,生命周期为卵、幼虫、蛹、成虫,其中成虫分为雌蚁、雄蚁和工蚁3个品级,各品级有明确分工,雌蚁在群体中个体最大,负责生育后代,雄蚁主要作用是与雌蚁交配,工蚁主要负责觅食、饲养幼虫、建造和清理蚁穴,在雌蚁短缺时可恢复生殖能力,替代雌蚁行使繁育后代的功能[17]。拟黑多刺蚁是一种优良的食药两用蚂蚁,是卫生部目前唯一允许使用的无毒无害蚂蚁,也是研究社会性昆虫生长发育、生理生化的优良材料。但目前关于拟黑多刺蚁5-HT2A基因的研究尚未见报道。鉴于此,本研究以拟黑多刺蚁为材料,克隆了拟黑多刺蚁5-HT2A受体基因,并以其推测出的氨基酸序列构建系统进化树;采用荧光实时定量PCR技术,对拟黑多刺蚁不同龄期幼虫和不同品级成虫的5-HT2A受体mRNA表达进行检测,探索5-HT2A受体基因对拟黑多刺蚁发育调控的影响作用,为深入了解5-HT2A受体基因在转录水平对拟黑多刺蚁生长发育调控的机制提供依据。
1 材料与方法
1.1 材 料
1.1.1供试动物拟黑多刺蚁购于浙江瑞丰蚂蚁工坊,3窝蚂蚁,每窝300~500只,雌蚁体长9~9.8 mm,雄蚁体长6.5~8 mm,工蚁体长6.5~7.5 mm,饲养于实验室恒温培养箱中,饲养温度为(25±2) ℃,相对湿度为60%~70%。每天饲喂蚂蚁冰糖和蜂蜜,水放于纸盘中供蚂蚁自由取食。
1.1.2主要试剂RNA提取试剂Trizol(TaKaRa)、RNA反转录试剂盒(RevertAidFirst Strand cDNA SynthesisKit,MBI)、琼脂糖凝胶DNA回收试剂盒(北京百泰克)、SYBRPremix Ex TaqKit(TaKaRa)、2×PCR Mix(TaKaRa)、6×DNA loading buffer(TaKaRa)、DNA Marker(TIANGEN)、琼脂粉(华大)、溴化乙锭(Sigma)。
1.2 方 法
1.2.1拟黑多刺蚁总RNA的提取及第一链cDNA的合成取25只工蚁头部于含有液氮的研钵中研磨,加入适量Trizol试剂提取总RNA。取2 μL RNA样品、1 μL 6×DNA loading buffer电泳检测总RNA的完整性。取2 μL RNA样品稀释25倍,在核酸蛋白分析仪上以260 nm处的吸光值确定RNA浓度,以OD260/OD280进行纯度检测,纯度较好的RNAOD260/OD280应在1.7~2.0。经完整性和纯度检测合格的RNA进行cDNA第一链的合成。cDNA第一链的合成使用MBI的RNA反转录试剂盒进行,产物可直接进行PCR反应或置于-80 ℃保存,用于后续试验。
1.2.2全长cDNA的克隆依据意大利蜜蜂(Apismellifera)、冈比亚按蚊(Anophelesgambiae)和黑腹果蝇(Drosophilamelanogaster)5-HT2A基因的保守序列设计简并引物,引物序列见表1,均由金斯瑞公司合成。利用巢式PCR克隆拟黑多刺蚁5-HT2A基因。第一轮PCR反应使用引物DF1和DR1,反应体系:cDNA 模板1 μL,上、下游引物(20 μmol/L)各1 μL,dNTP(2.5 mmol/L)2 μL,10×ExPCR 缓冲液(含Mg2+)2 μL,RNase Free ddH2O补足20 μL。反应条件:94 ℃预变性3 min;94 ℃变性45 s,56 ℃退火55 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min。第二轮PCR反应使用稀释10倍的第一轮PCR产物为模板,引物DF2和DR2,在与第一轮相同的PCR反应条件下扩增。PCR产物经1.8%琼脂糖凝胶电泳检测,再用Bioteke胶回收试剂盒纯化回收目的基因片段,连接到pMD-18T质粒载体上,转化到大肠杆菌感受态细胞中,37 ℃条件下培养过夜,并进行蓝白斑筛选,阳性克隆菌落再进行PCR鉴定后送上海生工公司测序。
根据扩增获得的中间片断序列设计特异性引物(表1),采用5′RACE和3′RACE试剂盒扩增5′RACE和3′RACE 端。5′RACE PCR进行两轮,第一轮加2 μL反转录混合物,8 μL 1×cDNA 稀释缓冲液Ⅱ,4 μL 10×LA PCR缓冲液Ⅱ(无Mg2+),3 μL MgCl2(25 mmol/L),0.25 μL LATaq(5 U/μL),外围特异性引物(10 μmol/L)(5R1)和5′RACE外围引物(10 μmol/L)(5R outer)到总体积50 μL。外围PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,20个循环;最后72 ℃延伸10 min。内围PCR以1 μL外围 PCR混合物为模板,5 μL 10×LA PCR 缓冲液 Ⅱ(无Mg2+),5 μL MgCl2(25 mmol/L),8 μL dNTP混合物(2.5 mmol/L),0.5 μL Takara LATaq(5 U/μL),内围特异性引物(10 μmol/L)(5R2)和5′RACE内围引物(10 μmol/L)(5R inner)以及26.5 μL无菌水。内围PCR反应条件:94 ℃变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,25个循环;最后72 ℃延伸10 min。3′RACE反应的试剂和条件与5′RACE相似。PCR产物用1.8%琼脂糖凝胶电泳检测并纯化回收。扩增出的片段与质粒载体连接并转化到大肠杆菌,再进行测序。
1.2.3序列分析用ProtParam (http://web.expasy.org/protparam/)预测蛋白质序列的分子量和等电点,Blast比较蛋白质序列的同源性,PROSITE(http://prosite.expasy.org/)分析氨基酸序列的功能位点,NetNGlye分析糖基化位点,TMHMM分析跨膜域,Signal P 4.1分析信号肽。
1.2.4系统进化树用Clustal X进行核酸和氨基酸序列的多重比对,MEGA 6.0比邻法生成系统进化树。进行1 000次多重比对,计算聚集重复比率。
1.2.5Pv5-HT2A实时定量表达取卵、1~4龄幼虫(L1~L4)、蛹、雌蚁、雄蚁、工蚁作为测试样本用于实时定量表达。用RNAiso试剂盒提取8~10只蚂蚁总RNA,取1 μg RNA 样品合成第一条cDNA。基因特异性引物扩增的112 bp片段用于基因表达的研究,内参基因合成250 bp片段。SYBR Green实时定量PCR反应在Biorad上进行,反应体系(25 μL):12.5 μL SYBR Premix ExTaqⅡ,1 μL PCR上游引物(10 μmol/L),1 μL PCR下游引物(10 μmol/L),1 μL DNA模板和9.5 μL无菌水;反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。每个样品重复3次,以β-actin为内参基因。反应结束后,观察荧光值变化曲线和熔解曲线,熔解曲线(65~90 ℃,每15 s升高0.5 ℃)保证只有一种PCR产物被扩增和检测。

表1 试验所用引物序列Table 1 Primers used in this study
2 结果与分析
2.1 Pv5-HT2A受体cDNA克隆及序列分析
利用简并引物扩增出长443 bp的片段,再根据该片段设计5′RACE 和3′RACE 的特异性外围和内围引物,分别扩增出1 344 bp的5′RACE端和1 517 bp的3′RACE 端,对扩增产物进行测序,将测序结果于NCBI数据库中进行BLAST分析,结果表明成功获得Pv5-HT2A受体的中间片段、5′RACE片段及3′RACE片段序列(图1)。
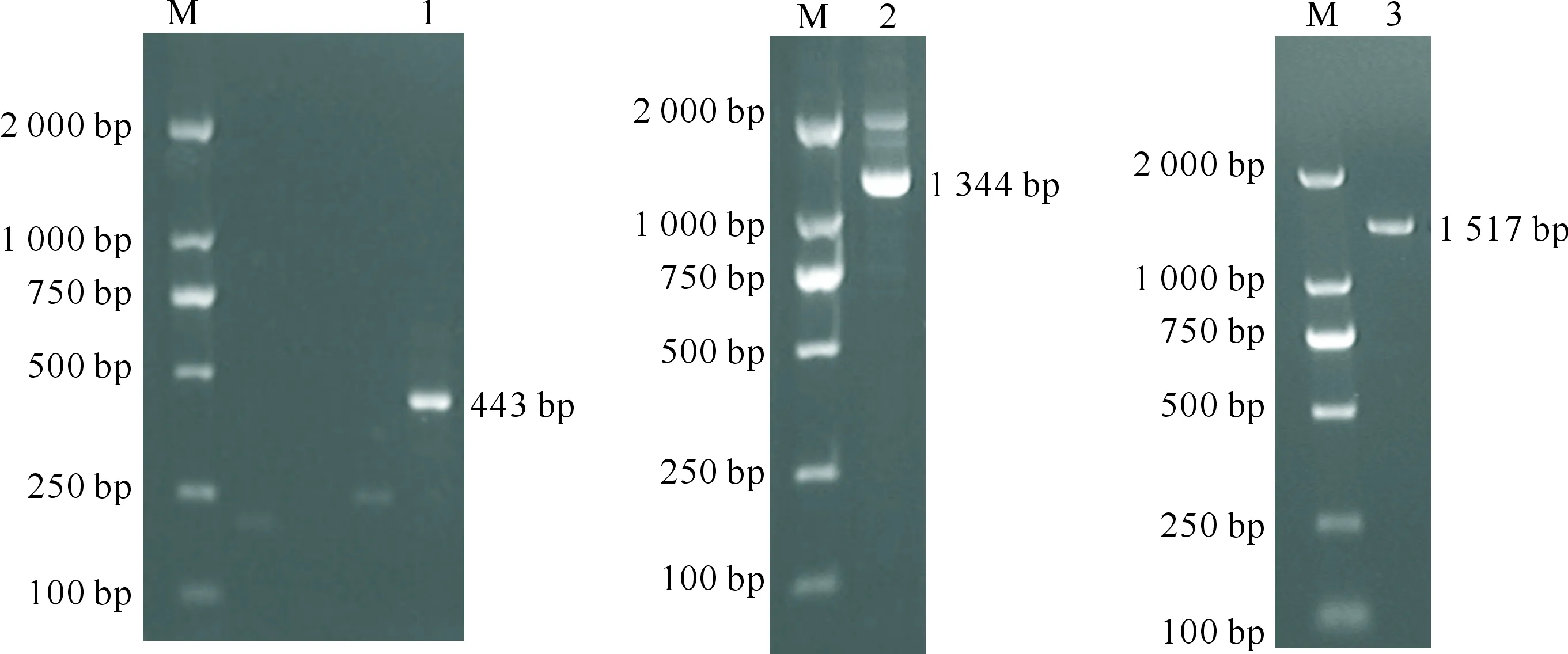
M.DL2000 DNA Marker;1.中间序列;2.5′RACE产物;3.3′RACE 产物M.DL2000 DNA Marker;1.Intermediate sequence;2.5′RACE product;3.3′RACE product图1 拟黑多刺蚁5-HT2A 基因全长cDNA序列的PCR扩增结果Fig.1 PCR amplification of full-length cDNA sequence of P.vicina
Pv5-HT2A受体cDNA (NCBI GenBank登录号:KJ666537.2)全长2 965 bp,开放阅读框(ORF)长1 926 bp,编码641个氨基酸,5′和3′非编码区(UTR)分别包含593和446个核苷酸。Pv5-HT2A氨基酸序列的分子量为69.68 ku,等电点为9.60。Pv5-HT2A氨基酸序列有8个N-糖基化位点、5个蛋白激酶A磷酸化位点、4个蛋白激酶C磷酸化位点和3个酰基化位点(图2)。

预测的Pv5-HT2A受体氨基酸序列在图中以单个密码子表示。起始密码子(ATG)和终止密码子(TAA)用黑色背景显示。星号(*)代表终止密码子, N-糖基化位点用下划线表示,蛋白激酶A磷酸化位点用下弧线表示,蛋白激酶C磷酸化位点用上弧线表示,酰基化位点用双下划线表示。跨膜结构域Ⅰ-Ⅶ用灰色背景和黑色边框显示The deduced amino acid sequence of the Pv5-HT2A receptor is shown in a single letter under the respective codon.The initiation condon (ATG) and termination codon (TAA) are highlighted in black.The asterisk represents the terminator codon,potential N-glycosylation sites are highlighted in single underline,putative protein kinase A phosphorylation sites are highlighted in downward arc underline,putative protein kianse C phosphorylation sites are highlighted in double upward arc underline,putative palmitoylation sites are highlighted indouble underline.The transmembrane domains Ⅰ-Ⅶ determined are shaded and boxed in black图2 拟黑多刺蚁5-HT2A受体的核苷酸序列和预测的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequence of full-length 5-HT2A receptor of P.vicina
2.2 Pv5-HT2A受体的系统进化树
由NCBI网站获取5-HT2A氨基酸序列,用Clustal X进行多重比对,Pv5-HT2A与其他物种5-HT2A受体蛋白的进化关系如图3所示。由图3可以看出,5-HT2A氨基酸序列分为脊椎动物和无脊椎动物两个组, 拟黑多刺蚁Pv5-HT2A受体蛋白与红收获蚁的亲缘关系最近,相似度为69%,与阿根廷蚁的亲缘关系次之,相似度为58%,与意大利蜜蜂的亲缘关系较远,相似度为48%。

图3 拟黑多刺蚁受体与其他物种5-HT2A受体蛋白的系统进化树Fig.3 Phylogenetic analysis of 5-HT2A receptors of P.vicina and other animals
2.3 Pv5-HT2A受体mRNA的表达
采用实时定量PCR检测Pv5-HT2A mRNA在拟黑多刺蚁不同发育阶段和不同品级成虫中的表达情况,结果如图4所示。由图4可知,Pv5-HT2A mRNA在拟黑多刺蚁不同发育阶段和不同品级成虫中均有表达,其中卵、3龄幼虫及蛹期的表达量较高,1,2,4龄幼虫的表达量相对较低;成虫中,雄蚁表达量最高,工蚁次之,雌蚁的表达量最低,且工蚁的表达量显著高于雌蚁。

*表示P<0.1时差异显著,**表示P<0.05时差异显著,***表示P<0.01时差异显著* means significant at P<0.1,** means significant at P<0.05,*** means significant at P<0.01图4 拟黑多刺蚁5-HT2A受体基因mRNA在拟黑多刺蚁不同发育阶段的相对表达量Fig.4 Relative expressions of 5-HT2A receptor mRNA in different developmental stages in whole body of P.vicina
3 讨 论
本研究成功克隆了拟黑多刺蚁Pv5-HT2A受体的cDNA序列,其全长为2 965 bp,开放阅读框(ORF)大小为1 926 bp,编码641个氨基酸,5′和3′非编码区(UTR) 分别包含593和446个核苷酸。通过对Pv5-HT2A氨基酸序列分析发现,它具有7个跨膜结构域,属于典型的G蛋白偶联受体类型[13]。Pv5-HT2A受体的典型特征是具有糖基化位点、磷酸化位点及酰基化位点[6],这些特征实际是氨基酸序列翻译后的修饰,以提高受体的稳定性,便于与细胞膜结合[18]。本研究发现,Pv5-HT2A氨基酸序列有8个N-糖基化位点、5个蛋白激酶A磷酸化位点、4个蛋白激酶C磷酸化位点和3个酰基化位点。
将不同动物的5-HT2A氨基酸序列与拟黑多刺蚁Pv5-HT2A受体进行比对,发现拟黑多刺蚁Pv5-HT2A与其他物种5-HT2A受体具有高度的同源性,从而进一步证实所克隆基因属于拟黑多刺蚁Pv5-HT2A受体基因,同时也证实了5-HT2A受体基因保守性的特点[13]。拟黑多刺蚁5-HT2A受体蛋白与红收获蚁的亲缘关系最近,相似度为69%。
荧光实时定量PCR检测结果表明,Pv5-HT2A受体mRNA在拟黑多刺蚁不同发育阶段和不同品级成虫中均有表达,且表达量有显著差异性。说明5-HT2A对拟黑多刺蚁的发育存在调控的阶段特异性,与Markus等[19]的研究结果相吻合。Markus等[19]发现,5-HT2A受体在意大利蜜蜂不同发育阶段的脑部均有表达,且不同阶段的表达量不均匀,这与脑部5-HT2A含量对其不同发育阶段产生的影响有关。本研究发现,Pv5-HT2A受体mRNA在拟黑多刺蚁的卵、3龄幼虫、蛹期的表达量较高;成虫中,雄蚁的表达量最高,工蚁次之。有研究表明,5-HT2A受体在黑腹果蝇的胚胎发育期有表达[20],其表达对于维持胚胎正常发育和存活率很有必要[21],黑腹果蝇Dm5-HT2A受体可调节胚胎发育中胚带延长和角质层形成[22-23],由此推测拟黑多刺蚁在胚胎期及蛹期的高表达可能与调节胚胎发育及蛹期的角质层增厚有关。5-HT可以促进蜜蜂寻找食物及提高运动能力[24], 5-HT2还与雄性果蝇的攻击行为有关[25-26],由此推测拟黑多刺蚁雄蚁中5-HT2A受体mRNA的高表达可能与其运动能力和攻击行为有关,具体有待进一步研究。
[参考文献]
[1]Schlenstedt J,Balfanz S,Baumann A,et al.Am5-HT7:molecular and pharmacological characterization of the first serotonin receptor of the honeybee (Apismellifera) [J].J Neurochem,2006,98(6):1985-1998.
[2]Weiger W A.Serotonergic modulation of behaviour: a phylogenetic overview [J].Biol Rev Camb Philos Soc,1997,72(1):61-95.
[3]Jones B J,Blackburn T P.The medical benefit of 5-HT research [J].Pharmacol Biochem Behav,2002,71(4):555-568.
[4]齐易香,吴顺凡,黄佳,等.昆虫5-羟色胺及其受体的研究进展 [J].昆虫学报,2014,57(7):844-859.
Qi Y X,Wu S F,Huang J,et al.Advances in 5-hydroxytryptamine and its receptors in insects [J].Acta Entomologica Sinica,2014,57(7):844-859.
[5]Blenau W,Thamm M.Distribution of serotonin (5-HT) and its receptors in the insect brain with focus on the mushroom bodies:lessons fromDrosophilamelanogasterandApismellifera[J].Arthropod Structure and Development,2011,40(5):381-394.
[6]Nicholas M B,Trevor S.Areview of central 5-HT receptors and their function [J].Neuropharmacology,1999,38(8):1083-1152.
[7]Jason H,Daniel H.Molecular biology of 5-HT receptors [J].Behavioral Brain Research,2008,195(1):198-213.
[8]Pazos A,Cortés R,Palacios J M.Quantitative autoradiographic mapping of serotonin receptors in the rat brain:Ⅱ.serotonin-2 receptors [J].Brain Res,1985,346(2):231-249.
[9]Pazos A,Probst A,Palacios J M.Serotonin receptors in the human brain:Ⅳ.autoradiographic mapping of serotonin-2 receptors [J].Neuroscience,1987,21(1):123-139.
[10]López-Giménez J F,Mengod G,Palacios J M,et al.Selective visualization of rat brain 5-HT2A receptors by autoradiography with [3H]MDL 100,907 [J].Naunyn Schmiedebergs Arch Pharmacol,1997,356(4):446-454.
[11]Pritchett D B,Bach A W,Wozny M O,et al.Structure and functional expression of cloned rat serotonin 5HT-2 receptor [J].EMBO Journal,1988,7(13):4135-4140.
[12]Saltzman A G,Morse B,Whitman M M,et al.Cloning of the human serotonin 5-HT2 and 5-HT1C receptor subtypes [J].Biochem & Biophys Res Comm,1992,181(3):1469-1478.
[13]Gerhardt C C,Van Heerikhuizen H.Functional characteristics of heterologously expressed 5-HT receptors [J].European Journal of Pharmacology,1997,334(1):1-23.
[14]Foguet M,Daniel H,Luis A P,et al.Cloning and functional characterization of the rat stomach fundusreceptor [J].EMBO Journal,1992,11(9):3481-3487.
[15]Chambard J C,Van Obberghen S E,Haslam R J.Chinese hamster serotonin 5-HT type 2 receptor cDNA sequence [J].Nucleic Acids Res,1990,18(17):52-82.
[16]Johnson M P,Baez M,Kursar J D,et al.Species differences in 5-HT2A receptors:cloned pig and rhesus monkey 5-HT2A receptors reveal conserved transmembrane homology to the human ratherthanrat sequence [J].Biochimca et Biophysica Acta,1995,1236(1):201-206.
[17]王彦男,奚耕思,杨栋梁.拟黑多刺蚁生活史研究及幼虫龄期划分 [J].西北农林科技大学学报(自然科学版),2016,44(3):167-172.
Wang Y N,Xi G S,Yang D L.Life cycle and larval instar differentiation ofPolyrhachisvicinaRoger [J].Journal of Northwest A&F University (Nat Sci Ed),2016,44(3):167-172.
[18]Clagett D M,Schoenleber R,Chung C,et al.Preparation of an affinity chromatography matrix for the selective purification of the dopamine D2 receptor from bovine striatal membranes [J].Biochim Biophys Acta,1989,986(2):271-280.
[19]Markus T,Danie R,Nadine J,et al.Function and distribution of 5-HT2 receptors in the honeybee (Apismellifera) [J].PLoS One,2013,8(12):e82407.
[20]Colas J F,Launay J M,Kellermann O,et al.Drosophila 5-HT2 serotonin receptor:coexpression with fushi-tarazu during segmentation [J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(12):5441-5445.
[21]Sykes P A,Condron B G.Development and sensitivity to serotonin ofDrosophilaserotonergicvaricosities in the central nervous system [J].Developmental Biology,2005,286(1):207-216.
[22]Colas J F,Launay J M,Vonesch J L.MaroteauxL serotonin synchronises convergent extension of ectoderm with morphogenetic gastrulation movements in Drosophila [J].Mech Dev,1999,87(1/2):77-91.
[23]Schaerlinger B,Launay J M,Vonesch J L,et al.Gain of affinity point mutation in the serotonin receptor gene 5-HT2Droaccelerates germband extension movements duringDrosophilagastrulation[J].Dev Dyn,2007,236(4):991-999.
[24]Alice S F,Kerry L S,Daniel R,et al.The role of serotonin in feeding and gut contractions in the honeybee [J].Journal of Insect Physiology,2013,61(100):8-15.
[25]Johnson O,Becnel J,Nichols C D.Serotonin 5-HT2 and 5-HT1A-like receptors differentially modulate aggressive behaviors inDrosophilamelanogaster[J].Neuroscience,2009,158:1292-1300.
[26]Dierick H A,Greenspan R J.Serotonin andneuropeptide F have opposite modulatory effects on flyaggression [J].Nat Genet,2007,39:678-682.
