同种异体原位肝移植麻醉管理1例
2018-04-10吕洁萍
任 昕,吕洁萍
(1山西医科大学麻醉学系,太原 030001;2山西医科大学第一医院麻醉科;*通讯作者,E-mail:691597018@qq.com)
肝脏是人体单一的重要器官,其功能既复杂又多样,肝脏受到严重损害后根治率极低,对顽固性肝病施行肝移植是有希望的一种疗法。但肝脏与肾、心等脏器不同,肝脏移植手术操作复杂、对全身干扰大、时间长,加之大部分病患均为终末期肝病,常伴发严重的全身脏器功能损伤及内环境紊乱,且新移植肝脏面临再灌注损伤及排异反应,决定了肝脏移植的麻醉与其他手术的麻醉有明显不同,不能用传统的麻醉观念来简单地理解肝脏移植麻醉,纯麻醉处理在肝移植的麻醉处理中已不再是肝移植手术期的主要内容,麻醉期处理措施恰当与否是肝脏移植手术能否成功的关键因素之一。
2017年7月,我院成功地进行了1例活体肝移植术,患者术后恢复良好,现将病例及术中麻醉管理报道如下,通过对其麻醉资料进行分析、讨论,进一步总结该类手术麻醉的处理要点和注意事项,从而为以后的临床工作提供参考。
1 病例报告
1.1 一般情况
患者,男性,53岁,身高176 cm,体重97 kg,BMI 31.3 kg/m2,主因“诊断乙肝肝硬化10余年,发现肝右叶占位4月余”入院,术前确诊为:肝癌,肝硬化,门脉高压,脾大,乙型病毒性肝炎,肝脏多发小囊肿。胸片,心电图,各项化验检查包括血常规、肝肾功能、凝血均无明显异常,无腹水。
1.2 麻醉经过
患者上午8:00入手术室后给予五导联心电监护、血氧饱和度(SpO2)、脑电双频谱指数(BIS)监测后,于左上肢、右上肢开放两个外周静脉液路,使用快速输液加温装置分别给予左上肢输注复方氯化钠,右上肢输注抗生素(亚胺培南2 g),入室心率(HR)100次/min,SpO299%,BIS 98,术前给予咪达唑仑2 mg静脉推注,先于局麻下行左侧桡动脉穿刺并置管,通过转换器连接常规监护仪及Vigileo监护仪分别进行有创血压及连续心排出量(CO)监测。麻醉前有创血压(IBP)170/68 mmHg。麻醉诱导依次给予舒芬太尼42.5 ug,顺苯磺阿曲库铵15 mg,依托咪酯40 mg,甲强龙40 mg,奥美拉唑钠80 mg静脉推注,待血流动力学平稳后,BP 118/60 mmHg,HR 70次/min,SpO299%, BIS=39时可视喉镜下经口插入直径7.5 mm气管导管,插入深度24 cm,听诊双肺呼吸音清晰对称后固定气管导管。之后超声引导下行右颈内静脉穿刺并置入三腔中心静脉导管及漂浮导管,漂浮导管置入正确位置后,连接常规监护仪及Vigileo监测仪,行连续中心静脉压(CVP)、肺动脉压(PAP)监测。术前肺动脉压22/8 mmHg,CVP 3 cmH2O,CO 9.1 L/min。行动脉血气分析。
9:48手术开始。给予静吸复合麻醉。
无肝前期:手术开始30 min行血气分析后,给予补充醋酸林格液200 ml、聚明胶肽1 000 ml、氨甲环酸2 g、乌司他丁30万IU、人血白蛋白40 g。血压维持到120-150/60-90 mmHg之间,HR 80-90次/min,无肝期前20 min再次行血气分析后给予10%葡萄糖酸钙1 g。13:17肝下下腔静脉阻断,13:21肝门静脉阻断,13:28肝上下腔静脉阻断。此期尿量共600 ml。
无肝期:门静脉阻断后BP 112/60 mmhg,HR 80次/min,CO 2.7 L/min,CVP为-3 cmH2O,肺动脉压17/1 mmHg。将麻醉药量减少,同时泵注去甲肾上腺素,依次给予巴利昔单抗20 mg、乙肝免疫球蛋白4 000 U、氨甲环酸1 g、乌司他丁30万IU、还原型谷胱甘肽2.4 g、10%葡萄糖酸钙1 g静脉输注。无肝期20 min行动脉血气后,为防止新肝期进一步加重酸中毒,给予5%碳酸氢钠250 ml。门静脉开放前5 min给予10%葡萄糖酸钙1 g、甲强龙1 g,14:09开放肝上下腔静脉,14:13开放门静脉,14:17开放肝下下腔静脉。BP 110/60 mmhg,HR 110次/min。此期尿量共400 ml。
新肝期:开放门静脉后,BP 136/80 mmHg,HR 108次/min,CO 6.7 L/min,CVP 2 cmH2O,肺动脉压24/10 mmHg。给予肾上腺素30 μg、甲氧明1 mg、鱼精蛋白50 mg,新肝期5 min、30 min、1 h分别行血气分析,结果见表1。期间根据血气分析报告依次给予10%葡萄糖酸钙3 g、氨甲环酸2 g、抗生素(亚胺培南2 g)、呋塞米10 mg、10%氯化钾0.5 g、5%碳酸氢钠250 ml。此期监测血常规、电解质、肝肾功能(包括血糖)及凝血功能、血栓弹力图(TEG),TEG、肝功结果。结果显示,:凝血因子活性正常,纤维蛋白原功能正常,血小板功能正常(见表2,3)。测ACT 133 s。缝皮时及手术结束前分别行血气分析。新肝期尿量500 ml。术后带气管导管返ICU。肝功恢复指标结果见表3。
表1术中各时段血气变化
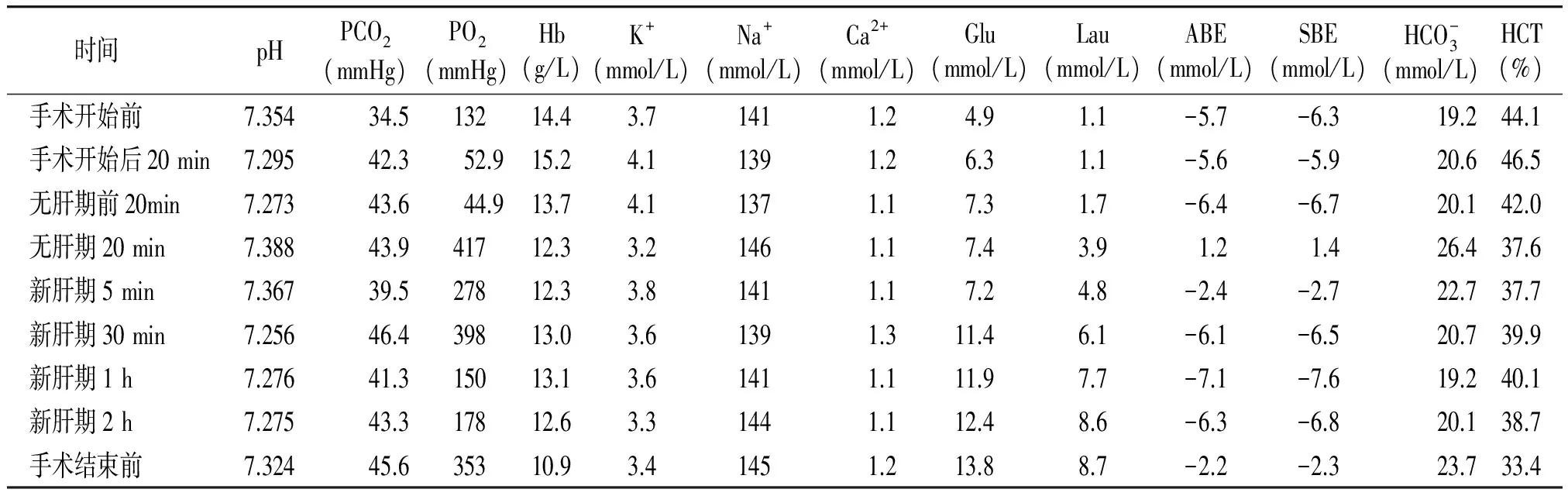
时间pHPCO2(mmHg)PO2(mmHg)Hb(g/L)K+(mmol/L)Na+(mmol/L)Ca2+(mmol/L)Glu(mmol/L)Lau(mmol/L)ABE(mmol/L)SBE(mmol/L)HCO-3(mmol/L)HCT(%) 手术开始前7.35434.513214.43.71411.24.91.1-5.7-6.319.244.1 手术开始后20min7.29542.352.915.24.11391.26.31.1-5.6-5.920.646.5 无肝期前20min7.27343.644.913.74.11371.17.31.7-6.4-6.720.142.0 无肝期20min7.38843.941712.33.21461.17.43.91.21.426.437.6 新肝期5min7.36739.527812.33.81411.17.24.8-2.4-2.722.737.7 新肝期30min7.25646.439813.03.61391.311.46.1-6.1-6.520.739.9 新肝期1h7.27641.315013.13.61411.111.97.7-7.1-7.619.240.1 新肝期2h7.27543.317812.63.31441.112.48.6-6.3-6.820.138.7 手术结束前7.32445.635310.93.41451.213.88.7-2.2-2.323.733.4
表2新肝期血栓弹力图(TEG)结果
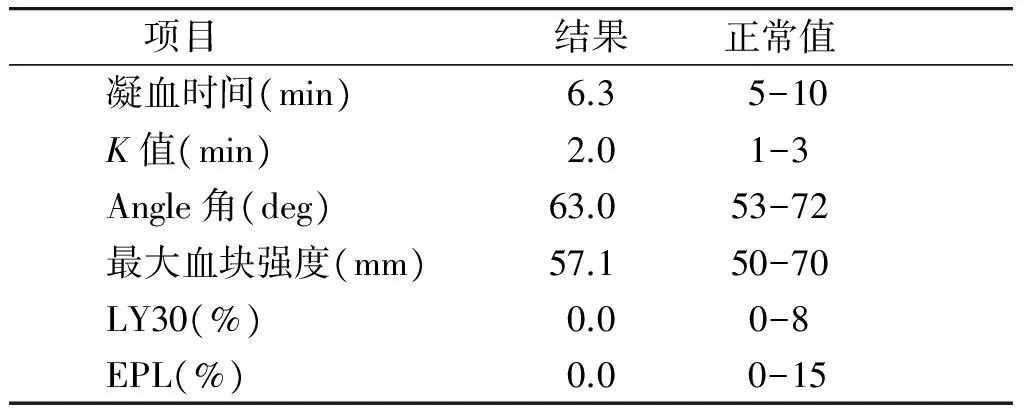
项目结果正常值凝血时间(min)6.3 5-10K值(min)2.01-3Angle角(deg)63.053-72最大血块强度(mm)57.150-70LY30(%)0.00-8EPL(%)0.0 0-15
表3各阶段肝功、凝血情况分析
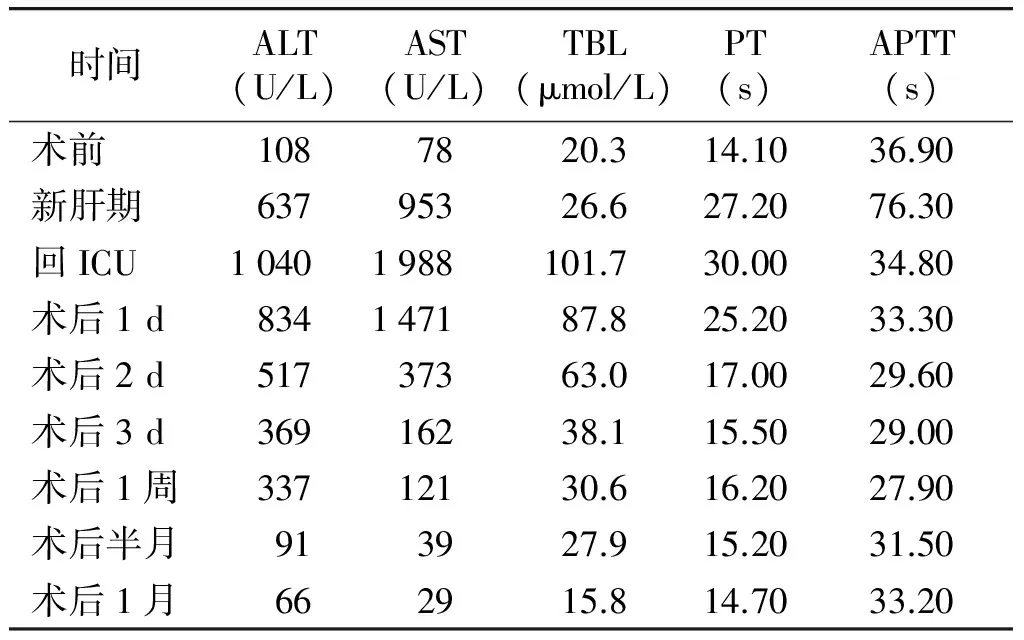
时间ALT(U/L)AST(U/L)TBL(μmol/L)PT(s)APTT(s)术前1087820.314.1036.90新肝期63795326.627.2076.30回ICU10401988101.730.0034.80术后1d834147187.825.2033.30术后2d51737363.017.0029.60术后3d36916238.115.5029.00术后1周33712130.616.2027.90术后半月913927.915.2031.50术后1月662915.814.7033.20
手术历时8 h,无肝期44 min,术中补液总量6 730 ml,出血量1 225 ml,尿量共计1 500 ml。术后患者恢复良好。
术后1 d、2 d、3 d、1周、半月、1月随访,病人一般状况良好,未见并发症。于术后1周转出重症监护室,术后1个月康复出院。
2 讨论
结合肝移植手术各个阶段的特点及本例受体肝移植麻醉过程,总结有以下几点。
2.1 术前准备
由于肝脏具有各种复杂的功能,所以终末期肝病可累及全身众多的系统、器官。因此,对于肝移植患者进行详细完整的术前评估是十分必要的[1]。尤其应对心血管系统、肝肾系统、电解质、呼吸系统、凝血系统进行重点评估[2]。本例患者术中无输血,过程大致比较平稳,这和术前完善的准备、选择合适手术时机、改善低蛋白血症、贫血、特别是凝血功能有很大的关系,可以减少术中出血量、创造良好的手术条件。
2.2 术中监测
终末期肝病患者生理功能变化大,肝移植手术也明显干扰患者的生理功能,可能出现显著血流动力学的波动、凝血障碍和代谢紊乱[3]。这就要求麻醉医师在术中密切控制患者生理功能的变化,确保患者术中安全和手术成功。而控制患者生理功能变化的前提是对各种生理功能的监测。
2.2.1常规监测包括体温监测、心电监测、SpO2、CVP、IBP、尿量监测。
2.2.2心输出量的监测目前被证实可用于肝移植术中心排出量监测的有:肺动脉导管有创监测、经食道超声多普勒监测(EDM)[4]、脉搏指数连续心排量监测(Picco)[5]和FloTrac/Vigileo监测[6]。肺动脉导管的使用虽然因其创伤性大一直被质疑,但是不可否认的是在心排出量监测方面仍是金标准[7]。本例患者在麻醉诱导插管后置入漂浮导管和利用Vigileo监护仪进行平均动脉压(PAP)、一氧化碳(CO)的监测,还可提供混合静脉血氧饱和度(SvO2)[8],这些指标有助于术中对心功能直观的判断从而指导血管活性药物的合理应用及液体治疗。
2.2.3麻醉深度的监测BIS监测可以实时监测患者的麻醉深度,根据BIS值可以及时调整麻醉深度。适宜的麻醉深度BIS值为40-60。本例术中应用了BIS监测,全程将BIS控制到40-50范围内,根据BIS及时调整麻醉用药。
2.2.4血栓弹力图(TEG)监测术中止血和凝血管理可能非常困难,因为这些病人可能会出血或有血栓形成的危险。监测的方式有血栓弹力图监测[9],评估凝血、纤溶功能,对指导术中成分输血和止血疗法起着很重要的作用,此外还可以评估术后血栓风险、判断出血原因,减少二次手术率。此次术中应用了快速的血栓弹性描记图(TEG),为指导术中是否需要输血起了很重要的作用。
2.2.5化验监测血气分析和血糖、电解质测定及凝血功能的监测。这些监测对于术中液体的补充、补充液体种类的选择都有很重要的参考作用。
2.3 麻醉诱导及维持
麻醉药物及方法的选择主要应考虑的问题是:所用药物对肝脏的毒性;麻醉方法是否影响肝脏的血流;能否引起缺氧、二氧化碳蓄积和内脏血管收缩等。使用的药物应从减轻移植肝的负担着眼。由于刚移植的肝脏受到了缺血、缺氧、低温阶段、长时间手术带来的低血压、严重电解质紊乱和代谢性酸中毒等不良影响,肝细胞会受到一次打击。因此,麻醉药物的选择和麻醉管理应为移植肝的生存创造条件。氟烷、甲氧氟烷、氨氟醚、乙醚均应慎用或免用,对镇痛药和肌松药的剂量应严格掌握。因肝移植手术肌松要求较高,目前国外多广泛使用静吸复合全身麻醉,国内有部分学者主张使用静吸复合全身麻醉加硬膜外麻醉。静吸复合全身麻醉加硬膜外麻醉,该方法的优点是可以减少全身麻醉药的用量,同时还可术后镇痛[10],但是对于术前有凝血功能障碍的患者,硬膜外穿刺有发生硬膜外血肿的风险[11],应谨慎选择。此例患者选择了静吸复合全身麻醉方法,术中基本上满足外科手术的要求,患者生命体征也比较平稳。
2.4 术中麻醉管理
维持术中血流动力学的稳定是肝移植术中麻醉管理很重要的一部分。肝移植手术历经无肝前期、无肝期、新肝期三个阶段。血流动力学波动大主要体现在阻断和开放门静脉及腔静脉时期。
2.4.1无肝前期无肝前期指手术开始至下腔静脉阻断的过程。此期主要的手术操作是游离肝脏。当大量腹水被吸出,腹内压突然下降导致腹腔血管床扩张,回心血量明显减少,心排出量下降。此时可加快输液或将病人置于头低足高位,促进血液回流增加前负荷。必要时可使用少量缩血管药维持血压。大曲张静脉离断、腹腔粘连分解、游离肝脏会造成大量的失液和失血。
此期麻醉重点是随时观察手术出血量,严密监测血容量,及时处理术中失血引起的心排出量及血压的降低,但是除非有过多的失血,否则不应过度纠正凝血障碍。该期对低钠血症不应过快纠正,对低钾的纠正也不应太积极,尤其是开放前。对肾功能的保护也应该从此期开始。具体措施包括维持适当的血压和血容量、使用利尿剂、小剂量多巴胺等以维持足够的尿量。
因此,此期补液很重要,一般选用胶体。同时可应用一些抑制纤溶的药物如:氨甲环酸,减少术中的出血量。有人主张控制性低中心静脉压即手术中通过麻醉及其他手段将中心静脉压控制在正常水平以下,通常在3-5 cmH2O之间,同时维持动脉收缩压≥90 mmHg及心率稳定,从而使手术中出血量明显减少的技术。这样可以减少术中出血[12],但是低中心静脉压可造成术中空气栓塞、增加术中升压等血管活性药物的使用,从而可能导致术后肾功能不全。此例患者术前无腹水,游离肝脏过程比较平稳,共220 min,使用了氨甲环酸2 g,输注液体总量2 100 ml,胶体1 100 ml,出血量约650 ml,未输血。中心静脉压在3-5 cmH2O之间。
2.4.2无肝期无肝期开始的标志是门静脉阻断。门静脉和下腔静脉的完全阻断对病人的循环功能和体液平衡干扰大,给麻醉管理带来很大困难。腔静脉完全阻断后,血流动力学发生剧烈变化:静脉回流减少50%,心输出量降低,体循环动脉压和上腔静脉压(前负荷)降低。内脏和下腔静脉压力增加,在下腔静脉阻断后试图单纯通过快速输血输液维持血流动力学的稳定是困难的,也是不合理的。如果在无肝期输入过多的液体,在下腔静脉开放后会极大加重心脏负担,同时不利于新肝的灌注。除了快速输血和输液外,还可以在阻断前调节病人体位于头低位,促进下半身的血液回流。血管活性药物在阻断后低血压的处理中具有重要的地位。通常使用作用于α受体的药物,如去甲肾上腺素和去氧肾上腺素。此期肾脏的血液回流基本中断,肾脏失灌注。在整个无肝期一般无尿,同时有下腔静脉瘀血、组织缺氧和酸中毒。
此期麻醉处理有4个重点:一是处理由于下腔静脉被阻断引起的剧烈血流动力学波动如:回心血流量减少,心排出量减少,内脏和下腔静脉压力增高导致的体循环动脉压降低伴心率增快[13],以及严重的酸中毒;二是无肝期可能出现的低体温、低血糖、乳酸的增加和酸中毒:因肝脏的产热及糖异生停止,同时新肝的置换,以及输血输液等导致可能出现中心体温的下降、低血糖,而乳酸浓度增加的直接原因是肝脏无功能和下半身的淤血;三是电解质的紊乱:突出的表现为低钙。血浆钙离子浓度的减少会导致心肌收缩力下降,对循环造成不良影响;四是此期纤溶开始活跃,可开始抗纤溶治疗。
因此,此期应加强血管活性药物的合理应用;使用加温毯同时对输注液体进行加温,严密监测血糖、电解质,多数情况下在此期均需要补充钙离子。此例手术无肝期共44 min,在下腔静脉阻断后出现血压下降、心率增快,给予泵注去甲肾上腺素维持平均动脉压于60 mmHg以上;术中全程液体加温输注,体温维持到36 ℃以上;此期给予葡萄糖酸钙2 g;血糖7.4 mmol/L。
2.4.3新肝期当门静脉吻合完毕,血管开放后,就进入了新肝期。此期麻醉处理中风险最大的时刻是移植肝血管开放后即刻,会发生剧烈的血流动力学波动:原本淤积于下半身的血流进入循环,会导致一系列的病理生理变化。回心血量骤增,心脏前负荷明显增加。此外,下半身的淤血中含有的大量无氧代谢产物乳酸、酸中毒及酸性含高钾的冷保存液突然进入循环导致血浆钾离子浓度明显增高,导致可能会出现严重的低血压、高钾血症、严重的酸中毒、体温过低和凝血功能障碍,有时甚至心搏骤停。
再灌注综合征[14]是指肝门静脉再灌注5 min内体循环血压下降30%,肺动脉压力升高并持续1 min以上,其特征为平均动脉压、全身血管阻力及心肌收缩力降低,而肺血管阻力和肺毛细血管充盈压却升高。预防再灌注综合征的方法有:①在进入新肝期前纠正低钙血症,提高碱剩余;②适当增加血容量和提高平均动脉压;③纠正和预防低温;④通过肝下腔静脉放出一定量供肝和门静脉的血液;⑤尽量减少无肝期的时间;⑥将患者调至头高位;⑦提高每分通气量,适度过度通气,部分代偿代谢性酸中毒。
因此,此期麻醉处理应采取多种综合措施保证尽量减少血流动力学的大幅波动。此期纤溶活性增强,可能需用抗纤溶药和冷沉淀物。下腔静脉开放后,肾脏的灌注恢复,肾功能也应逐渐恢复。通常给予速尿(呋塞米)和甘露醇。但甘露醇有可能导致肾间质水肿反而造成肾损害。本例病例在移植肝开放前,给予葡萄糖酸钙纠正低钙血症,输注碳酸氢钠提高碱剩余,应用血管活性药物维持平均动脉压于60 mmHg以上,保持体温于36 ℃以上,术者通过肝下腔静脉放出一定量供肝和门静脉的血液,多方措施实施的情况下,此例患者开放后血流动力学基本上稳定。
2.5 术后监测及管理
肝移植手术结束后,应将患者送入加强医疗病房(ICU)。在ICU对患者的生命体征进行严密观察,包括心电图、动脉压、中心静脉压、血气及水电解质情况、尿量、体温、腹腔引流量及颜色等的改变。
麻醉处理的合理性应该表现为术后存活率的提高和并发症的降低,而不单纯是围麻醉期的平稳和各项实验室检查结果的正常。比如凝血功能的纠正问题,如果术中的实验室检查结果正常往往导致第2天或第3天的高凝状态,明显增加术后肝动脉和门静脉血栓形成的概率;术中追求正常的容量就会增加术后肺水肿和肝脏水肿的概率,导致肝脏功能恢复减慢或不良,这些并发症的发生并不是在术中,而是在术后几天内出现,麻醉医师应在避免和减少术后并发症(包括属于外科领域或术后ICU范围的并发症)、提高肝脏移植患者预后方面比其他手术发挥更大的作用,甚至是最主要作用。
参考文献:
[1]Thakrar SV, Melikian CN. Anaesthesia for liver transplantation[J]. Br J Hosp Med (Lond), 2017,78(5):260-265.
[2]Jawan B, Wang CH, Chen CL,etal. Review of anesthesia in liver transplantation[J]. Acta Anaesthesiol Taiwan, 2014, 52(4):185-196.
[3]Perilli V, Aceto P, Sacco T,etal. Anaesthesiological strategies to improve outcome in liver transplantation recipients[J]. Eur Rev Med Pharmacol Sci, 2016, 20(15):3172-3177.
[4]石屹崴.经食管超声监测对肝移植术中容量管理的指导意义[D].天津:天津医科大学,2014.
[5]Redondo FJ, Padilla D, Villazala R,etal. Global end-diastolic volume could be more appropiate to reduce intraoperative bleeding than central venous pressure during major liver transection[J]. Anaesth Intensive Ther, 2017, 49(2):100.
[6]董兰,刘多辉,蔡俊刚,等.FloTrac/Vigileo-(V3.0)系统在肝移植手术中的应用[J].临床麻醉学杂志,2015,31(6):550-554.
[7]颜彦,郭兴明,肖守中.心脏功能评价指标及其检测方法进展[J].医疗卫生装备,2005,26(1):21-23.
[8]Feltracco P, Biancofiore G, Ori C,etal. Limits and pitfalls of haemodynamic monitoring systems in liver transplantation surgery[J]. Minerva Anestesiol, 2012, 78(12):1372.
[9]Saner FH, Gieseler RK, Akz H,etal. Delicate balance of bleeding and thrombosis in end-stage liver disease and liver transplantation[J]. Digestion, 2013, 88(3):135-44.
[10]Werawatganon T, Charuluxanun S. Patient controlled intravenous opioid analgesia versus continuous epidural analgesia for pain after intraabdominal surgery[J]. Cochrane Database Syst Rev, 2005, 100(5):CD004088.
[11]Pitkänen MT, Aromaa U, Cozanitis DA,etal. Serious complications associated with spinal and epidural anaesthesia in Finland from 2000 to 2009[J]. Acta Anaesthesiol Scand, 2013, 57(5):553.
[12]Chen H, Merchant NB, Didolkar MS. Hepatic resection using intermittent vascular inflow occlusion and low central venous pressure anesthesia improves morbidity and mortality[J]. J Gastroin-test Surg, 2000, 4(2):162-167.
[13]朱伟,田伟千,谈珊柏,等.原位肝移植术中血流动力学变化[J].江苏医药,2008,34(8):803-805.
[14]Koelzow H, Gedney JA, Baumann J,etal. The effect of methylene blue on the hemodynamic changes during ischemia reperfusion injury in orthotopic liver transplantation[J]. Anesth Analg, 2002, 94(4):824.
