ILK、Cyclin D1及MMP-9在膀胱癌中的表达及意义
2018-04-10张渭波董兵卫
高 娟,张渭波,李 卓,董兵卫*
(1西安医学院第一附属医院检验科,西安 710077;2咸阳市中心医院病理科;*通讯作者,E-mail:rxrfdbw@126.com)
根据美国癌症学会统计,膀胱癌是全球病死率较高的恶性肿瘤之一。现代分子生物学研究表明,肿瘤的发生、发展、转移是一个复杂的多步骤过程,与细胞周期失控和肿瘤细胞间黏附力下降有密切的关系[1],因此,探明膀胱癌生长、增殖的关键靶基因和分子,为其安全有效地诊断、治疗,提高患者的生存率和生活质量具有重要的意义。
整合素连接激酶(intergrin-linked kinase,ILK)是一个59 kDa的细胞内信号蛋白,它在胞内的两个靶向催化位点是蛋白激酶B和糖原合成酶激酶-3。研究显示,ILK与结肠癌、前列腺癌、乳腺癌、卵巢癌、神经胶质瘤等的发生、分化及侵袭转移密切相关[2],而我们前期实验证实,运用siRNA ILK或小分子抑制剂抑制ILK的活性,在膀胱癌细胞中,可以抑制细胞的生长、迁移、侵袭和血管生成[3]。Cyclin D1作为细胞周期调节因子之一,其过度表达是人类多种原发性肿瘤的特征[4],许多肿瘤存在它们的表达异常。基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)是基质金属蛋白酶(MMPs)的重要成员之一,其作用于癌细胞介导的ECM降解活动中,可破坏基底膜,从而促发癌细胞转移与浸润[5]。有资料表明,整合素连接激酶可刺激MMP-9的表达,并在恶性肿瘤细胞的浸润、转移和侵袭中发挥作用[6]。目前有关ILK、CyclinD1和MMP-9在膀胱癌中的表达及其相互作用的研究,国内外报道很少。因此,本实验运用免疫组化方法检测ILK、CyclinD1和MMP-9在膀胱癌和癌旁正常组织中的表达情况,以探讨其与膀胱癌病理分级的关系及三者的相关性,为进一步研究膀胱癌发生发展机制、诊治和评价预后提供必要的理论依据。
1 材料与方法
1.1 一般资料
收集2014-01~2016-12咸阳市中心医院病理科膀胱肿瘤手术切除标本,取58例(其中男45例,女13例)膀胱癌,经病理证实为原发性膀胱癌,且无进行放、化疗。患者年龄52-76岁,平均年龄64岁。同时取相应癌旁正常膀胱组织20例,用10%中性福尔马林固定标本,经脱水、透明、浸蜡、包埋,用4 μm厚连续切片。
1.2 方法
1.2.1主要试剂兔抗人ILK多克隆抗体、免疫组化及DAB染色试剂盒购自博奥森公司;兔抗人CyclinD1及MMP-9多克隆抗体为福州迈新生物技术有限公司产品。
1.2.2免疫组化免疫组化采用SP法进行染色,一抗兔抗人ILK、CyclinD1及MMP-9多克隆抗体稀释浓度为1 ∶100。操作步骤严格按试剂盒说明进行,以0.01 mol/L PBS(pH 7.4)替代一抗作为阴性对照,用已知阳性切片作为阳性对照。
1.2.3结果判断ILK和MMP-9阳性染色细胞为细胞质中见浅或棕黄(褐)色颗粒,CyclinD1阳性染色细胞定位于细胞核内,由3位病理医师分别独立观察3个检测指标,最后结果取3人的平均值。①随机选择10个高倍视野,计数1 000个细胞,计数阳性细胞百分率:阳性细胞数<10%为0分,10%-50%为1分,50%-90%为2分,>90%为3分。②癌细胞染色强度:无着色为0分,浅黄色为1分,黄色为2分,棕黄(褐)色为3分。将两项得分结果相乘:0-1分为阴性(-),2-4分为弱阳性(+),6-8分为阳性(++),9分为强阳性(+++)。
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析,各组间样本差异及两组资料间的相关性分别采用χ2检验及Spearman等级相关分析法处理统计结果。
2 结果
2.1 ILK、CyclinD1及MMP-9在膀胱癌和癌旁正常组织中的表达
ILK、CyclinD1及MMP-9在膀胱癌组织中的阳性表达见图1。ILK在58例膀胱癌及20例癌旁正常组织中的阳性表达率分别为62.1%(36/58)和15.0%(3/20),且随着肿瘤分化程度的降低表达呈递增趋势,差异具有统计学意义(χ2=16.139,P<0.05)。CyclinD1的阳性表达分别为70.7%(41/58)和20.0%(4/20),其在正常膀胱组织中的表达信号最弱,并随着肿瘤分化程度的增加其表达率呈下降趋势,差异具有统计学意义(χ2=15.655,P<0.05)。MMP-9的阳性表达分别为65.5%(38/58)和15.0%(3/20),且在高分化癌中的表达呈中度阳性,在低分化癌中的表达呈强阳性,差异具有统计学意义(χ2=15.221,P<0.05,见表1)。
表1ILK、CyclinD1及MMP-9在膀胱癌和癌旁正常组织中的表达
Table1ExpressionofILK,CyclinD1andMMP-9inbladdercancerandnormalcontrol
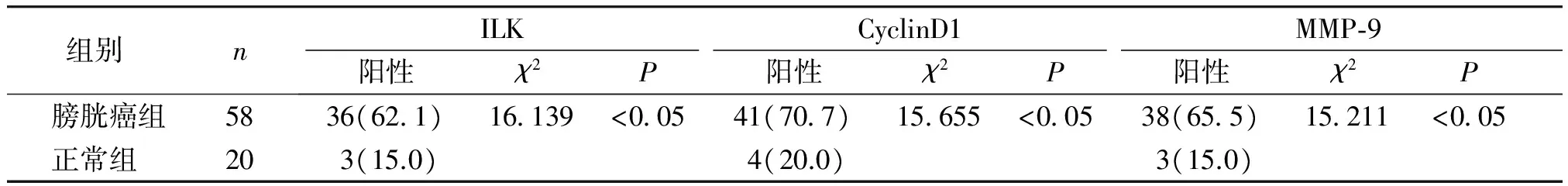
组别 n ILKCyclinD1MMP⁃9阳性χ2P阳性χ2P阳性χ2P 膀胱癌组58 36(621)16139<00541(707)15655<00538(655)15211<005 正常组 20 3(15.0)4(20.0)3(15.0)
2.2 ILK、CyclinD1及MMP-9表达与膀胱癌病理分级的关系
ILK在膀胱癌不同病理分级间的表达为:低分化75.7%(25/33),高分化44.0%(11/25),两组相比差异具有统计学意义(χ2=6.093,P<0.05);CyclinD1在膀胱癌不同病理分级间的表达为;低分化84.8%(29/33),高分化48.0%(12/25),两组相比差异具有统计学意义(χ2=7.408,P<0.05);MMP-9在膀胱癌不同病理分级间的表达:低分化78.8%(26/33),高分化48.0%(12/25),两组相比差异具有统计学意义(χ2=5.968,P<0.05,见表2)。
2.3 膀胱癌中CyclinD1、MMP-9与ILK表达的相互关系
膀胱癌中CyclinD1与ILK表达呈正相关(r=0.3,P<0.05),MMP-9与ILK表达亦呈正相关(r=0.3,P<0.05,见表3)。

A.膀胱癌组织:细胞核高度异型,间质内出现单个癌细胞或不规则形的癌巢(HE染色,×100);B.ILK在膀胱癌组织中阳性表达,(SP法,×100);C.Cyclin D1在膀胱癌组织中阳性表达(SP法,×100);D.MMP-9在膀胱癌组织中阳性表达(SP法,×100)图1 ILK、CyclinD1及MMP-9在膀胱癌组织中的表达Figure 1 Expression of ILK, CyclinD1 and MMP-9 in bladder cancer
表2ILK、CyclinD1及MMP-9表达与膀胱癌病理分级的关系
Table2RelationshipbetweentheexpressionofILK,CyclinD1andMMP-9andthepathologicalgradeofbladdercancer
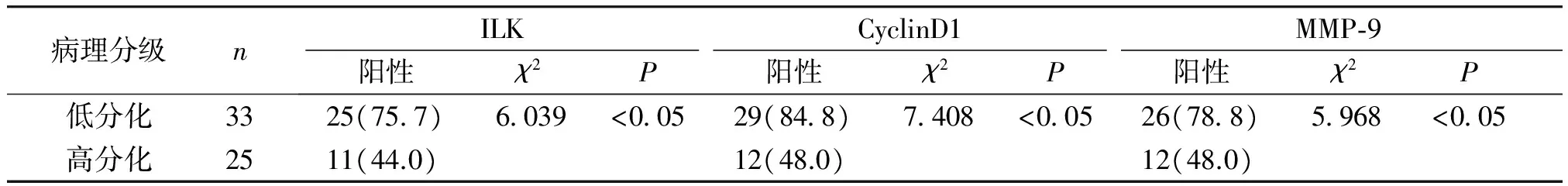
病理分级n ILKCyclinD1MMP⁃9阳性χ2P阳性χ2P阳性χ2P 低分化33 25(757)6039<00529(848)7408<00526(788)5968<005 高分化25 11(44.0)12(48.0)12(48.0)
表3CyclinD1、MMP-9与ILK在膀胱癌中表达的关系
Table3RelationshipbetweentheexpressionofCyclinD1,MMP-9andILKinbladdercancer

ILKCyclinD1MMP⁃9+-rP+-rP+29703<00528803<005-12101012
3 讨论
研究结果表明,ILK、CyclinD1、MMP-9在膀胱癌中的表达明显高于癌旁正常组织。提示三种蛋白在膀胱癌的发生发展过程中均上调,即涉及三种蛋白的激活。在对其表达和膀胱癌分化程度之间的关系研究发现,三种蛋白在膀胱癌中的表达随着肿瘤分化程度的增加而增强,与国内外关于ILK、CyclinD1、MMP-9的独立研究一致[7,8]。研究还发现膀胱癌组织中ILK与CyclinD1及ILK与MMP-9的表达均呈正相关,表明ILK的高表达促使CyclinD1、MMP-9的表达上调,增强了肿瘤细胞的侵袭能力,其确切机制尚待研究。现代学者在观察肿瘤的不协调生长和增生时,发现了与细胞周期调控有关的蛋白,并认为肿瘤与细胞周期调控失常有着密切联系[9]。cyclin D1作为细胞周期调节因子之一,其过度表达是多种人类原发性肿瘤的特征,对肿瘤的诊断和预后判断具有重要意义[10]。本实验发现,CyclinD1在膀胱癌中的表达明显高于癌旁正常组织,且CyclinD1的表达随肿瘤恶性程度的增加而增高,其过度表达与肿瘤的分化程度密切相关。因此,可以推断,CyclinD1作为原癌基因,促增殖作用的细胞周期素,在分化较差增殖较多的低分化肿瘤中表达更多,提示CyclinD1表达异常可能是膀胱癌发生的分子事件。以上结果与以往研究报道结果大致相同[8]。本研究表明,CyclinD1在膀胱癌的发生发展中起重要的作用,并且与肿瘤的恶性程度、转移及预后密切相关。
MMPs是一组高度同源的参与基底膜与细胞外基质降解的蛋白酶类,有研究结果发现,在正常组织中,MMPs没有表达,或仅有较弱水平的表达,与良性肿瘤及正常组织相比,MMPs在恶性肿瘤细胞中的表达明显提高[11,12]。临床上认为,MMP-2(明胶酶A)与MMP-9(明胶酶B)是与肿瘤浸润和转移关系最为密切的MMPs家族[13]。大量研究表明,MMP-9在多种恶性肿瘤中呈现过度表达,在恶性肿瘤浸润转移过程中扮演着重要角色[14]。本研究发现,MMP-9在膀胱癌组织中的表达显著高于正常组织,且肿瘤分化程度越低,MMP-9的表达越高;提示MMP-9与膀胱癌的发生、发展密切相关,可作为反映膀胱癌恶性程度的指标之一,用于预测膀胱癌患者的预后。目前有研究证实,ILK可以使MMP-9表达上调,参与生长因子信号通路[15],我们研究也发现,ILK与MMP-9在膀胱癌组织中的表达呈显著正相关。提示ILK和MMP-9在促进膀胱癌的发生、发展中可能存在某种时间或空间上的协同作用,可能的机制为高表达的ILK诱导MMP-9表达增加以促进细胞外基质和基底膜的降解,从而增强肿瘤细胞的侵袭力[16],并预示联合检测两项指标有助于膀胱癌生物学行为的判断和预后的估计。
本研究发现,ILK、CyclinD1及MMP-9的表达与膀胱癌的临床病理分级密切相关,并且,CyclinD1、MMP-9的表达与ILK的表达均呈正相关。因此我们推测,三者可能在基因水平存在正向调节作用,ILK的高表达使得CyclinD1、MMP-9的表达上调,从而在膀胱癌的发生、发展中发挥协同效应,构成膀胱尿路上皮肿瘤恶性生物学行为的基础。所以,三者联合检测更有助于判断膀胱癌分级分期及预后。
参考文献:
[1]陈宇,宋永胜.14-3-3ζ、S100A8在膀胱癌中的表达及与膀胱癌侵袭和迁移的关系[J].现代肿瘤医学,2014,22(1):106-109.
[2]D’ Abaco GM,Kaye AH.Integrin-linked kinase:a potential therapeutic target for the treatment of glioma[J]. Clin Neurosci, 2008, 15(10):1079-1084.
[3]Gao J,Zhu J,Li HY,etal.siRNA targeted ILK inhibited growth and induced apoptosis in Human bladder cancer cells[J]. Int J Biochem Cell B, 2011,43(9):1294-1304.
[4]Pestell RG. New roles of Cyclin D1[J]. Am J Pathol, 2013, 183(1):3-9.
[5]王素梅,陈玲,唐卉,等.MMP-8、MMP-9和FFN在细菌性阴道病妊娠妇女中的意义[J].中国妇幼保健,2013,28(28):4615-4617.
[6]Di Ferdinando A, Patacchiola F,Perilli MG,etal. Expression of matrix metalloproteinase-9 (MMP-9) in human mid-pregnancy amniotic fluid and risk of preterm labor[J]. Clin Exp Obstet Gynecol, 2010, 37 (3):193-196.
[7]李传应,李明,王晓秋.CyclinD1、P53、CK20在膀胱尿路上皮癌中的表达及其意义[J].安徽医药,2015,19(7):1325-1326.
[8]高放,张风梅,李胜水,等.膀胱良、恶性上皮肿瘤中MMP-9的表达及临床意义[J].现代肿瘤医学,2014,22(1):134-136.
[9]Larkin S,Kyprianou N.Molecular signatures in urologic tumors[J].Int J Mol Sci,2013,14(9): 1821-1836.
[10]Fang Y, Cao Z, Hou Q,etal. Cyclin d1 down regulation contributes to anticancer effect of isorhapontigenin on human bladder cancer cells[J]. Mol Cancer Ther, 2013, 12(8): 1492-1503.
[11]朱宏刚,张军,傅斌,等.MMP-2、MMP-9及TIMP-3在膀胱移行细胞癌中的表达及临床意义[J].现代泌尿外科杂志,2010,12(1):15-17.
[12]Friedrich MG, Chandrasoma S, Siegmund KD,etal. Prognostic relevance of methylation markers in patients with non-muscle invasive bladder carcinoma[J]. Eur J Cancer, 2005,41(17): 2769-2778.
[13]宋牧,倪多,朱丽萍.VEGF、MMP-2在乳腺癌中的表达及其临床意义[J].新疆医科大学学报,2008,31(1):57-59.
[14]Jia FX, Liu JW, Zhang D,etal. Prognostic value of the expressions of MMP-9 and COX-2 in pancreatic carcinoma[J]. Chin J Clinicians, 2011,5(7):1917-1922.
[15]姚艳红,王海涛.肌层浸润性膀胱癌分子预后标记物研究进展[J].中国肿瘤临床,2013,40(1):60-62.
[16]张凤梅,李胜水,李秀清,等.ILK和MMP-9在胃癌及其侵袭、转移中的表达及意义[J].胃肠病学和肝病学杂志,2015,24(1):95-98.
