癌痛放疗中止痛药物应用经验浅谈
2018-04-10余宗艳邵秋菊齐宇红周苏娜
余宗艳,邵秋菊,齐宇红,周苏娜,梁 军
(空军军医大学(原第四军医大学)唐都医院放射治疗科,西安 710038;*通讯作者,E-mail:liangjun1964@126.com)
我国每天恶性肿瘤新发病例数已达到1 200例,而癌痛作为肿瘤最常见伴随症状,治疗现状不容乐观。癌痛亦可引起机体发生严重的应激反应,导致体内多种应激激素的释放,影响机体各个系统的功能,使病情恶化,严重影响病人生存质量,而在癌痛患者中有56%-82.3%的患者疼痛没有得到规范有效的治疗[1]。实际上,癌痛患者需要接受综合治疗、精准治疗以及相对个体化的治疗。关于癌痛治疗方式及现状的文献不计其数,但是,关于癌痛患者在接受放射治疗期间如何与药物有效配合的问题,并未有太多文献参考或共识。现将我科多年来癌痛患者放疗与药物治疗配合过程中遇到的问题及取得的成绩回顾性分析总结如下。
1 癌痛的药物治疗
随着镇痛理念的不断发展,癌痛管理在我国越来越受到重视,管理水平也在逐步提高。并且随着三阶梯癌痛治疗原则的应用与发展,我国医师在用药方面也发生了如下演化:首先,对疼痛评估的深化。全面、及时、准确的癌痛评估是确保止痛适宜治疗的前提条件,也是判断癌痛疗效的必要基础。其次,对第2阶梯用药的淡化。第三,对某些传统代表性止痛药物(阿司匹林、可待因)的边缘化。第四,对第2,3阶梯阿片类药物选择的多样化。第五,使用强阿片类药物止痛有条件的全程化(用于各个阶梯)。第六,癌痛治疗使用辅助性药物的专业化。随着对止痛药物研究的不断深化,用药的经验日益丰富,更加个体化的整体止痛治疗必将使患者获益[2]。
癌痛治疗过程中,还要强调其伴随症状的辅助治疗。因为疼痛可从生理、心理、社会和精神等多个方面影响患者的生活质量[3],并且癌痛治疗不足时,可直接影响患者的生活质量,并成为焦虑抑郁情绪的主要原因,需要给予必要的心理支持和干预治疗[4]。根据WHO三阶梯镇痛原则,辅助药物可以用于癌痛治疗的任何一个阶梯,与阿片类药物联合应用具有协同镇痛、减少阿片类药物用量、减轻阿片类药物不良反应的作用,尤其适用于对阿片类药物部分敏感的神经病理性疼痛。常用的辅助镇痛药物包括:抗抑郁药(TCAs代表药物包括:阿米替林及去甲替林等)、抗惊厥药(加巴喷丁、卡马西平)、皮质类固醇激素(地塞米松)及NMDA受体拮抗剂(氯胺酮)等[5],此外配合泻药(乳果糖、番泻叶)及中医(中药、针灸与推拿)针对恶心、呕吐及便秘等不良反应的预防和处理。
2 癌痛的放射治疗
中国肿瘤患者中约有70%接受放疗,据1999年世界卫生组织(WHO)统计,约有45%的恶性肿瘤可以治愈,22%为手术治愈,18%为放疗治愈,5%为药物治愈[6]。放疗有较手术有更广泛的适应证,根据NCCN指南(美国国立综合癌症网络,National Comprehensive Cancer Network),放疗可作为部分肿瘤的首选治疗、或者术后治疗、或者术前治疗、或同步放化疗等。
在此处,强调放射治疗对于那些癌症晚期并伴有明显癌痛患者的治疗作用。诸如鼻咽癌、颅内原发肿瘤、脑转移癌引起的头痛;肺癌、纵隔肿瘤、胸膜间皮瘤等引起的胸痛;可切除或不可切除的中晚期胰腺癌、肝癌、腹腔淋巴结转移癌引起的腹痛。癌痛的放疗不仅包括原发肿瘤的治疗,使原发病灶缩小,从而减轻或消除肿瘤浸润、压迫引起的疼痛,而且包括可以有效缓解骨转移癌所致的病理性、神经性疼痛[7]。下面将以我科收治的疼痛最明显的骨转移癌和胰腺癌所致的癌痛治疗为例简单阐述。
骨转移是恶性肿瘤的一个重要的并发症,放射治疗的主要目标是缓解疼痛,减小肿瘤体积,保护相邻神经不适,从而改善患者生活质量。放疗对于骨转移引起的疼痛缓解率在85%以上,约50%能完全消失;50%以上的疼痛在放疗1-2周内开始缓解,90%的疼痛能在3个月内缓解[8]。此外,已被证实骨痛症状缓解后24 h内初始放疗,可以减少炎症细胞和化学疼痛介质参与这种快速反应[9]。
体外放疗及近距离放疗在胰腺癌的癌痛治疗中疗效显著,有研究表明放疗在杀灭肿瘤细胞的同时,许多患者的疼痛也得到了缓解[10-12]。Wang等[13]腹腔镜引导下对14例晚期胰腺癌患者进行放疗,除治疗肿瘤外,87.5%的患者疼痛症状得到缓解。Jin等[14]关于22例晚期胰腺癌患者经超声内镜下给予近距离放疗并联合化疗的研究也证实了上述观点,故放射治疗在胰腺癌治疗中可以有效缓解患者癌痛症状,进而提高生活质量。
综上所述,尽管放射治疗对诸如中晚期胰腺癌、骨转移瘤等原发灶或转移灶所致的癌痛疗效显著,但在治疗过程中,我们常常需要面对那些因癌痛而无法完成放疗定位,更无法配合后续每日一次的治疗摆位的困境。这时需要配合药物治疗,关于癌痛患者的放疗与止痛药物究竟应如何配合,目前尚未达成共识。
3 放射治疗与药物治疗有效配合
基于我科76例癌痛患者的数据分析可以发现在放疗定位、摆位后患者NRS评分升高,爆发痛次数增加(见图1,2),这会增加患者对治疗的抗拒性,因此需要在放疗期间提高癌痛控制。我科参考癌痛规范化治疗示范病房建设经验,制定了《唐都医院放射治疗科癌痛患者规范化治疗临床路径》及《唐都医院放疗科癌痛药物配合指南》。

图1 定位前后、摆位前后NRS评分变化
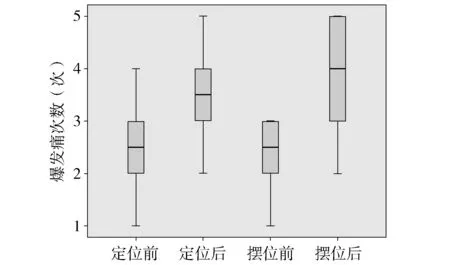
图2 定位前后、摆位前后爆发痛次数变化
《唐都医院放疗科癌痛药物配合指南》如下:首先进行疼痛评估,若未使用长效镇痛药物进入标准滴定,依据WHO三阶梯止痛原则及EAPC(欧洲姑息治疗学会)指南中口服给药首选原则[15,16],我们选择盐酸羟考酮缓释片(奥施康定)进行滴定,起始剂量为20 mg,12 h一次,若给药后NRS评分为2-3分直接安排定位,随后安排放疗;若奥施康定给药后NRS评分仍大于4分,定位前20 min给予口服即释吗啡片10 mg,若NRS评分下降超过2分,给予安排定位,若NRS评分下降小于2分,再次给予口服即释吗啡20 mg,1 h后评估,NRS评分下降超过2分,则给予安排定位,随后安排放疗。在定位及摆位过程中,爆发痛的次数增加,依据“TIME”原则加量(见图3)。
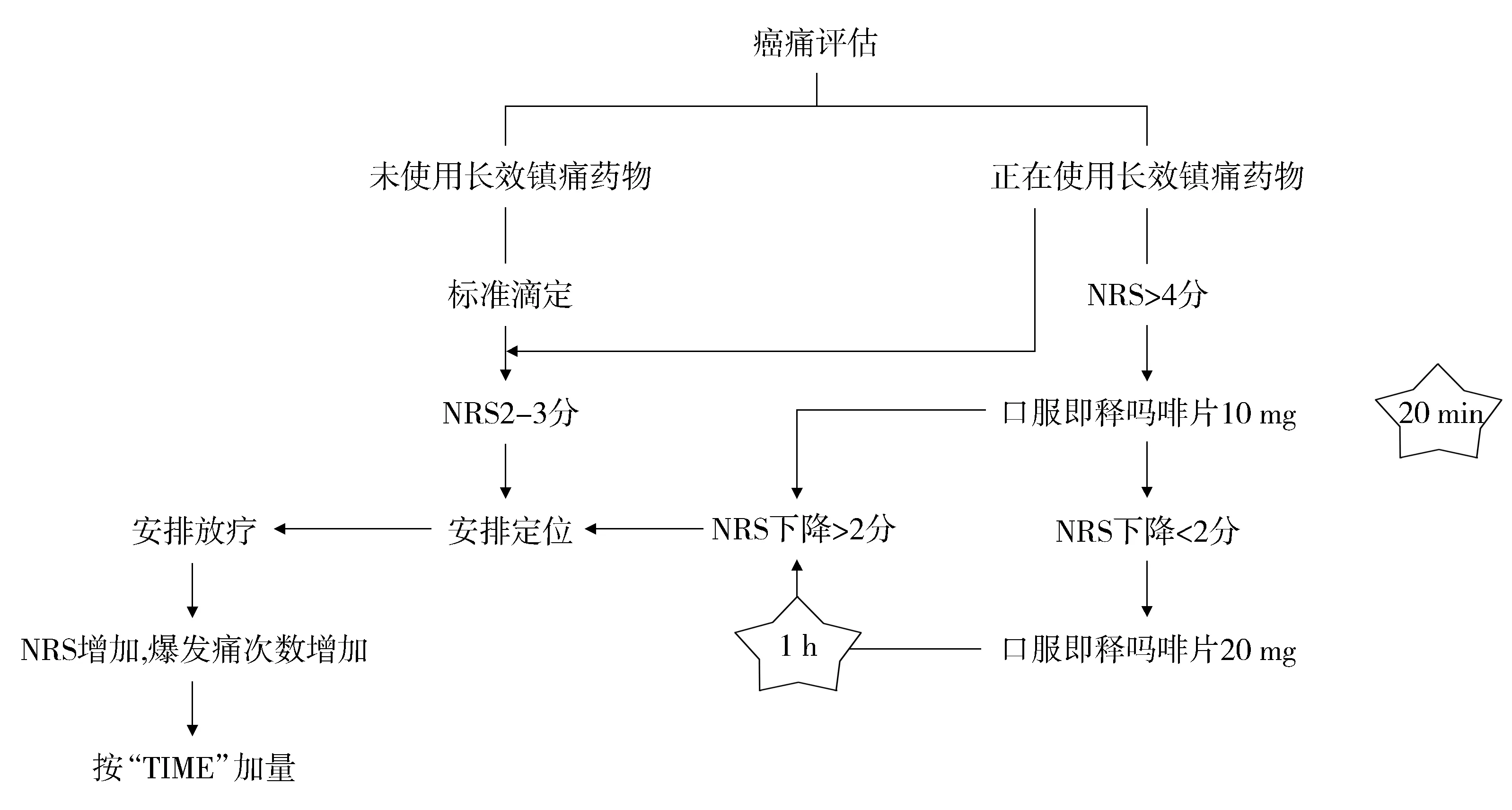
图3 放疗科癌痛药物配合指南(此指南版权归唐都医院放疗科)
自我科放疗与药物配合指南建立以来,放疗患者(尤其是伴癌痛患者)明显获益。首先,治疗依从性显著提高;其次,因疼痛控制不佳原因导致的放疗暂停现象明显减少;第三,患者对放疗的满意度较高;最后,随着上述问题的改善,可以明显减少因多次定位所致体模资源消耗,可以缩短技术员治疗摆位时间,缩短患者总放疗时间,为后续有效的抗肿瘤治疗提供更多机会。
2011年在卫计委的推动下各地都在进行《癌痛规范化治疗示范病房》的建设,不论从技术,还是从政策等方面都提高和保证了癌痛治疗的规范化。癌痛药物治疗在种类、用药途径、辅助用药和减少副作用等方面都取得了较大的进展,有效地减轻疼痛及癌症治疗带来的身体及心理负担,维护和提高了患者的生活质量。治疗体会主要体现在几个方面:首先,强调改变医生的观念,塑造治病全局观。我们需要明白癌痛治疗与抗肿瘤治疗同等重要。不仅仅治病,更要求救人,让患者在放疗或治疗过程中感受到爱与希望,实现真正无痛[17]。其次,尽早对癌痛患者进行常规、量化、动态及全面评估并详细记录。要求尊重患者的感受,相信患者的主诉。我科要求对于来诊患者3 h内完成疼痛评估,强调对疼痛病因及类型、发作情况、止痛治疗、重要器官功能、心理精神、家庭及社会功能及既往史的了解,做到常规评估、量化评估、动态评估、全面评估并记录。第三,强调对患者及家属关于癌痛的健康教育、知识宣教及康复指导。美国国家综合癌症网络成人癌痛指南明确指出健康教育能带领家属及患者走出疼痛误区,增加疼痛相关知识的了解及治疗依从性,改善患者生活质量。在患者癌痛治疗过程中,我们常常发现家属未能做到辅助督促作用,存在着部分患者私自减少服药次数或用药剂量、不按时服药或自行改服其他止痛药物等现象,导致疼痛无法理想控制[18]。并且对于初诊患者、老年患者、低文化水平患者由于知识掌握少、沟通交流能力低下也容易导致其用药依从性低下,所以疼痛目标管理需要医护人员、患者、家属三方共同协作来完成。使癌痛患者在放疗过程中能有较好的心理状态,使患者感受被家人关爱,更好地配合治疗与护理,从而提高了患者的生活质量[19]。第四,强调辅助镇痛药物的使用。最后,希望能推行放疗患者的标准化共识。只有我们每一个人都做到癌痛的规范化治疗,才能提高患者的获益。希望通过我们共同的努力,能让患者实现远离癌痛,善待生命的美好愿望。
参考文献:
[1]程斌.癌痛规范化治疗示范医院临床药师工作模式建立及其应用研究[J].杭州:浙江大学,2016:78.
[2]李虹义,刘端祺.阿片类药物治疗癌痛:理念和认知在实践中的演化[J].中国新药杂志,2014,23(14):1651-1653.
[3]杨萍,刘玮,孙丽秋,等.晚期肿瘤病人疼痛控制状况及其生活质量的研究[J].护理管理杂志,2014,14(1):13-16.
[4]李小梅,肖文华,焦顺昌.一项癌痛患者焦虑抑郁的回顾性队列研究[J].中国疼痛医学杂志,2016,22(5):354-359.
[5]邵月娟,王昆.辅助镇痛药物在癌痛治疗中的应用进展[J].中国肿瘤临床.2015,42(10):530-534.
[6]沈瑜.肿瘤放疗相关研究的进展[J].中华放射肿瘤学杂志,2005,14(1):75-76.
[7]任刚,王颖杰,邸玉鹏,等.老年Ⅳ期胰腺癌高剂量少分次放疗的效果观察[J].临床肝胆病杂志,2016,32(5):873-875.
[8]郭信伟,刘阳晨.骨转移癌及其骨痛的综合治疗进展[J].中华临床医师杂志:电子版,2015,9(15):2907-2911.
[9]De Felice,Piccioli A,Musio D.etal.The role of radiation therapy in bone metastases management.Oncotarget[J].2017,8(15):25691-25699.
[10]Hong JC,Czito BG,Willett CG.etal.A current perspective on stereotactic body radiation therapy for pancreatic cancer[J].Onco Targets Ther,2016,9(9):6733-6739.
[11]郭金友,郑家平,费伦.CT引导下125I粒子植入治疗合并癌痛难治性恶性肿瘤[J].介入放射学杂志,2016,25(2):141-144.
[12]Hanada T. Physical and handling properties of I-125 seed source[J].Nihon Hoshasen Gijutsu Gakkai Zasshi,2009,65(4):476-481.
[13]Wang J,Jiang Y,Li J,etal.Intraoperative ultrasound-guided iodine-125 seed implantation for unresectable pancreatic carcinoma[J].Exp Clin Cancer Res,2009,28(1):88.
[14]Jin Z,Du Y,Li Z,etal.Endoscopic ultrasonography-guided interstitial implantation of iodine 125-seeds combined with chemotherapy in the treatment of unresectable pancreatic carcinoma:a prospective pilot study[J].Endoscopy,2008,40(4):314-320.
[15]杨平,王昆.盐酸羟考酮缓释片用于癌痛治疗的滴定[J].中国肿瘤临床,2015,42(12):600-602.
[16]朱颖,刘渤娜,盐酸羟考酮缓释片在癌痛治疗中应用[J].现代仪器与医疗,2016,22(1):70-72.
[17]汪济东.癌痛治疗研究进展[J].临床医学研究与实践,2016,1(13):190-191.
[18]柳丽娜,周秀敏.病人及照顾者同步健康教育在恶性肿瘤病人护理中的应用[J].全科护理,2015,13(5):457-458.
[19]林丛,杨娜妩,王晓慧.家属同步持续健康教育在癌症患者疼痛管理中的应用研究[J].护理与康复,2017,16(5):486-488.
