胶原诱导关节炎小鼠体内Tfh细胞及其相关免疫分子的表达
2018-04-10胡志芳李爱连姜凤良
王 宁,胡志芳,李爱连,郭 娜,姜凤良
(西安医学院免疫学教研室,西安 710021;*通讯作者,E-mail:1026751112@qq,com)
interleukin-21
类风湿性关节炎(rheumatoid arthritis,RA)是一种以多个小关节病变为特点的系统性自身免疫性疾病,其病变特点为关节滑膜炎症伴随有骨质和关节软骨的破坏,并常有关节外器官受累,最终导致关节畸形甚至功能丧失[1]。目前尚无有效根治药物和措施。该病发病机制尚未完全阐明,可能为遗传、环境、免疫等多因素综合作用的结果。鸡Ⅱ型胶原蛋白诱导性关节炎(collagen-induced arthritis,CIA)小鼠因具有和人类RA相似的病理损伤和疾病进程,成为人类RA研究的经典动物模型[2]。
滤泡辅助性T(T follicular helper,Tfh)细胞是一类重要的CD4+T细胞亚群,可促进淋巴滤泡生发中心的形成、B淋巴细胞的发育和高亲和力抗体的产生[3],Tfh细胞持续性高表达趋化因子受体5(C-X-C chemokine receptor type 5,CXCR5)和协同刺激性因子(inducible co-stimulator,ICOS)[4],并特异性分泌细胞因子白细胞介素21(interleukin-21,IL-21)[5]。Bcl-6为Tfh细胞特异性转录因子,研究表明缺乏Bcl-6可引起Tfh细胞和生发中心发育受损[6]。近年来研究发现T细胞免疫功能失调是RA发病的中心环节[7],但相关研究多涉及到辅助性T细胞(helper T cell,Th)如Th1、Th2、Th17和调节性T细胞(regulatory T cells,Treg),对于Tfh细胞及其相关免疫分子在类风湿性关节炎病人或动物模型体内的变化鲜有报道。本文利用CIA小鼠模型,采用多种实验方法检测RA病理状态下Tfh细胞及其相关免疫分子表达变化,为进一步明确Tfh细胞与RA发病机制关系提供科学依据。
1 材料与方法
1.1 实验试剂及仪器
鸡Ⅱ型胶原、完全弗氏佐剂(Sigma,美国),RPMI 1640(Hyclone,美国),胎牛血清(四季青,浙江),小鼠淋巴细胞分离液(Dakewei,深圳),青链霉素混合液(博艾尔,北京),小鼠percp-CD4荧光抗体、小鼠PE-CXCR5荧光抗体、小鼠APC-ICOS荧光抗体和IgG同型抗体(Biolegend,美国),小鼠IL-21 ELISA检测试剂盒(eBioscience,美国),RNA提取试剂盒和SuperScriptⅡ反转录试剂盒(Takara,日本)。
1.2 实验动物
C57BL/6野生型雄性小鼠20只,6-8周龄,平均体质量为(20.0±0.5)g,购自第四军医大学,动物自由饮食,每笼5只,室温(24±1)℃,湿度(55±5)%。
1.3 方法
1.3.1建立CIA小鼠模型将鸡Ⅱ型胶原(ColⅡ)溶解于0.01 mol/L冰醋酸中,使其终浓度为2 g/L并充分混匀,4 ℃放置过夜,将浓度为5 mg/ml的完全弗氏佐剂(CFA)与预先溶解好的ColⅡ等体积混合,利用三通管预混匀后,匀浆器研磨至充分乳化呈油包水状态。麻醉小鼠后,在其尾跟部皮下注射100 μl。首次免疫后第21天按照如上方法和相同剂量进行二次加强免疫。对照组WT小鼠按照上述方法和时间注入等量生理盐水。ColⅡ免疫组小鼠足关节红肿变形,提示造模成功。
1.3.2CIA小鼠关节炎症状评分造模后每天观察小鼠足爪关节肿胀情况,并用关节炎指数(arthritis index,AI)衡量小鼠足爪部肿胀情况,肢体关节的病变程度参考以下评分进行评估[8]。0级,关节正常,无红肿;1级,关节红但无肿大;2级,关节轻度红肿;3级,关节中度红肿;4级,关节重度红肿伴随功能障碍。每只小鼠病情评分为其四肢关节分数的总和。关节炎评分为每只小鼠四肢关节分数的总和,最高分为16分,AI值≥4分提示造模成功。
1.3.3实验动物分组和取材取20只小鼠分为CIA模型组和WT正常对照组,每组各10只,小鼠造模后每日进行AI评分和病情观察,CIA造模成功率为100%。取病情高峰期时间段(再次免疫后第26-30天)小鼠,2%戊巴比妥钠45 mg/kg腹腔注射麻醉后颈椎脱臼法处死小鼠,摘除眼球进行采血并在无菌条件下分离脾脏和外周淋巴结。
1.3.4流式细胞术检测病情高峰期小鼠脾脏和淋巴结Tfh细胞表达情况制备脾脏和淋巴结单细胞悬液,利用台盼蓝拒染法确定活细胞>95%。Tfh细胞数量和比例测定:收集各组细胞,调整细胞密度为1.0×106/管,1 200 r/min离心5 min,弃上清,加入流式洗液重悬,1 200 r/min离心5 min,重复该步骤两遍,以彻底去除培养基;弃上清,加入细胞膜抗体,分别为:Percp标记的CD4抗体1.25 μl,PE标记的CXCR5抗体2.5 μl,APC标记的ICOS抗体2.5 μl,并设置同型对照管和补偿管;混匀,4 ℃放置30 min后用流式洗液洗两遍,加入200 μl甲醛固定液保存待上机,所测结果使用FlowJo 10软件进行分析。
1.3.5qRT-PCR检测脾脏Bcl-6 mRNA和IL-21 mRNA表达水平使用Primer 3软件设计引物,引物序列见表1,委托上海生工有限公司合成。将分选的脾脏细胞(2×106)置入1.5 ml EP管中,1 500 r/min离心5 min,弃上清,按照RNA提取试剂盒操作说明提取脾脏细胞RNA,DEPC水重悬后定量;利用反转录试剂盒进行cDNA反转录后行PCR,PCR反应体系20 μl ∶1 μl cDNA,10 μl SYBR GreenⅠ,2 μl引物,7 μl去离子水;管家基因GAPDH的表达量作为内参照进行分析。PCR反应条件:激活95 ℃,10 min;40个循环,变性95 ℃,30 s;退火55 ℃,30 s,延伸72 ℃,1 min;扩增完成后,进行溶解曲线分析,并应用MJ Research option2荧光定量PCR仪软件分析目的基因的表达。
表1小鼠PCR引物序列
Table1PCRprimersequence

基因 引物序列 Bcl⁃6F:5′-GCACTGGGCAAACACAACAT-3′R:5′-AGCG-TGCCGGGTAAACTG-3′ IL⁃21F:5′-GGCTGCCTTACTCCTGCTG-3′R:5′-TCATCTTGCCAGGTGAGACTG-3′ GAPDHF:5′-AAATGGTGAAGGTCGGTGTG-3′R:5′-TGAAGGGGTCGTTGATGG-3′
1.3.6ELISA检测血浆中IL-21表达水平采集眼球血于肝素抗凝管中,混匀,2 500 r/min离心20 min,小心吸取上层血浆,严格按照ELISA试剂盒使用说明操作,绘制标准曲线并设空白对照,每份样本设置复孔,酶标仪读取OD值后利用标准曲线计算小鼠血浆IL-21表达水平。
1.4 统计学分析
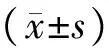
2 结果
2.1 CIA小鼠造模后AI评分
CIA组小鼠从加强免疫后出现活动减少、食欲和体质量下降,尾根部皮肤逐渐红肿溃疡,加强免疫第10天时,绝大多数CIA模型组小鼠出现足爪发红肿胀和运动受限,加强免疫第28天时,CIA小鼠病情进入高峰期,95%小鼠足爪肿胀明显,不能负重且运动受限,31 d后足爪红肿和运动受限逐渐减轻(见图1),但部分小鼠遗留足爪关节畸形问题。WT对照组小鼠无异常。两组小鼠均无死亡发生。
2.2 CIA小鼠发病高峰期脾脏Tfh细胞数量和比例变化
流式细胞术检测正常对照WT小鼠和CIA小鼠再次免疫后第26-30天脾脏CD4+CXCR5+ICOS+Tfh细胞数量和比例。正常对照WT小鼠与CIA发病高峰期小鼠Tfh细胞在CD4+T中所占比例分别为(1.928±0.162 4)%和(2.684±0.116 8)%,见图2,非配对t检验分析两组间Tfh细胞的比例,显示CIA小鼠脾脏Tfh细胞比例明显高于WT小鼠,有明显统计学意义(P<0.05),此外在CIA小鼠脾脏CD4+T细胞中,CXCR5+细胞所占比例为(53.12±4.342)%,ICOS+细胞所占比例为(13.328±3.456)%,WT小鼠脾脏CD4+T细胞中CXCR5+细胞所占比例为(42.31±3.452)%,ICOS+细胞所占比例为(11.153±2.434)%,CIA小鼠均明显高于WT小鼠(P<0.05)。
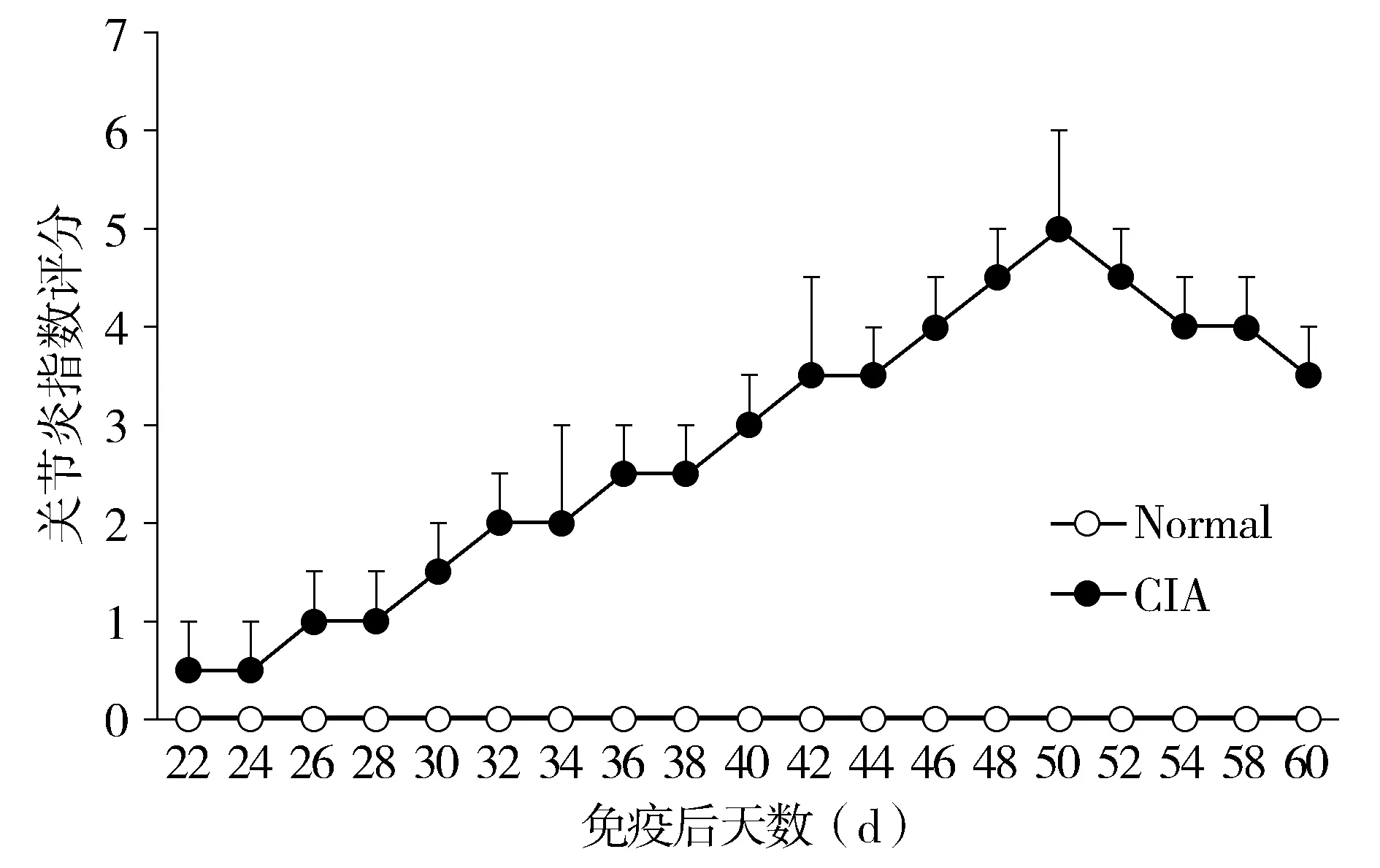
图1 CIA小鼠造模后平均关节炎指数评分Figure 1 The mean arthritis index of CIA mice after modeling
2.3 CIA小鼠发病高峰期淋巴结Tfh细胞数量和比例变化
流式细胞术检测正常对照WT小鼠和CIA小鼠再次免疫第26-30天淋巴结中CD4+CXCR5+ICOS+Tfh细胞数量和比例。正常对照WT小鼠与CIA发病高峰期小鼠Tfh细胞在CD4+T中所占比例分别为(1.211±0.093 9)%和(1.960±0.169 5)%,非配对t检验分析两组间Tfh细胞的比例,显示CIA小鼠淋巴结Tfh细胞比例明显高于WT小鼠,有明显统计学差异(P<0.05,见图3)。此外,在CIA小鼠淋巴结CD4+T细胞中,CXCR5+细胞所占比例为(61.50±4.321)%,ICOS+细胞所占比例为(11.643±2.534)%,WT小鼠淋巴结CD4+T细胞中CXCR5+细胞所占比例为(39.24±3.547)%,ICOS+细胞所占比例为(7.820±3.214)%,CIA小鼠均明显高于WT小鼠(P<0.05)。
2.4 CIA小鼠发病高峰期脾脏Bcl-6 mRNA和IL-21 mRNA表达水平
实时荧光定量PCR检测正常对照WT小鼠和CIA发病高峰期小鼠脾脏Bcl-6 mRNA和IL-21mRNA表达水平,非配对t检验分析结果显示:CIA发病高峰期小鼠脾脏Bcl-6 mRNA表达倍数比率(1.000±0.050 69)明显高于正常对照WT小鼠(0.600±0.050 54),差异具有统计学意义(P<0.05,见图4);CIA发病高峰期小鼠脾脏IL-21mRNA表达倍数比率(1.000±0.060 75)明显高于正常对照WT小鼠(0.530±0.050 54),差异具有统计学意义(P<0.05,见图5)。
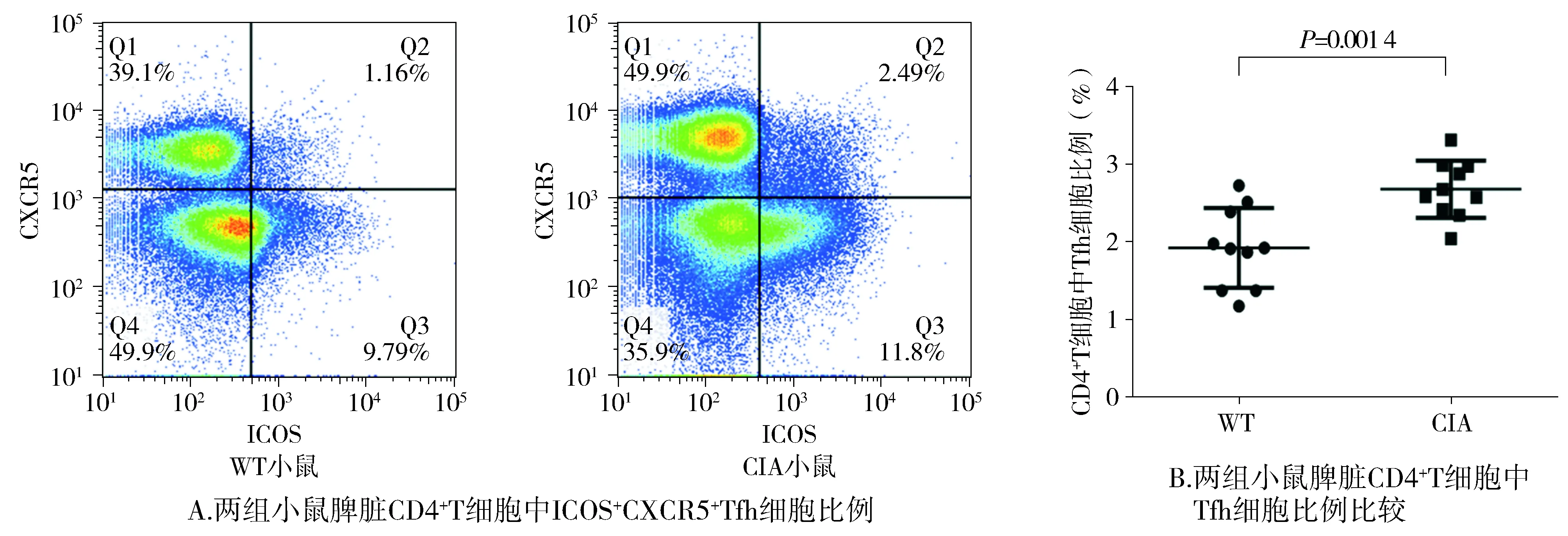
图2 CIA小鼠发病高峰期脾脏CD4+T细胞中Tfh细胞比例变化Figure 2 Changes of Tfh cell percentage in splenic CD4+T cells during the incidence peak of CIA mice
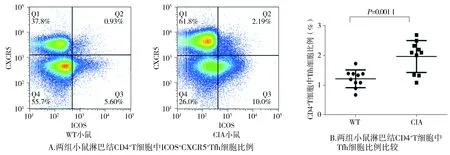
图3 CIA小鼠发病高峰期淋巴结CD4+T细胞中Tfh细胞比例变化Figure 3 Changes of Tfh cell percentage in CD4+T cells of lymph nodes during incidence peak of CIA mice
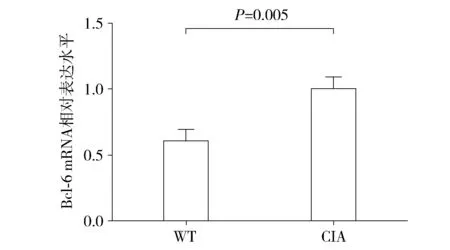
图4 CIA小鼠发病高峰期脾脏细胞中Bcl-6 mRNA表达水平Figure 4 Expression of Bcl-6 mRNA in spleen cells of CIA mice during the incidence peak

图5 CIA小鼠发病高峰期脾脏细胞中IL-21 mRNA表达水平Figure 5 Expression of IL-21 mRNA in spleen cells of CIA mice during the incidence peak
2.5 CIA小鼠发病高峰期血浆中IL-21表达水平
ELISA检测正常对照WT小鼠和CIA发病高峰期小鼠血浆IL-21表达水平,结果显示CIA小鼠血浆IL-21表达量为(104.3±3.541)pg/ml,明显高于正常对照WT小鼠IL-21表达水平[(60.2±10.170)pg/ml],非配对t检验分析显示差异具有统计学意义(P<0.05,见图6)。
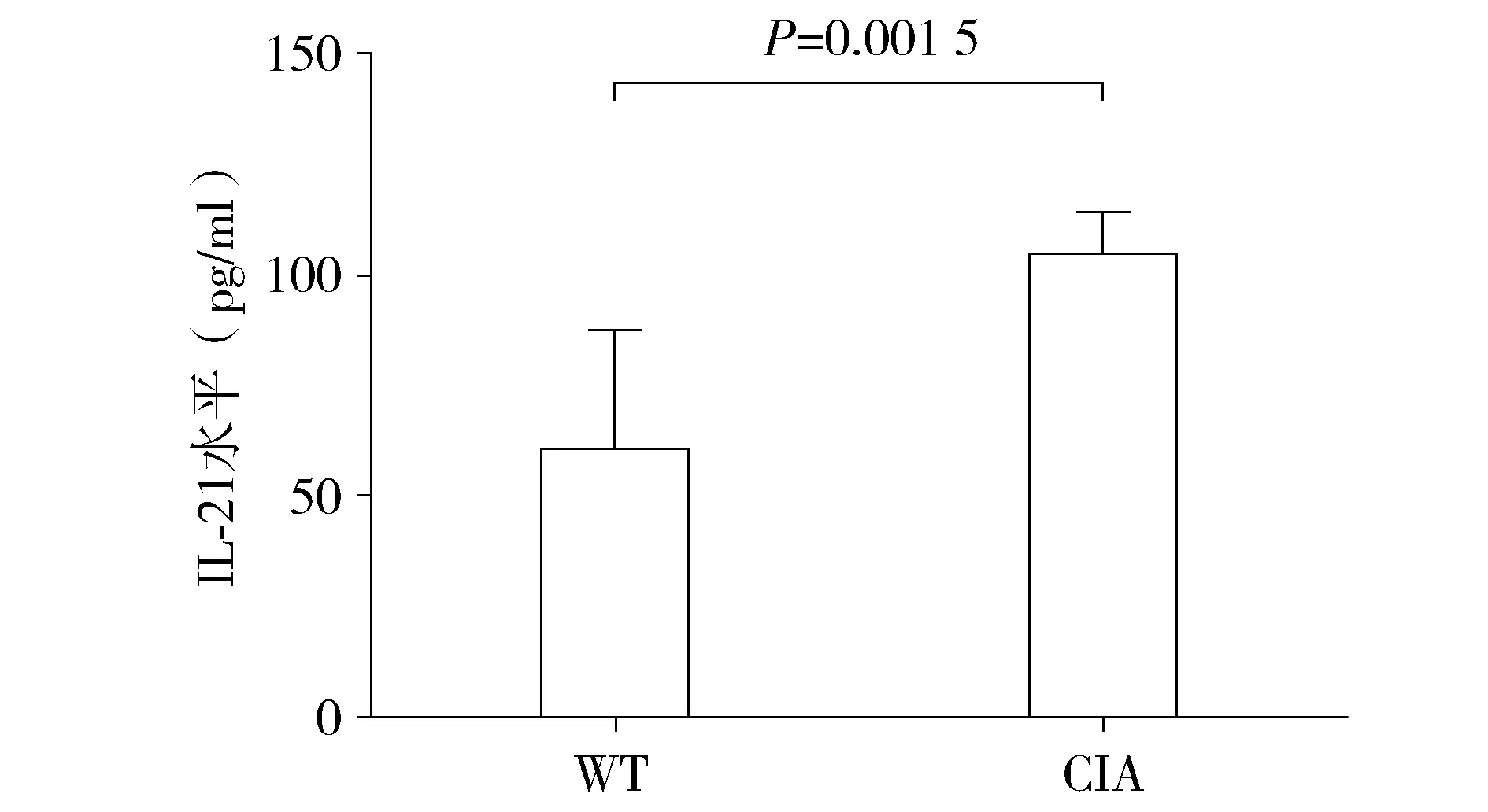
图6 CIA小鼠发病高峰期血浆中IL-21表达水平Figure 6 Expression of IL-21 in plasma of CIA mice during the incidence peak
3 讨论
近年来,越来越多的研究证实RA的发生与免疫系统异常激活密切相关,如持续存在的Th1和Th17反应以及它们所分泌的细胞因子参与到以RA为代表的多种自身免疫性疾病发生发展中[9]。Tfh是近年来发现的一种特殊Th细胞,特异性高表达CXCR5和ICOS并分泌细胞因子IL-21,通过多种方式实现对B细胞进行调节作用并辅助B细胞分化为浆细胞和长期驻留的记忆性B细胞,从而间接调控体液免疫来影响免疫应答[10],研究表明Tfh细胞参与系统性红斑狼疮、甲状腺功能亢进和干燥综合征等多种自身免疫性疾病病理进程[11,12]。
在本实验中我们检测CIA发病高峰期小鼠脾脏和淋巴结Tfh细胞数量比例,结果显示CIA小鼠脾脏和淋巴结CD4+T中Tfh细胞比例明显增高,脾脏和淋巴结CD4+T细胞中CXCR5和ICOS的表达均增高,因趋化因子CXCR5为归巢分子,可促使B淋巴细胞归巢到淋巴结滤泡并促进淋巴滤泡集结和发育,而表达于Tfh细胞上的ICOS与B细胞上高表达的ICOSL结合可诱导Tfh细胞表达Bcl-6,从而促进Tfh细胞分化、增殖,使其产生更多的IL-21、IL-4、IL-10等以进一步增强B细胞功能,故此结果说明了在RA发病高峰期,体内异常增高的Tfh细胞及其相关特异性免疫分子均参与了炎症免疫应答过程和病理进程,此结果与Simpson等[13]在系统性红斑狼疮病人中的研究结果一致。另外,我们检测到CIA发病高峰期小鼠脾脏Bcl-6 mRNA和IL-21 mRNA表达均升高且血浆中IL-21含量升高。早在2009年就发现Bcl-6过表达可诱导Tfh细胞相关基因表达,并以DNA结合依赖性方式抑制其他Th谱系细胞分化[14],同时文献报道IL-21可以促进Tfh细胞Bcl-6的上调[15],且Tfh细胞可高水平分泌细胞因子IL-21[16],并通过自分泌的方式刺激T-B细胞交互作用,促进抗体产生和B细胞对胸腺依赖性抗原应答后浆细胞产生的IgG1类别转化[10],活化的Tfh细胞可通过释放IL-21等细胞因子促进CD8+细胞毒性T细胞的增殖,使CD4+T/CD8+T比例失调,进一步加重炎症反应[17,18]。综合以上结果,更加明确了Tfh参与RA炎症的发展从而促进了自身反应性抗体的出现,在RA病理性免疫应答进程中发挥着重要作用。
综上所述,本实验利用人类RA经典动物模型CIA小鼠,系统检测了CIA小鼠发病高峰期外周免疫器官Tfh细胞和相关免疫分子(ICOS,CXCR5,Bcl-6)表达情况并检测了血浆中与Tfh细胞分泌水平,明确Tfh细胞可通过细胞因子IL-21、跨膜分子ICOS和CXCR5以及转录因子Bcl-6参与RA病理进程,但相关调控机制仍需通过进一步实验来明确,此研究可为深入研究RA发病机制提供实验基础,为其有效治疗提供新的思路。
参考文献:
[1]Elalouf O, Elkayam O.Preclinical rheumatoid arthritis[J].Harefuah, 2017,7(1):451-454.
[2]Hirose J, Tanaka S. Animal models for bone and joint disease.CIA, CAIA model[J].Clin Calcium, 2011,21(2):253-259.
[3]Papa I,Saliba D,Ponzoni M,etal. TFH-derived dopamine accelerates productive synapses in germinal centres[J]. Nature,2017,547(7663):318-323.
[4]DiPlacido LD, Craft J.Emerging from the shadows: follicular helper T cells in autoimmunity[J].Arthritis Rheum, 2010,62(1):6-8.
[5]Bauquet AT, Jin H, Paterson AM,etal.The costimulatory molecule ICOS regulates the expression of c-Maf and IL-21 in the development of follicular T helper cells and TH-17 cells[J].Nat Immunol, 2009,10(2):167-175.
[6]Read KA,Powell MD,Baker CE,etal.Integrated STAT3 and ikaros zinc finger transcription factor activities regulate Bcl-6 expression in CD4+Th cells[J].J Immunol,2017,199(7):2377-2387.
[7]Ye L, Jiang B, Deng J,etal. IL-37 alleviates rheumatoid arthritis by suppressing IL-17 and IL-17-triggering cytokine production and limiting Th17 cell proliferation[J].J Immunol, 2015,194(11):5110-5119.
[8]Yang Y, Dong Q, Li R,etal. Matrine induces the apoptosis of fibroblast-like synoviocytes derived from rats with collagen-induced arthritis by suppressing the activation of the JAK/STAT signaling pathway[J].Int J Mol Med, 2017,39(2):307-316.
[9]Kotake S, Yago T, Kobashigawa T,etal. The plasticity of Th17 cells in the pathogenesis of rheumatoid arthritis [J]. J Clin Med,2017, 6(7): 3390-3402.
[10]Vogelzang A, McGuire HM, Yu D,etal. A fundamental role for interleukin-21 in the generation of T follicular helper cells[J]. Immunity, 2008, 29(1):127-137.
[11]Sawaf M, Dumortier H, Monneaux F. Follicular Helper T Cells in Systemic Lupus Eryth-ematosus: Why should they be considered as interesting therapeutic targets[J]? J Immunol Res, 2016,10(22):5767106.
[12]Jin L, Yu D, Li X,etal. CD4+CXCR5+follicular helper T cells in salivary gland promote B cells maturation in patients with primary Sjogren's syndrome[J]. Int J Clin Exp Pathol, 2014,7(5):1988-1996.
[13]Simpson N, Gatenby PA, Wilson A,etal. Expansion of circulating T cells resembling follicular helper T cells is a fixed phenotype that identifies a subset of severe systemic lupus erythematosus[J]. Arthritis Rheum,2010,62(1):234-244.
[14]Nurieva RI, Chung Y, Martinez GJ,etal. Bcl-6 mediates the development of T follicular helper cells[J].Science, 2009,325(5943):1001-1015.
[15]Johnston RJ, Poholek AC, DiToro D,etal. Bcl-6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation[J].Science,2009,325(5943):1006-1010.
[16]Rasmussen TK. Follicular T helper cells and IL-21 in rheumatic diseases[J].Dan Med J, 2016,63(10): 5297-5310.
[17]Karnell JL, Ettinger R. The interplay of IL-21 and BAFF in the formation and maintenance of human B cell memory[J]. Front Immunol, 2012,24(3): 3389-3397.
[18]Shekhar S, Yang X. The darker side of follicular helper T cells: from autoimmunity to immunodeficiency[J]. Cell Mol Immunol, 2012,9(5):380-385.
