中国小麦品种抗赤霉病基因Fhb1的鉴定与溯源
2018-04-10朱展望徐登安程顺和高春保夏先春郝元峰何中虎
朱展望 徐登安 程顺和 高春保 夏先春 郝元峰,*何中虎,4
1 中国农业科学院作物科学研究所, 北京100081; 2 湖北省农业科学院粮食作物研究所, 湖北武汉430064; 3 江苏里下河地区农业科学研究所, 江苏扬州225007; 4 国际玉米小麦改良中心(CIMMYT)中国办事处, 北京100081
由禾谷镰刀菌等引起的小麦赤霉病(Fusariumhead blight, FHB)是一种广泛流行的真菌病害, 严重影响小麦产量和品质[1-2]。我国长江中下游和东北麦区一直是其常发和重发区域[3]。近年来, 受气候变化、小麦–玉米轮作制度下秸秆还田等影响, 赤霉病已成为黄淮麦区的常发病害。目前我国小麦赤霉病年均发生面积超过533.3万公顷[4], 其中2012、2015和2016年尤为严重。江苏省2012—2015年均发生面积约 120万公顷, 超过该省小麦种植面积的50%[5]; 河南省 2012年发生最为严重, 发病面积达339.7万公顷, 2016年次之, 为174.0万公顷[6]。感病籽粒含真菌毒素如脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON), 不仅危害人畜健康, 还严重影响食用和饲用价值[7]。
培育抗病品种是降低赤霉病危害的经济有效手段。国内外对赤霉病抗性遗传进行了大量研究,已定位约100个抗赤霉病QTL, 分布在小麦所有染色体[8], 其中抗病基因Fhb1~Fhb7已被正式命名[9-16],以位于3B染色体短臂的Fhb1抗性最强, 且稳定[8,17-18]。虽然在不同遗传背景下,Fhb1的效应有一定差异,但高病害压力下仍可平均降低赤霉病严重度 20%左右[18]。该基因还可将DON转化为低毒的脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(DON-3G), 减轻毒素危害[19]。
Fhb1在赤霉病重发的北美春麦区已得到较为广泛应用, 如美国北达科他州立大学利用苏麦 3号育成抗赤霉病硬红春小麦品种 Alsen, 年推广面积为95万公顷, 占该州小麦种植面积的1/3左右, 标记检测其携带Fhb1[20]; 明尼苏达大学利用Fhb1分子标记辅助育成了抗赤霉病品种 Sabin[21], 且新近育成的多数品种(系)含此基因[22]。日本品种Nobeokabouzu Komugi、Nyubai、Shinchunaga 等也含有Fhb1, 其中 Shinchunaga作为赤霉病抗源在日本得到广泛应用[9,23-24]。国际玉米小麦改良中心(CIMMYT)小麦育种中很少利用Fhb1, 原因是抗秆锈病基因Sr2与Fhb1相斥相紧密连锁, 且Sr2在育种中必不可少, 但近期利用分子标记已育成同时含Sr2和Fhb1的重组材料[25], 这将极大推动Fhb1在CIMMYT小麦育种中的应用。
我国利用苏麦 3号在长江中下游麦区育成了宁7840和鄂恩1号, 在黄淮麦区育成了郑麦9023和西农979等品种[26],但由于缺少诊断性标记, 即基因特异性标记, 除宁7840外, 其他品种是否含Fhb1尚不明确。最近, Rawat等[24]克隆了该基因, 并发现该基因为PFT(pore-forming toxin-like)类型, 全长 3472 bp, 含2个外显子, 1个内含子, 编码嵌合凝集素蛋白。本研究对229份小麦品种(系)的PFT基因测序,并对部分品种PFT邻近基因HC(HCBT-like defense response protein)和His(histidine-rich calciumbinding protein)进行研究, 开发了Fhb1基因区段的诊断性标记, 进一步利用该标记对73份扬麦和宁麦品种(系)检测, 结合系谱信息对我国小麦所含Fhb1溯源。
1 材料与方法
1.1 材料
用于赤霉病抗性鉴定和PFT基因测序的国内外小麦品种(系)共229份, 其中, 国内品种218份, 来自13个省市, 包括江苏34份、湖北17份、安徽3份、四川16份、河南63份、山东26份、陕西21份、河北12份、山西6份、甘肃8份、宁夏5份、北京6份、天津1份, 国外品种11份, 来自CIMMYT (附表1)。这些品种(系)由湖北省农业科学院粮食作物研究所提供。
西风(日本品种, 又名农林129)、扬麦6号及73份扬麦和宁麦品种(系)用于标记检测和Fhb1溯源(附表2), 由江苏里下河地区农业科学研究所提供。用于追溯西风Fhb1来源的农林61、农林95、农林105、农林117等由国家作物种质库提供(http://www.cgris.net/)。
1.2 赤霉病田间接种鉴定
于2014—2016连续3年在湖北省农业科学院南湖试验田进行赤霉病接种鉴定, 病原菌菌株为黄冈1号, 由农作物重大病虫草害防控湖北省重点实验室保存。试验采用完全随机区组设计, 2行区, 行长1 m, 行距0.25 m, 2次重复。标记10个正在开花且形态基本一致的穗子, 对其喷施病菌分生孢子悬浮液(5×105mL–1); 从抽穗期到调查结束, 用微电脑定时弥雾装置增湿, 促进发病[27-28]。接种后20 d调查发病穗数、每穗小穗数和病小穗数。病情指数 = 发病率 × 严重度[29], 其中发病率为发病穗数与总穗数的比值, 严重度为每穗病小穗数与小穗数比值的平均值, 均以百分率计。
采用QTL IciMapping V 4.1软件[30]估计229份小麦品种(系)赤霉病病情指数的方差和广义遗传力, 用SAS 9.2软件比较不同单倍型品种赤霉病病情指数。
1.3 PFT、HC和His的等位基因鉴定
1.3.1引物设计利用苏麦 3号Fhb1区段(GenBank登录号为 KX907434)内PFT、HC和His的编码区序列, 在EnsemblPlants数据库(http://plants.ensembl.org/)比对, 获取各基因同源序列, 设计各基因3B染色体特异引物(表1), 并经中国春缺体–四体系验证。由华大基因(北京)合成引物。
1.3.2DNA提取和PCR扩增采用CTAB法[31]从幼叶中提取基因组DNA。PCR体系30 μL, 含2×KOD buffer 15 μL, DNA 模板(50 ng μL–1) 3 μL, 上下游引物(10 μmol L–1)各 1.8 μL, dNTPs (2.5 mmol L–1)6 μL, KOD FX (TOYOBO)高保真性酶 0.6 μL, ddH2O 1.8 μL。扩增程序为 94°C预变性 3 min; 98°C变性10 s, 相应温度下退火30 s, 68°C延伸2 min 30 s, 共35个循环; 最后68°C延伸7 min, 4°C保存。

表1 用于扩增PFT、HC和His基因开放阅读框的特异引物Table 1 Specific primers used to amplify the open reading frames (ORF) of PFT, His, and HC
1.3.3扩增产物检测与回收测序用 1.5%琼脂糖凝胶电泳检测 PCR产物, 溴化乙锭(ethidium bromide, EB)染色, 紫外光下成像。凝胶回收 DNA,连接载体后转化大肠杆菌感受态细胞并培养, 从每个连接转化反应挑取12个单克隆, 扩大培养后由华大基因(北京)测序, 或将目标 DNA片段回收直接测序。采用Geneious 10.0.7软件(http://www.geneious.com/)进行序列分析。
1.4 PFT和His基因标记开发
用引物PFT-1F和PFT-2R (表1)对PFT基因第1外显子和内含子区段进行扩增, PCR体系20 μL, 含2× PCR Mix (0.1 U μL–1Taq酶、500 μmol L–1dNTPs、20 mmol L–1Tri-HCl、10 mmol L–1KCl、3 mmol L–1MgCl2) 10 μL, DNA 模板(50 ng μL–1) 2 μL, 上下游引物(10 μmol L–1)各 0.5 μL, ddH2O 7 μL。扩增程序为95°C预变性3 min; 94°C变性30 s, 65°C退火30 s,68°C延伸2 min 30 s, 共33个循环; 最后68°C延伸7 min, 4°C保存。用1.5%琼脂糖凝胶电泳检测PCR产物, 有扩增产物的用限制性核酸内切酶DraI (识别序列为 5′-TTT/AAA-3′) 37°C 下过夜酶切。酶切反应体系 15 μL, 含 PCR 产物 3 μL, 10× buffer 1.5 μL,DraI 0.8 μL, ddH2O 9.7 μL。用 1.5%琼脂糖凝胶电泳检测反应产物。该 CAPS (cleaved amplified polymorphic sequences)标记可用于检测PFT基因, 记为PFT-CAPS。
用引物His3B-4 (表1)对His基因进行扩增, PCR体系同PFT-CAPS标记。扩增程序为95°C预变性3 min; 94°C变性 30 s, 65°C退火 30 s, 68°C 延伸 2 min 30 s, 共35个循环; 最后68°C延伸7 min, 4°C保存。用1.5%琼脂糖凝胶电泳检测PCR产物。该标记记为His-InDel。
2 结果与分析
2.1 表型数据方差分析
赤霉病病情指数在基因型间、年份间以及基因型与年份互作间均呈显著差异(表2), 其广义遗传力为 0.76, 说明本试验中赤霉病抗性主要受基因型控制, 环境对其也有一定影响。

表2 229份小麦品种(系)赤霉病病情指数方差分析Table 2 Analysis of variance (ANOVA) of Fusarium head blight index in 229 wheat cultivars
2.2 PFT的等位基因与特异性标记
用引物PFT-1、PFT-2和PFT-3在229份品种(系)中扩增和测序, 共发现 3种等位基因, 分别记为PFT-I(苏麦 3号类型)、PFT-II(南大 2419类型)和PFT-III(基因缺失类型)。PFT-I和PFT-II的开放阅读框之间有14个核苷酸差异(图1), 其中12个位于内含子区, 位于第 2128位的 G/A突变可能导致mRNA错误剪接, 使基因丧失功能[24]; 2个SNP位于第2外显子区, 均属同义突变。
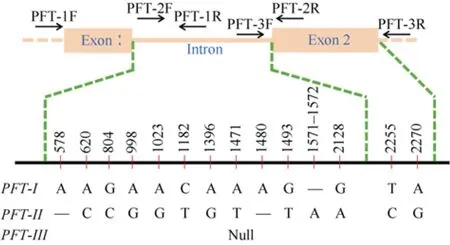
图1 PFT基因的结构、引物结合位点及其3种等位基因Fig. 1 Structure, primer binding sites and three alleles of PFT gene
为开发PFT基因的特异性标记, 用 PFT-1F和PFT-2R对PFT基因部分区段扩增, 含PFT-I和PFT-II的品种(系)分别得到2277 bp和2276 bp片段。DraI内切酶可在第 1471和第 1472位碱基之间将PFT-II扩增产物切割为1567 bp和709 bp两个片段,而PFT-I扩增产物不被酶切(图 2), 从而可将PFT-I和PFT-II区分。
综合测序和PFT-CAPS标记检测结果表明, 在229份品种(系)中有 24份与苏麦 3号序列相同, 为PFT-I基因型(表3), 35份为PFT-II基因型, 其余170份为PFT-III基因型(附表 1)。西农 9871和小偃 22等高感赤霉病品种也为PFT-I基因型(表 3和图 2),表明单独PFT-CAPS不能作为Fhb1的诊断性标记。为此, 以含PFT-I的 24份品种(系)为材料, 对PFT相邻基因HC和His测序, 以期找到可将西农9871等感病品种与苏麦3号区分的标记。
2.3 HC和His的等位基因及Fhb1诊断性标记
利用HC3B-3对24份材料所含HC基因扩增测序, 发现除烟2415为HC-II类型外, 其他均为HC-I类型(表3和图3), 表明HC位点不能将西农9871等感病品种与苏麦3号区分。

图2 PFT-CAPS标记在部分国内品种中的扩增结果Fig. 2 Amplification profiles of marker PFT-CAPS in partial Chinese cultivars M: DL5000 DNA marker; 1~4; PFT-I型品种, 依次是苏麦3号、宁麦9号、西农9871和小偃22; 5~8: PFT-II型品种, 依次是郑麦366、鲁麦21、衡观35和宁春4号。扩增产物用限制性核酸内切酶Dra I酶切。M: DL5000 DNA marker; 1–4: PFT-I cultivars, namely Sumai 3, Ningmai 9, Xinong 9871, and Xiaoyan 22; 5–8: PFT-II cultivars, namely Zhengmai 366, Lumai 21, Hengguan 35, and Ningchun 4. PCR products were digested with Dra I restriction endonuclease.

图3 PFT-I类型品种所含HC及His基因的结构、引物结合位点及其等位基因Fig. 3 Structure, primer binding sites, and alleles of HC and His genes for the cultivars with PFT-I
利用His3B-4对上述材料的His基因测序, 发现3种等位基因, 分别记为His-I(1309 bp)、His-II(2061 bp)和His-III(2061 bp), 其中His-I起始密码子附近有752 bp整段缺失,His-III较His-II有4个SNP变异(图3)。苏麦3号和宁7840等6个品种为His-I型, 西农9871和小偃22等17个品种(系)为His-II型,烟2415为His-III型(表3)。His位点能区分苏麦3号和西农9871等感病品种, 可用于诊断性标记开发。
引物His3B-4为His-InDel标记, 其检测结果表明, 苏麦 3号等明确含有Fhb1的品种扩增片段为1309 bp; 含PFT-I但推测不含Fhb1的品种, 如西农9871、小偃22和郑麦9023等, 其扩增片段为2061 bp;不含PFT-I的205个品种, 如扬麦158、济麦22和矮抗58等, 其扩增片段大小与西农9871的相近, 为2000 bp左右, 与苏麦3号等含Fhb1的品种差异明显(图4), 其His基因序列有待研究。综合赤霉病抗性资料及系谱信息,PFT-CAPS和His-InDel相结合可作为Fhb1的诊断性标记,PFT-I/His-I为抗病单倍型。

表3 PFT-I类型品种(系)所含His及HC的等位基因及其赤霉病病情指数Table 3 Alleles of His and HC genes for the cultivars with PFT-I and their FHB indexes
2.4 PFT与His基因单倍型抗性
将PFT-I记为 PFT(+), 其他等位基因记为PFT(-); 将His-I记为 His(+), 其他等位基因记为His(-)。在 229份品种(系)中, 有 6份为含Fhb1的PFT(+)/His(+)类型, 其平均病情指数为29.9; 18份为PFT(+)/His(-)类型, 其平均病情指数为 61.8, 与前者差异极显著(P< 0.001); 有205份为PFT(-)/His(-)类型, 其平均病情指数为 60.2, 与 PFT(+)/His(-)差异不显著(P= 0.73); 未发现PFT(-)/His(+)类型品种(图 5)。
2.5 我国小麦品种(系) Fhb1鉴定及溯源
利用PFT-CAPS和His-InDel标记对73份扬麦和宁麦品种(系)检测, 发现 20份含Fhb1, 包括扬麦18和扬麦21等17份扬麦品种(系)、宁麦14、宁麦18和宁麦26 (附表2)。加上此前发现的6份含Fhb1的品种, 系谱分析表明, 除苏麦3号和宁7840 (阿芙乐尔/安徽11//苏麦3号)外, 其余24份材料均有宁麦9号(扬麦 6号/西风)血缘, 推测其Fhb1来自宁麦 9号(图6和附表3)。
对宁麦9号双亲扬麦6号和西风的PFT、HC和His基因测序表明, 西风的上述基因序列与宁麦9号及苏麦3号完全一致, 而与扬麦6号有较大差异(结果未列出), 表明宁麦9号Fhb1来自西风。进一步检测发现, 西风的双亲农林 117和农林 105及其祖父母本(农林95和农林61)均含Fhb1, 推测来自日本小麦品种 Shinchunaga[24], 并追溯到日本地方品种(图6)。这说明宁麦9号Fhb1的确来自日本。

图4 His-InDel标记对国内部分品种的扩增结果Fig. 4 Amplification profiles of marker His-InDel in partial Chinese cultivarsM: DL5000 DNA marker; 1~4: His-I型品种, 依次是苏麦3号、宁7840、宁麦9号和宁麦13; 5~11: 非His-I型品种, 依次是西农9871、小偃22、郑麦9023、烟2415、扬麦158、济麦22和矮抗58。M: DL5000 DNA marker; 1–4: His-I cultivars, namely Sumai 3, Ning 7840, Ningmai 9, and Ningmai 13; 5–11: non His-I cultivars, namely Xinong 9871, Xiaoyan 22, Zhengmai 9023, Yan 2415, Yangmai 158, Jimai 22, and Aikang 58.

图5 不同PFT/His单倍型品种的赤霉病病情指数Fig. 5 Average FHB indexes of cultivars or lines with differentPFT/His haplotypes误差线上不同字母表示相应不同单倍型的病情指数差异显著(P < 0.05)。Different letters above error bars indicate significant FHB indexes among haplotypes at P < 0.05.
3 讨论
分子标记辅助选择(marker-assisted selection,MAS)在育种中成功应用需具备3个条件, 即标记选择较表型选择有优势、具诊断性标记(基因特异性标记)和实用性(低成本、高通量)[32]。黄淮麦区不具备赤霉病表型鉴定的理想环境, MAS是培育抗赤霉病品种的首选技术。Fhb1已被证明是抗性最强且稳定的抗赤霉病基因, 目前利用标记辅助选择Fhb1的限制因素是缺乏低成本的诊断性标记, 虽其连锁标记Xgwm493、Xgwm533、UMN10和Xsnp3BS-8等在育种中有一定应用[33-35], 但均受遗传背景影响较大[36]。Rawat等[24]证明Fhb1为PFT基因, 本研究发现, 以西农9871和小偃22为代表的部分陕西品种含该基因, 但高感赤霉病, 故PFT基因标记不能作为Fhb1的诊断性标记。对PFT邻近基因HC和His测序, 发现His位点的多态性可有效区分上述材料, 进而开发出Fhb1诊断性标记His-InDel, 该标记扩增稳定、片段差异大、用琼脂糖凝胶电泳即可检测, 成本较低, 是理想的育种标记。由于PFT和His基因紧密连锁, 且未见 His(+)/PFT(-)类型品种, 在标记辅助选择Fhb1时仅使用His-InDel即可取得满意效果,在亲本和高代品系鉴定时可使用PFT-CAPS和His-InDel标记组合。
Fhb1对赤霉病的抗性主要表现为抗扩展, 通常利用单花滴注法接种鉴定。由于效应较大, 在田间喷雾接种条件下也可鉴定出该基因, 如 Buerstmayr等[37]用此方法在苏麦3号衍生系 CM82036中定位到Fhb1, 解释表型变异29%; Chen等[38]用单花滴注和喷雾接种法在 W14 (太谷核不育轮回选择育成, 抗源包括苏麦3号、望水白、宁7840、Shinchunaga等)中均定位到Fhb1, 其中单花滴注法接种条件下其效应更大。本研究采用喷雾法接种, 用病情指数作指标分析Fhb1单倍型抗性, 与田间抗性较吻合, 如用单花滴注法接种, 抗感单倍型间赤霉病病情指数差异预计会更大。
标记检测结合系谱信息表明, 我国小麦品种(系)所含Fhb1至少有两类来源。一类来自苏麦3号, 可追溯到台湾小麦(地方品种); 长江流域含苏麦3号血缘的品种有宁7840、湘麦10号(友谊麦/苏麦3号)、湘麦11 (苏麦3号/独秆1042)和鄂恩1号(洛夫林10号/761//苏麦3号)等, 其中宁7840含Fhb1[24]; 湘麦10号和湘麦11是否含Fhb1, 有待检测; 大面积推广的鄂恩1号经检测不含Fhb1。另一类来自宁麦9号,由其传递到部分宁麦、扬麦和镇麦品种中; 经检测宁麦9号Fhb1来自日本小麦西风, 西风由日本九州农业试验场于1983年育成, 较抗赤霉病[39], 其母本农林117中抗赤霉病[40], 父本农林105抗性未知, 两者均有 Shinchunaga血缘, 含Fhb1[24], 抗源可追溯到地方品种。据Yu等聚类分析, Shinchunaga与中国地方品种聚为一类, 而非日本地方品种[41], 推测其与中国种质相关; 西风在我国表现早熟、抗纹枯病、农艺性状优良, 赤霉病抗性与扬麦158相当, 江苏省农业科学院利用西风选育出宁麦 9号[42]。与苏麦 3号相比, 宁麦9号及其衍生品种如宁麦18、宁麦26、扬麦18、扬麦21、镇麦5号等的综合农艺性状已大幅提升[43], 故建议在育种中扩大使用; 新选育的一批扬麦高代品系已固定Fhb1基因, 对赤霉病遗传改良具有重要意义, 也应多加利用。鉴于很多国内地方品种如望水白、白三月黄[44]、黄方柱[45]、翻山小麦等含Fhb1, 且与日本抗赤霉病地方品种相比具有更高的遗传多样性[41]。故推测Fhb1均来自地方品种,可能由中国江苏、浙江或福建等地传到中国台湾、韩国及日本, 并在这些地区的抗赤霉病育种中发挥了重要作用。

图6 Fhb1在73份扬麦和宁麦品种(系)中的传递路径Fig. 6 Gene flow of Fhb1 in 73 cultivars (lines) of Yangmai and Ningmai through founder parent Ningmai 9实线框内品种(系)经PFT-CAPS和His-InDel标记检测含Fhb1, 虚线框内品种未检测。Cultivars or lines in solid boxes were characterized carrying Fhb1 using PFT-CAPS and His-InDel markers, while those in dotted boxes were uncharacterized.
Fhb1在美国、日本等春麦区和我国江苏省等春性麦区均得到成功应用, 而在冬麦区进展相对缓慢,可能与对株高等农艺性状选择有关, 也可能是抗赤霉病育种的时间较短所致。20世纪70年代, 西北农林科技大学率先在黄淮冬麦区利用苏麦 3号进行抗赤霉病育种, 创制出一批抗病中间材料, 为后来黄淮麦区选育具有一定赤霉病抗性的品种奠定了基础。但本研究发现较多陕西来源品种虽含PFT抗病等位基因(PFT-I),His基因却为感病类型(His-II), 即不含Fhb1, 这可能与育种家对农艺性状的选择有关,即该区段的His-I或相邻基因可能与不利农艺性状连锁(至少对黄淮麦区而言);PFT-I可能来自苏麦 3号(PFT和His间发生重组)或小偃6号某一早代亲本;在赤霉病筛选压力较小情况下, 育种家首先考虑农艺性状, 导致没能选择Fhb1区段抗病的单倍型。在美国东部软红冬麦区, 育种家利用分子标记选择来自苏麦3号或宁7840的Fhb1, 含有该片段的品系由于农艺性状差、产量低, 能通过审定的品种不多(Carl Griffey, 个人交流, 2015; Jerry Johnson, 个人交流, 2015)。因此, 明确Fhb1区段与不利农艺性状连锁的基因, 对更好利用Fhb1具有重要意义, 对我国黄淮冬麦区尤为重要。本研究发现PFT-I/His-I为Fhb1抗病类型, 但Fhb1区段遗传解析和抗性机制尚未完全清楚, 可能有多个基因参与赤霉病抗性。除该位点外, 苏麦 3号所含其他抗赤霉病位点也尚待解析, 这些位点有可能会部分解释陕西材料及其衍生系具有一定赤霉病抗性。
提高赤霉病抗性已成为黄淮麦区特别是黄淮南片的主要育种目标。借鉴国内外成功的经验, 提出3点抗病育种建议: (1)在抗源利用上, 选择含Fhb1、农艺性状优良的抗病品种如扬麦 21、宁麦 26等作亲本, 但应注意此类抗源的冬春性和矮秆基因与黄淮麦区品种有一定差异, 周口市农业科学院利用宁麦 9号育成的材料其抗病性和农艺性状都有明显改良(殷贵鸿, 个人交流, 2017), 值得在育种中利用。(2)在育种方法上, 以高产广适品种为农艺亲本, 采用回交 1~2次、扩大群体的方法, 结合本研究开发的标记检测和赤霉病接种鉴定进行选择, 并适当降低农艺性状选择标准, 培育赤霉病抗性达到中感或中抗、农艺性状优良的新品种。(3)从长远来看, 可借鉴小麦抗锈病和白粉病育种的成功经验, 利用分子标记聚合多个微效基因, 以提高品种的整体抗性水平[46]。
4 结论
26份国内品种(系)具有PFT-I/His-I抗赤霉病单倍型, 含Fhb1, 可作为育种有效抗源。我国小麦所含Fhb1主要来自苏麦3号和宁麦9号(扬麦6号/西风), 并以后者为主。以PFT-CAPS和His-InDel可准确检测Fhb1, 将在抗赤霉病育种中发挥重要作用。
致谢感谢美国堪萨斯州立大学Guihua Bai教授和Zhenqi Su博士审阅全文, 并提供His基因为Fhb1新的候选基因这一信息。
[1] Dexter J E, Clear R M, Preston K R. Fusarium head blight: effect on the milling and baking of some Canadian wheats.Cereal Chem, 1996, 73: 695–701
[2] Dexter J E, Marchylo B A, Clear R M, Clarke J M. Effect of Fusarium head blight on semolina milling and pasta-making quality of durum wheat.Cereal Chem, 1997, 74: 519–525
[3]程顺和, 郭文善, 王龙俊, 姜东, 马鸿翔, 张伯桥. 中国南方小麦. 南京: 江苏科学技术出版社, 2012. pp 281–282 Cheng S H, Guo W S, Wang L J, Jiang D, Ma H X, Zhang B Q.Wheat in Southern China. Nanjing: Jiangsu Scientific and Technical Publishers, 2012. pp 281–282 (in Chinese)
[4]马忠华, 尹燕妮, 陈云. 小麦赤霉病发生规律及其防控技术研究进展. 见: 陈万权主编. 植保科技创新与农业精准扶贫—中国植物保护学会 2016年学术年会论文集. 北京: 中国农业科学技术出版社, 2016. p 29 Ma Z H, Yin Y N, Chen Y. The epidemic characteristics of wheatFusariumhead blight and the progress of its control technology development. In: Chen W Q, ed. Plant Protection Technology Innovation and Agricultural Targeted Poverty Alleviation—Proceedings of the 2016 Annual Conference of China Plant Protection Society. Beijing: China Agricultural Science and Technology Press, 2016. p 29 (in Chinese)
[5]吴佳文, 杨荣明, 朱凤, 田子华. 2015年江苏省小麦赤霉病发生特点与防控对策探讨. 中国植保导刊, 2016, 36(10): 31–34 Wu J W, Yang R M, Zhu F, Tian Z H. The epidemic characteristics of wheatFusariumhead blight in Jiangsu Province in 2015 and discussion of its control measures.China Plant Prot, 2016,36(10): 31–34 (in Chinese)
[6]金艳, 刘付领, 朱统泉, 陈杰, 赵立尚. 河南省小麦赤霉病的发生情况分析与防治对策. 河南科技学院学报(自然科学版),2016, 44(6): 1–4 Jin Y, Liu F L, Zhu T Q, Chen J, Zhao L S. Occurrence analysis and control measures of wheat scab in Henan province.J Henan Inst Sci & Technol(Nat Sci Edn), 2016, 44(6): 1–4 (in Chinese with English abstract)
[7] McMullen M, Jones R, Gallenberg D. Scab of wheat and barley:a re-emerging disease of devastating impact.Plant Dis, 1997, 81:1340–1348
[8] Buerstmayr H, Ban T, Anderson J A. QTL mapping and marker-assisted selection forFusariumhead blight resistance in wheat:a review.Plant Breed, 2009, 128: 1–26
[9] Cuthbert P A, Somers D J, Thomas J, Cloutier S, Brulé-Babel A.Fine mappingFhb1, a major gene controllingFusariumhead blight resistance in bread wheat (Triticum aestivumL.).Theor Appl Genet, 2006, 112: 1465–1472
[10] Cuthbert P A, Somers D J, Brulé-Babel A. Mapping ofFhb2on chromosome 6BS: a gene controllingFusariumhead blight field resistance in bread wheat (Triticum aestivumL.).Theor Appl Genet, 2007, 114: 429–437
[11] Liu S, Zhang X, Pumphrey M O, Stack R W, Gill B S, Anderson J A. Complex microcolinearity among wheat, rice, and barley revealed by fine mapping of the genomic region harboring a major QTL for resistance toFusariumhead blight in wheat.Funct Integr Genomics, 2006, 6: 83–89
[12] Qi L, Pumphrey M, Friebe B, Chen P, Gill B. Molecular cytogenetic characterization of alien introgressions with geneFhb3for resistance toFusariumhead blight disease of wheat.Theor Appl Genet, 2008, 117: 1155–1166
[13] Xue S, Li G, Jia H, Xu F, Lin F, Tang M, Wang Y, An X, Xu H,Zhang L. Fine mappingFhb4, a major QTL conditioning resistance toFusariuminfection in bread wheat (Triticum aestivumL.).Theor Appl Genet, 2010, 121: 147–156
[14] Xue S, Xu F, Tang M, Zhou Y, Li G, An X, Lin F, Xu H, Jia H,Zhang L. Precise mappingFhb5, a major QTL conditioning resistance toFusariuminfection in bread wheat (Triticum aestivumL.).Theor Appl Genet, 2011, 123: 1055–1063
[15] Cainong J C, Bockus W W, Feng Y, Chen P, Qi L, Sehgal S K,Danilova T V, Koo D H, Friebe B, Gill B S. Chromosome engineering, mapping, and transferring of resistance toFusariumhead blight disease fromElymus tsukushiensisinto wheat.Theor Appl Genet, 2015, 128: 1019–1027
[16] Guo J, Zhang X, Hou Y, Cai J, Shen X, Zhou T, Xu H, Ohm H W,Wang H, Li A, Han F, Wang H, Kong L. High-density mapping of the major FHB resistance geneFhb7derived fromThinopyrum ponticumand its pyramiding withFhb1by marker-assisted selection.Theor Appl Genet, 2015, 128: 2301–2316
[17] Schweiger W, Steiner B, Vautrin S, Nussbaumer T, Siegwart G,Zamini M, Jungreithmeier F, Gratl V, Lemmens M, Mayer K F X,Bérgès H, Adam G, Buerstmayr H. Suppressed recombination and unique candidate genes in the divergent haplotype encodingFhb1,a majorFusariumhead blight resistance locus in wheat.Theor Appl Genet, 2016, 129: 1607–1623
[18] Pumphrey M O, Bernardo R, Anderson J A. Validating theFhb1QTL forFusariumhead blight resistance in near-isogenic wheat lines developed from breeding populations.Crop Sci, 2007, 47:200–206
[19] Horevaj P, Brown-Guedira G, Milus E A. Resistance in winter wheat lines to deoxynivalenol applied into florets at flowering stage and tolerance to phytotoxic effects on yield.Plant Pathol,2012, 61: 925–933
[20] Mergoum M, Frohberg R C, Stack R W. Breeding hard red spring wheat forFusariumhead blight resistance. In: Buck H T, Nisi J E,Salomón N, eds. Wheat Production in Stressed Environments:Proceedings of the 7th International Wheat Conference. Dordrecht, Netherlands: Springer, 2007. pp 161–167
[21] Anderson J A, Wiersma J J, Linkert G L, Kolmer J A, Jin Y,Dillmacky R, Wiersma J V, Hareland G A. Registration of ‘Sabin’Wheat.J Plant Reg, 2012, 6: 174
[22] Steiner B, Buerstmayr M, Michel S, Schweiger W, Lemmens M,Buerstmayr H. Breeding strategies and advances in line selection forFusariumhead blight resistance in wheat.Trop Plant Pathol,2017, 42: 165–174
[23] Bai G, Shaner G. Management and resistance in wheat and barley toFusariumhead blight.Annu Rev Phytopathol, 2004, 42:135–161
[24] Rawat N, Pumphrey M O, Liu S, Zhang X, Tiwari V K, Ando K,Trick H N, Bockus W W, Akhunov E, Anderson J A, Gill B S.WheatFhb1encodes a chimeric lectin with agglutinin domains and a pore-forming toxin-like domain conferring resistance toFusariumhead blight.Nat Genet, 2016, 48: 1576–1580
[25] He X, Bonnett D, Singh P K, Hyles J, Spielmeyer W, Dreisigacker S. Advanced wheat breeding lines combiningFhb1andSr2in different genetic backgrounds. In: Proceedings of the 9th International Wheat Conference. Sydney, Australia, 2015. p 140
[26]孙道杰, 张玲丽, 冯毅, 陈春环, 张荣琦, 奚亚军, 何心尧, 王辉, 宋哲民. 西农系列小麦骨干新品种赤霉病抗源浅析. 麦类作物学报, 2016, 36: 822–823 Sun D J, Zhang L L, Feng Y, Chen C H, Zhang R Q, Xi Y J, He X Y, Wang H, Song Z M. Analysis of FHB resistance sources for newly released Xinong varieties.J Triticeae Crops, 2016, 36:822–823 (in Chinese)
[27]朱展望, 朱伟伟, 佟汉文, 刘易科, 陈泠, 杨立军, 汪华, 张宇庆, 邹娟, 焦春海, 高春保. 湖北小麦品种赤霉病抗性及其在生产中的应用. 麦类作物学报, 2015, 35: 1733–1738 Zhu Z W, Zhu W W, Tong H W, Liu Y K, Chen L, Yang L J,Wang H, Zhang Y Q, Zou J, Jiao C H, Gao C B. Fusarium head bight resistance and application of wheat varieties in Hubei Province.J Triticeae Crops, 2015, 35: 1733–1738 (in Chinese with English abstract)
[28]朱展望, 杨立军, 佟汉文, 唐道廷, 刘易科, 汪华, 陈泠, 张宇庆, 高春保. 湖北省小麦品种(系)的赤霉病抗性分析. 麦类作物学报, 2014, 34: 137–142 Zhu Z W, Yang L J, Tong H W, Tang D T, Liu Y K, Wang H, Chen L, Zhang Y Q, Gao C B. Analysis of the resistance to Fusarium head blight in wheat varieties and lines from Hubei.J Triticeae Crops, 2014, 34: 137–142 (in Chinese with English abstract)
[29] Stack R W, McMullen M P. A visual scale to estimate severity of Fusarium head blight in Wheat. North Dakota State University Extension Service 1994. p 1095
[30] Wang J, Li H, Zhang L, Meng L. Users’ Manual of QTL IciMapping. The Quantitative Genetics Group, Institute of Crop Science,Chinese Academy of Agricultural Sciences (CAAS), and Genetic Resources Program, International Maize and Wheat Improvement Center (CIMMYT), 2016
[31] Saghai-Maroof M A, Soliman K M, Jorgensen R A, Allard R W.Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics.Proc Natl Acad Sci USA, 1984, 81: 8014–8018
[32] Anderson J A, Chao S, Liu S. Molecular breeding using a major QTL forFusariumhead blight resistance in wheat.Crop Sci,2007, 47: S112–S119
[33] Anderson J A, Stack R W, Liu S, Waldron B L, Fjeld A D, Coyne C, Moreno-Sevilla B, Fetch J M, Song Q J, Cregan P B, Frohberg R C. DNA markers forFusariumhead blight resistance QTLs in two wheat populations.Theor Appl Genet, 2001, 102: 1164–1168
[34] Liu S, Pumphrey M O, Gill B S, Trick H N, Zhang J X, Dolezel J,Chalhoub B, Anderson J A. Toward positional cloning ofFhb1, a major QTL forFusariumhead blight resistance in wheat.Cereal Res Commun, 2008, 36: 195–201
[35] Jin F, Zhang D, Bockus W, Baenziger P S, Carver B, Bai G.Fusariumhead blight resistance in U.S. Winter wheat cultivars and elite breeding lines.Crop Sci, 2012, 53: 2006–2013
[36] Bernardo A N, Ma H, Zhang D, Bai G. Single nucleotide polymorphism in wheat chromosome region harboringFhb1forFusariumhead blight resistance.Mol Breed, 2012, 29: 477–488
[37] Buerstmayr H, Steiner B, Hartl L, Griesser M, Angerer N,Lengauer D, Miedaner T, Schneider B, Lemmens M. Molecular mapping of QTLs forFusariumhead blight resistance in spring wheat: II. Resistance to fungal penetration and spread.Theor Appl Genet, 2003, 107: 503–508
[38] Chen J, Griffey C A, Saghai Maroof M A, Stromberg E L,Biyashev R M, Zhao W, Chappell M R, Pridgen T H, Dong Y,Zeng Z. Validation of two major quantitative trait loci for fusarium head blight resistance in Chinese wheat line W14.Plant Breed, 2006, 125: 99–101
[39]金善宝. 中国小麦品种志(1983–1993). 北京: 中国农业出版社, 1997. pp 249–250 Jin S B. Chinese Wheat Varieties (1983–1993). Beijing: China Agriculture Press, 1997. pp 249–250 (in Chinese)
[40] Li T, Bai G, Wu S, Gu S. Quantitative trait loci for resistance toFusariumhead blight in the Chinese wheat landrace Huangfangzhu.Euphytica, 2012, 185: 93–102
[41] Yu J B, Bai G H, Cai S B, Ban T. Marker-assisted characterization of Asian wheat lines for resistance toFusariumhead blight.Theor Appl Genet, 2006, 113: 308–320
[42]杨学明, 姚金保, 钱存鸣, 周朝飞, 姚国才, 黄胜东. 宁麦9号选育方法的探讨. 麦类作物学报, 2000, 20: 88–90 Yang X M, Yao J B, Qian C M, Zhou C F, Yao G C, Huang S D.Discussion on the breeding method of Ningmai 9.J Triticeae Crops, 2000, 20: 88–90 (in Chinese)
[43]姚金保, 马鸿翔, 张平平, 姚国才, 杨学明, 任丽娟, 张鹏, 周淼平. 小麦优良亲本宁麦9号的研究与利用. 核农学报, 2012,26: 17–21 Yao J B, Ma H X, Zhang P P, Yao G C, Yang X M, Ren L J,Zhang P, Zhou M P. Research of wheat elite parent Ningmai 9 and its utilization.J Nucl Agric Sci, 2012, 26: 17–21 (in Chinese with English abstract)
[44] Zhang X, Pan H, Bai G. Quantitative trait loci responsible forFusariumhead blight resistance in Chinese landrace Baishanyuehuang.Theor Appl Genet, 2012, 125: 495–502
[45] Li T, Bai G, Wu S, Gu S. Quantitative trait loci for resistance to Fusarium head blight in the Chinese wheat landrace Huangfangzhu.Euphytica, 2012, 185: 93–102
[46]何中虎, 兰彩霞, 陈新民, 邹裕春, 庄巧生, 夏先春. 小麦条锈病和白粉病成株期抗性研究进展与展望. 中国农业科学,2011, 44: 2193–2215 He Z H, Lan C X, Chen X M, Zou Y C, Zhuang Q S, Xia X C.Progress and perspective in research of adult-plant resistance in stripe rust and powdery mildew in wheat.Sci Agric Sin, 2011, 44:2193–2215 (in Chinese with English abstract)
