干湿交替灌溉对水稻花后同化物转运和籽粒灌浆的影响
2018-04-10徐云姬许阳东李银银钱希旸王志琴杨建昌
徐云姬 许阳东 李银银 钱希旸 王志琴 杨建昌,*
1 扬州大学江苏省作物遗传生理重点实验室 / 粮食作物现代产业技术协同创新中心, 江苏扬州 225009; 2 扬州大学教育部农业与农产品安全国际合作联合实验室, 江苏扬州 225009
水稻籽粒充实的优劣和粒重的高低与颖花在穗上着生的位置密切相关。一般着生在稻穗中上部早开花的强势粒灌浆快、充实好、粒重高; 着生在稻穗下部迟开花的弱势粒灌浆慢、充实差、粒重低[1-2]。通过遗传改良和栽培途径促进弱势粒灌浆是提高产量的重要途径, 也一直受到研究者们的关注[3-8]。水稻干湿交替灌溉(AWD)作为一种新的节水灌溉技术已经在中国、孟加拉国、印度、越南等国被采用[9-12]。该技术在水稻生育过程中保持土壤水层和自然落干相互交替, 可以显著减少灌溉用水, 提高灌溉水利用效率[11,13-15]。有学者提出, 与常规灌溉相比, AWD不仅可以保持甚至可以提高产量[16-18]。但也有报道称, AWD会减少产量[19-20]。目前, 关于AWD增加或减少产量的机制一直受到研究者们的关注[6,8,16,18-21]。徐芬芬等[21]观察到, 水稻土壤适度干旱后的复水可以增强灌浆前期籽粒的生理活性, 有利于灌浆和粒重提高。付景等[18]报道, 结实期轻度干-湿交替灌溉可以显著提高水稻灌浆期剑叶的净光合速率和膜质过氧化酶活性, 增强根系氧化力和根系激素等根部性状以及根冠比, 进而提高结实率和粒重。陈婷婷等[6,8]提出, 花后轻度干-湿交替灌溉和重度干-湿交替灌溉条件下, 水稻弱势粒中多种与灌浆相关的蛋白质表达或淀粉合成相关酶活性及其基因表达的差异是其灌浆速率和粒重增加或降低的重要原因。前人的研究大多集中于从水稻根系活力、叶片光合性能和籽粒内部活性 3个方面阐述AWD对籽粒灌浆速率和粒重的影响机制, 有关干湿交替灌溉对花后茎(含鞘)中非结构性碳水化合物(NSC)的再运转与分配影响的研究较少。
水稻花前储存于茎鞘中的NSC既是籽粒灌浆物质的重要来源, 也是启动灌浆的重要物质基础[22]。有研究报道, 水稻花前储存于茎鞘中的NSC对籽粒产量的贡献率可高达 40%[23-25]。但水稻 AWD是否或如何促进茎鞘中NSC向籽粒转运, 进而促进弱势粒灌浆?相关研究较少。本研究以 3个水稻品种为材料, 研究干湿交替灌溉对水稻产量及构成因素、强弱势粒灌浆动态、籽粒中酶活性变化、剑叶光合性能、茎鞘NSC运转及其淀粉水解酶活性变化, 并利用13C同位素示踪茎鞘物质运转动态, 以期从光合性能、茎鞘NSC转运、叶片标记13C运转、籽粒库活性等方面较为深入地揭示 AWD对水稻花后同化物转运和籽粒灌浆的影响机制, 为水稻节水灌溉提供理论依据。
1 材料与方法
1.1 供试品种与试验处理
于 2014—2015年在扬州大学江苏省作物遗传生理重点实验室试验农场进行试验。试验地前茬作物为小麦, 土壤为沙壤土, 耕作层含有机质2.02%、有效氮103.2 mg kg-1、速效磷24.5 mg kg-1、速效钾85.6 mg kg-1。供试品种2014年为扬两优6号(两系籼型杂交稻)和武运粳24(常规粳稻), 2015年为旱优8号(粳型三系杂交稻)。每年5月10日至11日播种,6月9日至10日移栽。株、行距为15 cm × 25 cm, 扬两优6号单本栽, 武运粳24和旱优8号双本栽。
自移栽后10 d, 设灌溉处理为: (1)常规灌溉(CI):保持浅水层(1~2 cm), 收获前1周断水。(2)轻干-湿交替灌溉(WMD): 移栽 10 d 后, 自浅水层(1~2 cm)自然落干到土壤水势达-15 kPa时再灌水至浅水层,如此循环。(3)重干-湿交替灌溉(WSD): 移栽 10 d 后,自浅水层(1~2 cm)自然落干到土壤水势达-30 kPa时再灌水至浅水层, 如此循环。裂区设计, 灌溉方式为主区, 品种为裂区(小区), 两小区面积为8 m × 5 m,重复 3次, 随机区组排列。在试验大田建有砂浆混凝土为基底的遥控自动式遮雨大棚, 全钢架屋顶结构, 周边高3.6 m, 顶部高5.5 m, 薄膜的材质为聚碳酸酯型聚氨酯(PCU), 雨时关, 雨停即开, 在严格控水的基础上尽量避免遮光和增温现象。各试验小区内安装土壤水分张力计(中国科学院南京土壤研究所生产)监测土壤深度 15~20 cm处水势。通过在灌溉管道上安装流量表(LXSG-50流量计, 上海水分仪表制造厂)记录灌水量。全生育期施纯氮240 kg hm-2,按基肥(移栽前1 d)∶分蘖肥(移栽后7 d)∶穗肥(叶龄余数2.0)=5∶2∶3施用。基施过磷酸钙(含P2O513.5%) 445 kg hm-2和氯化钾(含K2O 62.5%)150 kg hm-2。其余田间管理同当地常规高产栽培。
1.2 叶片水势测定
于水稻花后当WMD和WSD处理的土壤水势分别达到-15 kPa和-30 kPa时(即土壤落干期, 花后8 d和25 d, 分别用D1和D2表示)及其相应复水期(花后10 d和28 d, 分别用W1和W2表示),采用压力室法(Model 3000, 土壤水分仪器公司,Santa Barbara, CA, USA)测定中午(11:30—12:30)水稻剑叶水势, 各处理重复测定10张叶片。
1.3 籽粒灌浆动态测定
于抽穗开花期选择穗型大小基本一致的穗子每小区 200个并挂牌, 标记部分穗各颖花开花日期。自开花后6、12、18、24、30、36、45和50 d分别取各小区标记穗15个(籼稻扬两优6号取样到45 d)用于测定强、弱势粒增重动态。于土壤落干期(D1和D2)和复水期(W1和W2)分别取标记穗18个(各小区6个)剥取强、弱势粒, 置液氮冷冻10 min后放入-70℃冰箱保存用于蔗糖-淀粉代谢途径关键酶活性测定。强势粒为穗上第1、2天开花的颖花, 着生在穗顶部一次枝梗, 弱势粒为穗上最后 2 d开花的颖花, 着生在穗基部二次枝梗。用于测定籽粒灌浆动态的籽粒在105℃杀青30 min后, 置于70℃烘箱中烘至恒重, 剥去颖壳后称重, 测定籽粒增重动态并参照朱庆森等[26]方法用Richards方程[27]对籽粒灌浆过程进行拟合, 计算灌浆速率。

对方程(1)求导, 得到籽粒灌浆速率(G)。
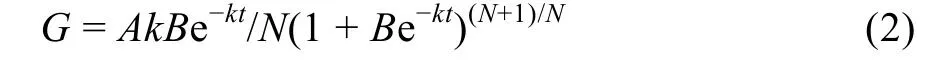
1.4 籽粒中蔗糖-淀粉代谢途径关键酶活性的测定
5~10粒去壳籽粒加 3~5 mL 100 mmol L-1Tricine-NaOH提取液[pH 8.0, 含有 10 mmol L-1MgCl2, 2 mmol L-1EDTA, 50 mmol L-12-mercaptoethanol, 12% (v/v) glycerol, 5% (w/v) PVP 40]于研钵中研磨(温度保持在0℃), 15 000 ×g离心10 min (4℃), 上清液(粗酶液)用于各酶活性测定。参照Yang等[28]方法测定蔗糖合酶(SuSase)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、淀粉合酶(StSase)和淀粉分支酶(SBE)的活性。
1.5 剑叶光合速率、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量测定
分别于上述土壤落干期(D1和D2)和复水期(W1和 W2), 使用美国LI-COR-6400便携式光合测定仪(Li-Cor 6400 portable photosynthesis measurement system, Li-Cor, Lincoln, NE, USA)测定水稻植株剑叶的光合速率。测定时间为上午 9:00—11:00, 使用红蓝光源, 光量子通量密度(PFD)为 1200 μmol m-2s-1, 叶室CO2浓度为380 μmol mol-1, 每个小区测定10张叶片。
分别于上述土壤落干期(D1和D2)和复水期(W1和W2), 取挂牌稻穗的剑叶于液氮冷冻10 min后放入-70℃冰箱保存待用。将冷藏的鲜样叶去除中部叶脉, 剪碎混匀后称取0.5 g, 加5 mL硫酸妥缓冲溶液(pH 7.8), 冰浴研磨至匀浆, 4℃离心20 min (12 000 r min-1), 上清液即为酶提取液。采用NBT光化还原法[29]测定SOD活性, 以抑制NBT光化还原50%的酶量为 1个酶活力单位; 采用硫代巴比妥酸法[30]测定MDA含量。为尽量减少叶片含水量差异的影响, 以干重计算SOD活性和MDA含量。
1.6 茎鞘非结构性碳水化合物(NSC)和淀粉水解酶(α-淀粉酶和 β-淀粉酶)活性测定
自抽穗期至成熟期每隔10 d分别在各小区内选择生长整齐一致水稻植株 5穴, 按叶、茎鞘和穗进行分解, 105℃下杀青 30 min后, 70℃烘干后称重,用蒽酮法[31-33]测定茎鞘干样淀粉和可溶性总糖含量。NSC为淀粉和可溶性总糖的总和。
茎鞘NSC的运转率(%) = (抽穗期茎鞘NSC-成熟期茎鞘NSC)/抽穗期茎鞘NSC×100
茎鞘NSC对籽粒产量的贡献率(%) = (抽穗期茎鞘NSC-成熟期茎鞘NSC)/籽粒产量×100
分别于上述土壤落干期(D1和D2)和复水期(W1和 W2), 取各处理植株茎鞘少许立即置液氮固定 10 min后保存, 用以测定 α-淀粉酶和 β-淀粉酶活性。参照 McCleary等[34-35]的方法并稍作改进测定 α-淀粉酶和 β-淀粉酶。参照 Bradford[36]的考马斯亮蓝G-250染色法测定蛋白质含量, 以牛血清蛋白(BSA)作为标准样品。酶活性单位记为 μmol mg-1protein h-1。
1.7 剑叶13CO2的饲喂和样品中13C的测定
于水稻孕穗期, 各小区分别选取长势一致的单茎30个挂牌标记, 将剑叶套上大小适中的聚乙烯薄膜塑料袋, 赶走空气后进行封闭, 并用医用注射器注入6 mL (粳稻, 叶片相对较小)或8 mL (籼稻, 叶片相对较大)的13CO2气体(购自于上海化工研究院有限公司, 由上海稳定性同位素工程技术研究中心研发,13CO2的纯度 > 99%)。选取的每张叶片自然光照下光合同化30 min后立即缓慢移除塑料袋, 饲喂时间为天气晴朗的上午 9:00—11:00。
于花后 0、10、30和40 d, 选取各处理标记单株15个(各小区5个), 分根系(20 cm×20 cm×20 cm挖出整穴土块, 放入网袋冲洗干净, 挑出所选单茎对应的根系部分)、叶片、茎鞘和穗(籽粒), 105℃杀青30 min, 70℃烘干至恒重。粉碎混匀后过100目筛,分别称取25.00 mg和3.00 mg过筛的样品, 分别利用 CHNS元素分析仪(CHNS elemental analyzer,Vario marco cube, Elementar, Germany)和 Isoprime公司的稳定同位素比例质谱仪(Isotope ratio mass spectrometer, Isoprime100, Elementar, Germany)测定总C含量和δ13C值, 计算同位素13C/12C比率(即R值)及13C含量。根据质谱仪使用手册,δ13C样品(‰) = (R样品/R标准-1)×1000。稳定同位素比例质谱仪中的国际标准物质为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Pee Dee Belemnite, 即 PDB,R标准=0.0112372, 定义其δ13C标准= 0‰), 通过计算, 下文以百分数表示标记13C在植株体内的积累与分配情况。
1.8 考种计产
取成熟期各处理 30穴植株, 考查每平方米穗数、每穗粒数、结实率和千粒重。实收各小区计产。
1.9 数据处理
采用Microsoft Excel 2003和SPSS 16.0统计软件分析试验数据, SigmaPlot 10.0作图。用最小显著差法(LSD0.05)检验平均数。
2 结果与分析
2.1 土壤与叶片水势
在水稻灌浆期, WMD处理下土壤水势达到-15 kPa需要4~6 d, WSD处理下土壤水势需要10~12 d才能达到-30 kPa (图1)。在同一灌溉处理下, 3个供试水稻品种的土壤水势变化基本一致(图1)。由图1可知, 花后8 d及25 d, WMD和WSD处理的土壤水势分别达到灌浆过程中两个不同程度干湿交替灌溉处理共同的土壤落干期-15 kPa和-30 kPa (D1和D2), 花后10 d和28 d为处理的复水期(W1和W2,图1中箭头所示)。

图1 干湿交替灌溉处理下水稻灌浆期土壤水势的变化Fig. 1 Changes in soil water potential under alternate wetting and drying irrigation (AWD) during grain filling of riceWMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉; D1和D2表示土壤落干期; 箭头指示复水期。WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying; D1 and D2 represent soil water potential at-15 kPa and -30 kPa, respectively, under WMD and WSD. Arrows indicate the re-watering period.
图2为中午水稻剑叶的水势情况。在土壤落干期(D1和D2), WMD和WSD处理下剑叶水势分别为-0.62~ -0.82 MPa和-0.91~ -1.27 MPa, 均显著低于CI处理(-0.40~ -0.64 MPa), 其中WSD处理降低的幅度更大。土壤复水期(W1和W2), WMD和WSD处理下的剑叶水势与对照CI无显著差异(图2)。
2.2 产量、产量构成因素以及灌溉水利用效率
与CI相比, WMD显著提高了扬两优6号、武运粳24和旱优8号的产量, 增加幅度分别为10.68%、10.96%和7.75% (表1)。WSD显著降低了3个水稻品种的籽粒产量(表1)。从产量构成因素分析, WMD和 WSD均显著降低了供试水稻品种的每公顷穗数,其中WSD处理后的穗数下降幅度较大。WMD却显著提高了每穗粒数、千粒重及结实率, WSD处理的结果则相反(表1)。
较CI处理而言, WMD和WSD均显著减少了3个供试水稻品种的灌溉用水量, 降低幅度分别为 21.01%~24.34%和 41.36%~44.03%, 抽穗后灌溉用水量也显著降低(表1)。另外, 干湿交替灌溉(AWD)显著提高了灌溉水利用效率(籽粒产量/整个生长期灌溉水量), 其中WMD处理下灌溉水利用效率达最高(表1)。表明WMD可提高灌溉水利用效率又可增加籽粒产量。

图2 干湿交替灌溉对灌浆期剑叶水势的影响Fig. 2 Effect of alternate wetting and drying irrigation on water potential of the flag leaf during grain filling of riceCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。D1和D2表示土壤落干期; W1和W2表示复水期。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying. D1 and D2 represent soil water potential at -15 kPa and -30 kPa, respectively, under WMD and WSD. W1 and W2 indicate the re-watering period.
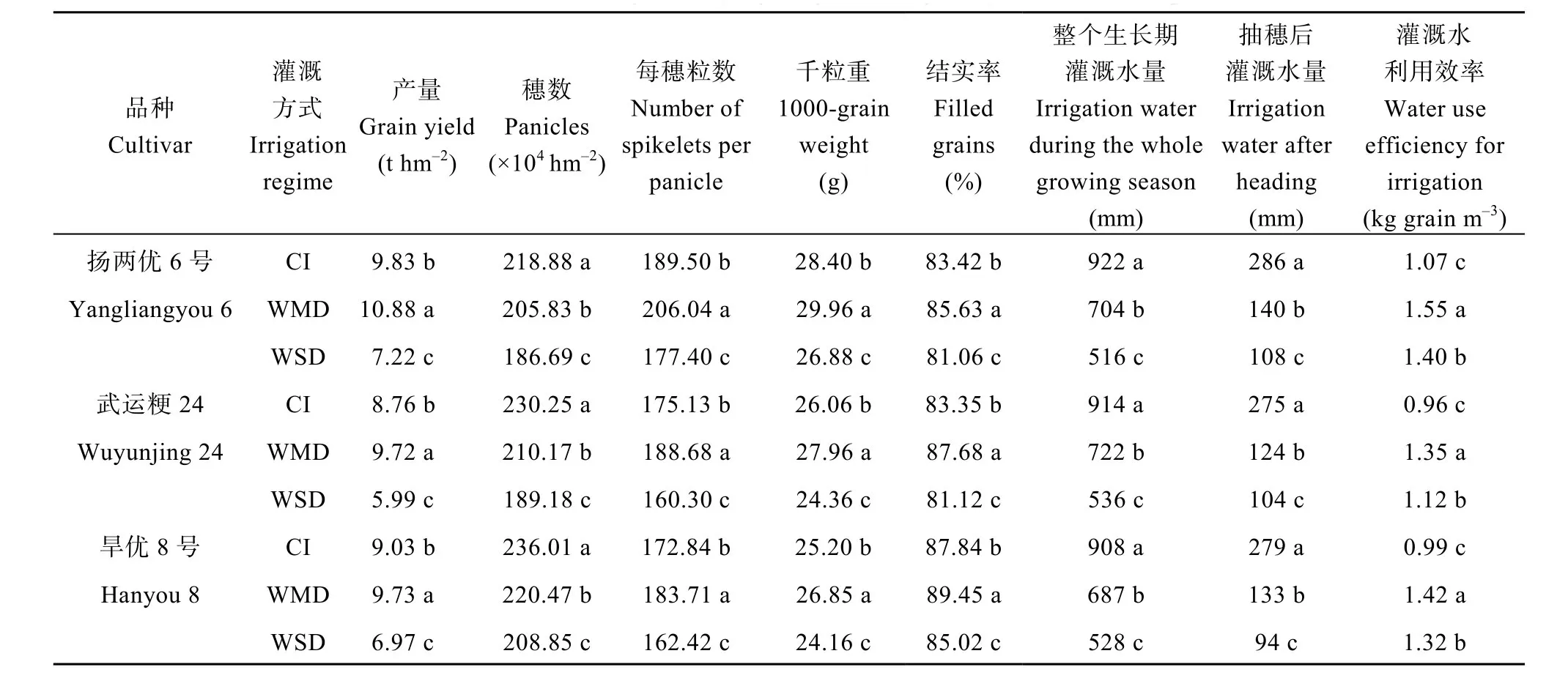
表1 干湿交替灌溉对供试水稻产量及其构成因素的影响Table 1 Effect of alternate wetting and drying irrigation on grain yield and its components of rice
2.3 籽粒灌浆特性
由图3和表2可知, 3个供试水稻品种强势粒的粒重、最大灌浆速率和平均灌浆速率均显著高于弱势粒。与CI相比, WMD显著增加了供试水稻品种弱势粒的粒重、最大灌浆速率和平均灌浆速率, 对强势粒没有显著影响; WSD显著降低了强势粒和弱势粒的粒重、最大灌浆速率和平均灌浆速率。说明WMD主要是通过促进弱势粒灌浆来提高千粒重和结实率。
2.4 籽粒中蔗糖-淀粉代谢途径关键酶活性变化
由图4可知, 3个供试水稻品种籽粒中的蔗糖合酶(SuSase, 图 4-a~c)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase, 图 4-d~f)、淀粉合酶(StSase, 图 4-g~i)和淀粉分支酶(SBE, 图 4-j~l)活性在灌浆前期表现为强势粒的显著高于弱势粒, 灌浆中后期逐渐呈现相反的趋势。在花后土壤落干期(D1和 D2), 与 CI相比, WMD处理下籽粒中上述4种蔗糖-淀粉代谢途径关键酶活性无明显变化; 在复水期(W1和 W2),WMD处理显著提高了弱势粒中上述 4种关键酶活性, 对强势粒无影响。不论土壤落干期还是复水期,WSD处理均显著降低了强势粒和弱势粒中上述酶活性(图4)。说明WMD增强上述4种关键酶活性是提高 3个供试水稻品种弱势粒灌浆速率的主要原因之一。
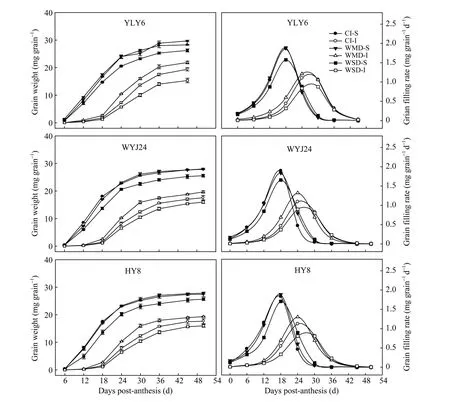
图3 干湿交替灌溉对供试水稻品种强、弱势粒增重动态和籽粒灌浆速率的影响Fig. 3 Effect of alternate wetting and drying irrigation on grain weight and grain filling rate for superior and inferior spikelets of riceCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉; S: 强势粒; I: 弱势粒。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying; S: superior spikelets; I: inferior spikelets.
2.5 剑叶光合特性和茎鞘NSC的积累与运转
在土壤落干期(D1和D2), WMD处理的剑叶光合速率与对照CI无显著差异, WSD处理下剑叶光合速率降低显著(表3)。土壤复水后(W1和W2), 较CI处理而言, WMD处理显著提高了剑叶的光合速率,WSD处理下光合速率仍然最低(表 3)。在土壤落干期, WMD处理下的剑叶SOD活性和MDA含量与对照 CI无显著差异; 复水则显著增加了剑叶 SOD活性和降低了MDA含量(图5)。无论是土壤落干期还是复水期, WSD处理均显著降低了剑叶SOD活性,增加了MDA含量(图5)。3个供试水稻品种的变化趋势相同(表3和图5)。表明WMD处理可以延缓叶片衰老, 进而提高灌浆期剑叶的光合速率。
与CI相比, WMD和WSD均显著降低了抽穗期和成熟期的茎鞘NSC积累量, 其中WSD降低的幅度远大于 WMD (表 4)。抽穗至成熟期茎鞘 NSC运转量在不同灌溉处理间表现为 WMD>WSD>CI, 运转率则表现为WMD和WSD处理下的差异不显著,但均显著高于CI (表4)。经计算, 茎鞘NSC对籽粒产量的贡献率表现为WSD>WMD>CI。3个水稻品种的趋势相同。表明干湿交替灌溉(AWD)能够促进花前茎鞘临时性贮藏同化物质向籽粒运转并且显著增加茎鞘NSC对籽粒产量的贡献率。
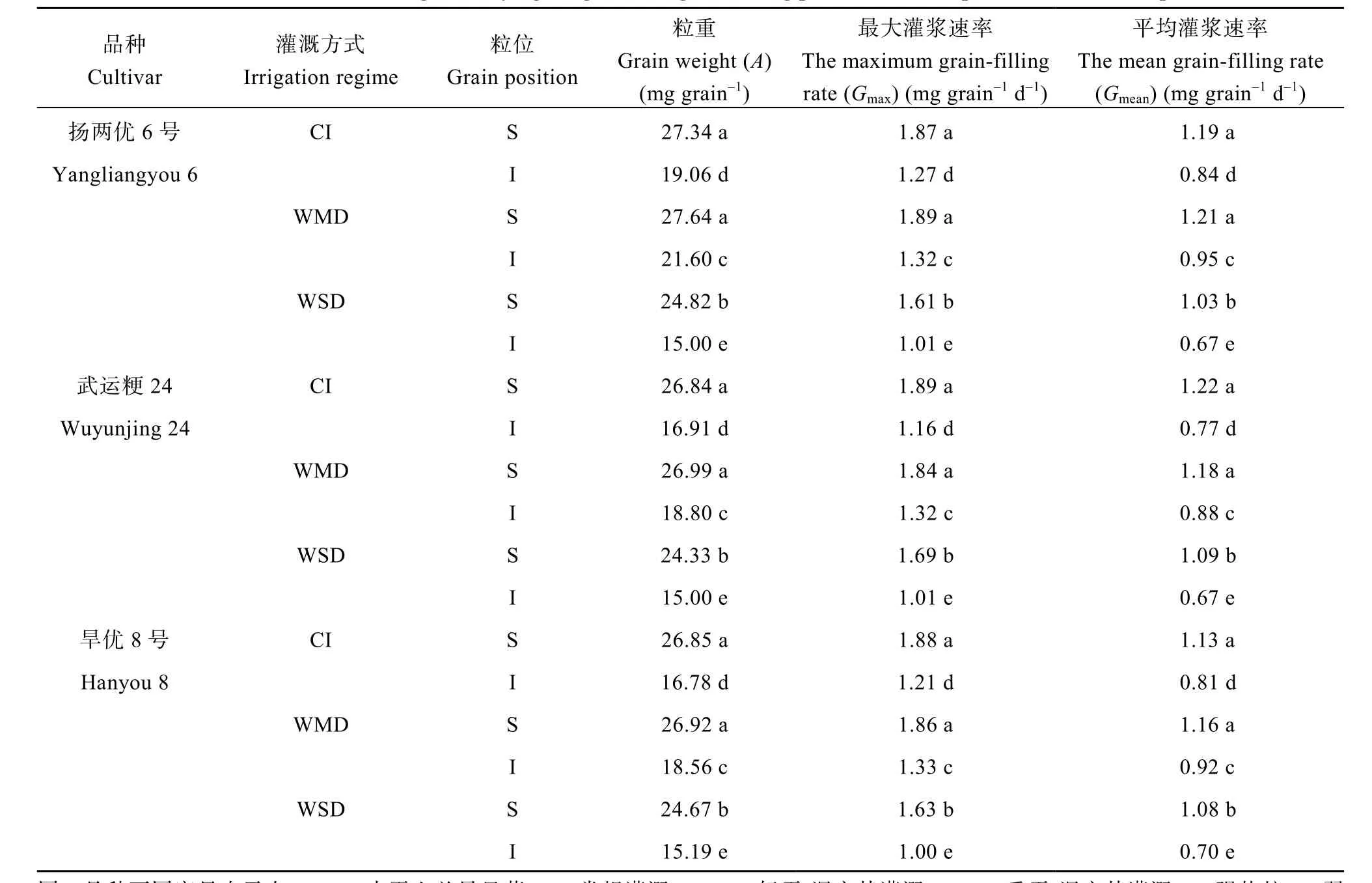
表2 干湿交替灌溉对水稻强、弱势粒灌浆特征参数的影响Table 2 Effect of alternate wetting and drying irrigation on grain filling parameters of superior and inferior spikelets of rice

表3 干湿交替灌溉对水稻剑叶光合速率的影响Table 3 Effect of alternate wetting and drying irrigation on photosynthetic rate of flag leaf of rice
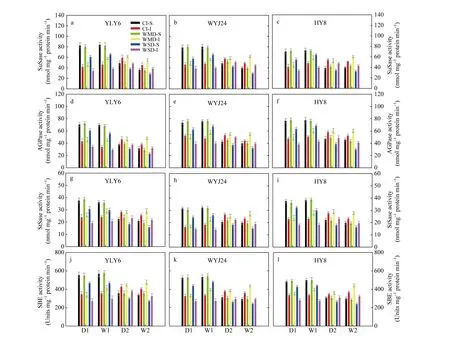
图4 干湿交替灌溉对水稻籽粒中蔗糖合酶(SuSase, a~c)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase, d~f)、淀粉合酶(StSase, g~i)和淀粉分支酶(SBE, j~l)活性的影响Fig. 4 Effect of alternate wetting and drying irrigation on activities of sucrose synthase (SuSase), adenosine diphosphate glucose pyrophosphorylase (AGPase), starch synthase (StSase), and starch branching enzyme (SBE) in rice grainsCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。S: 强势粒; I: 弱势粒。D1 和 D2 表示土壤落干期。W1 和 W2 表示复水期。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying. S: superior spikelets; I: inferior spikelets. D1 and D2 represent soil water potential at -15 kPa and -30 kPa, respectively, under WMD and WSD. W1 and W2 indicate the re-watering period.
2.6 茎鞘中淀粉含量及其水解酶活性变化
由表4和图6可知, 3个供试水稻品种抽穗开花期茎鞘贮藏的淀粉含量约占茎鞘NSC含量的75%~90%。在灌浆结实期, 茎鞘中淀粉的含量逐渐降低,而且降低幅度随着干旱程度的加剧而增大, 降低幅度具体表现为 WSD>WMD>CI (图 6), 这与茎鞘NSC运转的变化趋势一致(表 4), 表明灌浆期茎鞘NSC主要是淀粉经水解后向籽粒转运, 而且干湿交替灌溉(AWD)能够显著促进茎鞘淀粉的水解以及转运。
α-淀粉酶和 β-淀粉酶是淀粉水解的两个关键酶。在土壤落干期(D1和D2), 与CI相比, WMD和WSD 均显著增强了茎鞘 α-淀粉酶(图 7-a~c)和 β-淀粉酶(图 7-d~f)活性, 其中 WSD 处理增加的幅度更大。土壤复水后(W1和W2), WMD处理下的上述2种淀粉水解酶活性略有提高, 但与CI处理无显著差异, 而 WSD 处理下茎鞘仍具有较高的 α-淀粉酶和β-淀粉酶活性(图7)。表明茎鞘淀粉水解酶活性的提高是其淀粉转运加快的主要原因。从图7还可以看出, 干湿交替灌溉(AWD)处理下, α-淀粉酶活性远远高于 β-淀粉酶, 而且前者提高幅度大于后者。表明茎鞘NSC或淀粉转运过程中, α-淀粉酶发挥的作用可能更大一些。

图5 干湿交替灌溉对供试水稻品种剑叶超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的影响Fig. 5 Effect of alternate wetting and drying irrigation on SOD activity and MDA content of flag leaf of riceCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。D1和D2表示土壤落干期, W1和W2表示复水期。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying. D1 and D2 represent soil water potential at -15 kPa and -30 kPa, respectively, under WMD and WSD. W1 and W2 indicate the re-watering period.
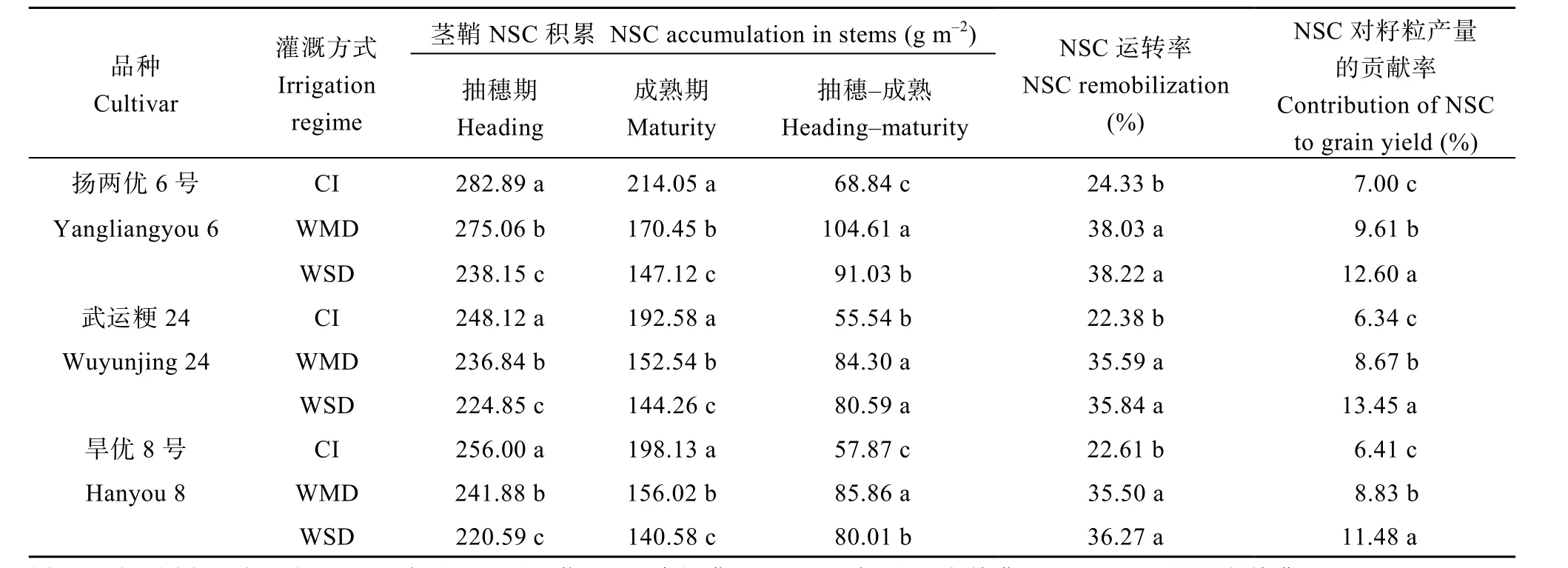
表4 干湿交替灌溉对供试水稻品种茎鞘NSC积累和运转的影响Table 4 Effect of alternate wetting and drying irrigation on NSC accumulation and remobilization of rice
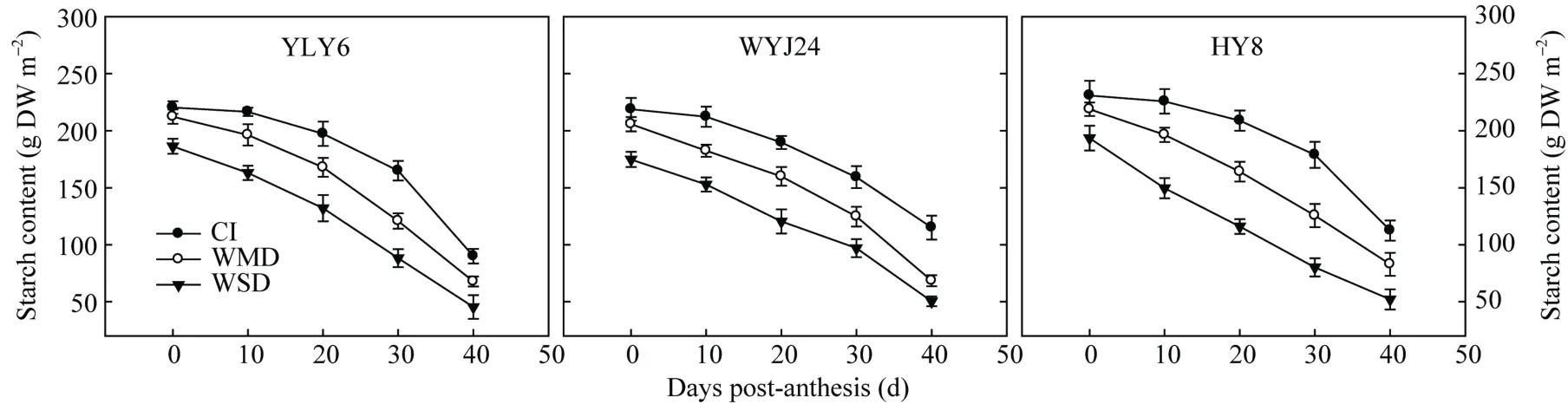
图6 水稻花后茎鞘中淀粉含量变化Fig. 6 Changes in starch content in rice stemsCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying.
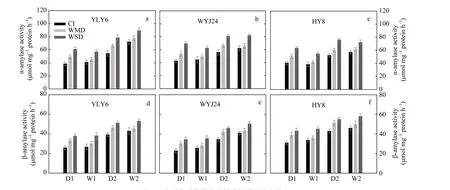
图7 水稻花后茎鞘中淀粉水解酶活性变化Fig. 7 Changes in hydrolytic enzymes in rice stemsCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。D1和D2表示土壤落干期, W1和W2表示复水期。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying. D1 and D2 represent soil water potential at -15 kPa and -30 kPa, respectively, under WMD and WSD. W1 and W2 indicate the re-watering period.
图 8显示, 开花时标记剑叶13C的 72.88%~84.00%分配到茎鞘中(图 8-a~c), 少部分(15.67%~19.22%)滞留在叶片中(表 5), 极微量的分配到穗子中(数据未显示), 根系中未检测到13C, 表明开花前植株茎鞘是光合同化物质的临时性贮藏库。随着灌浆的进行, 叶片中滞留的13C逐渐减少, 到花后30 d已降低到标记13C的1.97%~6.05% (表5)。无论哪种灌溉处理下, 茎鞘中13C比例均呈现降低趋势(图8-a~c), 而籽粒中13C 则逐渐积累(图 8-d~f)。灌浆期间茎鞘中13C比例均表现为 CI>WMD>WSD, 籽粒中13C 比例则呈现 CI<WMD<WSD (图 8)。3个供试水稻品种的结果一致。花后40 d, 在WMD和WSD处理下, 通过剑叶光合同化饲喂的13C在水稻茎鞘中比例已降为 8.40%~15.84% (图 8-a~c), 在籽粒中已积累到 70.50%~84.20% (图 8-d~f)。再次表明干湿交替灌溉(AWD)促进了花前茎鞘贮藏同化物向籽粒的再转运, 而且干旱程度越大, 这种促进作用就越大。
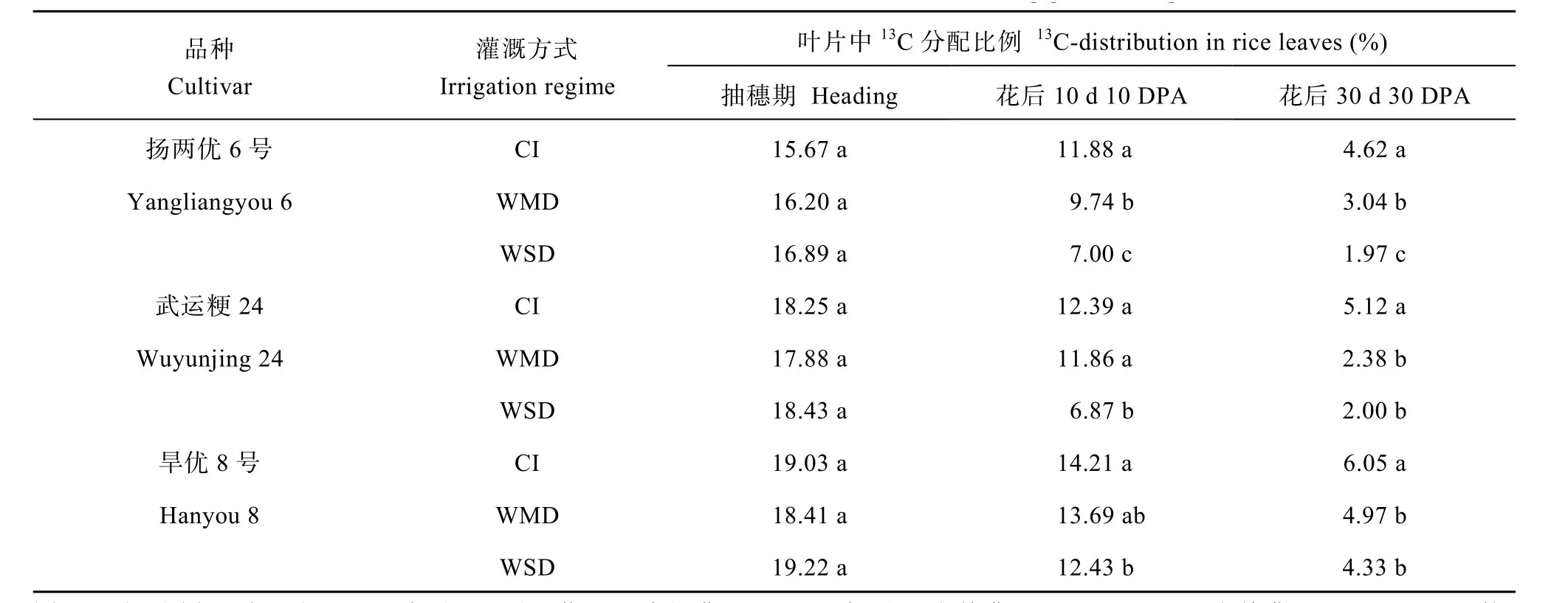
表5 水稻灌浆期叶片中13C的分配比例Table 5 Proportion of 13C-distribution in rice leaves during grain filling
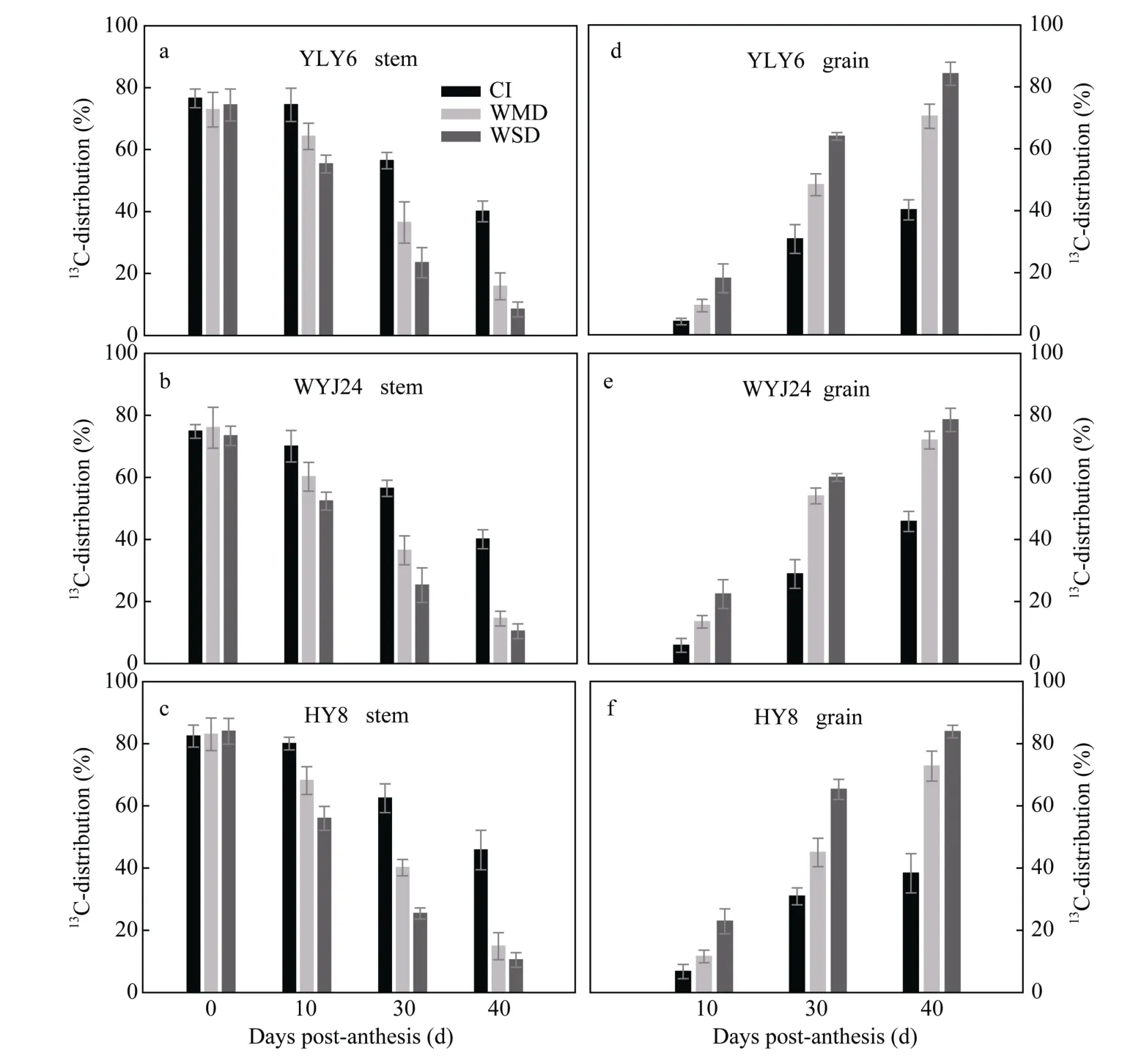
图8 水稻灌浆期茎鞘和籽粒中13C分配的变化Fig. 8 Changes in 13C-distribution in rice stems and grains during grain fillingCI: 常规灌溉; WMD: 轻干-湿交替灌溉; WSD: 重干-湿交替灌溉。CI: conventional irrigation; WMD: alternate wetting and moderate soil drying; WSD: alternate wetting and severe soil drying.
2.7 籽粒中蔗糖-淀粉代谢途径关键酶活性、剑叶性能以及茎鞘中淀粉水解酶活性与籽粒灌浆及物质运转的相关
由表 6可见, 籽粒粒重、最大灌浆速率和平均灌浆速率与 SuSase、AGPase和 StSase活性以及剑叶光合速率、超氧化物歧化酶活性均呈极显著正相关(r= 0.55**~0.94**,P=0.01), 与剑叶丙二醛含量呈极显著负相关(r= -0.82**~ -0.90**,P=0.01), 与SBE活性相关性不显著(r= 0.35~0.43,P>0.05)。表明增加灌浆期籽粒中 SuSase、AGPase和 StSase活性以及提高叶片光合性能, 有利于促进籽粒灌浆, 进而增加粒重。
表 7表明, 茎鞘 α-淀粉酶和 β-淀粉酶活性与茎鞘NSC运转率、NSC对产量的贡献率、淀粉运转、13C运转以及籽粒中13C分配比例呈显著或极显著正相关(r= 0.67*~0.94**,P=0.01), 与茎鞘中13C滞留比例呈极显著负相关(r=-0.77**~ -0.92**,P=0.01)。再次表明, 较高的 α-淀粉酶和 β-淀粉酶活性是茎鞘贮藏物质再转运并分配至籽粒的重要生理原因, 提高茎鞘淀粉水解酶活性, 有利于促进茎鞘物质转运,进而提高粒重。
3 讨论
有关干湿交替灌溉对产量影响的报道, 有的增产[16-18], 有的减产[19-20], 其差异可能与土壤落干的程度、灌溉处理的时期以及水稻品种的抗旱性等有密切关系。本研究表明, 与常规灌溉(CI)相比, 3个供试水稻品种在全生育期轻干-湿交替灌溉(WMD)下可增产 7.75%~10.96%, 在重干-湿交替灌溉(WSD)下则减产 22.81%~31.62%。表明干湿交替灌溉中土壤落干程度是决定产量增减的重要原因, WMD不仅可提高灌溉水利用效率, 而且可增加籽粒产量。WSD虽可提高灌溉水利用效率, 但会严重减产。从产量构成因素分析, WMD处理显著增加了各品种的每穗粒数、千粒重和结实率, 而WSD的作用则相反。本研究还发现, WMD可显著增加稻穗弱势粒的粒重、最大灌浆速率和平均灌浆速率, 对强势粒则无显著影响。表明WMD促进弱势粒灌浆是千粒重和结实率提高的主要原因。

表6 籽粒中蔗糖-淀粉代谢途径关键酶活性和剑叶光合性能与籽粒灌浆的相关系数Table 6 Correlation coefficients of key enzyme activities in sucrose-starch pathway and photosynthetic characteristics of flag leaf with grain weight and grain filling rate

表7 茎鞘中淀粉水解酶活性与物质运转的相关系数Table 7 Correlation coefficients of starch hydrolytic enzymes activities in stems with carbon remobilization
陈婷婷等[6,8]报道, 结实期轻干-湿交替灌溉能够显著提高弱势粒中多种与灌浆相关的蛋白质表达或淀粉合成相关酶活性及其相关基因的表达, 进而增加弱势粒粒重。本研究观察到, WMD可显著提高灌浆期剑叶中超氧化物歧化酶(SOD)活性, 降低过氧化物(MDA)含量, 提高剑叶的光合速率, WSD 处理的结果与之相反。粒重和籽粒灌浆速率与剑叶光合速率、SOD活性均呈极显著正相关, 与剑叶MDA含量呈极显著负相关。表明WMD可以增强叶片光合能力, 加大光合产物对籽粒特别是弱势粒的供给量。从籽粒内部因素分析, WMD显著增强了弱势粒中蔗糖合酶(SuSase)、腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、淀粉合酶(StSase)和淀粉分支酶(SBE)活性, WSD则显著降低了籽粒中上述4种关键酶活性。说明灌浆期弱势粒生理活性的增强, 是 WMD促进弱势粒灌浆和增加粒重的重要生理原因。
水稻抽穗前茎鞘中储存的碳水化合物是灌浆物质的重要组成部分[22,37-39]。有研究表明, 抽穗后土壤遭受干旱, 稻茎中储存的 NSC会大量转运至籽粒,对籽粒最终产量的贡献率可达40%以上[38]。但干湿交替灌溉是否可促进茎中同化物向籽粒转运, 相关研究很少。本研究表明, 无论是WMD还是WSD, 均可显著增加茎鞘中NSC向籽粒的转运。WMD既可提高花后叶片光合速率, 又可促进茎中同化物向籽粒转运, 因此产量显著提高, 而在 WSD条件下, 茎中光合同化物向籽粒转运增加之得不能补偿光合作用下降之失, 导致产量下降。
水稻干湿交替灌溉如何促进同化物向籽粒转运,其机制仍不清楚。本研究发现, WMD和WSD可显著增强茎鞘中 α-淀粉酶和 β-淀粉酶活性。13C同位素示踪试验进一步显示, 随着籽粒的灌浆, 茎鞘中13C比例逐渐降低, 籽粒中13C比例逐渐增加。相关分析表明, 茎鞘 α-淀粉酶和 β-淀粉酶活性与茎鞘NSC运转率、NSC对产量的贡献率、淀粉运转率、13C运转率以及籽粒中13C分配比例均呈显著或极显著正相关, 与茎鞘中13C滞留比例呈极显著负相关。表明 α-淀粉酶和 β-淀粉酶活性的大幅度提高是AWD处理下茎鞘NSC向籽粒转运的重要生理原因。Morita等[40]和杨建昌等[25,41]也有类似的研究结果。本研究还观察到, 水稻茎鞘中α-淀粉酶活性在AWD条件下增加的幅度大于 β-淀粉酶。α-淀粉酶活性与物质运转的相关系数均大于 β-淀粉酶。据此作者推测, AWD对α-淀粉酶活性的增强作用较对β-淀粉酶的促进作用更大, 前者与茎中同化物转运的关系较后者更为密切。但这一推测需要进一步的验证。
值得注意的是, 本研究中 WMD处理不仅提高了水稻的千粒重与结实率, 还提高了每穗粒数,WSD则显著降低了每穗粒数、千粒重和结实率。张慎凤[42]也有相近的研究结果。每穗粒数多, 说明颖花分化数多或颖花退化数少, 或两者兼之。表明WMD有利于稻穗颖花发育与形成。但有关干湿交替灌溉影响水稻颖花分化和退化的机制, 作者尚未查到相关文献, 也缺乏研究探讨。深入开展这方面的研究, 对于揭示干湿交替灌溉影响水稻产量形成的机制, 指导优质高产节水灌溉有重要意义。
4 结论
水稻干湿交替灌溉可显著增强花后茎鞘中 α-淀粉酶和 β-淀粉酶活性, 促进茎中同化物向籽粒转运。轻干-湿交替灌溉(WMD)可增强灌浆期弱势粒中蔗糖-淀粉代谢途径相关酶活性, 促进弱势粒灌浆,进而提高结实率和粒重, 重干-湿交替灌溉(WSD)则可抑制弱势粒灌浆。在 WMD下, 灌浆期叶片光合速率的提高, 茎中同化物向籽粒转运的增加以及弱势粒活性的增强是产量和水分利用效率提高的重要生理基础; WSD虽能提高水分利用效率, 但因茎中光合同化物向籽粒转运增加之得不能补偿光合作用下降之失, 导致产量下降。WMD还可增加每穗粒数,其机制有待深入研究。
[1] Mohapatra P K, Patel R, Sahu S K. Time of flowering affects grain quality and spikelet partitioning within the rice panicle.Aust J Plant Physiol, 1993, 20: 231-242
[2] Yang J C, Peng S B, Visperas R M, Gu S L. Grain filling pattern and cytokinin content in the grains and roots of rice plants.Plant Growth Regul, 2000, 30: 261-270
[3] Yang J, Zhang J, Wang Z, Xu G, Zhu Q. Activities of key enzymes in sucrose-to-starch conversion in wheat grains subjected: to water deficit during grain filling.Plant Physiol, 2004,135: 1621-1629
[4] Yang J, Zhang J, Wang Z, Liu K, Wang P. Post-anthesis development of inferior and superior spikelets in rice in relation to abscisic acid and ethylene.J Exp Bot, 2006, 57: 149-160
[5] 谈桂露, 张耗, 付景, 王志琴, 刘立军, 杨建昌. 超级稻花后强、弱势粒多胺浓度变化及其与籽粒灌浆的关系. 作物学报,2009, 35: 2225-2233 Tan G L, Zhang H, Fu J, Wang Z Q, Liu L J, Yang J C.Post-anthesis changes in concentrations of polyamines in superior and inferior spikelets and their relation with grain filling of super rice.Acta Agron Sin, 2009, 35: 2225-2233 (in Chinese with English abstract)
[6] 陈婷婷, 谈桂露, 褚光, 刘立军, 杨建昌. 超级稻花后强、弱势粒灌浆相关蛋白质表达的差异. 作物学报, 2012, 38:1471-1482 Chen T T, Tan G L, Chu G, Liu L J, Yang J C. Differential expressions of the proteins related to grain filling between superior and inferior spikelets of super rice after anthesis.Acta Agron Sin,2012, 38: 1471-1482 (in Chinese with English abstract)
[7] 徐云姬, 顾道健, 秦昊, 张耗, 王志琴, 杨建昌. 玉米灌浆期果穗不同部位籽粒碳水化合物积累与淀粉合成相关酶活性变化. 作物学报, 2015, 41: 297-307 Xu Y J, Gu D J, Qin H, Zhang H, Wang Z Q, Yang J C. Changes in carbohydrate accumulation and activities of enzymes involved in starch synthesis in maize kernels at different positions on an ear during grain filling.Acta Agron Sin, 2015, 41: 297-307 (in Chinese with English abstract)
[8] 陈婷婷, 许更文, 钱希旸, 王志琴, 张耗, 杨建昌. 花后轻干-湿交替灌溉提高水稻籽粒淀粉合成相关基因的表达. 中国农业科学, 2015, 48: 1288-1299 Chen T T, Xu G W, Qian X Y, Wang Z Q, Zhang H, Yang J C.Post-anthesis alternate wetting and moderate soil drying irrigation enhance gene expressions of enzymes involved in starch synthesis in rice grains.Sci Agric Sin, 2015, 48: 1288-1299 (in Chinese with English abstract)
[9] Tuong T P, Bouman B A M, Mortimer M. More rice, less water-integrated approaches for increasing water productivity in irrigated rice-based systems in Asia.Plant Prod Sci, 2005, 8:231-241
[10] Yang J, Liu K, Wang Z, Du Y, Zhang J. Water-saving and high-yielding irrigation for lowland rice by controlling limiting values of soil water potential.J Integr Plant Biol, 2007, 49:1445-1454
[11] Zhang H, Zhang S, Zhang J, Yang J, Wang Z. Post-anthesis moderate wetting drying improves both quality and quantity of rice yield.Agron J, 2008, 100: 726-734
[12] Zhang H, Xue Y, Wang Z, Yang J, Zhang J. An alternate wetting and moderate soil drying regime improves root and shoot growth in rice.Crop Sci, 2009, 49: 2246-2260
[13] Bouman B A M, Tuong T P. Field water management to save water and increase its productivity in irrigated lowland rice.Agric Water Manag, 2001, 49: 11-30
[14] Belder P, Bouman B A M, Cabangon R, Guoan L, Quilang E J P,Li Y, Spiertz J H J, Tuong T P. Effect of water-saving irrigation on rice yield and water use in typical lowland conditions in Asia.Agric Water Manag, 2004, 65: 193-210
[15] Belder P, Spiertz J H J, Bouman B A M, Lu G, Tuong T P. Nitrogen economy and water productivity of lowland rice under water-saving irrigation.Field Crops Res, 2005, 93:169-185
[16] Ye Y S, Liang X Q, Chen Y X, Liu J, Gu J T, Guo R, Li L. Alternate wetting and drying irrigation and controlled-release nitrogen fertilizer in late-season rice. Effects on dry matter accumulation,yield, water and nitrogen use.Field Crops Res, 2013, 144:212-224
[17] 张自常, 李鸿伟, 陈婷婷, 王学明, 王志琴, 杨建昌. 畦沟灌溉和干-湿交替灌溉对水稻产量与品质的影响. 中国农业科学,2011, 44: 4988-4998 Zhang Z C, Li H W, Chen T T, Wang X M, Wang Z Q, Yang J C.Effect of furrow irrigation and alternate wetting and drying irrigation on grain yield and quality of rice.Sci Agric Sin, 2011, 44:4988-4998 (in Chinese with English abstract)
[18] 付景, 刘洁, 曹转勤, 王志琴, 张耗, 杨建昌. 结实期干-湿交替灌溉对 2个超级稻品种结实率和粒重的影响. 作物学报,2014, 40: 1056-1065 Fu J, Liu J, Cao Z Q, Wang Z Q, Zhang H, Yang J C. Effects of alternate wetting and drying irrigation during grain filling on the seed-setting rate and grain weight of two super rice cultivars.Acta Agron Sin, 2014, 40: 1056-1065 (in Chinese with English abstract)
[19] Tabbal D F, Bouman B A M, Bhuiyan S I, Sibayan E B, Sattar M A.On-farm strategies for reducing water input in irrigated rice: case studies in the Philippines.Agric Water Manag, 2002, 56: 93-112
[20] Belder P, Bouman B A M, Cabangon R, Guoan L, Quilang E J P,Li Y, Spiertz J H J, Tuong T P. Effect of water-saving irrigation on rice yield and water use in typical lowland conditions in Asia.Agric Water Manag, 2004, 65: 193-210
[21] 徐芬芬, 曾晓春, 石庆华. 干-湿交替灌溉方式下水稻节水增产机制研究. 杂交水稻, 2009, 24: 72-75 Xu F F, Zeng X C, Shi Q H. Studies on yield-increasing effects of intermittent irrigation and its physiological mechanism in rice.Hybrid Rice, 2009, 24: 72-75 (in Chinese with English abstract)[22] Fu J, Huang Z, Wang Z, Yang J, Zhang J. Pre-anthesis non-structural carbohydrate reserve in the stem enhances the sink strength of inferior spikelets during grain filling of rice.Field Crops Res, 2011, 123: 170-182
[23] Cock J H, Yoshida S. Accumulation of14C-labelled carbohydrate before flowering and its subsequent redistribution and respiration in the rice plant.Jpn J Crop Sci, 1972, 41: 598-607
[24] Pan J F, Cui K H, Wei D, Huang J L, Xiang J, Nie L X. Relationships of non-structural carbohydrates accumulation and translocation with yield formation in rice recombinant inbred lines under two nitrogen levels.Physiol Plant, 2011, 141: 321-331
[25] 杨建昌, 徐国伟, 王志琴, 陈新红, 朱庆森. 旱种水稻结实期茎中碳同化物的运转及其生理机制. 作物学报, 2004, 30:108-114 Yang J C, Xu G W, Wang Z Q, Chen X H, Zhu Q S. Remobilization of carbon assimilates in the stems during grain filling and its physiological mechanism in dry-cultivated rice.Acta Agron Sin,2004, 30: 108-114 (in Chinese with English abstract)
[26] 朱庆森, 曹显祖, 骆亦其. 水稻籽粒灌浆的生长分析. 作物学报, 1988, 14: 182-193 Zhu Q S, Cao X Z, Luo Y Q. Growth analysis on the process of grain filling in rice.Acta Agron Sin, 1988, 14: 182-193 (in Chinese with English abstract)
[27] Richards F J. A flexible growth function for empirical use.J Exp Bot, 1959, 10: 290-300
[28] Yang J C, Zhang J H, Wang Z Q, Zhu Q S, Liu L J. Activities of enzymes involved in source-to-starch metabolism in rice grains subjected to water stress during filling.Field Crops Res, 2003, 81:69-81
[29] 王爱国, 罗广华, 邵从本, 吴淑君, 郭俊彦. 大豆种子超氧物歧化酶的研究. 植物生理学报, 1983, 9: 77-84 Wang A G, Luo G H, Shao C B, Wu S J, Guo J Y. A study on the superoxide dismutase of soybean seeds.Acta Phytophysiol Sin,1983, 9: 77-84 (in Chinese with English abstract)
[30] 赵世杰, 许长成, 邹琦, 孟庆伟. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 1994, 30: 207-210 Zhao S J, Xu C C, Zou Q, Meng Q W. Improvements of method for measurement of malondialdehyde in plant tissues.Plant Physiol Commun, 1994, 30: 207-210 (in Chinese with English abstract)
[31] Yoshida S, Forno D, Cock J, Gomez K. Determination of sugar and starch in plant tissue. In: Yoshida S, ed. Laboratory Manual for Physiological Studies of Rice. Philippines: the International Rice Research Institute, 1976
[32] Somogyi M. A new reagent for the determination of sugars.J Biol Chem, 1945, 160: 61-68
[33] Pucher G W, Leavenworth C S, Vickery H B. Determination of starch in plant tissues.Anal Chem, 1948, 20: 850-853
[34] McCleary B V, Sheehan H. Measurement of cereal α-amylase: A new assay procedure.J Cereal Sci, 1987, 6: 237-251
[35] McCleary B V, Codd R. Measurement of β-amylase in cereal flours and commercial enzyme preparations.J Cereal Sci, 1989, 9:17-33
[36] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976, 72: 248-254
[37] 潘俊峰, 李国辉, 崔克辉. 水稻茎鞘非结构性碳水化合物再分配及其在稳产和抗逆中的作用. 中国水稻科学, 2014, 28:335-342 Pan J F, Li G H, Cui K H. Re-partitioning of non-structural carbohydrates in rice stems and their roles in yield stability and stress tolerance.Chin J Rice Sci, 2014, 28: 335-342 (in Chinese with English abstract)
[38] 王维, 张建华, 杨建昌, 朱庆森. 水分胁迫对贪青迟熟水稻茎贮藏碳水化合物代谢及产量的影响. 作物学报, 2004, 30:196-204 Wang W, Zhang J H, Yang J C, Zhu Q S. Effect of water stress on metabolism of stored carbohydrate of stem and yield in rice grown under unfavorable-delayed senescence.Acta Agron Sin,2004, 30: 196-204 (in Chinese with English abstract)
[39] 王彬, 张英华, 邓万云, 韩美坤, 宋文品, 徐学欣, 姚得秀, 黄菁, 李金鹏, 王志敏. 小麦茎鞘非结构性碳水化合物代谢与调控研究进展. 科技导报, 2016, 34: 87-94 Wang B, Zhang Y H, Deng W Y, Han M K, Song W P, Xu X X,Yao D X, Huang J, Li J P, Wang Z M. Review on metabolism and regulation of non-structural carbohydrates in wheat stem.Sci Tech Rev, 2016, 34: 87-94 (in Chinese with English abstract)
[40] Morita S, Nakano H. Nonstructural carbohydrate content in the stem at full heading contributes to high performance of ripening in heat-tolerant rice cultivarNikomaru.Crop Sci, 2011, 51:818-828
[41] Yang J, Zhang J, Wang Z, Zhu Q. Activities of starch hydrolytic enzymes and sucrose-phosphate synthase in the stems of rice subjected to water stress during grain filling.J Exp Bot, 2001, 52:2169-2179
[42] 张慎凤. 干-湿交替灌溉对水稻生长发育、产量与品质的影响.扬州大学硕士学位论文, 江苏扬州, 2009 Zhang S F. Effects of Alternate Wetting and Drying on the Growth and Development, Grain Yield and Quality of Rice. MS Thesis of Yangzhou University, Yangzhou, Jiangsu, China, 2009(in Chinese with English abstract)
