小鼠毛囊发育中细胞增殖区及干细胞巢的形成演化
2018-04-09王洪阳王海涛李树伟
王洪阳 王海涛 李树伟
843300新疆阿拉尔,塔里木大学生命科学学院 塔里木盆地生物资源保护利用兵团重点实验室
毛囊干细胞巢[1]的生物学功能探究是目前干细胞研究较为热门的方向,研究者已将其定位在毛囊隆突部位[2],且发现毛囊隆突部细胞具有修复创面及再生皮肤的功能[3]。但是毛囊干细胞巢的形成机制与过程尚不明确。干细胞转录因子Sox2作为Sox B1家族的重要一员,主要调控干细胞发育及决定干细胞分化方向,尤其在维持干细胞多能性方面具有重要作用[4⁃5],其表达是保证干细胞处于未分化状态的重要条件之一[6]。我们在EdU标记后进行免疫染色,检测小鼠毛囊细胞增殖活跃区,并针对Sox2进行免疫荧光染色,定位不同发育阶段毛囊Sox2表达区域,追踪定位毛囊干细胞巢祖细胞来源,初步演化毛囊隆突部的形成过程。

图1 不同时期触须毛囊发育形态及触须毛囊结构;1A~1C:出生后第1、7、15天触须毛囊实物图;1D:第7天触须毛囊纵切面结构图(×100);1E:第7天触须毛囊横切面结构图(×400)
一、材料
1.小鼠:成年发情期的SPF级健康昆明(KM)远交系小鼠由第四军医大学实验动物中心提供,动物合格证号(军):SCXK 2012⁃0007,批号0014379,雌雄各10只,体重60 ~ 80 g。饲养在洁净通风处,塔里木大学实验动物中心定期检测致病原,以确保新生KM小鼠符合本试验要求,试验小鼠均采用SPF级洁净鼠粮饲养。
2.主要试剂和仪器:KeyFluor488 Click⁃iT 5-溴-2-脱氧尿嘧啶(EdU)成像检测试剂盒(KGA331⁃50,南京凯基生物科技有限公司),一抗兔抗小鼠Sox2蛋白(SC⁃20088,上海玉博生物科技有限公司),二抗KeyFluor488标记的山羊抗兔IgG(SA00003⁃2,武汉三鹰生物科技有限公司)。牛血清蛋白(BSA)(美国Gibco公司),抗荧光猝灭剂(北京索莱宝科技有限公司),杜氏磷酸盐缓冲液(DPBS,北京优尼康生物科技有限公司)。
二、方法
1.触须毛囊样品处理:随机选取刚出生、6 d龄乳小鼠、14 d龄断乳鼠各2只,雌雄不限,每年龄段小鼠均随机分成两组,即标记组和无标记组:标记组小鼠触须部位皮下注射40 μl用磷酸盐缓冲液(PBS)稀释的EdU(20 μmol/L);无标记组小鼠不做任何处理。6只小鼠正常饲养24 h后,均断颈处死。采用显微外科解剖法获取不同日龄小鼠触须完整毛囊60个/只,PBS清洗干净,OCT冰冻包埋,液氮速冻1 h,-80℃冰箱冷冻48 h,制作8 μm厚冰冻切片,正电荷防脱载玻片吸附冰冻切片,-20℃冰箱中冻存。
2.常规病理染色:HE染色毛囊组织切片,晾干,封片,显微镜观察并拍照。
3.毛囊切片EdU标记染色:EdU标记培养的组织切片滴加1 ml 4%多聚甲醛室温固定30 min,然后3%BSA溶液清洗2次,加入0.5%Triton X⁃100溶液(混合PBS配制)透化细胞质膜和核膜,20 min后,再使用3%BSA溶液清洗2次。每张玻片上加入0.5 ml Click⁃iT反应混合物,室温避光孵育30 min,同时以PBS代替Click⁃iT反应混合物作为阴性对照。弃去Click⁃iT反应混合物,使用3%BSA溶液漂洗2次,采用抗荧光猝灭剂封片,荧光显微镜拍照观察。
4.毛囊切片Sox2免疫荧光染色:冰冻切片自然晾干30 min,4%多聚甲醛固定30 min,PBS漂洗3次,使用0.5%Triton X⁃100透膜20 min,3%BSA和10%山羊血清各250 μl混合滴至冰冻切片,放入湿盒4℃避光孵育1 h,弃孵育液,滴加100 μl一抗兔抗小鼠Sox2蛋白稀释液,以PBS代替一抗做免疫荧光阴性对照,4℃下湿盒孵育过夜,然后使用PBS漂洗3次,滴加二抗KeyFluor488标记的山羊抗兔IgG。加入细胞核荧光染色剂DAPI,4℃湿盒避光孵育1 h,PBS漂洗3次,弃漂洗液,抗荧光猝灭剂封片。荧光显微镜拍照观察。
三、结果
1.触须毛囊形态结构:对每个日龄无标记小鼠30个毛囊HE染色后显微镜下观察发现,同一日龄不同毛囊间形态结构类似。第1天时(图1A),触须毛囊呈灰白色,可以看到毛干,毛球部中可明显区分出真皮乳头;第7天时(图1B),触须毛囊毛干变得粗壮,同时毛囊外根鞘上部出现环周隆突,并且大量毛细血管包绕整个毛囊,但毛球部毛细血管数没有毛囊中上部多;第15天时(图1C),触须毛囊毛干变得更加粗壮,且每个触须毛囊不仅伸出1条毛干,同时包绕毛囊的毛细血管更加丰富,但相对于第7天毛囊球部毛细血管依旧没有出现增多的迹象。从第7天分离出的单独触须毛囊的纵切(图1D)和横切(图1E)图上可以清楚地看到触须毛囊的各个结构,包括结缔组织鞘、毛囊外根鞘、毛囊内根鞘、毛干、毛母质、玻璃膜、真皮乳头。
2.触须毛囊发育过程中细胞增殖活跃区标记:对每个日龄Edu标记小鼠60个毛囊染色后发现,同一日龄不同毛囊间细胞增殖活跃区分布一致。见图2。第1天时,小鼠触须毛囊细胞的增殖活跃区在真皮乳头以及毛母质,增殖活跃区呈现“O”型,毛囊的中上端增殖不明显,只在毛囊外根鞘上端存在散在增殖毛囊细胞;第7天时真皮乳头不再是小鼠触须毛囊细胞增殖活跃区,毛母质依旧是增殖活跃区,但活跃区开始向毛球部外根鞘转移,增殖活跃区呈“∩”型,毛囊中上端细胞增殖依旧不明显;第15天时,小鼠触须毛囊细胞增殖活跃区开始转变成毛球基底部,同时沿着内根鞘向上延伸,增殖活跃区呈现“U”型,同时毛囊中上段细胞增殖明显(白色箭头示),阳性细胞信号增多,并在毛囊外根鞘处形成一定的隆起。阴性对照组不显示增殖活跃区。

图2 不同发育时期触须毛囊干细胞增殖活跃区标记 白色虚线内部为细胞增殖强活跃区,白色箭头示毛囊中上部隆突部旁细胞增殖。ORS:外根鞘;Bulge:隆突部;DP:真皮乳头
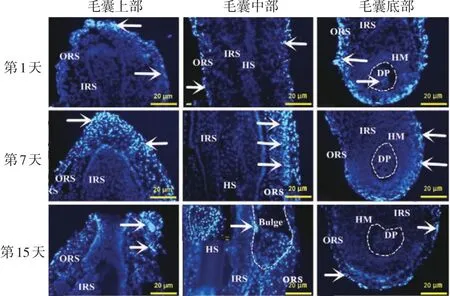
图3 免疫荧光染色检测干细胞转录因子Sox2在不同发育时期触须毛囊中的表达 白色箭头示Sox2表达区域;Bulge:隆突部(白色虚线部位);ORS:外根鞘;IRS:内根鞘;GM:玻璃膜;HS:毛干;HM:毛母质;DP:真皮乳头(白色虚线部位)
3.Sox2在触须毛囊中的表达:对每个日龄无标记小鼠30个毛囊行Sox2染色显示,同一日龄不同毛囊间Sox2表达相似,见图3。在出生第1天的小鼠触须毛囊中,Sox2的表达主要集中在毛囊外根鞘,且在外根鞘的外围形成一层表达带。毛囊球部外根鞘细胞中Sox2表达强于其他部位,真皮乳头部位也有少量Sox2表达。第7天Sox2的表达主要集中在毛囊中上部,且中上部毛囊外根鞘中表达Sox2的细胞增多,表达带增厚,但毛球部毛囊细胞中Sox2表达减弱。第15天Sox2的表达依旧主要集中在毛囊中上部,且毛囊最上端的外根鞘周围出现次级毛囊,Sox2在次级毛囊中强阳性表达,毛囊中部外根鞘有隆起,且隆起部中有大量表达Sox2的细胞存在,毛球部毛囊细胞中Sox2表达依旧减弱,且真皮乳头细胞中没有检测到表达Sox2的细胞。阴性对照组触须毛囊中无Sox2表达。
四、讨论
本研究发现,毛囊隆突部的形成基础来源于毛囊真皮乳头,即毛囊毛球部的成纤维细胞,毛球部成纤维细胞的大量增殖及迁移在不同时期的毛囊中显示出动态变化,Sox2定位显示随着毛囊的成熟,毛囊干细胞增殖能力下降,但是Sox2的表达增多,同时Sox2也主要集中在毛囊隆突部,形成相对封闭的空间,空间内细胞大量表达Sox2,但是却不再增殖,毛囊隆突部细胞进入静息期,毛囊干细胞不再分化增殖,除非毛囊受损,毛囊启动修复再生机制,受损毛囊干细胞巢中干细胞激活后开始增殖、分化,迁移出干细胞巢,分化成受损处的同源细胞,修复毛囊受损或者皮肤创面[7]。
研究发现,毛囊干细胞巢的生成过程中,可能是表皮基底层首先形成毛囊样结构[8⁃9],毛囊发育过程中形成毛囊毛球部,毛球部中真皮乳头具有较强的增殖分化功能,真皮乳头细胞增殖分化出的细胞沿着毛囊外根鞘和内根鞘向毛囊上部迁移,集中在毛囊中上部,形成隆突(隆突部中的细胞也被称为毛囊干细胞),进入不再增殖分化的静息期。
毛囊隆突部干细胞巢的形成是一复杂的过程,形成机制涉及皮肤表皮和真皮的相互作用以及毛囊内部细胞的自身发育过程等。另外毛囊隆突部位锁定在毛囊中上部,离表皮的基底层很近,但同时它又处在皮肤的真皮层中,因此,皮肤受创后,毛囊隆突部干细胞巢中的干细胞可以就近根据创面的大小与深度增殖迁移,修复创面,修复过程中,毛囊隆突部的位置对缩短增殖细胞的迁移距离具有重要作用。
综上所述,我们初步探索了毛囊隆突部干细胞巢的形成过程,同时也为进一步研究毛囊隆突部干细胞巢中细胞生物学功能打下基础。
[1]Paus R,Arck P,Tiede S.(Neuro⁃)endocrinology of epithelialhairfolliclestemcells[J].MolCell Endocrinol,2008,288(1⁃2):38⁃51.doi:10.1016/j.mce.2008.02.023.
[2]Demehri S,Kopan R.Notch signaling in bulge stem cells is not required for selection of hair follicle fate[J].Development,2009,136(6):891⁃896.doi:10.1242/dev.030700.
[3]Taylor G,Lehrer MS,Jensen PJ,et al.Involvement of follicular stem cells in forming not only the follicle but also the epidermis[J].Cell,2000,102(4):451⁃461.doi:10.1016/S0092⁃8674(00)00050⁃7.
[4]Girouard SD,Laga AC,Mihm MC,et al.SOX2 contributes to melanoma cell invasion[J].Lab Invest,2012,92(3):362⁃370.doi:10.1038/labinvest.2011.188.
[5]Kamachi Y,Kondoh H.Sox proteins:regulators of cell fate specification and differentiation[J].Development,2013,140(20):4129⁃4144.doi:10.1242/dev.091793.
[6]Gao Z,Cox JL,Gilmore JM,et al.Determination of protein interactome of transcription factor Sox2 in embryonic stem cells engineered for inducible expression of four reprogramming factors[J].J Biol Chem,2012,287(14):11384⁃11397.doi:10.1074/jbc.M111.320143.
[7]Plikus MV,Gay DL,Treffeisen E,et al.Epithelial stem cells and implications for wound repair[J].Semin Cell Dev Biol,2012,23(9):946⁃953.doi:10.1016/j.semcdb.2012.10.001.
[8]Nakrieko KA,Rudkouskaya A,Irvine TS,et al.Targeted inactiva⁃tion of integrin⁃linked kinase in hair follicle stem cells reveals an important modulatory role in skin repair after injury[J].Mol Biol Cell,2011,22(14):2532⁃2540.doi:10.1091/mbc.E11⁃01⁃0035.
[9]Cotsarelis G.Epithelial stem cells:a folliculocentric view[J].J Invest Dermatol,2006,126(7):1459 ⁃1468.doi:10.1038/sj.jid.5700376.
