定量检测绿色荧光蛋白-轻链蛋白3转基因小鼠角质形成细胞自噬水平
2018-04-09金婷婷HeidemarieRossiterMichaelMildnerFlorianGruberLeopoldEckhartErwinTschachler赵邑
金婷婷 Heidemarie Rossiter Michael Mildner Florian Gruber Leopold EckhartErwin Tschachler 赵邑
100034北京大学第一医院皮肤性病科[金婷婷(现在浙江省人民医院整形外科,310000 杭州)];奥地利维也纳医科大学(Heidemarie Rossiter、Michael Mildner、Florian Gruber、LeopoldEckhart、ErwinTschachler);清华大学附属北京清华长庚医院皮肤科(赵邑)
自噬是对细胞内物质进行自我消化的动态过程,对于机体生长发育、生理变化和疾病发生具有重要作用[1⁃2]。自噬发生时,微管相关蛋白1轻链3(LC3)由胞质可溶性Ⅰ型LC3(LC3⁃Ⅰ)与磷脂酰乙醇胺共价结合变为Ⅱ型LC3(LC3⁃Ⅱ)聚集到自噬体膜上,其含量与自噬小体数量成正比。因此通常把LC3作为自噬标记蛋白用于自噬研究[3]。我们对绿色荧光蛋白-轻链蛋白3(GFP⁃LC3)转基因小鼠的角质形成细胞分别给予饥饿处理和UVA照射,观察到GFP⁃LC3绿色荧光由胞质弥漫分布变为聚集的荧光斑点(指示自噬小体)。在此基础上,利用ImageJ软件宏程序尝试对GFP⁃LC3荧光标记的自噬小体进行自动、快速定量,以探索一种更为简捷、客观、准确的高通量定量检测自噬水平的方法。
材料与方法
1.试剂和仪器:角质形成细胞培养基、基础培养基(美国Lonza公司),胃酶抑素A(美国Selleck公司),4%多聚甲醛(北京索莱宝科技有限公司),Hoechst 33258(美国Millipore公司),甘油封片剂(北京莱恩多美科技有限公司),Sellamed 3000 UVA⁃1灯(德国Sellas公司),紫外线指数检测仪(德国Waldmann公司),LSM700激光共聚焦显微镜(德国Zeiss公司)。
2.细胞培养:按文献[4]培育GFP⁃LC3转基因小鼠并原代培养鼠尾角质形成细胞。GFP⁃LC3转基因小鼠角质形成细胞(第9代)在培养基中重悬后接种于1 cm×1 cm盖玻片上,置于37℃含5%CO2培养箱中,当细胞80%融合时开始处理细胞。
3.自噬诱导:将培养的GFP⁃LC3小鼠角质形成细胞随机分为对照组、饥饿组、20 J/cm2UVA和40 J/cm2UVA照射组。照射组UVA光源高度30 cm,功率66 mW/cm2。照射前吸去原培养基,磷酸盐缓冲液(PBS)漂洗2次后加入1 ml PBS。照射完成后,吸去PBS,加入2 ml培养基并置于37℃含5%CO2培养箱中继续培养6 h。饥饿组给予饥饿处理,即将完全培养基吸去,用PBS漂洗2次后,加入2 ml基础培养基培养6 h。对照组给予和照射组基本相同的处理,仅在照射时给予锡箔纸遮盖避光。为了检测自噬流,自噬诱导处理前在部分细胞培养基中加入胃酶抑素A(10 μg/L),培养12 h后按分组给予上述不同处理。各组细胞培养6 h后,用4%多聚甲醛固定15 min后,加入Hoechst 33258室温放置15 min染色细胞核。实验重复3次。
4.激光共聚焦显微镜观察及图像采集:将固定后的细胞爬片轻轻覆盖于滴加了封片剂的载玻片上,用滤纸吸去多余封片剂。置于LSM700激光共聚焦显微镜下,选择488 nm波长激光和紫外线分别激发GFP和Hoechst 33258,40倍物镜观察并拍照。每组细胞拍摄多个视野,每个视野自细胞底部、中部至顶部拍摄4~5张图片(Z⁃stack),选择中部荧光最亮的图片进行定量分析。
5.ImageJ软件自动检测自噬点数量:用ImageJ软件计数细胞自噬点。自行编程设定一个宏指令“GFP⁃LC3”,用于计算绿色荧光点的数量与大小。简要步骤为:打开前述步骤中获取的待分析图片,拆分色彩通道(“Split Channels”)为绿色(green)、红色(red)和蓝色(blue),选绿色通道,反转颜色(“Invert”),见图1;设置颜色阈值为0 ~ 160,然后分析颗粒(“Analyze Particles”,设定颗粒大小4 ~ 40),即可得到荧光点数量和大小数据。程序可自动逐次打开文件夹内每张图片,进行分析后关闭图片。所有分析结果自动存储到结果表格中。分析细胞总数量时,把图片设置为32⁃bit型,翻转颜色(“Invert”),设置颜色阈值为0 ~ 110,然后分析颗粒(“Analyze Particles”,设定颗粒大小1000⁃Infinity)。结果数据获取及存储同前。
6.统计学分析:结果以x±s显示。采用SPSS 23.0对数据进行统计学分析。各实验组间自噬荧光点的比较采用单因素方差分析(one⁃way ANOVA),两两比较采用LSD法。统计学检验均采用双侧检验,P<0.05为差异有统计学意义。
结 果
应用ImageJ软件宏指令可以成功识别荧光图片中自噬荧光点。用测试计算机[英特尔Core(TM)i3⁃5010U CPU,2.1G Hz,4 GB内存,Windows 1 064位操作系统]分析68张420万像素的图片,耗时仅约40 s,分析每张图片平均仅需0.59 s。
未加入胃酶抑素A时,饥饿组、20 J/cm2和40 J/cm2UVA照射组每个细胞内平均自噬荧光点数量高于对照组;而UVA照射组与饥饿组间、不同剂量UVA组间比较,差异均无统计学意义(P>0.05)。自噬诱导前在培养基中加入胃酶抑素A处理12 h,饥饿组、20 J/cm2和40 J/cm2UVA照射组每个细胞内平均自噬荧光点数量显著高于对照组;而UVA照射组与饥饿组间、不同剂量UVA组间自噬水平差异均无统计学意义(P>0.05)。见表1。
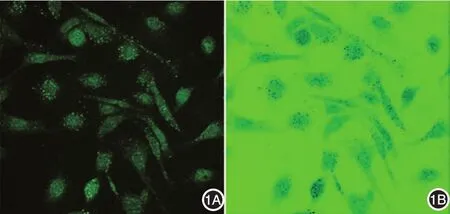
图1 利用ImageJ软件检测细胞及自噬小体数量 1A:激光共聚焦显微镜采集原始图片(×400);1B:经过ImageJ软件反转图片

表1 ImageJ软件自动检测绿色荧光蛋白-轻链蛋白3转基因小鼠角质形成细胞各实验组自噬水平(x±s)
讨 论
尽管自噬检测技术不断更新,但如何准确鉴别、观察、定量细胞自噬始终是自噬领域研究的关键。目前常用的自噬检测方法主要有电镜下观察双层膜的自噬体结构,Western印迹检测LC3B⁃Ⅱ蛋白的表达水平以及荧光显微镜检测GFP⁃LC3等融合蛋白的荧光改变[5]。电镜检测自噬相关组分仍是金标准,除了能够观察超微结构,还可用于定量分析[6]。在超微结构水平上,观察到双层膜结构的自噬小体,在电镜检测中对胞质面积和自噬小体或自噬溶酶体面积进行定量,计算自噬小体或自噬溶酶体占胞质面积的比例并进行定量分析,从而评价细胞自噬流的活化情况[7]。然而这种检测方法具有以下缺点:①从准备标本开始到最后观察,耗时较长,成本较高[8⁃9];②标本制备对检测结果至关重要,要尽可能保持样本的天然特征及其在检测环境中的稳定性,避免人为因素干扰,对研究者的操作技术提出较高要求;③由于样本的复杂性和多样性,准确区分自噬小体和自噬溶酶体并不容易,容易把很多亚细胞结构错当成自噬组分[9]。因此,电镜多用于自噬的定性研究,用它来定量自噬尚存在较大争议。Western印迹检测LC3⁃Ⅱ/LC3⁃Ⅰ比值或LC3⁃Ⅱ/内参蛋白比值[10]除了能判断自噬是否发生外,还可以测定条带灰度实现半定量。但是,该方法的最大缺陷在于无法直观观察自噬流的动态改变。
近年最常用的自噬研究方法是观察荧光标记的LC3⁃Ⅱ在自噬小体膜上聚集的情况,即通过构建GFP⁃LC3质粒、腺病毒转染细胞或者培育GFP⁃LC3转基因小鼠观察自噬发生后细胞GFP⁃LC3荧光点的变化。目前有两种量化GFP⁃LC3荧光点的方法,一是计数一定数量细胞中GFP⁃LC3荧光点超过设定参考值的细胞比例,二是通过计数一定数量细胞的GFP⁃LC3荧光点总数,定量每个细胞的平均荧光值[5]。这种定量方法与电镜相比,操作更为简单,并且可以在不同时间点进行动态观察、计数。在荧光显微镜下检测自噬小体可以采用人工计数或者计算机软件定量的方法,而前者存在以下缺陷:①耗时太长[3];②肉眼分辨能力有限,无法识别一些小的自噬小体[11];③主观偏差较大,有待建立统一的标准[3,5]。因此,我们通过编辑ImageJ软件来评价自噬水平,一次可对大量图片数据进行自动分析,并且更为客观准确。
本研究采用UVA照射GFP⁃LC3转基因小鼠的角质形成细胞诱导自噬,以饥饿作为阳性对照,可以观察到UVA能诱导GFP⁃LC3绿色荧光点数量上升。单纯的GFP⁃LC3荧光点聚集既可能是自噬信号活化的体现,也可能是自噬降解受阻导致,因此我们使用溶酶体酶抑制剂胃酶抑素A作为对照。在经过胃酶抑素A处理之后,各实验组分别给予相同处理,结果仍显示UVA照射组自噬水平高于对照组。这表明UVA照射能诱导角质形成细胞产生自噬,与之前研究的结论一致[4,12]。以上结果证明,采用ImageJ软件定量细胞的自噬小体数量,能准确反映细胞整体的自噬水平。此外,我们也观察到在20 J/cm2和40 J/cm2两种剂量组间细胞自噬水平无明显差异,可能一方面是当前两种剂量下自噬水平差异不显著,另一方面是该方法不足以检测出当前剂量组之间的自噬水平差异。因此,还需要设立更多不同剂量UVA照射组进行验证。
如前所述,这种方法的优点是能快速自动计算各实验组单个细胞自噬点的相对数量,体现在以下3个方面:①通过计数一定区域内细胞个数和GFP⁃LC3荧光点总数,得到不同组每个细胞自噬点的平均数量,辅以对照组设计,可以进行较精确的定量分析研究;②能同时分析多张图片,实现高通量检测细胞自噬水平;③通过设定软件,可以完全实现自动计数,快速获取结果。这种依赖图像进行分析的方法对采集图片的条件要求高,所有图片需在统一环境、时间、参数下采集,以获得统一质量的图像;其次对图片的质量要求高,需在高倍镜下拍摄高分辨率的图片,有文献认为拍摄倍数应高于40[13]。因而它的局限性在于图片拍摄条件和拍摄质量的一致性对分析结果影响较大。细胞内非特异性荧光点造成的假阳性可导致高估细胞自噬水平,但通过用尽可能高的拍摄倍数可减少这种因素引起的假阳性。另一方面细胞核底部自噬点被遮挡等原因可造成对自噬水平的低估,应用该方法时应通过多次重复及合理设立对照以消除此类系统误差。此外,本研究还有一些局限性,如未用金标准方法检测细胞自噬,也没有用Western印迹检测LC3水平进行对照,主要原因是Western印迹的半定量特征无法满足定量检测要求。
综上,我们利用自行设定的ImageJ软件宏指令程序,可对大量的图片数据进行自动评估和自噬荧光点定量,从而较为精确地检测细胞自噬水平,为自噬的定性定量研究提供一种简单快速的高通量成像分析方法。
[1]Choi AM,Ryter SW,Levine B.Autophagy in human health and disease[J].N Engl J Med,2013,368(7):651⁃662.doi:10.1056/NEJMra1205406.
[2]Kroemer G.Autophagy:a druggable process that is deregulated in aging and human disease[J].J Clin Invest,2015,125(1):1⁃4.doi:10.1172/JCI78652.
[3]Fassina L,Magenes G,Inzaghi A,et al.AUTOCOUNTER,an ImageJ JavaScript to analyze LC3B⁃GFP expression dynamics in autophagy⁃induced astrocytoma cells[J].Eur J Histochem,2012,56(4):e44.doi:10.4081/ejh.2012.e44.
[4]Zhao Y,Zhang CF,Rossiter H,et al.Autophagy is induced by UVA and promotes removal of oxidized phospholipids and protein aggregates in epidermal keratinocytes[J].J Invest Dermatol,2013,133(6):1629⁃1637.doi:10.1038/jid.2013.26.
[5]Mizushima N,Yoshimori T,Levine B.Methods in mammalian autophagy research[J].Cell,2010,140(3):313⁃326.doi:10.1016/j.cell.2010.01.028.
[6]Lucocq JM,Hacker C.Cutting a fine figure:on the use of thin sections in electron microscopy to quantify autophagy[J].Autophagy,2013,9(9):1443⁃1448.doi:10.4161/auto.25570.
[7]Swanlund JM,Kregel KC,Oberley TD.Investigating autophagy:quantitative morphometric analysis using electron microscopy[J].Autophagy,2010,6(2):270⁃277.
[8]Rosenfeldt MT,Nixon C,Liu E,et al.Analysis of macroautophagy by immunohistochemistry[J].Autophagy,2012,8(6):963 ⁃969.doi:10.4161/auto.20186.
[9]Klionsky DJ,Abdelmohsen K,Abe A,et al.Guidelines for the use and interpretation of assays for monitoring autophagy(3rd edition)[J].Autophagy,2016,12(1):1 ⁃222.doi:10.1080/15548627.2015.1100356.
[10]Chen Y,Azad MB,Gibson SB.Methods for detecting autophagy and determining autophagy⁃induced cell death[J].Can J Physiol Pharmacol,2010,88(3):285⁃295.doi:10.1139/Y10⁃010.
[11]Rodríguez⁃Arribas M,Pizarro⁃Estrella E,Gómez⁃Sánchez R,et al.IFDOTMETER:anewsoftwareapplicationforautomated immunofluorescence analysis[J].J Lab Autom,2016,21(2):246 ⁃259.doi:10.1177/2211068215600650.
[12]Yan M,Liu Z,Yang H,et al.Luteolin decreases the UVA⁃induced autophagy of human skin fibroblasts by scavenging ROS[J].Mol MedRep,2016,14(3):1986⁃1992.doi:10.3892/mmr.2016.5517.
[13]Chu CT,Plowey ED,Dagda RK,et al.Autophagy in neurite injury and neurodegeneration:in vitroandin vivomodels[J].Methods Enzymol,2009,453:217 ⁃249.doi:10.1016/S0076 ⁃6879(08)04011⁃1.
