建立SCID鼠增生性瘢痕模型的实验研究
2018-04-09钱进邓辰亮杨松林郑江红
钱进 邓辰亮 杨松林 郑江红
增生性瘢痕(Hypertrophic scars,HS)是外伤、烧伤和手术后,皮肤损伤处经过一系列复杂的炎症反应及病理性纤维化过程而产生的,其组织学特点是大量炎性细胞及生长因子浸润、新生血管大量形成、细胞外基质(ECM)过度堆积,胶原沉积及形态重塑、肌成纤维细胞形成等[1-3]。HS表现为高出皮面、充血状、质地实韧的红色或暗红色皮损,伴有局部疼痛瘙痒,其特点是病变范围不超过原损伤范围。尽管增生性瘢痕属于良性病变[1,3-4],但由于影响美观,关节部位的瘢痕还可影响关节活动,而且容易复发,因此是临床上亟待解决的一大难题[5]。
增生性瘢痕治疗手段主要有压迫疗法、瘢痕内药物注射治疗、激光治疗、生物敷料辅助治疗及手术治疗等[6-8]。由于病因尚未明确,因此缺乏针对性的治疗手段。由于种属间的差异,实验研究中缺乏一种病理特征完全相同的动物模型[9-10]。本实验尝试在重症联合免疫缺陷鼠(SCID鼠)背部移植人类刃厚皮片,建立SCID鼠增生性瘢痕模型,并验证该模型的可行性,以期进一步揭示增生性瘢痕的发病机制。
1 材料和方法
1.1 实验材料
4周龄SCID小鼠30只(上海市肿瘤研究所),雌性,体质量 18~23 g,为 T、B 淋巴细胞缺陷(BABL/c同源近交的突变系);人类移植皮肤来源于临床腹壁整形术切除皮肤,术前征得患者知情同意。
1.2 实验方法
1.2.1人类刃厚皮片切取
将手术切除的人类皮肤组织,经75%乙醇消毒后,用滚轴取皮刀取下刃厚皮片,厚度约0.3 mm,修剪成1.5 cm×1.0 cm的皮片,用生理盐水纱布包裹,放入无菌标本盒中,置于-4℃冰箱中保存备用。
1.2.2刃厚皮片移植
小鼠随机分组,实验组20只,对照组10只。腹腔麻醉,实验组小鼠背部剪去1.5 cm×1.0 cm的皮肤,注意保留皮下毛细血管网完整,移植人刃厚皮片,凡士林纱布覆盖并以缝线固定,无菌纱布加压包扎。对照组形成创面后直接覆盖凡士林纱布,同样方法固定包扎。术后,同样条件下分笼饲养,10 d后拆线,暴露术区。
1.2.3观察术区移植物大体变化
术后10 d观察瘢痕颜色、质地、面积等变化,并拍照记录,随机选择5只每周测量大体瘢痕厚度。
1.2.4模型瘢痕组织学检测
术后2周、4周时,取下类瘢痕组织标本,10%福尔马林液固定24 h,制成石蜡标本,切片(5μm厚),分别进行HE染色和Masson's染色,镜下观察①瘢痕组织形态特点②新生血管生成情况③胶原形态及排列情况。
1.2.5瘢痕模型4-羟脯胺酸含量测定
参照Tejiram等[11]的方法,在术后4周时分别取实验组(5只)、对照组(2只)的标本组织,磨成匀浆,与4N盐酸溶液混匀后100℃酸解18 h,缓冲液清洗后超速离心,冷却过滤后制成样液,然后用比色法测定样液中的羟脯胺酸含量(μg/mg),标准曲线由波长(558±2)nm处吸光值绘制而成。
1.2.6检测瘢痕模型组织中细胞因子的表达
RT-PCR测定TGF-β1和CTGF的表达情况。参考Wang等[12]的方法,术后2周、4周时分别取实验组(5只)、对照组(2只)标本,磨成匀浆,用 DNA酶降解1 h以去除DNA杂质干扰,离心提取mRNA。引物序列:TGF-β1(正)5'-TGTTAAAACTGGCATCTGA-3'、(反)5'-GTCtCTTAGGAAGTAGGT-3'; CTGF(正)5'-GAGTGTGCACTGCCAAAGAT-3'、(反)5'-GGCAAGTGCATTGGTATTTG-3'。合成初级cDNA后按照如下条件循环扩增:95℃下变性10 min,间隔15 s,扩增40次,然后在60℃下退火引物链结合,间隔60 s。将PCR产物电泳30 min后观察结果,表达水平记录为实验组与对照组的比值。
1.3 数据分析
所有数据以(x±s)表示,采用单因素方差检验,Excel统计数据,P<0.05为差异有统计学意义。
2 结果
2.1 瘢痕模型形态学变化
术后10 d拆线后,实验组皮片颜色暗红、质地柔软;术后2周时,实验组2只小鼠皮片颜色逐渐变为黑色,干燥,结痂脱落;其余小鼠皮片周围逐渐隆起,有灰褐色边界,整个皮片颜色逐渐变为咖啡色,表皮结痂,约30 d后痂皮逐渐脱落,瘢痕样组织逐渐隆起,高出皮面,呈淡红褐色,质地偏硬,充血状;术后8周时,瘢痕逐渐收缩,颜色呈深褐色。对照组小鼠皮肤自行愈合结痂,长期存活,20 d后结痂脱落,皮肤与周围皮肤无差异。实验组大体组织厚度明显增加,术后2周、4周时分别增加(20.2%±4.3%)、(25.1%±3.5%);术后8周时有所下降,但仍较原组织增加了(22.6%±3.2%)(P<0.05)(图 1、图 3A)。
2.2 瘢痕模型组织学变化
术后4周的标本HE染色后,镜下可见真皮层增厚,皮肤附属器结构改变,毛囊减少,部分层次不连续,新生血管形成,类瘢痕组织厚度较对照组明显增加。Masson's染色结果显示胶原排列紊乱,胶原束较细,呈结节状或旋涡状分布(图2)。
2.3 瘢痕模型组织总羟脯胺酸含量上调
羟脯胺酸的含量能够反映组织中胶原的含量。术后4周时实验组平均羟脯胺酸含量(52±9)μg/mg,较对照组(37±7)μg/mg明显增加(P<0.05)(图 3B)。
2.4 瘢痕模型中TGF-β1与CTGF表达上调
TGF-β1和CTGF在瘢痕形成过程中共同调节纤维化过程[13]。RT-PCR结果显示,术后2周和4周时,TGF-β1 mRNA表达水平较对照组明显提高(P<0.01);CTGF的变化和TGF-β1相似,实验组亦较对照组明显提高(P<0.01)(图 3C、D)。

图1 移植皮片后瘢痕模型大体观察Fig.1 Gross observation of scar model after skin graft
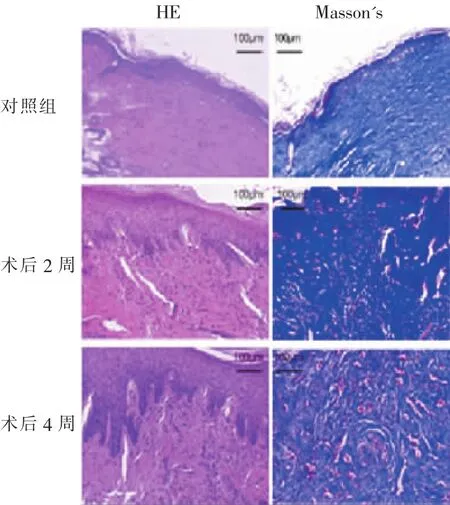
图2 移植皮片后瘢痕模型组织学观察Fig.2 Histological observation of scar model after skin graft
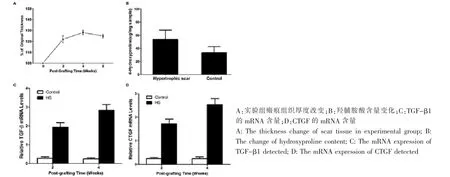
图3 数据统计Fig.3 Data statistics
3 讨论
HS的主要病理特点为过度的炎症反应及病理性纤维化过程[2,14]。大量研究表明,过度的炎症反应会阻碍创面的正常愈合,并且炎症细胞可导致正常纤维化过程紊乱,从而导致病理性纤维化。因此,在病程早期,HS组织学上表现为炎性细胞的大量浸润及新生血管形成,而随着病程推移,则表现为纤维化过程的紊乱,细胞外基质的沉积,尤其是Ⅰ型胶原的沉积[2,15]。但是,进一步的研究受制于理想动物模型的缺乏,许多动物模型尝试移植人类瘢痕,但由于只局限于终末期瘢痕的纤维化改变,而不包括对瘢痕形成初始影响因素的研究,因此这类模型存在很大的局限性[9]。
迄今为止,比较理想的动物模型有以下几种。Morris等[16]首先建立了兔耳瘢痕模型,该模型在兔耳表面制造深达软骨膜毛细血管网的创面,通过软骨表面愈合形成瘢痕组织,但兔耳皮肤层次中缺乏皮下组织层,与人类皮肤结构存在明显差异[17-18]。Zhu等[19]报道了红色Duroc猪背部深层次创面通过瘢痕样组织修复,尽管猪皮肤解剖结构与人类最为相似,但所形成的类瘢痕组织在形态学上表现为低平紧缩,而不是人HS那样潮红充血,高出皮面[20-22]。Yang等[23]建立了裸鼠表面移植人全厚皮片的瘢痕模型,形成的移植产物在形态学与组织学上与人HS相似。后续研究进一步优化了这个模型,通过在裸鼠表面移植人刃厚皮片,形成的瘢痕组织较之前的模型在组织学与形态学方面与人HS更为接近[24-25]。
SCID鼠由于其T、B细胞缺乏,而对外源性抗原无细胞免疫及抗体反应,和裸鼠相似。这种免疫缺陷也使得皮肤移植排斥反应减轻,从而使皮肤存活时间延长,为后续瘢痕长时间维持提供了理论支持[26]。我们将人刃厚皮片移植到SCID鼠背部,术后10 d拆线后,移植组织颜色粉红、质软、边缘轻度高出皮面,提示皮片存活良好。约1个月左右,移植物逐渐变硬、颜色加深,且表面干燥结痂。待痂皮逐渐脱落后,观察到明显高出皮面的红褐色瘢痕样组织,与人HS外观相似。实验组20只小鼠中,18只可得到具有上述特点的类瘢痕组织,形成后均能存活2个月以上,且厚度逐渐增加,但持续一段时间后逐渐降低。另外两只SCID鼠移植皮片颜色逐渐发黑,约术后20 d坏死脱落,术后1个月创面由邻近自身皮肤修复。皮片坏死可能由于移植皮肤抗原性过强、小鼠个体免疫差异,以及手术包扎等原因引起。
人HS在组织学上表现为真皮层增厚,真皮乳头层及网状层界限不清,皮肤附属器结构改变,包括毛囊及钉突数量减少,毛细血管化明显[25]。我们在模型中可以观察到上述变化,并且组织学厚度的测量和大体结果一致,排除了小鼠自体愈合的干扰;值得一提的是,移植物的组织切片中可观察到肌成纤维细胞,而该细胞是人HS形成过程中的关键因素之一[27],该细胞的数量上升可导致细胞外基质过度合成,从而增加瘢痕厚度。
胶原过度沉积和胶原束排列紊乱是人HS的另一特点。由于炎性细胞及成纤维细胞分泌的大量生长因子,引起伤口愈合纤维化过程紊乱,导致胶原异常增生,特别是Ⅰ型胶原,在HS中胶原束往往较细长,直径在60 nm左右,而正常皮肤Ⅰ型胶原直径100 nm,成粗大条索状平行于皮面[25,28]。 Masson's染色后,观察到移植物胶原束较细长,成旋涡状或结节状分布,可提示该组织中胶原异常沉积且排列紊乱。羟脯胺酸含量测定表明组织中胶原含量增加[28-29],进一步说明该模型与人HS在胶原分布上的相似性。
TGF-β是人创面愈合过程中的重要作用因子,参与炎症反应、血管再生、成纤维细胞增生、胶原及细胞外基质的合成与重塑等过程[13,30]。在烧伤患者的血清中,往往可以观察到TGF-β的过度表达。研究表明,HS与TGF-β1的作用关系密切,而CTGF作为TGF-β1表达通路下游调节因子,在调节纤维化过程中和TGF-β1协同作用,TGF-β1和CTGF的表达水平可能对纤维化过程及瘢痕预后有潜在影响[13]。本实验中,移植物中的TGF-β1及CTGF的mRNA水平相较对照组有显著升高,表明该模型中类瘢痕组织的产生可能是TGF-β1与CTGF协同作用的结果。Sisco等[31]的研究显示,在动物模型中抑制CTGF的表达能够有效减少肌成纤维细胞的数量、TIPM-1及Ⅰ型胶原的合成,从而抑制HS的形成,但不会延长伤口愈合时间。我们拟在后续实验中进一步通过该模型来研究CTGF对于人HS的作用机制。
除了TGF-β外,该模型产生瘢痕的原因较复杂,考虑到该模型所用SCID鼠是一种免疫缺陷鼠,但其巨噬细胞、粒细胞、NK细胞均正常,而巨噬细胞也是HS形成早期就存在并发挥功能的一种炎性细胞,并能够分泌大量生长因子,从而影响炎症反应及纤维化[32-34],其中就包括TGF-β。因此,可以推测巨噬细胞的功能可能是该模型类瘢痕组织形成的另一因素,也可能是该模型的潜在应用方向和治疗靶点。
综上所述,我们可通过移植人类刃厚皮片于SCID鼠背创面,获得类似于人HS的组织,其在形态学及组织学上和人HS相似,但是尚不能证明两者完全一致,还需要从细胞水平进一步检测巨噬细胞和肌成纤维细胞的表达水平。但该模型制作操作简单,并能从瘢痕形成初始开始观察,具有很好的可控性,是一种理想的瘢痕模型。
[1]Momtazi M,Ding J,Kwanp,et al.Morphologic and histologic comparison of hypertrophic scar in nude mice,T-cell receptor,and recombination activating gene knockout mice[J].Plast Reconstr Surg,2015,136(6):1192-1204.
[2]Ogawa R.Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis[J].Int JMol Sci,2017,18(3):E606.
[3]Ali S,Hajrah NH,Ayuob NN,et al.Morphological and morphometric study of cultured fibroblast from treated and untreated abnormal scar[J].Saudi Med J,2010,31(8):874-881.
[4]Shekhter AB,Guller AE.The morphologic characteristics of scar tissues and the new clinicomorphologic classification of human skin scars[J].Arkh Patol,2008,70(1):6-13.
[5]Mari W,Alsabri SG,Tabal N,et al.Novel insights on understanding of keloid scar:article review[J].JAm Coll Clin Wound Spec,2016,7(1-3):1-7.
[6]Ledon JA,Savas J,Franca K,et al.Intralesional treatment for keloids and hypertrophic scars:a review[J].Dermatol Surg,2013,39(12):1745-1757.
[7]Kadunc BV,Trindade de Almeida AR.Surgical treatment of facial acne scars based on morphologic classification:a Brazilian experience[J].Dermatol Surg,2003,29(12):1200-1209.
[8]Rabello FB,Souza CD,Farina Júnior JA.Update on hypertrophic scar treatment[J].Clinics(Sao Paulo),2014,69(8):565-573.
[9]Domergue S,Jorgensen C,No e l D.Advances in research in animal models of burn-related hypertrophic scarring[J].J Burn Care Res,2015,36(5):e259-e266.
[10]Honardoust D,Kwan P,Momtazi M,et al.Novel methods for the investigation of human hypertrophic scarring and other dermal fibrosis[J].Methods Mol Biol,2013,1037:203-231.
[11]Tejiram S,Zhang J,Travis TE,et al.Compression therapy affects collagen type balance in hypertrophic scar[J].J Surg Res,2016,201(2):299-305.
[12]Wang J,Ding J,Jiao H,et al.Human hypertrophic scar-like nude mousemodel:characterization of themolecular and cellular biology of thescar process[J].Wound Repair Regen,2011,19(2):274-285.
[13]Penn JW,Grobbelaar AO,Rolfe KJ.The role of the TGF-βfamily in wound healing,burns and scarring:a review[J].Int J Burns Trauma,2012,2(1):18-28.
[14]Berman B,Maderal A,Raphael B.Keloids and hypertrophic scars:pathophysiology,classification,and treatment[J].Dermatol Surg,2017,43 Suppl 1:S3-S18.
[15]Ogawa R,Akaishi S.Endothelial dysfunction may play a key role in keloid and hypertrophic scar pathogenesis-Keloids and hypertrophic scars may be vascular disorders[J].Med Hypotheses,2016,96:51-60.
[16]Morris DE,Wu L,Zhao LL,et al.Acute and chronic animal models for excessive dermal scarring:quantitative studies[J].Plast Reconstr Surg,1997,100(3):674-681.
[17]Nabai L,Ghahary A.Hypertrophic scarring in the rabbit ear:a practical model for studying dermal fibrosis[J].Methods Mol Biol,2017,1627(4):81-89.
[18]Jia S,Xie P,Hong SJ,et al.Local application of statins significantly reduced hypertrophic scarring in a rabbit ear model[J].Plast Reconstr Surg Glob Open,2017,5(6):e1294.
[19]Zhu KQ,Engrav LH,Gibran NS,et al.The female,red Duroc pig as an animal model of hypertrophic scarring and the potential role of the cones of skin[J].Burns,2003,29(7):649-664.
[20]Foubert P,Zafra D,Liu M,et al.Autologous adipose-derived regenerative cell therapy modulates development of hypertrophic scarring in a red Duroc porcine model[J].Stem Cell Res Ther,2017,8(1):261.
[21]Sood RF,Muffley LA,Seaton ME,et al.Dermal fibroblasts from the red Duroc pig have an inherently fibrogenic phenotype:an in vitro model of fibroproliferative scarring[J].Plast Reconstr Surg,2015,136(5):990-1000.
[22]Harunari N,Zhu KQ,Armendariz RT,et al.Histology of the thick scar on the female,red Duroc pig:final similarities to human hypertrophic scar[J].Burns,2006,32(6):669-677.
[23]Yang DY,Li SR,Wu JL,et al.Establishment of a hypertrophic scar model by transplanting full-thickness human skin grafts onto the backs of nude mice[J].Plast Reconstr Surg,2007,119(1):104-109.
[24]Alrobaiea SM,Ding J,Ma Z,et al.A novel nude mouse model of hypertrophic scarring using scratched full thickness human skin grafts[J].Adv Wound Care(New Rochelle),2016,5(7):299-313.
[25]Momtazi M,Kwan P,Ding J,et al.A nude mouse model of hypertrophic scar shows morphologic and histologic characteristics of human hypertrophic scar[J].Wound Repair Regen,2013,21(1):77-87.
[26]de Vries TJ,Andreotta S,Loos BG,et al.Genes critical for developing periodontitis:lessons from mouse models[J].Front Immunol,2017,8:1395.
[27]Wang J,Jiao H,Stewart TL,et al.Accelerated wound healing in leukocyte-specific,protein 1-deficient mouse is associated with increased infiltration of leukocytes and fibrocytes[J].J Leukoc Biol,2007,82(6):1554-1563.
[28]Berthod F,Germain L,Li H,et al.Collagen fibril network and elastic system remodeling in a reconstructed skin transplanted on nude mice[J].Matrix Biol,2001,20(7):463-473.
[29]Marcos-Garcés V,Harvat M,Molina Aguilar P,et al.Comparative measurement of collagen bundle orientation by Fourier analysis and semiquantitative evaluation:reliability and agreement in Masson's trichrome,Picrosirius red and confocal microscopy techniques[J].JMicrosc,2017,267(2):130-142.
[30]Guo J,Lin Q,Shao Y,et al.BMP?7 suppresses excessive scar formation by activating the BMP?7/Smad1/5/8 signaling pathway[J].Mol Med Rep,2017,16(2):1957-1963.
[31]Sisco M,Kryger ZB,O'Shaughnessy KD,et al.Antisense inhibition of connective tissue growth factor(CTGF/CCN2)mRNA limits hypertrophic scarring without affecting wound healing in vivo[J].Wound Repair Regen,2008,16(5):661-673.
[32]Hesketh M,Sahin KB,West ZE,et al.Macrophage phenotypes regulate scar formation and chronic wound healing[J].Int J Mol Sci,2017,18(7):E1545.
[33]He L,Marneros AG.Macrophages are essential for the early wound healing response and the formation of a fibrovascular scar[J].Am JPathol,2013,182(6):2407-2417.
[34]Willenborg S,Eming SA.Macrophages-sensors and effectors coordinating skin damage and repair[J].J Dtsch Dermatol Ges,2014,12(3):214-221.
