骨髓间充质干细胞对七氟烷所致的原代神经元凋亡及细胞活性的影响
2018-04-09程燕咏王佳怡蒋云凤孙宇
程燕咏 王佳怡 蒋云凤 孙宇
七氟烷是最常用的吸入麻醉药,具有代谢率高、起效快、恢复快等特点。然而,大量的研究发现,七氟烷暴露与严重的神经系统副作用有关,如大脑结构异常、认知功能障碍、异常行为、自闭症等[1-3]。我们早先的研究也验证了长时间七氟烷暴露,能使发育期及成年大鼠产生认知功能障碍[4-5],猜测可能是激活了凋亡途径进而产生神经毒性[6],然而其具体机制尚未被阐明。
最近的研究表明,骨髓间充质干细胞(BMSCs)可以通过分泌神经营养因子、趋化因子和细胞因子,产生强大的神经保护作用[7-10]。注射BMSCs可改善鼠类缺血再灌注诱导的神经损伤[11]。临床试验表明,基于间充质干细胞的治疗是安全有效的[12-13]。但尚无研究证实BMSCs是否能改善七氟烷导致的神经毒性损伤。
本实验尝试应用BMSCs预处理干预七氟烷对原代神经元的凋亡和细胞活性产生的影响,探索BMSCs在缓解神经毒性损伤中起的作用;并通过检测培养液上清中的炎症因子TNFα水平,探索BMSCs通过抗炎、抗免疫失调机制产生神经保护作用的可能性,为防治七氟烷造成的神经毒性损伤提供新的思路。
1 材料和方法
1.1 主要试剂与仪器
DMEM培养基、Neuron-basal培养基、胎牛血清、0.25%胰蛋白酶(Gibco公司,美国);多聚赖氨酸(Sigma公司, 美国);caspase-3 抗体、β-actin 抗体(Cell Signaling Technology 公司,美国);电转液、电泳液 (生工生物工程有限公司);MTT检测试剂盒(上海翊圣生物科技有限公司);乳酸脱氢酶(LDH)检测试剂盒 (南京建成科技有限公司);ELISA检测试剂盒(联科生物技术股份有限公司)。
超净工作台、细胞培养箱(ThermoFisher公司,美国);倒置相差显微镜(Nikon公司,日本);电泳仪(Bio-Rad公司,美国);超敏化学发光成像系统(GE公司,美国);多功能酶标仪(BioTek公司,美国)。
1.2 细胞培养
1.2.1原代神经元的分离培养
50μg/mL的多聚赖氨酸包被培养皿,37℃过夜,吸除赖氨酸,PBS清洗晾干后备用。取出生24 h内的SD乳鼠 (中科院上海生命科学研究院提供),处死后75%乙醇消毒,无菌条件下将头部剪下,置于盛有预冷DMEM高糖培养液的培养皿中。分离出大脑,仔细剥除软脑膜和血管后,快速将脑组织移入另一盛有预冷DMEM高糖培养液的培养皿中,将脑组织剪成大小约1 mm3的碎块,加入0.25%胰蛋白酶,置于37℃培养箱中消化25 min后取出。终止消化后移入离心管,反复轻轻吹打使其成为细胞悬液,1 500 r/min离心10 min,弃上清。重悬静置后筛网过滤,再次离心弃上清,加接种培养液对细胞重悬后静置,以5×105cells/mL的细胞密度接种于多聚赖氨酸包被的细胞培养皿中。置于37℃培养箱中,4 h后换成含2%B27的Neuron-basal培养基继续培养。第3天进行半换液,第5天开始BMSC预处理。倒置相差显微镜下观察原代神经元的生长情况。
1.2.2BMSC的分离培养
取6 d龄雄性SD大鼠(上海第九人民医院动物实验中心提供),脱颈处死后75%乙醇消毒,无菌条件下取股骨,用5 mL DMEM低糖完全培养基(含10%胎牛血清,100 mg/mL青、链霉素)冲洗骨髓腔。冲洗得到的细胞悬液接种于6 cm培养皿。48~72 h半换液,之后每3天换液1次。细胞生长融合至80%~90%后,0.25%胰蛋白酶消化传代,取第3代细胞备用。
1.3 BMSC预处理及七氟烷暴露
BMSC的预处理以运用Transwell(24孔,0.4μm孔径,Costar)构建非接触性共培养体系的形式完成。以是否接受BMSCs预处理(BMSCs+/BMSCs-)和是否接受七氟烷暴露(SEV+/SEV-)为标准,分为4组。①SEV-BMSCs-组:原代神经元在孔下部,DMEM低糖完全培养基在膜上;②SEV-BMSCs+组:原代神经元在孔下部,200 μL BMSCs(1×105cells/mL)在膜上;③SEV+BMSCs-组:原代神经元在孔下部,DMEM低糖完全培养基在膜上;④SEV+BMSCs+组:原代神经元在孔下部,200 μL BMSCs(1×105cells/mL)在膜上。BMSCs预处理在正常培养箱中维持24 h。结束后,4组的上层小室均被取走,下层的培养基也均被更换。③④组随即进行七氟烷暴露 (4%七氟烷暴露6 h)。①②组继续在培养箱中培养。6 h后各组同时结束,取样检测。
1.4 Western Blot检测细胞凋亡
细胞蛋白的抽提和定量按照说明书操作。蛋白样品每次使用前煮沸5 min。配置12%凝胶,80 V恒压电泳至染料刚出胶底部,200 mA恒流转膜1 h。膜在5%脱脂奶粉中封闭1 h,加入一抗,4℃孵育过夜,TBST洗膜3遍后加入二抗,室温孵育1 h,TBST洗膜3遍后显色。以Image J软件统计灰度值。
1.5 MTT检测细胞活性
每孔加入100μL MTT,放入培养箱避光孵育4 h,吸除培养基,每孔加入600μL DMSO,低速震荡10 min,用酶标仪在490 nm波长下测定吸光度。
1.6 LDH检测细胞活性
收集各组培养液样本进行LDH检测。按说明书步骤加标准品绘制标准曲线。空白孔加入25μL双蒸水;标准孔加入5μL双蒸水和20μL丙酮酸标准应用液;测定孔加入20μL待测样品,5μL辅酶Ⅰ应用液;对照孔加入5μL双蒸水和20μL待测样品;各孔均加入25μL基质缓冲液。混匀,37℃温浴15 min后各孔加入25μL 2,4-二硝基苯肼。混匀,37℃温浴15 min后各孔加入250μL NaOH溶液。混匀,室温静置5 min,用酶标仪在450 nm波长测定OD值。
1.7 ELISA检测TNFα水平
各组培养液样本按说明书步骤加标准品绘制标准曲线。样本孔每孔加入50μL检测缓冲液和50 μL样本,每孔加入50μL检测抗体。封板膜封板,300 r/min振荡,室温孵育2 h。弃液,每孔加洗液洗板6次。每孔加100μL稀释的链霉亲和素。封板膜封板,300 r/min振荡,室温孵育45 min。弃液,每孔加洗液洗板6次。每孔加入100μL显色底物,避光室温孵育30 min。加入100μL反应终止液,用酶标仪测定在450 nm最大吸收波长和570 nm参考波长下的OD值。
1.8 数据处理及统计学分析方法
利用SPSS19.0软件进行统计分析,计算各测量项目的均值和标准差,组间差异采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 七氟烷处理对原代神经元形态学的影响
4%七氟烷处理6 h后,相差显微镜观察发现,原代神经元细胞分布稀疏,贴壁性降低,坏死脱落增加,部分神经元崩解。神经元胞体回缩,突起之间连接断裂;BMSC预处理可以减少七氟烷对原代神经元产生的形态学上的改变(图1)。
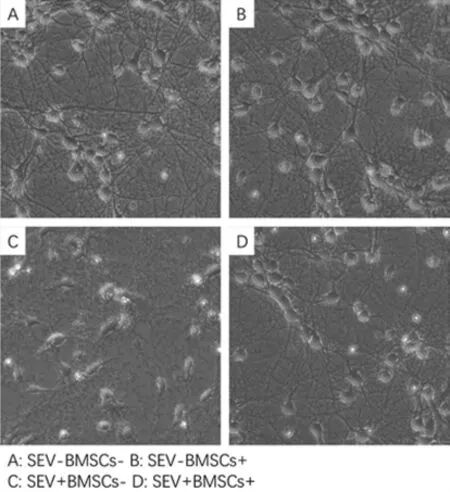
图1 各组原代神经元细胞形态学改变(100×)Fig.1 Morphological changes of primary cultured neuron in each group(100×)
2.2 BMSC对七氟烷暴露后原代神经元凋亡的影响
Western Blot结果显示,七氟烷暴露对于未进行BMSC预处理组的原代神经元细胞凋亡率的影响具有显著差异 (P<0.01);BMSC预处理可明显降低由七氟烷暴露引起的原代神经元凋亡(P<0.01);而未经七氟烷暴露组的原代神经元中,BMSC预处理对其凋亡率的影响没有统计学差异(图2)。说明BMSC预处理可减轻七氟烷暴露导致的原代神经元凋亡。
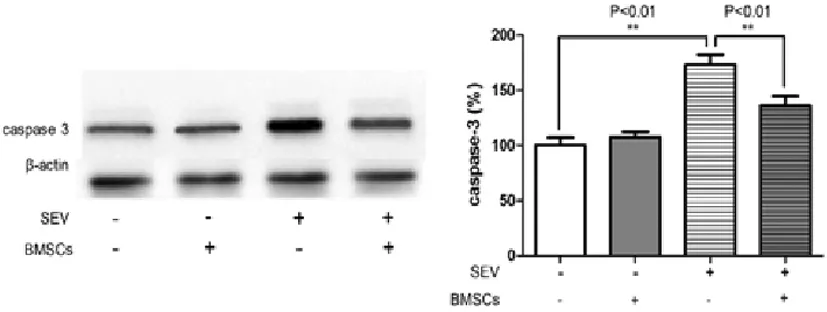
图2 Western Blot检测各组原代神经元细胞凋亡情况Fig.2 The cell apoptosis of primary cultured neuron in each group by Western Blot examine
2.3 BMSC对七氟烷暴露的原代神经元细胞活性的影响
MTT及LDH实验的统计分析结果均显示,七氟烷暴露对于未进行BMSC预处理组的原代神经元细胞活性的影响具有统计学差异 (P<0.05);BMSC预处理可缓解由七氟烷诱导的原代神经元活性降低,差异显著(P<0.05);在未接受七氟烷处理组的原代神经元中,BMSCs预处理对其细胞活性没有明显影响(图3)。以上数据表明,BMSCs预处理可改善七氟烷暴露导致的原代神经元活性降低。
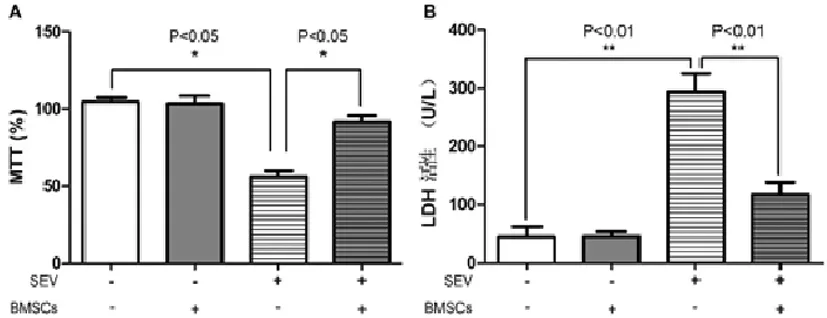
图3 MTT和LDH检测各组原代神经元细胞活性情况Fig.3 The cell viability of primary cultured neuron in each group by MTT and LDH examine
2.4 BMSC影响七氟烷暴露的原代神经元TNFα水平
ELISA检测显示,七氟烷暴露增加了未进行BMSC预处理的原代神经元上清TNFα水平,差异具有统计学意义 (P<0.01);BMSC预处理可降低由七氟烷诱导的原代神经元上清TNFα分泌水平,差异显著(P<0.01);在未接受七氟烷处理组的原代神经元中,BMSC预处理对上清TNFα水平的影响没有统计学差异。说明BMSC预处理可以减少七氟烷导致的TNFα大量释放。
3 讨论
本实验中,我们发现七氟烷暴露会导致原代神经元细胞形态改变,引起细胞凋亡,细胞活性降低及TNFα释放。TNFα有导致肿瘤细胞坏死、抗感染、免疫调节等作用,又可作为应激反应指标。七氟烷暴露后,原代神经元培养基中TNFα水平明显增高,说明七氟烷使原代神经元处于一种免疫失调、炎症反应过度的状态。我们的研究发现,利用非接触性共培养模型完成的BMSC预处理可以缓解这些损伤。BMSC可以分泌神经营养因子、细胞因子和其他与神经保护相关的可溶性因子[7-9],由此减少七氟烷导致的原代神经元的凋亡,改善细胞活性的降低,减少TNFα释放。说明BMSC预处理可以减轻七氟烷导致的神经毒性损伤,且这种治疗效果可能是通过改善七氟烷暴露后的炎症反应和免疫功能失调达成的。这些发现为防治七氟烷的神经毒性损伤提供了新的见解。鉴于七氟烷是一种被广泛应用于临床的吸入麻醉剂,我们应该对其临床使用持有更谨慎的态度。
考虑到七氟烷引起的原代神经元凋亡是一种氧化级联反应,此类损伤一旦启动将很难被克服[14]。故本研究选择在七氟烷暴露之前用BMSC进行预处理。七氟烷造成的神经损伤与其他不可预期的神经损伤不同,绝大部分发生七氟烷暴露的手术都是择期手术,BMSC的预防性处理也是符合基本临床情况的。
BMSC已被证实可以分泌神经营养因子、细胞因子和其他胞外囊泡(EVs),并由此发挥其免疫抑制活性,且神经保护功能也可能与细胞间接触无关[15]。本研究的BMSCs预处理方法是通过Transwell小室构建的非接触性共培养体系来完成的。因此,我们的研究也支持以上观点,认为BMSC的抗七氟烷神经毒性作用是通过分泌可溶性因子介导的。BMSC分泌的EVs包括外泌体、核外颗粒体、细胞微泡、微粒和凋亡小体等[16]。鉴于大多数EVs能够通过血脑屏障且相对稳定,确定具体的作用成分将对研究各种神经毒性损伤的治疗具有重大意义。
本研究存在一定的局限性。首先,BMSC是从新生SD大鼠中获取的,而原代神经元是从新生小鼠中获得。在动物实验中,人类、小鼠、大鼠的异种BMSC已被广泛应用[17-19],具有低免疫原性的优点,这也使其成为临床应用的理想工具。自体和同种异体BMSC已被证明可在人类中安全使用[20-21]。我们计划分离出BMSC具体的有效成分进行下一步动物实验,并发现其具体机制,由此更好地避免异种之间可能发生的排斥反应。其次,本次研究观察的是七氟烷暴露后即刻的损伤,这可能不能完全模拟神经损伤的完整状态。在进一步的研究中,我们将延长观察期。第三,这些结果均基于细胞实验,仍需要在动物实验中得到证实。
[1]Takaenoki Y,Satoh Y,Araki Y,et al.Neonatal exposure to sevoflurane in mice causes deficits in maternal behavior later in adulthood[J].Anesthesiology,2014,120(2):403-415.
[2]Shen X,Dong Y,Xu Z,et al.Selective anesthesia-induced neuroinflammation in developing mouse brainandcognitive impairment[J].Anesthesiology,2013,118(3):502-515.
[3]Satomoto M,Satoh Y,Terui K,et al.Neonatal exposure to sevoflurane induces abnormal social behaviors and deficits in fear conditioning in mice[J].Anesthesiology,2009,110(3):628-637.
[4]Yu Y,Zhang P,Yan J,et al.Sevoflurane induces cognitive impairments via the MiR-27b/LIMK1-signaling pathway in developing rats[J].Inhal Toxicol,2016,28(14):731-738.
[5]Jiang J,Lv X,Wu X,et al.Downregulation of circulating insulinlike growth factor 1 contributes to memory impairment in aged mice after sevoflurane anesthesia[J].Behav Pharmacol,2017,28(2 and 3-Special Issue):238-243.
[6]王来,罗艳,薛庆生,等.七氟烷对发育期中枢神经系统毒性的研究进展[J].国际麻醉学与复苏杂志,2013,34(5):461-463.
[7]Fu Y,Karbaat L,Wu L,et al.Trophic effects of mesenchymal stem cells in tissue regeneration[J].Tissue Eng Part B Rev,2017,23(6):515-528.
[8]Kim HS,Choi DY,Yun SJ,et al.Proteomic analysisof microvesicles derived from human mesenchymal stem cells[J].JProteome Res,2012,11(2):839-849.
[9]Koh SH,Noh MY,Cho GW,et al.Erythropoietin increases the motility of human bone marrow-multipotent stromal cells(hBMMSCs)and enhances the production of neurotrophic factors from hBM-MSCs[J].Stem Cells Dev,2009,18(3):411-421.
[10]王东梅,郭子宽.新型干细胞治疗:科学和政策[J].组织工程与重建外科,2011,7(2):61-64.
[11]Shen LH,Li Y,Chen J,et al.Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke[J].JCereb Blood Flow Metab,2007,27(1):6-13.
[12]Bordignon C,Carlo-Stella C,Colombo MP,et al.Cell therapy:achievements and perspectives[J].Haematologica,1999,84(12):1110-1149.
[13]Si YL,Zhao YL,Hao HJ,et al.MSCs:Biological characteristics,clinical applications and their outstanding concerns[J].Ageing Res Rev,2011,10(1):93-103.
[14]Griendling KK,Fitzgerald GA.Oxidative stress and cardiovascular injury:Part I:basic mechanisms and in vivo monitoring of ROS[J].Circulation,2003,108(16):1912-1916.
[15]Lai RC,Arslan F,Lee MM,et al.Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury[J].Stem Cell Res,2010,4(3):214-222.
[16]Lotvall J,Hill AF,Hochberg F,et al.Minimal experimental requirements for definition of extracellular vesicles and their functions:a position statement from the International Society for Extracellular Vesicles[J].JExtracell Vesicles,2014,3:26913.
[17]Costa-Ferro ZS,De Borba Cunha F,De Freitas Souza BS,et al.Antiepileptic and neuroprotective effects of human umbilical cord blood mononuclear cells in a pilocarpine-induced epilepsy model[J].Cytotechnology,2014,66(2):193-199.
[18]Venturin GT,Greggio S,Marinowic DR,et al.Bone marrow mononuclear cells reduce seizure frequency and improve cognitive outcome in chronic epileptic rats[J].Life Sci,2011,89(7-8):229-234.
[19]Li T,Ren G,Kaplan DL,et al.Human mesenchymal stem cell grafts engineered to release adenosine reduce chronic seizures in a mouse model of CA3-selective epileptogenesis[J].Epilepsy Res,2009,84(2-3):238-241.
[20]Karussis D,Karageorgiou C,Vaknin-Dembinsky A,et al.Safety and immunological effects of mesenchymal stem cell transplantation in patientswith multiplesclerosisand amyotrophic lateral sclerosis[J].Arch Neurol,2010,67(10):1187-1194.
[21]Zhang H,Zeng X,Sun L.Allogenic bone-marrow-derived mesenchymal stem cells transplantation as a novel therapy for systemic lupus erythematosus[J].Expert Opin Biol Ther,2010,10(5):701-709.
