骨髓间充质干细胞移植对周围神经损伤后施旺细胞的影响
2018-04-09邱超郑亚妮许硕贵
邱超 郑亚妮 许硕贵
周围神经损伤是临床常见疾患,随着神经桥接和自体神经移植等方法的应用,其修复取得了一定进展,但损伤后的功能恢复仍不尽如人意。其中,影响神经再生和功能修复的主要因素是神经远侧段施旺细胞支持神经再生的能力,故围绕促进施旺细胞再生及存活的研究,成为周围神经损伤修复研究的热点问题。
间充质干细胞 (Mesenchymal stem cells,MSCs)具有自我更新和多向分化能力,是临床细胞治疗中极具吸引力的干细胞资源,可由骨髓、脂肪、脐血和其他成体组织分离获得[1-2]。前期研究发现,MSC植入后可治疗神经损伤和退化[3-5]。其中,BMSCs发现较早,具有来源丰厚、获取简单、增殖力强等诸多优点,是常用的神经组织工程种子细胞[6]。本研究采用SD大鼠来源的BMSCs,将其植入大鼠坐骨神经损伤处,观察其对神经损伤后施旺细胞的影响。
1 材料和方法
1.1 实验动物和材料
雄性SD大鼠,3周龄2只,体质量40~50 g;6周龄9只,体质量180~200 g(第二军医大学动物中心)。DMEM/F12培养基(广州赛业生物科技有限公司);胎牛血清(FBS)和 1%青霉素/链霉素(美国Gibco公司);小鼠抗S100β抗体 (美国Abcam公司);山羊抗小鼠IgG二抗 (美国Invitrogen公司);DAPI和RIPA(武汉谷歌生物科技有限公司)。
1.2 大鼠BMSCs的分离和培养
将2只3周龄SD大鼠经脱臼处死后,置于75%乙醇中消毒5 min,取双侧股骨,15 m L PBS冲洗骨髓腔,收集冲洗液,并用70μm细胞筛网过滤,将滤液移至15 m L离心管中,1 500 r/min离心5 min,用培养基(DMEM/F12+10%FBS+1%青霉素/链霉素)重悬后种植于培养瓶中,置37℃、5%的CO2培养箱中培养。24 h后全换液,PBS冲洗3次,去除未贴壁细胞。当细胞达80%融合时,按1∶2传代,传至第4代后备用。
1.3 坐骨神经横断损伤模型的制备
9只6周龄SD大鼠,其中3只为正常组,仅分笼正常饲养即可。其余6只腹腔麻醉后,暴露坐骨神经,在距坐骨结节远侧4 mm处切断,神经断端旷置,将肌肉和皮肤缝合。2周后即成为神经损伤模型。术后常规抗感染治疗,正常分笼饲养。
1.4 BMSCs移植
将损伤模型分为BMSCs组和PBS组,每组3只,损伤2周后进行细胞移植。腹腔麻醉,暴露横断损伤后的坐骨神经。BMSCs组用10μL的 Hamilton微量注射器,向损伤神经远侧段注入BMSCs,细胞浓度2×105cells/μL,总量 3 μL,分 3点注入。 PBS 组,即对照组,同法注入等量PBS。然后缝合肌肉和皮肤,术后进行抗感染治疗,正常分笼饲养,6周后取材。
1.5 HE染色和免疫荧光染色
将厚度为5μm的坐骨神经石蜡切片,常规HE染色,中性树胶封片,镜下观察拍照。
坐骨神经石蜡切片 (5μm厚),4%多聚甲醛固定 10 min,PBS清洗 3遍,0.3%Triton-X-100打孔10 min,5%驴血清封闭 20 min,孵育一抗(S-100β,1∶400),4℃过夜, 二抗室温孵育1.5 h,PBS清洗3遍,每次 5 min,DAPI染核 5 min,PBS 清洗 3 遍,每次5 min。抗荧光淬灭剂封片,荧光显微镜下观察。
1.6 统计学处理
以SPSS21.0统计学软件进行分析,计量数据以(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs形态特征
BMSCs呈典型长梭形贴壁生长,两端有较长突起,胞核为卵圆形,均匀分布。细胞从原代(图1A)至第4代形态变化不明显(图1B)。我们的前期实验已对同样方法获得的细胞进行了鉴定,其对于CD44、CD90的表达高达90%,而CD34、CD45的表达则为阴性,证实其为BMSCs[7]。

图1 BMSCs的形态特征(标尺=100μm)Fig.1 Morphology of BMSCs(Scale bar=100μm)
2.2 HE染色观察
HE染色可见正常坐骨神经轴突及雪旺细胞排列整齐,施旺细胞完整且结构清晰,并间断形成有规律的迂曲(图2 A)。坐骨神经损伤后有些轴突肿胀、轴突及雪旺细胞破溃、排列杂乱;BMSCs组相较于PBS组,施旺细胞数量明显较多,且排列较均匀,连接较紧密(图2 C);PBS组细胞排列稀疏,分布混乱(图 2 B)。

图2 损伤坐骨神经远侧段HE染色观察(标尺=50μm)Fig.2 Morphological observation of the distal of injured sciatic nerve by HE staining(Scale bar=50μm)
2.3 免疫荧光染色观察
结果显示,纵切面(图3 A-C)施旺细胞在正常坐骨神经组织中,平行有序致密排列。而损伤后的组织中,施旺细胞数量变少,且出现破碎和中断,排列间隙变大。与PBS组相比,BMSC s组的细胞结构更清晰,细胞数量更多,细胞完整度更高。横切面上(图3 D-F)正常神经的施旺细胞呈圆形,排列均匀。PBS组细胞破碎,出现大量零星的S-100β的表达,而在BMSC组中,完整的施旺细胞数量显著增多 (图3 G),与正常组的施旺细胞形态更为接近。实验结果提示,植入的BMSCs能促进施旺细胞的存活或再生,促进细胞生成更规则和完整的形态。
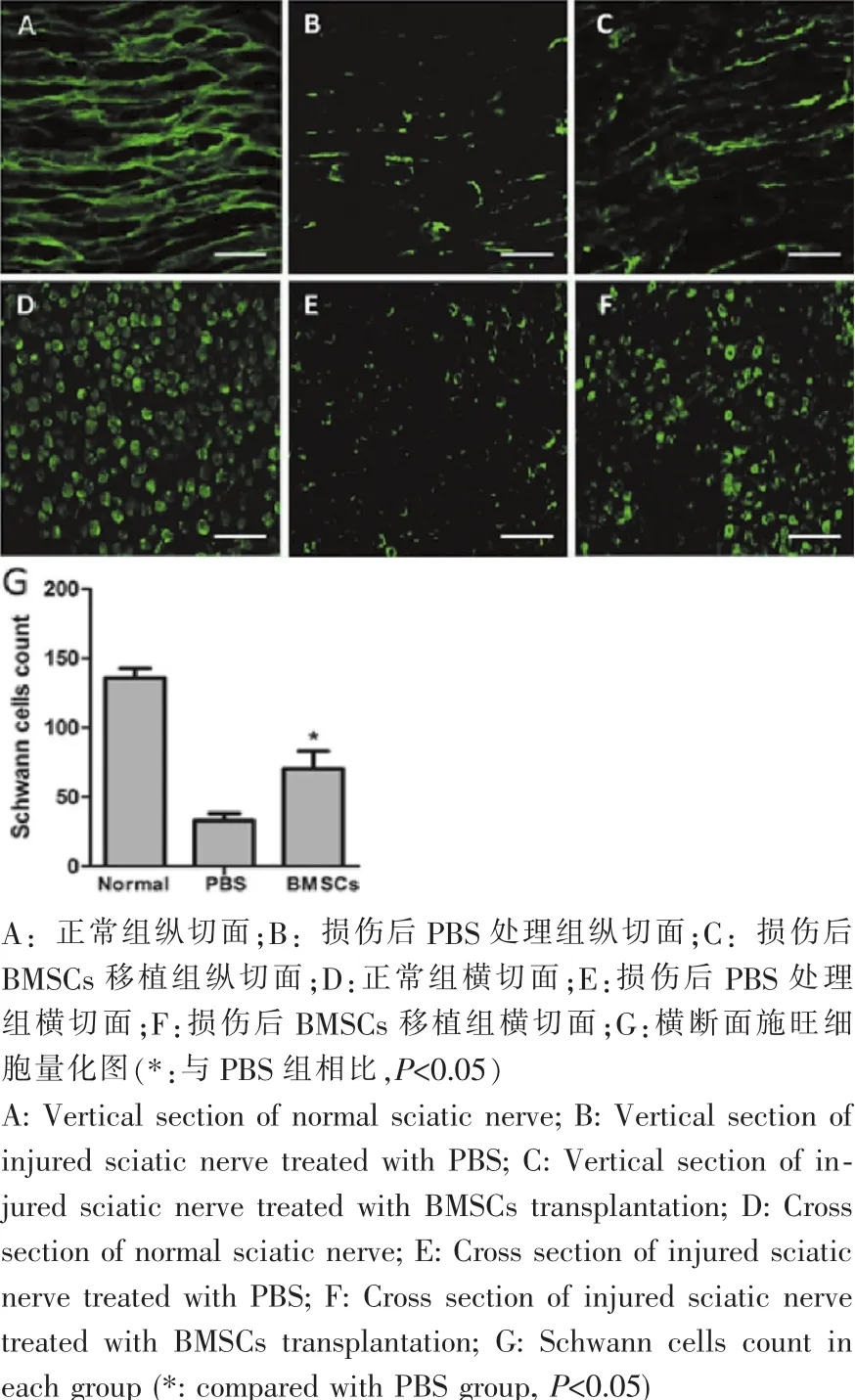
图3 损伤坐骨神远侧段免疫荧光染色观察(A-C:标尺=10μm;D-F:标尺=25μm)Fig.3 Morphological observation of the distal of injured sciatic nerve by immunofluorescence staining(A-C:Scale bars=10μm;D-E:Scale bars=25μm)
3 讨论
周围神经再生速度很慢,过程复杂,影响其再生和功能修复的主要因素涉及3个方面:神经元的再生能力;损伤神经远侧段施旺细胞支持神经再生的能力;靶器官接受神经再支配能力。而其中导致神经再生受阻的主要原因是损伤神经远侧段施旺细胞对神经再生的支持[8-9]。
神经损伤后,其远侧段失神经施旺细胞基因表达迅速发生改变,细胞表型由髓鞘型转变为生长支持型。施旺细胞开始分裂、增殖,并在1周时达到高峰,增殖的施旺细胞在基膜内形成Büngner带,为再生轴突提供营养支持和物理保护功能[10-11]。如果长期得不到近侧段轴突的再接触,施旺细胞会萎缩、塌陷和凋亡。施旺细胞上调炎性因子、神经营养因子以及黏附分子的表达,同时会募集巨噬细胞于损伤处,以清除损伤轴突及髓鞘残骸,为轴突再生提供合适的微环境[10]。轴突再生后,施旺细胞转变为髓鞘型,包绕轴突形成髓鞘,支持后期神经功能的恢复[12]。神经末端的施旺细胞引导再生轴突方向,使其准确找到靶器官。施旺细胞通过以上多种方式支持周围神经的再生和功能恢复。
基于损伤远侧段失神经施旺细胞是维持神经再生的关键因素,施旺细胞替代治疗和组织工程的研究成为周围神经损伤修复的热点问题[13-15]。有研究将施旺细胞或将干细胞植入体内,观察移植后轴突再生和功能恢复情况[16-17]。但是,却少有报道观察干细胞植入后对宿主施旺细胞的保护及促再生作用。本实验重点观察BMSCs移植后施旺细胞的变化,探究其是否对宿主施旺细胞有保护和促进再生的作用,以进一步探讨干细胞促进周围神经再生的作用机制。
本实验检测了损伤区域BMSCs对施旺细胞的保护和再生作用,BMSC s组相较于PBS组有更好的细胞形态和更多的细胞数量,而且HE染色也同时观察到神经纤维的排列更加整齐有序,神经恢复情况更好。在免疫荧光染色中,可见PBS组中施旺细胞大多破碎分布不均,而BMSC组中完整细胞数量更多,结构更加清晰。说明BMSCs细胞的接触对长期失神经的施旺细胞有保护功能,使其维持正常细胞形态,在损伤8周后,施旺细胞依然能够保持其正常的细胞结构并发挥其支持神经再生的功能。
上述结果说明,BMSCs植入坐骨神经后除了有替代功能外,还可以通过保护施旺细胞,进而促进周围神经的再生和功能恢复。
[1]Zou JP,Huang S,Pen g Y,et al.Mesenchymal stem cells/multipotent mesenchymal stromal cells(MSCs):potential role in healing cutaneous chronic wounds[J].Int JLow Extrem Wounds,2012,11(4):244-253.
[2]Du WJ,Chi Y,Yang ZX,et al.Heterogeneity of proangiogenic features in mesenchymal stem cells derived from bone marrow,adipose tissue,umbilical cord,and placenta[J].Stem Cell Res Ther,2016,7(1):163.
[3]Huang T,He D,Kleiner G,et al.Neuron-like differentiation of adipose-derived stem cells from infant piglets in vitro[J].J Spinal Cord Med,2007,30(Suppl 1):S35-S40.
[4]Alexanian AR,Fehlings MG,Zhang Z,et al.Transplanted neurally modified bone marrow-derived mesenchymal stem cells promote tissue protection and locomotor recovery in spinal cord injured rats[J].Neurorehabil Neural Repair,2011,25(9):873-880.
[5]Spejo AB,Carvalho JL,Goes AM,et al.Neuroprotective effects of mesenchymal stem cells on spinal motoneurons following ventral root axotomy:synapse stability and axonal regeneration[J].Neuroscience,2013,250:715-732.
[6]Kern S,Eichler H,Stoeve J,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24(5):1294-1301.
[7]Zheng Y,Huang C,Liu F,et al.Comparison of the neuronal differentiation abilities of bone marrowderived and adipose tissue-derived mesenchymal stem cells[J].Mol Med Rep,2017,16(4):3877-3886.
[8]Sulaiman OA,Gordon T.Effects of short-and long-term Schwann cell denervation on peripheral nerve regeneration,myelination,and size[J].Glia,2015,32(3):234-246.
[9]Sulaiman OA,Gordon T.Role of chronic Schwann cell denervation in poor functional recovery after nerve injuries and experimental strategies to combat it[J].Neurosurgery,2009,65(4 Suppl):A105-A114.
[10]Hall SM.The biology of chronically denervated Schwann cells[J].Ann N Y Acad Sci,1999,883:215-233.
[11]Corfas G,Velardez MO,Ko CP,et al.Mechanisms and roles of axon-Schwann cell interactions[J].J Neurosci,2004,24(42):9250-9260.
[12]Bosse F.Extrinsic cellular and molecular mediators of peripheral axonal regeneration[J].Cell Tissue Res,2012,349(1):5-14.
[13]Fansa H,Keilhoff G.Comparison of different biogenic matrices seeded with cultured Schwann cells for bridging peripheral nerve defects[J].Neurol Res,2004,26(2):167-173.
[14]Fox IK,Schwetye KE,Keune JD,et al.Schwann-cell injection of cold-preserved nerve allografts[J].Microsurgery,2005,25(6):502-507.
[15]Arino H,Brandt J,Dahlin LB.Implantation of Schwann cells in rat tendon autografts as a model for peripheral nerve repair:long term effects on functional recovery[J].Scand J Plast Reconstr Surg Hand Surg,2008,2(6):281-285.
[16]Walsh S,Midha R.Practical considerations concerning the use of stem cells for peripheral nerve repair[J].Neurosurg Focus,2009,26(2):E2.
[17]Walsh SK,Kumar R,Grochmal JK,et al.Fate of stem cell transplants in peripheral nerves[J].Stem Cell Res,2012,8(2):226-238.
