Adv-GFP标记的骨髓间充质干细胞输注对肝癌中TGF-β1、PDCD4及c-fos的影响
2018-04-08胡泽楠周永宁
胡泽楠 任 茜 严 俊 周永宁
(兰州大学第一医院消化科,甘肃 兰州 730000)
肝癌是常见的恶性肿瘤,目前尚缺乏行之有效的方法辅助手术切除的肝癌患者自我修复〔1〕。骨髓间充质干细胞(BMSCs)由于来源丰富,具有多方向分化的潜能,而展现出良好的应用前景〔2〕。BMSCs归巢的特性,也为输注辅助治疗肝癌提供了新策略〔3,4〕。本研究采用腺病毒转染标记绿色荧光的BMSCs输注,观察输注BMSCs对肝癌是否有保护作用。
1 材料与方法
1.1材料健康雄性SD幼鼠,实验操作符合动物伦理学要求。主要仪器及试剂:酶标仪(TECAN sunrise)、低温超高速离心机(Thermo)、荧光显微镜(Zeiss)、恒冷箱切片机(Shandon)、低糖DMEM培养液(hyclone)、胎牛血清(FBS,Sigma)、青霉素100 U/ml、链霉素100 μg/ml。
1.2方法
1.2.1BMSCs的体外分离、培养将成年雄性SD大鼠泡在碘酒中消毒处死,剥离皮肤和肌肉,取出两侧股骨,剪断两端。用L-DMEM 培养液反复冲洗骨髓腔,收集冲洗液,接种到涂有多聚赖氨酸的50 ml 培养瓶中,并置入37℃、5%CO2培养箱中培养。以后每隔2 d进行换液。当细胞长满培养瓶时,进行传代培养。用D-Hank液清洗细胞表面,0.25% 胰酶(0.02%EDTA) 消化1 min后,用含血清的培养液终止消化。等到90%的细胞从贴壁状态转化为悬浮状态,吹打细胞,并收集细胞悬液,1 000 r/min离心5 min后,用含10%FBS的培养液重新悬浮细胞。将细胞接种至两个培养瓶中继续培养。当细胞再长满瓶底时,同样按照上述方法进行传代。
1.2.2BMSCs的标记鉴定获取P3~P5代BMSCs,去除培养液后,用D-Hank漂洗1次,用0.25%胰酶(0.02% EDTA) 消化至细胞悬浮后,再用含血清的培养液终止消化。离心5 min收集细胞。用含血清的培养液重悬细胞后,用计数板计数。计算体积0.5 ml、含3×106mmol/L BMSCs,获取相应细胞量再离心,后弃上清液。以相应体积的D-Hank培养液重新悬浮BMSCs。将构建好的表达绿色荧光蛋白的腺病毒(Adv-GFP)按MOI200转染细胞。第2天将标记上GFP的MSCs按3×106mmol/L 0.5 ml尾静脉注射到大鼠体内。标记上绿色荧光的BMSCs在荧光显微镜下拍照鉴定。
1.2.3SD鼠肝癌模型构建和BMSCs输注及其观察用含0.02 ppm黄曲霉毒素(AF)B1的饲料喂食大鼠120 d,构建肝癌模型。将建模成功的肝癌大鼠随机分为对照组和治疗组。对照组接受0.5 ml D-Hank输注。治疗组接受含3×106mmol/L,0.5 ml BMSCs的D-Hank输注。
1.2.4BMSCs输注2 w后观察治疗效果移植2 w后,检测两组中输注细胞的归巢情况。SD大鼠用1%的戊巴比妥钠麻醉后备皮,切开皮肤,在脊柱旁开1 cm处椎旁肌内植入2 mm PLGA支架,去细胞脊髓支架和三维明胶海绵支架。两组大鼠缝线缝合肌肉及皮肤,术后分组饲养,每日2次肌注抗菌素。每天观察皮肤手术切口及动物反应变化。于手术后第1周将大鼠灌注,固定:将1%戊巴比妥钠注射到大鼠腹腔内致死; 剪开胸腔,充分暴露心脏。将灌注针从心室插管至升主动脉,并用钳子固定针管。同时快速灌注磷酸盐缓冲液(PBS)120 ml以冲去血液,开始灌注时剪开心耳放血,以形成灌注流,冲洗至肝脏无血色即为冲洗血液干净。先快速灌注50 ml 4%的多聚甲醛,后慢速灌注250 ml,固定时间控制在至少30 min。取肝脏组织,冰冻切片,片厚30 μm,取组织进行Hoechst33342染色,荧光镜下计数组织中绿色荧光细胞数目。每组5只动物,每只动物选8张切片进行统计。
1.2.5RT-PCR检测转化生长因子(TGF)-β1、程序化凋亡因子PDCD4基因的表达引物设计见表1。使用Trizol法裂解细胞,提取细胞总RNA,进行纯度鉴定,将RNA 用反转录试剂盒反转录为cDNA,最后经PCR扩增出相应cDNA。PCR产物最后通过电泳进行半定量。
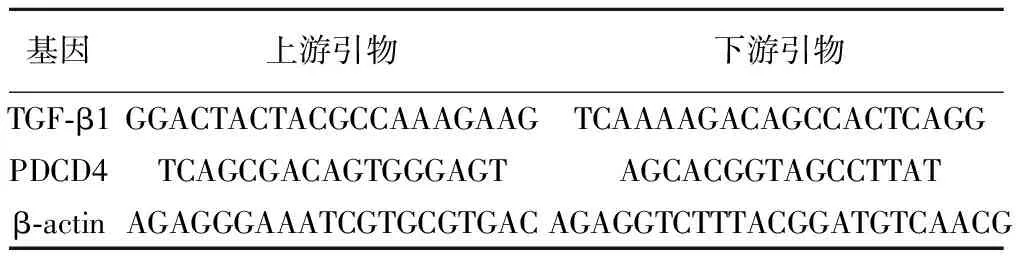
表1 TGF-β1、PDCD4基因的引物
1.2.6Western印迹检测c-fos蛋白的表达用10%分离胶分离蛋白,然后湿转法将蛋白转至聚偏氟乙烯(PVDF)膜上,室温下封闭,使用总抗c-fos(abcam,ab48942)一抗孵育过夜,第2天用羊抗兔
辣根过氧化物酶(HRP)孵育1 h后,加入显色剂,曝光。
1.3统计学方法采用SPSS13.0软件行方差分析。
2 结 果
2.1大鼠BMSCs的标记见图1,第4代细胞中BMSCs形态比较均一,多为长梭形或纺锤状。将标记有GFP的腺病毒转染之后,骨髓干细胞在荧光显微镜下显示绿色荧光,细胞形态为长梭形、成纤维细胞样或多角形,呈放射状,形成小集落,胞界清楚。经过细胞核Hoechst33342染色,可以观察到转染病毒后的细胞状态良好,可用于体内示踪标记。
2.2大鼠肝脏中绿色BMSCs的数量见图2。对照组肝脏中无含绿色荧光标记的BMSCs,而治疗组中可以看到切面上有部分绿色荧光的BMSCs(16.1±5.42),说明标记绿色荧光的BMSCs能够通过尾静脉注射归巢到达肝脏组织中行使某种功能。
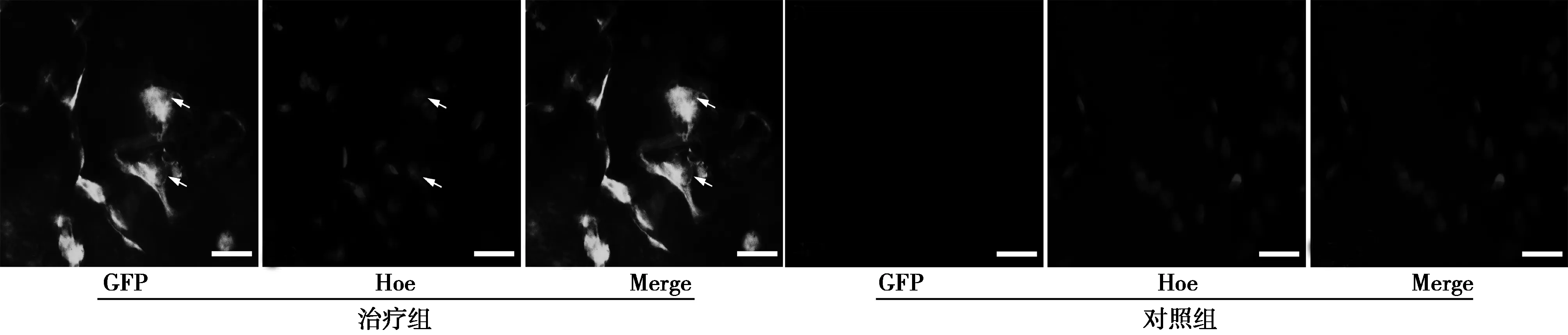
图2 两组肝脏中绿色BMSCs
2.3大鼠肝脏中TGF-β1和PDCD4基因表达情况对照组肝脏中TGF-β1较高表达(2.93±0.30)、PDCD4基因低表达(0.76±0.36);治疗组接受治疗2 w后,TGF-β1表达显著降低(1.52±0.23)、PDCD4基因表达显著提高(3.62±0.24,均P<0.05)。
2.4大鼠肝脏中c-fox蛋白表达对照组肝脏中有更高的c-fos蛋白表达(1.18±0.14),而治疗组在接受BMSCs治疗2 w后,c-fos蛋白表达显著降低(0.21±0.07,P<0.05)。见图3。
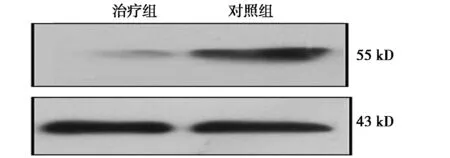
图3 两组c-fos的蛋白量
3 讨 论
肝癌是我国常见高发的恶性肿瘤之一,目前肝癌治疗的最有效手段是手术切除,但对于无法进行手术切除及手术切除预后不好的病人,仍然需要寻找更好的辅助手段治疗〔4〕。近年来BMSCs由于来源方便,可由病人自身提供,移植后免疫排斥反应低,无伦理争议,受到了广泛的关注。BMSCs输注治疗的相关研究很多,如何能够更好地观察干细胞的去向成为研究的关键〔5~7〕。本研究通过基因手段,将普通的BMSCs改造成为自发绿色荧光的细胞,能更准确地进行标记、追踪和观察干细胞,为相关研究提供了新的实验思路和依据〔8,9〕。本实验观察到,尾静脉注射后,治疗组中的BMSCs能够归巢到达肝脏。这种归巢机制十分复杂,有研究发现,通过尾静脉注射,BMSCs能够归巢到心肌梗死老鼠的心肌中,这种归巢到损伤组织的特性由组织损伤后释放的多种趋化因子介导〔10〕。
TGF-β1是一种蛋白多肽,具有多种功能,是TGF-β超家族成员之一。在细胞生长、分化、炎症免疫、调节和损伤修复等方面,TGF-β1都发挥重要作用。在肝细胞增殖调节方面,TGF-β1具有负相调节作用〔11〕。有研究发现正常干细胞无TGF-β1,而在肝癌细胞中TGF-β1 mRNA表达提高,而TGF-β1水平提高也会促进肝癌的进一步侵袭和转移〔12〕。本研究发现,尾静脉输注BMSCs,TGF-β1表达受到抑制,虽然这种抑制并没能达到零,即达到正常肝脏的零表达水平,但这种表达的下调说明BMSCs输注能够有效调节肝脏中TGF-β1表达。
PDCD4基因是一种抑癌基因,具有启动eIF4A、eIF4G,从而抑制细胞生长的作用。研究发现,癌组织中PDCD4表达下降甚至缺失,提示PDCD4表达上调可能是癌症受到抑制的标志之一〔13〕。本研究再一次证明了尾静脉输注BMSCs具有一定的治疗效果。
原癌基因c-fos在细胞生长的静止期不表达,在有增生的正常肝组织中也能检测到少量表达,而在癌症组织的细胞中过度表达,可作为一种探寻癌症状态的标志物。c-fos蛋白可与c-jun蛋白形成二聚体AP-1,进一步与DNA结合参与转录的过程〔14〕。本课题研究结果说明通过BMSCs尾静脉输注能够从mRNA到蛋白水平逆转肝脏细胞中的癌症状态,这种逆转可能无法达到正常水平,但是为无法接受肝脏切除的病人或接受肝脏切除病人的预后提供了可能的干预手段。
1Zuo TT,Zheng RS,Zhang SW,etal.Incidence and mortality of liver cancer in China in 2011〔J〕.Chin J Cancer,2015;34(3):56.
2Pittenger MF,Blanc KL,Phinney DG,etal.MSCs:scientific support for multiple therapies〔J〕.Stem Cell Int,2015;2015:280572.
3穆丽雅,韩明子,祁金锋.门静脉和尾静脉注入小鼠骨髓干细胞向肝脏迁移的比较〔J〕.世界华人消化杂志,2006;14(14):1408-11.
4Shinohara T,Maeda Y,Hamada T,etal.Survival benefit of surgical treatment for liver metastases from gastric cancer〔J〕.J Gastrointest Surg,2015;19(6):1043-51.
5Sheng G.The developmental basis of mesenchymal stem/stromal cells(MSCs)〔J〕.Bmc Dev Biol,2015;15(1):44.
6Yulyana Y,Ho IAW,Sia KC,etal.Paracrine factors of human fetal MSCs inhibit liver cancer growth through reduced activation of IGF-1R/PI3K/Akt signaling〔J〕.Mol Ther,2015;23(4):746-56.
7Hao NB,Li CZ,Lü MH,etal.SDF-1/CXCR4 axis promotes MSCs to repair liver injury partially through trans differentiation and fusion with hepatocytes〔J〕.Stem Cells Int,2015;2015:960387.
8Gao Y,Yao A,Zhang W,etal.Human mesenchymal stem cells over-expressing pigment epithelium-derived factor inhibit hepatocellular carcinoma in nude mice〔J〕.Oncogene,2010;29(19):2784-94.
9Niess H,Bao Q,Conrad C,etal.Selective targeting of genetically engineered mesenchymal stem cells to tumor stroma microenviron-mentsusing tissue-specific suicide gene expression suppresses growth of hepatocellular carcinoma〔J〕.Ann Surg,2011;254(5):767-74.
10Assis ACM,Carvalho JL,Jacoby BA,etal.Time-dependent migration of systemically delivered bone marrow mesenchymal stem cells to the infarcted heart〔J〕.Cell Transpl,2010;19(2):219-30.
11Yeh MM,Larson AM,Campbell JS,etal.The expression of transforming growth factor-alpha in cirrhosis,dysplastic nodules,and hepatocellular carcinoma:49 an immunohistochemical study of 70 cases〔J〕.Am J Surg Pathol,2007;31:681-9.
12Bissell DM.Chronic liver injury,TGF-β,and cancer〔J〕.Exp Mol Med,2001;33(4):179-90.
13Matsuhashi S,Hamajima H,Xia JH,etal.Control of a tumor suppressor PDCD4:Degradation mechanisms of the protein in hepatocellular carcinoma cells〔J〕.Cell Signal,2014;26(3):603-10.
14Manimala NJ,Frost CD,Lane ML,etal.Cardiac hormones target nuclear oncogenes c-Fos and c-Jun in carcinoma cells〔J〕.Eur J Clin Invest,2013;43(11):1156-62.
