红花黄色素对糖尿病肾病的保护作用
2018-04-08袁鲁亮
高 燕 谭 虎 常 显 刘 宁 郑 鹏 袁鲁亮
(河北大学附属医院肾内科,河北 保定 071000)
糖尿病肾病(DN)作为一种慢性疾病,约有10%的患者死于肾衰竭〔1,2〕,DN以肾小球受损、肾小球硬化及结节性病变为主〔3~5〕。NLRP3炎性小体是一种Nod样受体蛋白3〔2,6〕,作为介导机体炎症反应的重要物质,在DN的发生发展中扮演着重要的角色,但是其诱导炎性反应的相关作用和机制并未深入阐述。目前,针对DN缺少有效的治疗方案。本研究通过分析红花黄色素对DN基本生理指标的影响,从炎症角度探讨红花黄色素治疗DN的机制。
1 材料与方法
1.1实验动物、仪器与试药雄性SPF级SD大鼠购自广东省医学实验动物中心,体质量(250±10)g,实验动物许可证号:(粤)2013-0005。Trizol,Caspase1和NLRP3引物(生工生物工程科技有限公司);胰岛素(Eli-Lilly公司);红花黄色素氯化钠注射液(山西华辉凯德制药有限公司);白细胞介素(IL)-18,肿瘤坏死因子(TNF)-α,IL-1β酶联免疫吸附(ELISA)试剂盒(武汉华美生物技术有限公司);BCA总蛋白测定试剂盒(碧云天生物技术有限公司);血糖试剂盒(中生北控生物科技股份有限公司);酶标仪;PCR仪(Thermo赛默飞世尔科技公司,美国);电子天平(上海精天电子仪器有限公司)。动物高脂饲料(60%脂肪)购自广东省实验动物中心。
1.2造模分组和给药造模前将动物分为正常组(12只)和模型组(48只),模型组饲喂油脂含量为30%的高脂饲料,正常组为普通饲料。模型组动物按照20 mg/kg的剂量腹腔注射链脲佐菌素(STZ),连续注射3 d;正常组注射等体积的生理盐水作为对照。持续观察12 w,造模结束后尾静脉取血,3 000 r/min离心10 min取血清,测定血清中空腹血糖(FBG)、TNF-α、IL-18、IL-1β等指标的含量。将模型组动物分成模型组、胰岛素组(0.5 U/d)、红花黄色素高剂量组(40 mg/kg)、红花黄色素低剂量组(20 mg/kg),正常组和模型组等量注射生理盐水作为参照,给药持续4 w,每2 w经尾静脉取血测定血清中FBG、TNF-α、IL-18、IL-1β的含量,给药结束后,采用10%的水合氯醛麻醉,腹主动脉取血,3 000 r/min离心10 min后分离血清,用于测定血清相关指标;分离肝脏和肾脏称重并计算脏器系数,肾脏冻存在-80℃冰箱中,备用。
1.3血清中相关指标的检测方法血清中FBG、TNF-α、IL-18、IL-1β水平严格按照试剂盒说明书的方法进行测定。
1.4尿液中相关指标的测定收集各组24 h的尿液,在收集容器中加入0.8%硼酸,同时在容器下方放置冰袋,降低尿液的温度防止蛋白出现腐败变质,收集尿液之后,离心取上清液,采用BCA法测定尿蛋白(UPRO)含量,计算24 h尿蛋白排泄率。
1.5测定肾脏中Caspase1和NLRP3 mRNA表达精确称取100 mg的肾脏组织,加入Trizol匀浆,每1 ml Trizol 加入 0.2 ml 三氯甲烷;在低温条件下剧烈混合30 s后,12 000 r/min离心15 min,将水相层液体小心转移至新的离心管中;然后加入0.5 ml异丙醇,混合均匀,室温静置10 min;随后4℃,12 000 r/min离心10 min,可见少量 RNA 沉淀;吸弃上清溶液,用75%乙醇洗涤沉淀2次;7 500 r/min离心沉淀5 min,弃上清,放置在洁净的空气中自然干燥,DEPC水溶解RNA沉淀;取2 μl溶解后的RNA,用紫外分光光度法测定RNA纯度及浓度;计算总RNA浓度。将溶解后的RNA按试剂盒说明书进行逆转录及扩增。引物如表1所示。扩增条件为95℃,2 min;95℃,5 s,60℃,32 s,共40个循环〔7,8〕。
1.6统计学分析采用SPSS17.0软件,方差齐性使用t检验,方差不齐采用秩和检验。
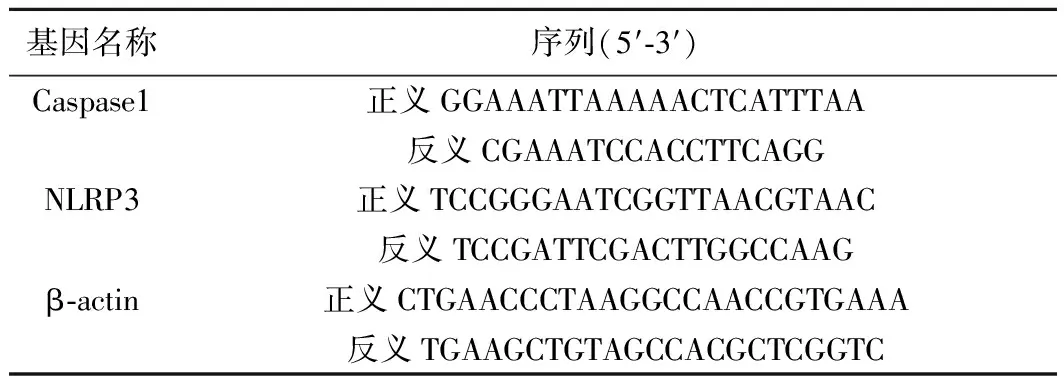
表1 引物序列
2 结 果
2.1给药前后各组血清FBG、TNF-α、IL-18、IL-1β水平造模12 w之后,与正常组比较,模型组FBG水平明显提高(P<0.01),提示模型成功;同时,TNF-α、IL-18、IL-1β含量也显著升高(P<0.01),提示动物出现一定程度的炎症活化。见表2。给药2 w后,与正常组相比,模型组各项指标显著升高(P<0.01),提示模型稳定。与模型组相比,胰岛素组和红花黄色素高剂量组血清中FBG、TNF-α、IL-18、IL-1β的含量显著降低(P<0.01),红花黄色素低剂量组血清中FBG、TNF-α、IL-18含量也明显降低(P<0.05),但是未能降低血清中IL-1β 的含量。给药4 w后,与模型组相比,胰岛素组、红花黄色素低、高剂量组血清FBG、TNF-α、IL-18、IL-1β含量均降低(P<0.05,P<0.01)。见表3。
表2 给药前正常组与模型组血清FBG、TNF-α、IL-18、IL-1β含量比较
与正常组比较:1)P<0.01

表3 给药2 w、4 w后各组血清中FBG、TNF-α、IL-18、IL-1β的含量比较
与正常组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01;下表同
2.2各组24 h尿蛋白排泄率和尿蛋白含量与正常组比较,模型组、胰岛素组、红花黄色素低、高剂量组尿蛋白排泄率和UPRO含量均显著提高(均P<0.01),与模型组比较,胰岛素组、红花黄色素低、高剂量组UPRO含量及尿蛋白排泄率均显著降低(P<0.01或P<0.05)。见表4。

表4 各组24 h尿蛋白排泄率和尿蛋白的含量
2.5各组肝脏和肾脏的脏器系数比较模型组的肝脏和肾脏系数均显著高于正常组(P<0.01),提示动物出现一定程度的肝肾损伤;胰岛素组、红花黄色素低、高剂量组肝脏、肾脏系数明显低于模型组(P<0.01)。见表5。
2.6各组肾脏中Caspase1和NLRP3 mRNA表达模型组Caspase1(1.64±0.21)和NLRP3 mRNA(1.63±0.12)表达水平较正常组(0.42±0.05,0.57±0.08)明显上升(P<0.01),红花黄色素低、高剂量组和胰岛素组Caspase1(1.30±0.13,1.03±0.09,1.48±0.16)及NLRP3 mRNA(1.12±0.10,0.95±0.07,1.30±0.11)显著下调表达(P<0.01)。
表5 各组肝脏和肾脏的脏器系数比较
3 讨 论
近期研究表明NLRP3炎性小体的活化是DN的重要机制之一。DN出现在糖尿病后期,严重威胁病人的生存时间和生存质量,同时糖尿病后期伴随组织损伤和微血管循环受阻,出现严重的炎症反应,进一步加重DN。本研究发现红花黄色素能显著降低血清FBG含量,同时能下调动物UPRO以及尿蛋白排泄率,提示红花黄色素不仅能够抑制血糖升高,还能改善肾脏功能。
DN与机体的炎症反应密切相关。NLRP3是机体固有免疫反应的起点。相关研究已经证实,高血糖作为一种诱导NLRP3活化的因素,能够使NLRP3介导的免疫反应进一步产生其下游的IL-1β和IL-18,在这个机制过程中Caspase1是重要的活性蛋白,NLRP3-Caspase1激活进一步加重机体的炎症反应,同时造成组织损伤和氧化应激等不良后果〔4,9〕。本研究结果提示红花黄色素能够抑制NLRP3和Caspase1介导的炎症反应。TNF-α和IL-1β能够促进机体产生黏附因子和趋化因子,进一步刺激肾脏系膜细胞的增殖,造成组织损伤。本实验中红花黄色素能显著下调TNF-α和IL-1β水平,提示其具有很好的抗炎效果;IL-18能够诱导INF-γ、MCP-1、IL-1、ICAM-1等生物活性因子的产生,长期作用下产生炎性浸润和组织受损〔10,11〕。本研究发现红花黄色素能下调血清IL-18表达,同时Ins也有相关的调控作用,揭示了IL-18和IL-1β的下调与血糖的水平相关,同时也有可能与红花黄色素的抗炎作用有一定的联系。
本研究结果显示,红花黄色素能显著改善DN的病理状态,其改善作用的发挥可能依赖于红花黄色素抑制NLRP3-Caspase1的表达来降低机体的免疫炎症,从而改善DN并发症的产生。
1高国丽,车光升,董瑶,等.糖尿病肾病发病机制的研究进展〔J〕.中国老年学杂志,2007;27(22):2254-55.
2Gao P,Meng XF,Su H,etal.Thioredoxin-interacting protein mediates NALP3 inflammasome activation in podocytes during diabetic nephropathy〔J〕.Biochimica Et Biophysica Acta,2014;1843(11):2448-60.
3Bǎlǎsescu E,Ion DA,Cioplea M,etal.Caspases,cell death and diabetic nephropathy〔J〕.Rom J Intern Med,2015;53(4):296.
4Ibrahim DS,El-Maksoud MAEA.Effect of strawberry(Fragaria × ananassa ) leaves extract on diabetic nephropathy in rats〔J〕.Int J Exp Pathol,2015;96(2):87-93.
5Kim SM,Lee SH,Kim YG,etal.Hyperuricemia-induced NLRP3 activation of macrophage contributes to the progression of diabetic nephropathy〔J〕.Am J Phys Renal Phys,2015;308(9):637-2014.
6Shahzad K,Bock F,Dong W,etal.Nlrp3-inflammasome activation in non-myeloid-derived cells aggravates diabetic nephropathy〔J〕.Kidney Int,2015;87(1):74-84.
7Motawi TK,Ahmed SA,Hamed MA,etal.Combination of melatonin and certain drugs for treatment of diabetic nephropathy in streptozotocin-induced diabetes in rats〔J〕.Diabetol Int,2016;7(4):1-12.
8Liu DX,Liu XM,Su Y,etal.Renal expression of proto-oncogene Ets-1 on matrix remodeling in experimental diabetic nephropathy〔J〕.Acta Histochemica,2011;113(5):527-33.
9顾晶.缬沙坦联合黄葵胶囊治疗高血压合并糖尿病肾病的疗效〔J〕.中国老年学杂志,2015;35(23):6747-9.
10Shahzad K,Bock F,Wang H,etal.Activation of the Nlrp3 inflammasome via mitochondrial ROS in glomerular cells aggravates experimental diabetic nephropathy〔J〕.Diabetologie Und Stoffwechsel,2014;9(S01):496-504.
11Susztak K,Raff AC,Schiffer M,etal.Glucose-induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy〔J〕.Diabetes,2006;55(1):225.
