景芝浓香大曲随储存期延长的变化规律
2018-04-04曹建全杨爱华张学梅
刘 雪 ,曹建全 ,李 霞 ,杨爱华 ,张学梅
(1.山东景芝酒业股份有限公司,山东景芝 262119; 2.山东省酿造食品生物发酵技术重点实验室,山东景芝 262119)
大曲是我国古老的曲种,根据大曲在发酵中的作用也可将其称为糖化发酵剂[1],它巧妙地将野生菌进行人工自然培养,选育有益菌种,积蓄酶及发酵前体物质,并为发酵提供营养物质。
利用大曲生产的白酒称为大曲酒,一般来说大曲酒比小曲酒、麸曲酒质量好。俗话说“曲乃酒之骨[2]”,这充分说明了曲在白酒中的重要作用。大曲的主要原料是小麦,把小麦制成大曲的过程是一个培菌的过程,整个制曲工艺过程中有众多种类的微生物先后交替、共同作用,关系极为复杂。简单来说,大曲中的有益微生物将小麦等原料中的蛋白质转化为氨基酸、酚类化合物等香味成分,使其产生曲
香气味,成为大曲酒微量香味成分的主要来源[3]。大曲除了是重要的糖化发酵剂和生香剂以外,还能够富集各种微生物,整个制曲过程和储存过程都是在开放性环境中进行的,大曲制作发酵完成后必须经过适当的储存才能投入生产使用,适当的储存对于大曲的质量提升有着极其重要的作用。因此,本研究对不同储存时间的中温大曲和高温大曲进行分析,主要从大曲理化指标变化和微生物的种类演变、数量变化规律方面进行研究,为合理设定大曲储存时间提供一定的理论依据。
1 材料与方法
1.1 材料、仪器
样品:景芝新出房中温曲、新出房高温曲、外购高温曲(储存3个月以上),装袋后储存,每隔1个月分析1次。
培养基:细菌及芽孢杆菌培养基:PCA培养基;霉菌和酵母培养基:PDA培养基;乳酸菌培养基:MRS培养基,均购自北京奥博星生物技术有限公司。
仪器设备:MLS-3751-PC高压蒸汽灭菌锅,日本松下公司;DNP型电热恒温培养箱,上海精宏实验设备有限公司;5804R台式高速冷冻离心机,德国Eppendorf公司;厌氧培养盒,日本三菱公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;JY10002电子天平,上海舜宇恒平科学仪器有限公司;恒温双层振荡培养箱,太仓实验仪器厂。
1.2 实验流程(图1)
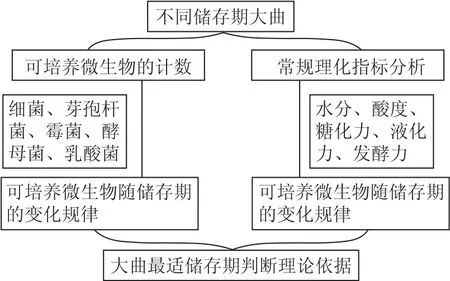
图1 实验流程图
1.3 实验方法
(1)大曲理化指标分析采用酿酒大曲通用分析方法QB/T 4257—2011。
(2)细菌总数计数采用GB 47892—2010食品微生物学检验菌落总数测定法;其中芽孢杆菌计数采用80℃加热15 min后涂平板,培养24 h后计数;霉菌和酵母检测采用GB4789.15—2010食品微生物学检验霉菌和酵母计数法;乳酸菌检测采用GB 4789.35—2010食品微生物学检验乳酸菌检验法。
2 结果与分析
2.1 理化指标随储存期的变化
2.1.1 大曲水分、酸度的变化情况(表1)
表1中的分析数据显示,在大曲储存的5个月期间,水分和酸度两项理化指标未随储存期的延长而发生变化。不同的大曲之间,水分差别不大,但高温曲的酸度比中温曲高。众所周知,水分受环境的影响较大,由于样品的储存环境相对稳定,因此水分未出现明显变化规律。据报道,大曲中的酸有两大来源,最主要的是由醋酸菌和乳酸菌代谢产生的醋酸和乳酸,其次就是原料中的脂肪、淀粉和蛋白酶发生降解而产酸[4]。据此分析酸度变化不大的原因主要是在制曲过程中微生物繁殖,引起了酸度的增加,制曲结束后,虽然生酸菌减少,但由微生物代谢产生的淀粉酶、蛋白酶和脂肪酶等开始水解淀粉、蛋白质和脂肪产酸,因此使得大曲的酸度维持在一个相对稳定的水平。
2.1.2 糖化力的变化情况(图2)
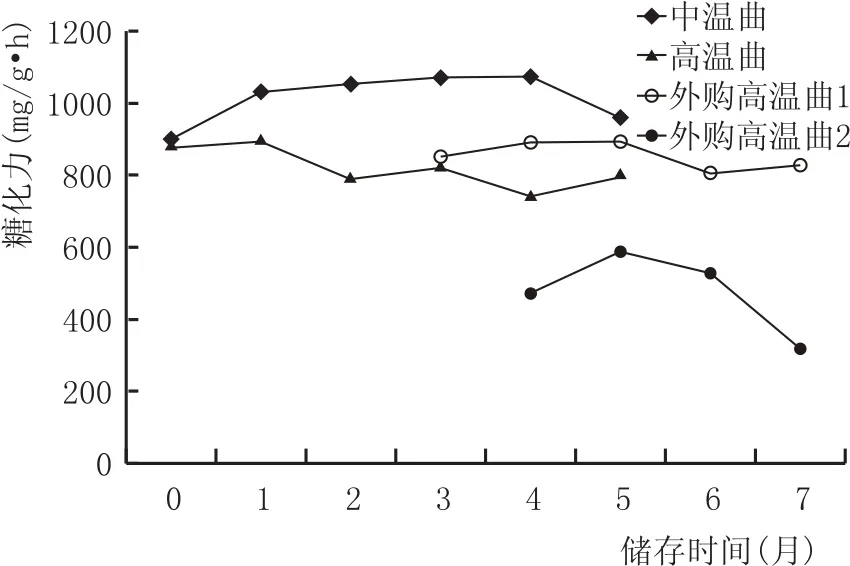
图2 大曲在不同储存时间糖化力的变化情况
糖化力高可以提高出酒率,但不利于酒的质量提高,而糖化力太低又不利于发酵,因此合适的糖化力水平对于白酒生产十分重要。由图2可知,随着储存期的延长,大曲的糖化力均呈现先上升后缓慢下降的趋势。主要是由于进入储存期后温度降低,霉菌等产糖化酶的微生物开始繁殖,糖化力会
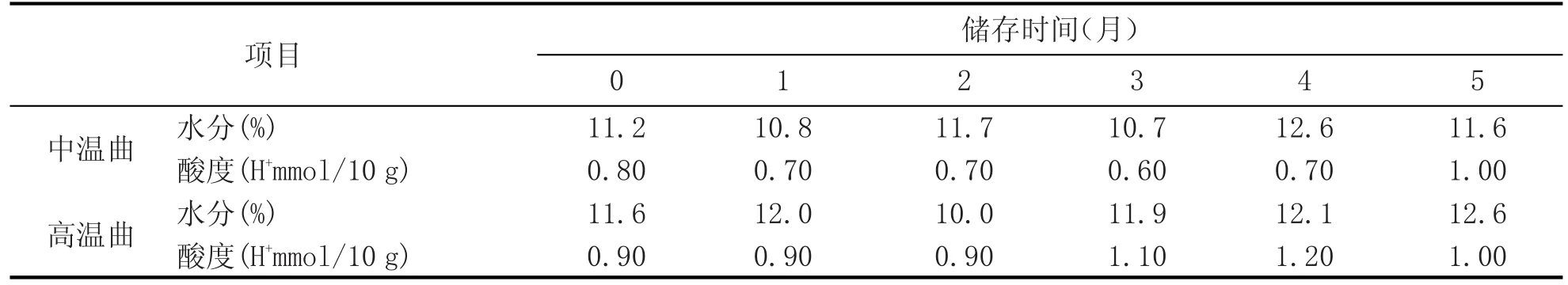
表1 中高温大曲的水分和酸度随储存期延长的变化情况
出现一个短暂的上升期,随着储存时间的继续延长(3个月后),糖化力便开始下降直到稳定,这一点在霉菌的变化规律中也可以证实(图7)。另外还可以看出,中温大曲的糖化力较高,平均在1015葡萄糖mg/g·h左右,而高温大曲的糖化力普遍低于中温曲,平均约820葡萄糖mg/g·h,外购高温曲1和景芝高温曲糖化力基本接近,外购高温曲2糖化力较低,处于300~500葡萄糖mg/g·h之间,是高温曲较为理想的水平。中温曲储存至5个月时糖化力为960葡萄糖mg/g·h,仍然较高,因此实际应用时还要进一步延长储存期或调整制曲工艺,将大曲的糖化力降到合适的水平。
2.1.3 液化力的变化情况(图3)
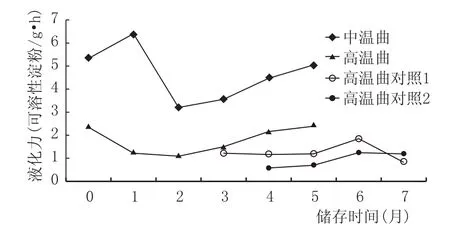
图3 大曲在不同储存时间液化力的变化情况
粮食中的淀粉首先是转变成糊精,然后再进一步转化成糖,这一过程我们称作液化,而液化力指的是微生物酶将淀粉转化成糖的能力。由图3可知,大曲储存0~2个月时,液化力处于下降的趋势,而3个月之后液化力开始逐步升高。这说明大曲在储存过程中微生物酶的含量和活性也在发生变化,储存3个月以上的大曲中微生物酶活力较高,因此液化力会有所提高。另外还可以看出高温曲的液化力明显低于中温曲。
2.1.4 发酵力的变化情况(图4)
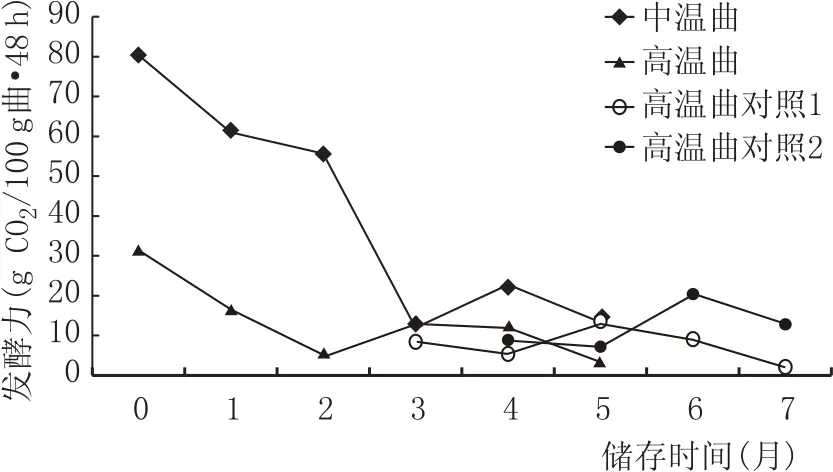
图4 大曲在不同储存期发酵力变化情况
大曲的发酵力是反映大曲产酒能力的重要指标之一。发酵力与大曲中的酵母菌有关,它可以将酒醅中的糖分转化为乙醇[5]。由图4可知,大曲储存前期,发酵力迅速下降,而3个月后发酵力趋于稳定。因此一般大曲储存满3个月使用时,发酵力已经处于较为理想的平稳状态。
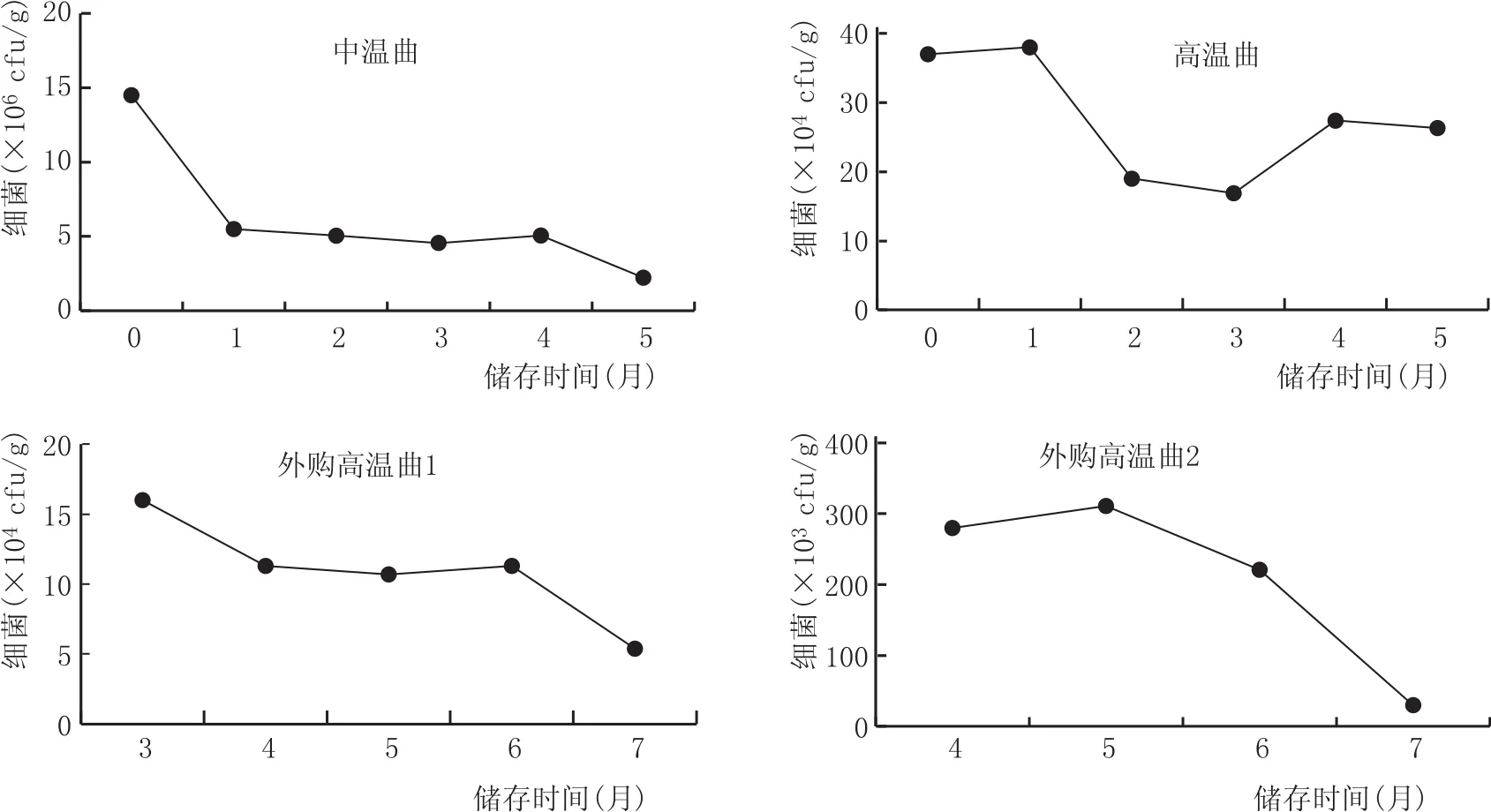
图5 细菌总数随储存时间的变化情况
2.2 储存过程中微生物的消长情况(图5—图9)
大曲中的细菌主要包含芽孢杆菌、乳酸菌、醋酸菌等[6],种类多,分布广,生长快,是大曲产酸、分解蛋白质的重要来源[7],在大曲储存过程中,细菌的变化趋势如图5所示,由图5可知,大曲出房时细菌总数达到最高值,其中中温曲为1.45×107cfu/g、高温曲为3.7×105cfu/g,外购高温曲1为1.6×105cfu/g,外购高温曲2为2.8×104cfu/g,进入储存期后,由于储存环境干燥,不利于细菌的富集,菌数便逐渐下降。储存至5个月时,中温曲中细菌总数下降至2.23×106cfu/g,降低了84.6%,高温曲由于制曲温度较高,出房时细菌中的芽孢杆菌居多,能适应极端环境而不易死亡,因此储存时下降幅度比中温曲要小一点,储存至5个月时细菌总数下降了20.8%,为2.93×105cfu/g。外购高温曲1和高温曲2也都有所下降。
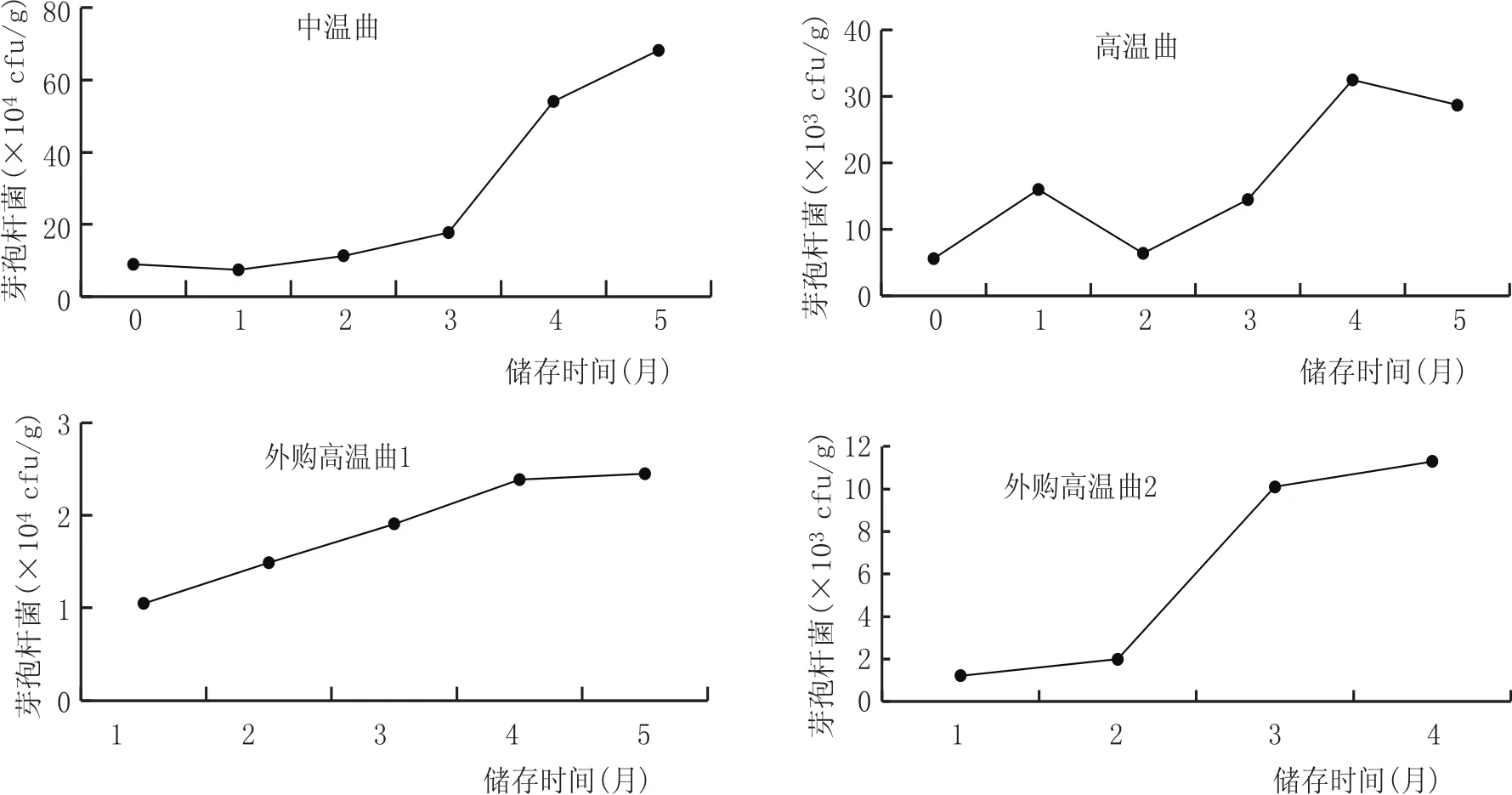
图6 芽孢杆菌总数随储存时间的变化情况
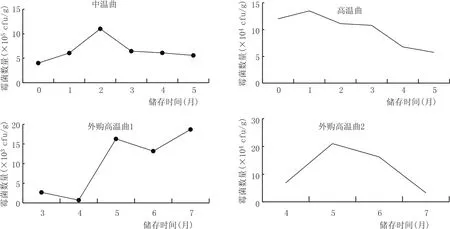
图7 霉菌数量随储存时间的变化情况
芽孢杆菌在白酒酿造中具有非常重要的作用,能够产生吡嗪类、挥发性酸、芳香类以及酚类物质[8-9],还能强化美拉德反应[10],是影响白酒口感的重要菌株。据报道[11],随着储存期的延长,细菌的种类趋于单一,芽孢杆菌成为优势菌种。由图6可知,芽孢杆菌数量随着储存期的延长而明显升高,在出房时中温大曲芽孢杆菌的数量为8.97×104cfu/g,储存3个月后开始明显增多,储存5个月时芽孢杆菌数增加到6.82×105cfu/g;高温大曲芽孢杆菌数由刚出房的5.6×103cfu/g,增长到2.87×104cfu/g,提高了约4倍。结合细菌总数的变化趋势(图5)可以看出,细菌中芽孢杆菌所占的比例明显上升,这说明虽然中温曲储存过程中细菌总数在降低,但芽孢杆菌数量并未下降,其减少的大部分都是杂菌,因此可以说大曲储存的过程也是优势菌群自然筛选富集的过程。
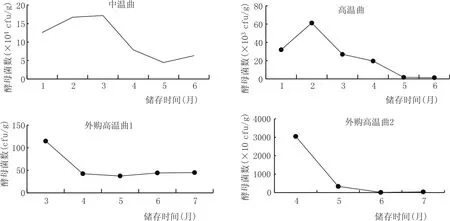
图8 酵母菌随着储存时间的变化情况
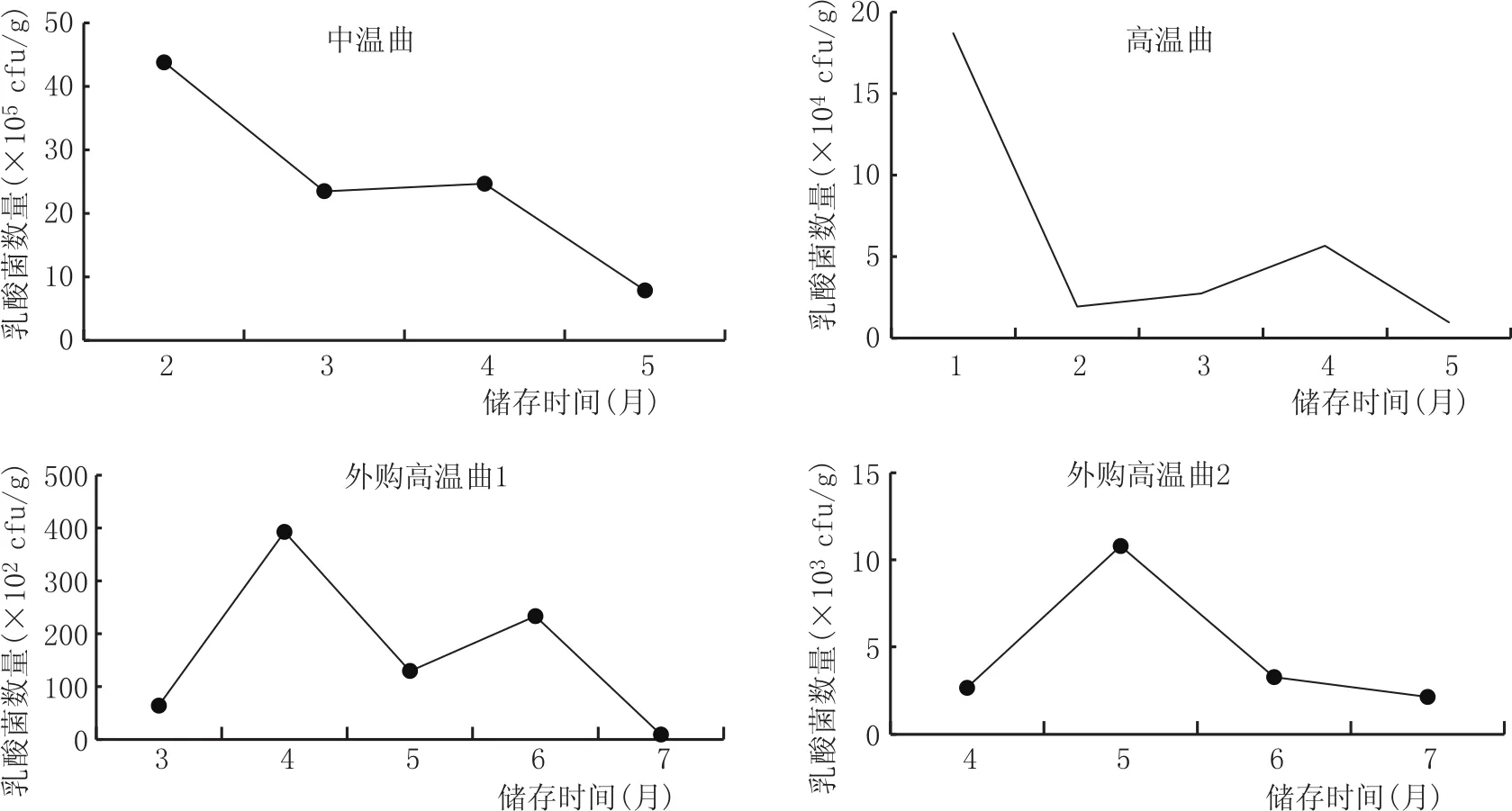
图9 乳酸菌随着储存时间的变化情况
霉菌是大曲中主要的微生物,含有多种产糖化酶的菌种,与大曲的糖化力和液化力息息相关[12]。由图7可知,外购高温曲1霉菌的数量在3个月之后还持续上升,除此之外,其他大曲霉菌的数量整体都随着储存时间的延长而下降,分析原因可能是由于制曲过程中的温度较高,不利于霉菌的繁殖,进入储存阶段,随着温度下降,霉菌便得以繁殖。具体来看,中温曲中的霉菌先上升后持续下降,最高时达到1.1×106cfu/g,储存至5个月时中温曲的霉菌数量降低至5.58×105cfu/g,与糖化力的变化趋势(图2)相吻合,说明储存期糖化力的高低与霉菌的数量呈正相关。高温曲的霉菌数量最高为1.35×105cfu/g,经过5个月储存后降至5.75×104cfu/g。由图2可知,外购高温曲2的糖化力处于较为理想水平,据此可初步将高温大曲霉菌的数量定为不超过2.1×105cfu/g即可。
大曲中含有的酵母种类和数量都很多,其中酿酒酵母是白酒发酵过程中的优势菌株,是酒精发酵的主要动力[13],另外还包括很多产酯酵母、产香酵母等等。大曲在储存时期的酵母数量变化情况如图8所示,由图8可知,在大曲储存的前期酵母数量有小幅度的上升,在随后的储存过程中,随着储存期的延长,其酵母菌的数量开始下降,且下降趋势越来越明显,外购高温曲在储存期达到7个月时,仅检测到少量酵母的存在,结合大曲发酵力变化趋势(图4)可以看出,随着储存期延长,大曲的酵母数量及酶活力均有下降趋势,导致发酵力也随之下降。
乳酸菌的代谢产物主要是乳酸,乳酸和乙醇进一步酯化可生成乳酸乙酯,乳酸乙酯是白酒中四大酯类物质之一,因此乳酸菌也是白酒酿造过程中非常重要的一种微生物。白酒酿造过程中存在适宜的乳酸菌有利于维护酿酒环境、促进酿酒发酵、促进美拉德反应等作用[14],但乳酸菌数量过多或者过少都对白酒的酿造不利,影响白酒口感。中高温大曲在储存过程中乳酸菌的变化情况如图9所示,由图9可知,在大曲的储存阶段,乳酸菌数量随着储存时间的延长呈现明显的下降趋势,尤其在储存的前2个月下降幅度很大。这表明实际储存时,至少要超过2个月的储存期,才可获得相对稳定的乳酸菌数量。外购高温大曲1和高温大曲2由于储存时间超过3个月,前期变化情况无法获知,且由于检测到的菌数较少,导致误差较大,但仍能反映出变化规律,即储存3个月后乳酸菌数量仍有下降趋势。
3 结论
为研究大曲随着储存时间延长的变化规律,将新出房的中温曲和高温曲进行储存,每月跟踪分析其理化指标和可培养微生物变化情况,发现随着储存时间的延长,大曲水分酸度变化不大,进一步对可培养微生物种类进行分析发现,随着储存期的延长,细菌数量逐渐减少而芽孢杆菌的占有率逐步上升;霉菌、酵母菌、乳酸菌都随着储存期的延长而下降,糖化力指标也呈先升高后缓慢降低趋势,液化力在前2个月时迅速降低,3个月后有所升高,然后趋于平稳;酵母菌在初期出现小幅上升后也缓慢降低,相应的发酵力在前3个月时急剧下降,之后也趋于平稳;各类微生物和理化指标变化情况在储存3个月以后变化缓慢,并逐步趋于平稳。
综合考虑以上各项指标在储存过程中的变化情况,结合大曲在白酒酿造中的作用,实际生产中应当注意制曲温度和糖化力的关系,不能片面追求高糖化力,而是要求菌系、物系和酶系的平衡与协调。本研究发现大曲从刚出房至储存的前两个月过程中,各项理化指标和微生物指标都处在不稳定的状态,3个月之后才逐步趋于稳定,且储存期延长细菌等生酸菌逐渐减少,芽孢杆菌等有益微生物还在增加,生物酶也在不断累积,这些都更利于白酒生产。据报道[15],储存3~4个月的大曲,其纤维素酶、半纤维素酶、蛋白酶、酯化酶的活力均达到最佳状态。综合考虑所有影响因素,建议大曲最短要储存3个月才可投入生产使用,其中中温曲最好储存超过5个月才可使用,这并不意味着大曲储存时间越长越好。众所周知,储存期在12个月之内,对出酒率影响不大,且储存期长者,曲香好,酒质口感更醇和。超过12个月以上的陈年老曲,曲虫会很多,这会造成大曲淀粉的流失,甚至破坏大曲的微生物群落结构和酶系,使大曲质量变差,严重影响窖内发酵,出酒率明显下降。且曲块储存期越长,其损耗越大,加之库存占用也大,会挤压大量资金。所以,从经济效益、曲块的微生物数量及生化性能变化、酿造效果等几个方面综合考虑,并结合大生产的实践经验,建议高温大曲储存3个月以上,中温大曲储存期以5个月以上为好,最长不宜超过12个月,特别是一些大曲储存条件差的酒厂,更不宜久贮。另外,由于大曲贮存过程中各项指标(糖化力、液化力、发酵力、微生物种类及数量等等)消长不一致,故可采取不同贮存期的大曲相互搭配调节使用的方式。
值得注意的是本研究采用的是传统的稀释平板法测定大曲中微生物的数量,这种方法受到很多因素的影响,如温度、湿度,另外还存在样品均匀度差异和操作人员差异等因素,故计数的重复性较差,虽不能精确反映微生物在大曲中的数量,但却可以大致反映大曲储存过程中微生物的生长趋势和规律。随着现代分子生物学技术的发展,我们将采用高通量测序以及荧光定量的方法对微生物数量和种类进行更准确的研究,这也是我们今后的研究方向之一。
参考文献:
[1]路星,相里加雄.汾酒大曲与普通清香型大曲酿酒性能对比[J].酿酒,2014,41(4):53-56.
[2]沈才洪,许德富.千锤百炼铸造国窖大曲水火交融酿制国窖 1573[J].酿酒科技,2002(1):97-98.
[3]FAN W L,QIAN M C.Headspace solid phase microextraction and gas chromatography-olfactometry dilution analysis of young and aged Chinese“Yanghe Daqu”liquors[J].Journal of agricultural and food chemistry,2005,53(20):7931-7938.
[4]沈才洪,应鸿,许德富,等.大曲的理化指标特征探讨[J].酿酒科技,2005(9):20-22.
[5]肖美兰,刘建文,吴生文.特香型大曲储存过程中几个理化指标的变化分析[J].酿酒,2013(5):48-50.
[6]聂凌鸿,樊璐,季方.大曲中细菌和酵母菌的分离及其Biolog微生物系统分析鉴定[J].安徽农业科学,2012,40(2):1036-1038.
[7]聂慧芳,蒋英丽,沈毅,等.酱香型大曲中高产蛋白酶细菌的分离鉴定[J].酿酒科技,2015(12):41-44.
[8]YAN Z,HAN B Z,NOUT M J R.Monitoring the ecology ofBacillusduring Daqu incubation,a fermentation starter,using culture-dependent and culture-independent methods[J].Microbiol biotechn,2013,23(5):614-622.
[9]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced withBacillus licheniformisby solid-state fermentation[J].Letters in applied microbioloy,2013,57(1):11-18.
[10]杨涛,梁明锋,李国友,等.微生物技术在酱香型白酒生产中的应用研究[J].酿酒科技,2011(4):20-28.
[11]梁丽文,缪礼鸿,杨团元,等.浓酱兼香型白酒不同储存期的高温大曲微生物群落结构与发酵特征分析[J].酿酒科技,2016(7):37-41.
[12]王世宽,潘明,徐艳丽,等.浓香型大曲发酵过程中霉菌消长情况的研究[J].中国酿造,2010,29(1):42-45.
[13]孟醒,吴群,徐岩.酿酒酵母与地衣芽孢杆菌相互作用及基于蛋白组学的作用机制分析[J].微生物学通报,2015,42(9):1679-1688.
[14]谢玉球,钟雨,谢旭,等.乳酸菌在固态法白酒生产中的地位与作用[J].酿酒科技,2008(11):83-86.
[15]刘建文,吴生文,朱力红,等.特香型大曲中纤维素酶、半纤维素酶、蛋白酶、酯化酶活力变化规律的研究[J].酿酒,2013(5):40-42.
