高产β-苯乙醇黄酒酵母的选育
2018-04-04徐新彪刘双平邹慧君周志磊姬中伟
徐新彪 ,刘双平 ,,4,邹慧君 ,周志磊 ,3,韩 笑 ,5,姬中伟 ,3,毛 健 ,3,5
(1.江南大学粮食发酵工艺与技术国家工程实验室食品学院,江苏无锡 214122; 2.浙江古越龙山绍兴酒股份有限公司,浙江绍兴 312000; 3.国家黄酒工程技术研究中心,浙江绍兴 312000; 4.江苏省产业技术研究院食品生物技术研究所(如皋江大食品生物技术研究所有限公司),江苏南通 226500; 5.江南大学(如皋)食品生物技术研究所,江苏南通 226500)
β-苯乙醇天然存在于玫瑰花、康乃馨等植物及精油中,是具有玫瑰花香的芳香醇,同时作为一种重要的香精香料成分,广泛应用于食品、烟草和日化用品中[1-2]。β-苯乙醇在发酵酒中广泛存在,在啤酒中含量为15~20 mg/L;在清酒中含量为40~60 mg/L,在黄酒中含量可以达到100 mg/L左右,虽然浓度已经较高,但是进一步提高β-苯乙醇含量有利于提升黄酒风味[3-4]。β-苯乙醇是黄酒中重要的芳香化合物,赋予黄酒优雅的香气,在黄酒国标GB/T 13662—2008中,对不同类型黄酒中β-苯乙醇最低含量有要求[5]。
黄酒中β-苯乙醇主要由黄酒酵母(酿酒酵母Saccharomyces cerevisiae)代谢产生,黄酒酵母合成β-苯乙醇主要有Ehrlich途径和从头合成途径(见图1),其中有两个关键反馈抑制,DAHP合成酶分别受到L-苯丙氨酸和酪氨酸的反馈抑制。在含有一定浓度L-苯丙氨酸结构类似物即对氟苯丙氨酸(PFP)的筛选培养基上,低产DAHP合成酶的菌株容易被杀死或抑制生长,经诱变后产酶量高的菌株可以先与底物类似物结合以消除其抑制作用,从而筛选出高产β-苯乙醇的正突变菌株[6-7]。虽然目前基因工程技术已成熟运用于微生物优良性状定向改造,但是基因工程菌株在传统发酵黄酒中应用仍存在争议与市场风险,为避免此问题,本研究选用传统紫外诱变结合底物类似物抗性选育,所选育出的黄酒酵母完全可以在黄酒发酵工业中应用。

图1 酿酒酵母β-苯乙醇合成途径
酿酒酵母作为双倍体菌株,诱变后正突变菌株可能会存在遗传不稳定的问题,双倍体营养体可以通过产生子囊孢子生成单倍体孢子,而在HO基因未敲除的情况下单倍体自身会转化为双倍体。
目前酿酒酵母发酵法提高β-苯乙醇产量分为两类,一类是选育酿酒酵母并在发酵体系中外源添加前体化合物L-苯丙氨酸,通过Ehrlich途径提高β-苯乙醇产量,如崔志峰等紫外诱变获得了1株在L-苯丙氨酸为5 g/L的发酵培养基中β-苯乙醇产量为3.6 g/L,比出发菌株提高了9.1%的菌株,以及黄筱萍等筛选出1株在L-苯丙氨酸含量为8 g/L的发酵体系下,β-苯乙醇质量浓度达4.3l g/L的酿酒酵母菌株,但是在发酵工业中外源添加氨基酸的成本较高;另一类是选育的酿酒酵母直接利用碳源从头合成β-苯乙醇,如李记明等报道酿酒酵母在干红葡萄酒中产量达169.38 mg/L,但是并未对酒精发酵能力做具体报道[8-10]。由于β-苯乙醇对酵母的胁迫能力高于乙醇,高产β-苯乙醇酿酒酵母产乙醇能力通常会有降低,所以在不外源添加前体化合物下,选育高产β-苯乙醇并且酒精发酵性能优良的酿酒酵母在酿造工业中具有较高应用价值。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌株与主要试剂
酿酒酵母出发菌株Y1615:资源平台号S.cerevisiaeRWBL Y1615 ZC,从绍兴地区酒厂筛选并在实验室菌种库保藏;对氟苯丙氨酸(PFP):上海百灵威公司;无氨基酵母氮源(YNB)培养基:美国BD公司。
1.1.2 主要仪器
e2695高效液相色谱系统(配有2489UV/Vis Detector检测器),美国沃特世公司;5805CL台式高速冷冻离心机,德国艾本德公司;Thermo Micro CL17高速离心机,美国赛默飞世尔科技公司;紫外可见分光光度计,优尼柯(上海)仪器有限公司;CX31RTSF显微镜,日本OLYMPUS公司;立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;恒温培养箱,上海森信实验仪器有限公司;恒温摇床,上海合恒仪器设备有限公司。
1.2 培养基
YPD培养基:酵母提取物10 g/L、鱼粉蛋白胨20 g/L、葡萄糖20 g/L。
YNBP培养基:6.7 g/L的YNB、20 g/L的葡萄糖,琼脂粉20 g/L,额外的分别加入0、0.04 g/L、0.05 g/L、0.06 g/L、0.07 g/L、0.08 g/L、0.09 g/L、0.1 g/L的对氟苯丙氨酸(PFP)。
酒精筛选培养基:YPD液体培养基额外加入10%vol乙醇。
McClary生孢培养基:葡萄糖1 g/L,KCl 1.8 g/L,NaAc 8.2 g/L,酵母提取物2.5 g/L,琼脂20 g/L。
黄酒模拟液筛选培养基:1 kg蒸熟米饭(含水率为70%)中加入水1 L、麦曲0.05 kg,搅拌均匀,60℃保温8 h,以4500 r/min离心5 min,取上清液以115℃灭菌15 min。
黄酒发酵培养基:蒸熟米饭(含水率为70%)50%,水40%,酒母5%,麦曲5%,搅拌均匀。
1.3 实验方法
1.3.1 出发菌株生长曲线的确定
取200 μL甘油保藏酿酒酵母Y1615涂布YPD平板纯化,再经YPD平板和YPD摇瓶传代复壮。
取5mL菌液接种100mLYPD摇瓶,以200r/min、30℃培养,每隔1 h测定OD600,确定出发菌株指数增长中期时间即是紫外诱变开始时间,做3个平行。
1.3.2 紫外照射时间的确定
按1.3.1方法获得指数增长中期的诱变出发菌株菌液,取10 mL菌液以6000 r/min离心5 min,弃上清液,无菌生理盐水洗涤后加50 mL无菌生理盐水得菌悬液。
紫外灯开20 min以稳定光波,取5 mL上述菌悬液到无菌培养皿中,培养皿中加入灭菌大头针。培养皿置于磁力搅拌器上,垂直放置于紫外灯(15 W)以下20 cm处,黑暗条件下打开皿盖,照射时间为40 s、60 s、80 s、100 s、120 s、140 s、160 s。
照射完毕后,在红光灯下或者黑暗条件下,将诱变后菌悬液以10倍稀释法稀释4次,未经紫外照射的菌悬液以10倍稀释法稀释5次,各取200 μL稀释液涂布YPD平板,用锡纸包好,30℃倒置培养48 h,每组3个平行。
观察记录平板菌落数,计算致死率,绘制紫外照射致死率曲线,确定致死率为90%~100%的紫外照射时间。致死率=(对照菌落数-诱变菌落数)/对照菌落数。
1.3.3 PFP对出发菌株最低全致死浓度确定
如1.3.1获得出发菌株菌悬液,用10倍稀释法稀释4次,分别涂布200 μL到不同PFP浓度的YNBP平板上,每个梯度做3个平行。
30℃培养2~3 d,记录菌落数后绘制PFP对出发菌株致死率曲线。
1.3.4 紫外诱变与PFP抗性、酒精耐受性筛选
如1.3.2中步骤获得紫外诱变出发菌株并对其进行紫外照射,照射时间为140 s。取紫外诱变后菌悬液200 μL涂布到PFP浓度为0.12 g/L的YNBP平板,用锡纸包好以避光,10倍稀释法每个稀释梯度下3个平板,30℃培养72 h。
酒精耐受性筛选:挑取PFP抗性筛选后突变菌株,先在96孔板的YPD液体培养基上扩培,再接入96孔板的酒精筛选培养基,每株菌株接种量为5%,30℃培养,分别在12 h和24 h用酶标仪测定OD600并筛选OD600数值相对较高的突变菌株。
1.3.5 黄酒模拟液发酵筛选
对氟苯丙氨酸抗性、酒精耐受性筛选后菌株经YPD平板和YPD摇瓶复壮扩培,按5%接种量接到50 mL黄酒模拟液,30℃静置发酵7 d,每株菌做3个平行。高效液相色谱法测定黄酒模拟液中β-苯乙醇含量,筛选β-苯乙醇含量相对较高的菌株。
1.3.6 双倍体正菌株生孢纯化
对数生长中期正突变菌株用生理盐水重悬,菌悬液适度稀释后涂布于McClary生孢培养基,30℃培养1~2 d。单菌落划线到生孢培养基上,30℃培养5~7 d,每隔24 h取样用石炭酸复红染色法观察产孢情况,每次取3个视野,计算生孢率,生孢率达到90%时进行下一步实验。
灭活双倍体营养体:用pH7的磷酸钠缓冲液洗涤含有子囊孢子和部分双倍体菌体,65℃水浴加热10 min,取样涂布YPD平板以验证双倍体营养菌株是否完全灭活。
取灭活后菌液离心收集沉淀,加入1 mL的1.5%蜗牛酶和无菌玻璃珠,28℃下振荡0.5~1 h,酶解子囊壁使单倍体分离。以5000 r/min离心5 min收集菌体,磷酸钠缓冲液洗涤后混悬,梯度稀释至10-1到10-5,每梯度取100 μL涂布YPD平板,30℃下培养1~2 d。
黄酒发酵筛选:取YPD平板上菌落较大的菌株进行黄酒发酵实验,筛选正突变基因可稳定遗传的纯合双倍体菌株。黄酒前发酵5 d,后发酵15 d,结束后测定苯乙醇含量及其他理化指标。
1.3.7 菌株传代稳定性实验
将所筛选的生孢纯化后纯合双倍体菌株在YPD培养基上传代培养5代,每代进行黄酒发酵,测定β-苯乙醇含量及酒精产量。
1.3.8 高效液相色谱条件
取2 mL样品12000 r/min离心1 min,取上清液1 mL过0.22 μm水系膜。XbridgeTM Amide 5µm(4.6×0.25 mm)色谱柱,流动相为甲醇∶水=1∶1,流速1 mL/min,柱温30 ℃,进样量10 μL。
2 结果与分析
2.1 野生菌株生长曲线和紫外照射致死率曲线(图2、图3)

图2 出发菌株生长曲线
由图2可知,野生酵母菌株200 r/min培养3 h后酵母OD600值明显升高,酵母繁殖进入指数生长期,培养4 h时野生酵母菌株处于指数生长中期,因此以200 r/min培养4 h的酵母菌液作为诱变出发菌株进行紫外诱变。
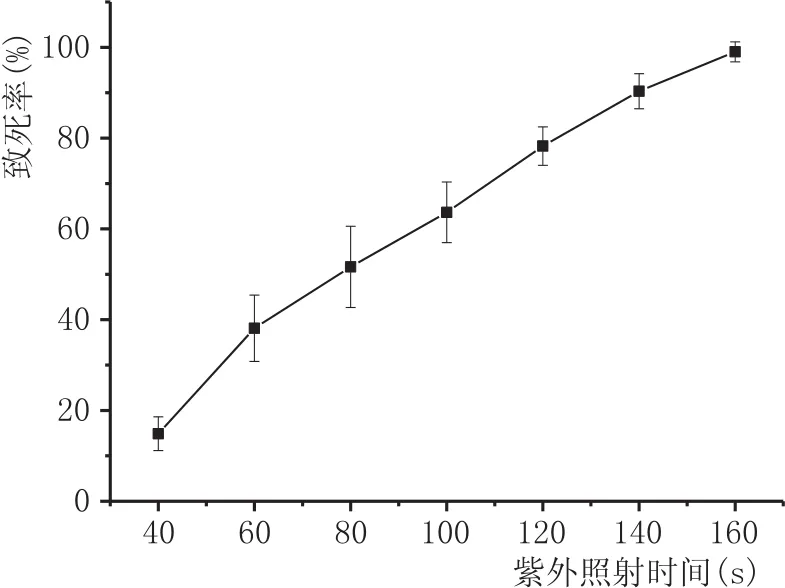
图3 紫外照射致死率曲线
由图3可知,随着紫外照射时间的增加,诱变出发菌株的致死率不断增加,一般认为致死率达到90%左右可筛选到变异幅度较大的正突变菌株[12]。照射时间为140 s时,致死率为90%以上,因此选择紫外照射140 s作为紫外诱变照射时间。
2.2 对氟苯丙氨酸致死率曲线(图4)
据Rafael报道,培养基中对氟苯丙氨酸浓度为5 mmol/L所筛选面包酵母的最低全部致死浓度[13]。据Akita报道,在含有0.5 mg/mL对氟苯丙氨酸的培养基中,正突变菌株分离效率为2.2×10-7,正突变菌株苯乙醇产量是野生菌株的12倍,达479 mg/L,因此选择合适的底物类似物及合适筛选浓度对筛选效果至关重要[14]。
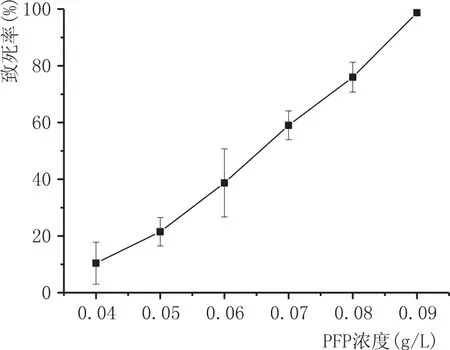
图4 对氟苯丙氨酸对出发菌株致死率曲线
如图4所示,将出发菌株涂布到PFP浓度为0.09 g/L的YNBP平板,几乎没有酵母菌株生长。紫外诱变后正突变菌株在0.09 g/L的YNBP平板上生长,为了保证筛选到高产β-苯乙醇的正突变菌株,将紫外诱变后菌悬液涂布到PFP浓度为0.2 g/L的YNBP平板。

表1 突变菌株酒精耐受性筛选
2.3 紫外诱变与对氟苯丙氨酸抗性、酒精耐受性筛选
紫外诱变后的菌悬液涂布到YPD平板,经对氟苯丙氨酸抗性筛选到526株菌株,在96孔板上酒精耐受性筛选,12 h和24 h时OD600数值相对较高的51株突变菌株,结果如表1所示,将51株突变菌株用于下一步黄酒模拟液筛选。
2.4 黄酒模拟液发酵筛选
将对氟苯丙氨酸抗性、酒精耐受性筛选后51株菌株经黄酒模拟液发酵后测定β-苯乙醇含量。为提高筛选效率及保证筛选培养基的一致性,选用黄酒模拟液作为筛选培养基,以β-苯乙醇产量和酒精产量为筛选指标(图5)。如图5所示,1-E4、4-C7、5-F5正突变菌株β-苯乙醇产量明显高于出发菌株,其中5-F5菌株β-苯乙醇产量为237.16 mg/L,3株菌株酒精发酵能力未受明显影响,酿酒酵母仍可良好进行酒精发酵,因此选择β-苯乙醇产量较高的5-F5正突变菌株进行下一步生孢纯化实验。
2.5 双倍体正菌株生孢纯化(图6、图7)
本研究对紫外诱变后双倍体菌株进行产孢处理,双倍体细胞中同源染色体中突变基因会转到单倍体孢子中,单倍体孢子再经培养后成纯合双倍体菌株,正突变基因得以稳定遗传,正突变菌株遗传稳定性增强。
将正突变菌株5-F5产孢处理,图6为子囊孢子和部分二倍体营养体形态。在平板上挑选菌落形态较大的8株菌株在黄酒发酵培养基中进行黄酒发酵实验。为探究正突变菌株在黄酒双边发酵和复杂微生物环境中的β-苯乙醇产量和酒精发酵特性,相比于黄酒模拟液筛选培养基在黄酒发酵培养基中添加麦曲,也因此正突变菌株在两种发酵体系下β-苯乙醇产量和酒精产量略显不同。黄酒发酵结果显示BYC-3菌株的β-苯乙醇产量是出发酿酒酵母的2.67倍,达到238.12 mg/L,产酒精能力均达到16%vol以上,酒精发酵性能与出发菌株相比没有显著性差异(P>0.05)。
2.6 菌株传代稳定性实验(表2)
将BYC-3菌株在YPD培养基上传代培养5次,每代酵母菌株作为酒母进行黄酒发酵检测β-苯乙醇和酒精含量变化,结果表明,传代后菌株的酒精产量没有显著性差异(p>0.05),β-苯乙醇产量稳定,没有显著下降(p>0.05),这为BYC-3菌株在工业中稳定生产奠定了基础。
3 结论
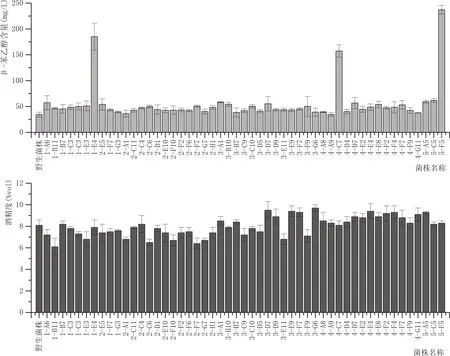
图5 突变菌株发酵模拟液中β-苯乙醇和酒精含量

图6 正突变菌株子囊孢子和部分二倍体营养体显微图
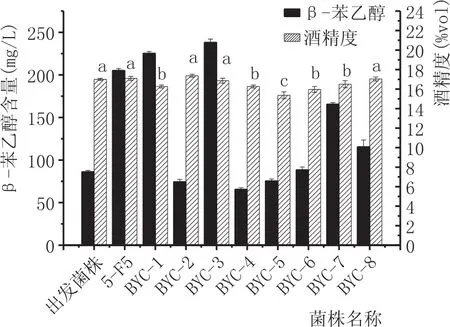
图7 产孢纯化后双倍体菌株β-苯乙醇和酒精产量
本研究以实验室保藏菌株S.cerevisiaeRWBL Y1615 ZC为诱变出发菌株,由于菌株用于黄酒酿造工业,选用安全有效的紫外诱变,再进行底物类似物即对氟苯丙氨酸抗性筛选,紫外照射诱变时间为140 s,对氟苯丙氨酸对出发菌株的最低全致死浓度为0.09 g/L,为保证筛选效果以含有0.2 g/L对氟苯丙氨酸的YNBP平板为筛选平板,将筛选的526株菌株进行酒精耐受性筛选,最后将51株菌株进行黄酒模拟液筛选,得到β-苯乙醇产量明显提高的3株正突变菌株;再将其中β-苯乙醇最高的正突变菌株5-F5进行产孢纯化和筛选,正突变菌株遗传稳定性得以增强,正突变菌株BYC-3菌株β-苯乙醇产量达238.12 mg/L,是出发菌株的2.67倍,并且产酒精性能和出发菌株相比无显著性差异,菌株传代稳定性好。
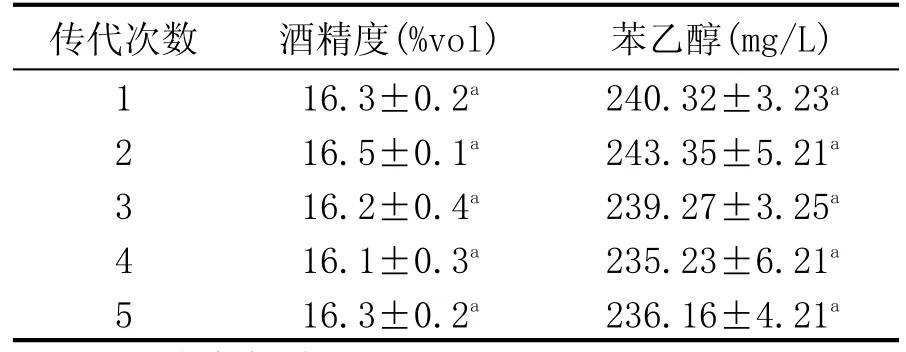
表2 传代稳定性实验酒精和β-苯乙醇产量
本研究在不外源添加前体化合物情况下,筛选得到高产风味物质β-苯乙醇且酒精发酵性能优良黄酒酵母BYC-3,对于发酵法提升黄酒风味有重要意义,在酿酒工业特别是黄酒酿造工业中具有较高应用价值。
参考文献:
[1]赵修报,唐育岐,刘天明.β-苯乙醇的研究进展[J].中国酿造,2011(8):1-4.
[2]卢健,卢少明,马集锋.β-苯乙醇的现状与发展前景[J].广东化工,2012,39(11):123-124.
[3]KAZURO F,MAKOTO W,KOZO A,et al.Breeding of brewing yeast producing a large amount of β-phenylethyl alcohol and β-phenylethyl acetate[J].Agricultural&biological chemistry,1990,54(1):269-271.
[4]TAO L,FAN W,YAN X.Characterization of volatile and semi-volatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatography-mass spectrometry[J].Journal of the Institute of Brewing,2008,114(2):172-179.
[5]李博斌.黄酒新国标介绍与分析[J].酿酒科技,2001(3):73-74.
[6]陈希,莫章桦,周国英,等.微波诱变结合底物类似物选育恶臭假单胞杆菌[J].工业微生物,2006,36(1):51-53.
[7]AOKI T,UCHIDA K.Enhanced formation of 2-Phenyl-ethanol in due to prephenate de-hydrogenase deficiency[J].Agricultural&biological chemistry,1990,54(1):273-274.
[8]黄筱萍,刘兰,熊大维,等.一株高产2-苯乙醇酵母菌的筛选及鉴定[J].食品与生物技术学报,2016,35(5):531-536.
[9]李记明,程仕伟,姜文广,等.一株高产苯乙醇的酿酒酵母及其在干红葡萄酒酿造中的应用:CN106244474A[P].2016-12-21.
[10]崔志峰,车智博,杨霄,等.2-苯乙醇耐受性高产酵母菌株的选育[J].浙江工业大学学报,2008,36(4):427-430.
[11]王航,孟春,石贤爱,等.2-苯乙醇对酿酒酵母生理生化特性影响[J].微生物学通报,2012,39(6):749-755.
[12]金志华,金庆超.工业微生物育种学[M].3版.北京:化学工业出版社,2015:146.
[13]DUENA R,PEREZ A,CODON A,et al.Overproduction of 2-phenylethanol by industrial yeasts to improve organoleptic properties of bakers'products[J].International journal of food microbiology,2014,180(1):7-12.
[14]AKITA O,IDA T,OBATAT,et al.Mutants ofSaccharomyces cerevisiaeproducing a large quantity of β-phenethyl alcohol and β-phenethyl acetate[J].Journal of fermentation&bioengineering,1990,69(2):125-128.
