UHPLC-LTQ Orbitrap MS快速鉴别无患子果皮中部分苷及苷元成分
2018-04-02齐梦蝶王方方曲继旭孙志蓉郭有枝王春国
张 权,齐梦蝶,康 莹,王方方,曲继旭,孙志蓉,郭有枝,王春国,刘 勇
(1.北京中医药大学,北京 100102;2.福建省源容生物科技有限公司,福建 三明 354500)
无患子(SapindusmukorossiGaertn.)为无患子科(Sapindaceae)无患子属(Sapindus)的一种落叶乔木植物[1]。无患子具有一定的文化渊源,如无患子果实,又名菩提子,即最早记载的念珠[2]。无患子果皮被认为是一种绿色天然的洗涤用品,自古以来人们就有用无患子果皮浸泡液洗发、沐浴、洗衣服的传统,称其为“肥皂树”、“洗手果树”[3-4]。此外,无患子果皮还具有抗菌、抗肿瘤、保肝、抗血小板聚集、抗溃疡、镇痛以及抑制胰脂肪酶等多种药理活性[5]。通过对无患子属植物不同部位进行分离鉴定,现已确定了70余种化合物,主要为苷类成分。根据母核官能团特点,可将这些成分归为常春藤型、齐墩果酸型、甘遂烷型、达玛烷型三萜皂苷和倍半萜苷,其结构示于图1。
LC/MS以其高灵敏度、高专属性、分析快速等特点,已成为复杂中药化学成分快速鉴别的主要技术之一[6-10]。国内外对无患子果皮的成分鉴别已有相关报道,如李锐等[11]通过串联质谱分析,在无患子果皮中鉴定了12种苷类成分;王小淳等[12]运用LC/MS分析发现了数个未见报道的苷类成分。但是,目前对无患子果皮成分的表征多采用低分辨质谱,缺乏高分辨质谱的碎裂信息,以及相近母核类型和复杂成分普遍存在等因素,难以实现复杂成分鉴别和精细结构区分。高分辨率、高精度(<1×10-6)和多级碎片信息是质谱鉴定化合物的必要条件。LTQ Orbitrap MS是将线性离子阱质谱和高分辨质谱结合的杂交型质谱仪,同时具有离子阱质谱的多级碎裂和Orbitrap的高分辨能力,有助于实现常规化合物的鉴定和复杂成分的定性分析[13-14]。多级质谱(MSn)数据多采用数据依赖性采集技术(data-dependent acquisistion, DDA),即将一级全扫描得到的母离子信号进行选择、分离并碎裂成更小的碎片子离子,再进行二级扫描,以此类推,获得相互关联的MSn多级碎片信息[15]。但是,常规的数据依赖性采集技术更倾向于采集和检测高丰度的离子,对于复杂成分组来说,大量目标组分无法检测到二级碎片信息,而母离子列表(parent ion list, PIL)采集技术能够选择特定母离子进行MSn分析,提高了扫描速度,在一定程度上克服了低丰度目标组分难以检测多级碎片的难题[16]。另外,对于常规的裂解模式CID(collision induced dissociation),质谱分析会出现低质量碎片缺失效应,造成母核结构相近化合物无法进行精细结构深入区分的困境;而高能碰撞(high energy collision dissociation, HCD)碎裂模式,母离子通过HCD进行碎裂,然后子离子在Orbitrap中进行高分辨和高精度的二级扫描,该碎裂模式提高了碎裂效率,实现了对低质量碎片信息的检测,同时提供了精确质量数的碎片离子[17-18]。此外,对海量质谱数据的分析和深入挖掘,耗费了大量的人工精力,而质谱数据的计算机智能计算(Insilico)技术正成为未来中药小分子质谱数据深度挖掘的主要手段之一。Mass Frantier是一款最新的用于小分子结构鉴定的质谱软件,如其中的Fragment Ion Search(FISH)模块可以将碎裂规则或诊断离子导入软件进行高通量筛查,得到的化合物被认为是与目标化合物具有相似的母核和碎裂规则;MS Tree Match是一种谱图比对技术,通过软件内置或用户自建的数据库对相同水平(MSn)、具有相同母离子m/z的相应质谱图进行谱图匹配,软件自动给出1~999的匹配值用于化合物数据库的快速筛查。
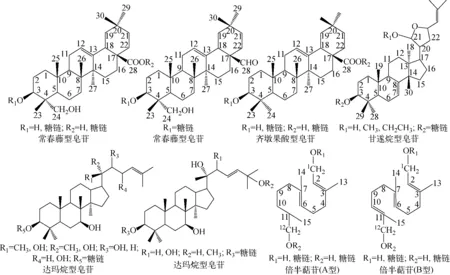
图1 无患子属植物苷类成分的主要结构类型Fig.1 Structure types of glycosides in Sapindus
本研究拟采用UHPLC-LTQ-Orbitrap MS技术对无患子果皮中苷类成分进行快速筛查和鉴定,并且区分母核结构相近的化合物,预测可能存在的新成分,以形成一套较为完整的成分表征策略。
1 实验部分
1.1 仪器与试剂
LTQ-Oribitrap XL线性离子阱-串联静电场轨道阱质谱仪:美国Thermo Scientific公司产品,配有热喷雾离子源(HESI)、Xcalibur 2.1化学工作站;Thermo Scientific Dionex Utimate 3000 UHPLC Plus Focused超高效液相色谱系统:美国Thermo Scientific公司产品,配有二元梯度泵、自动进样器、柱温箱、二级管阵列(DAD)检测器;Chromeleon 7工作站:美国 Thermo Scientific 公司产品;Millipore Synergy UV型超纯水机:美国Millipore公司产品;R200D型电子分析天平(十万分之一):德国Sartorius公司产品。
常春藤皂苷元(批号HA0820KA14,纯度≥98%)、齐墩果酸(批号K01016CA14,纯度≥98%)对照品:均购自上海源叶生物科技有限公司;水为超纯水;甲醇、乙腈:均为质谱级,美国Fishier Scientific公司产品;其余试剂均为分析纯;无患子果:采自福建建宁,经北京中医药大学资源系孙志蓉教授鉴定原植物为无患子SapindusmukorossiGaertn.。
1.2 标准品溶液的配制
精确称取1.02 mg常春藤皂苷元和1.04 mg齐墩果酸,分别置于2 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,得0.51 g/L常春藤皂苷元和0.52 g/L齐墩果酸标准液,过0.45 μm微孔滤膜,备用。
1.3 供试品溶液的配制
将无患子果皮烘干、粉碎,称取50 g果皮粉末,加入250 mL H2O,60 ℃回流提取3次,每次分别为3、2、2 h,合并、浓缩,定容至100 mL容量瓶中。AB-8大孔树脂富集,上样量50 mL,径高比1∶10,流速1 mL/min,水洗脱至molish反应呈阴性,然后用95%乙醇洗脱,流速1 mL/min,至大孔树脂柱无色,收集95%乙醇洗脱液,减压浓缩至无醇味,-80 ℃冰冻12 h,冷冻干燥48 h,得6.7 g皂苷粉末,得率为26.8%。取0.115 00 g皂苷粉末,溶于10 mL甲醇中,过0.45 μm微孔滤膜,即得供试品溶液。
1.4 实验条件
1.4.1色谱条件色谱柱:Waters Acquity UPLC BEH-C18柱(2.1 mm×50 mm×1.7 μm);流动相:A为乙腈,B为0.1%甲酸水溶液;洗脱程序:0~2 min(5%~32%A),2~14 min(32%~36%A),14~15 min(36%~40%A),15~25 min(40%~50%A),25~28 min(50%~80%A),28~28.1 min(80%~5%A),28.1~32 min(5%A);流速0.4 mL/min;柱温30 ℃;DAD检测波长210 nm;进样量4 μL。
1.4.2质谱条件HESI离子源,负离子检测模式,离子源温度350 ℃,电离源电压4 kV,毛细管电压35 V,管透镜电压110 V,鞘气和辅助气均为高纯氮气(纯度>99.99%),鞘气流速 40 L/h,辅助气流速20 L/h;采用傅里叶变换高分辨全扫描方式(TF,Full scan,分辨率30 000)数据依赖性DDA-MS2;母离子列表PIL-MS2和PIL-MS3;运用CID和HCD相结合的碎解方式等多种策略。
1.5 数据处理
运用HighChem Mass Frontier 7.0软件对成分进行解析,其搜索、解析途径分为两种:一是构建无患子属植物苷类成分的特征碎片模板,在FISH Filter中进行相似结构高通量搜索;二是构建离子树(MS tree)数据库,总结已鉴定化合物的裂解信息,以MS tree的形式录入数据库,进行MS Tree Match的高通量匹配,以Match得分大于400作为匹配阈值。
2 结果与讨论
本研究运用UHPLC-LTQ Orbitrap MS技术整合多种数据采集、挖掘策略,对无患子果皮中的苷类成分进行系统研究,共鉴别出67个化合物。首先,采用常规的DDA-MS2采集方法,根据常春藤皂苷元、齐墩果酸等标准品的裂解规律和特征碎片进行快速筛查,结合精确分子质量和相关文献[19-38],共鉴别出38种化合物;采用PIL-MS2,PIL-MS3和HCD高能碰撞采集方法,实现了18个母核结构相近化合物的精细区分和结构鉴别;采用Mass Frantier软件进行数据库对比和质谱碎片预测,共推测出11种新成分。
2.1 齐墩果酸型和常春藤型皂苷标准品的质谱裂解规律
在LTQ-Orbitrap MS中(分辨率30 000),齐墩果酸的准分子离子峰为m/z455.351 97[M-H]-,选择母离子进行CID裂解,在二级质谱图中出现m/z409、407、391、375、297、247、219等特征碎片离子。其中,碎片离子m/z409是由于C28位脱羧反应,母核失去1分子甲酸形成的, C21和C22位进一步失去氢,形成共轭结构的稳定碎片离子m/z407;碎片离子m/z409中性丢失1分子H2O形成m/z391;C24位角甲基不稳定进一步丢失1分子CH4形成碎片离子m/z375;碎片离子m/z247是由齐墩果酸发生逆狄尔斯-阿尔德(RDA)反应形成的,m/z247的C28位进一步中性丢失1分子CO形成m/z219碎片离子[19]。齐墩果酸二级质谱图和可能的裂解途径示于图2a和图3。
常春藤皂苷元的准分子离子峰为m/z471.346 88,选择母离子进行CID裂解,在二级质谱图中出现m/z425、405、393、377、347、203等特征碎片离子。其中,碎片离子m/z453是母核丢失1分子H2O形成的,m/z453中C28位丢失1分子CO及C4位脱CH4O后,分别形成m/z425和m/z393碎片离子。其中,m/z393脱去CH4后形成m/z377,进一步丢失2分子角甲基后形成m/z347,m/z377发生逆狄尔斯-阿尔德裂解后形成m/z203等碎片离子[6,19,20]。常春藤皂苷元二级质谱图和可能的裂解途径示于图2b和图4。
常春藤型和齐墩果酸型三萜皂苷的结构多样且复杂,主要体现在糖链的数目和键合的位置,单糖的种类、数目以及连接顺序、位点,乙酰基的数目以及键合位置的不同。根据以上裂解规律和母核特点,发现m/z471、393碎片离子和m/z455、407碎片离子可以作为区分两种类型三萜皂苷的特征碎片离子。

图2 负离子模式下,齐墩果酸(a)和常春藤皂苷元(b)的二级质谱图Fig.2 MS2 spectra of oleanolic acid (a) and hederagenin (b) at negative ion mode

图3 负离子模式下,齐墩果酸的质谱裂解途径Fig.3 Fragmentation pathways of oleanolic acid at negative ion mode

图4 负离子模式下,常春藤皂苷元的裂解途径Fig.4 Fragmentation pathways of hederagenin at negative ion mode
2.2 无患子果皮中皂苷类成分的快速筛查和鉴别
2.2.1常春藤型和齐墩果酸型的快速筛查和鉴别运用LTQ-Orbitrp MS仪,采用常规DDA-MS2数据采集方法,结合高分辨质谱精确分子质量,根据常春藤型皂苷元m/z471、393,齐墩果酸m/z455、407等特征碎片,对无患子果皮中三萜皂苷类成分进行快速筛查和鉴别,共鉴别了16种常春藤型三萜皂苷,2种齐墩果酸型三萜皂苷,结果列于表1(化合物1~18)。
2.2.2达玛烷型皂苷类成分的快速筛查和鉴别无患子果皮中达玛烷型三萜皂苷的结构多样性体现在母核官能团种类和键合位置的不同,以及糖链的差异[21-22]。根据其母核特点,常以达玛烷皂苷苷元碎片离子m/z505、492、489、475、459等作为区分达玛烷型三萜皂苷的特征碎片离子[23],据此对无患子果皮中该类成分进行快速筛查和鉴别,共鉴别了5种达玛烷型皂苷类成分,结果列于表1(化合物19~23)。
2.2.3倍半萜苷类成分的快速筛查和鉴别
无患子倍半萜糖苷类化合物的基本骨架主要分为羟基邻位C11上有氢的A型倍半萜苷和羟基邻位C11上没有氢而形成双键的B型倍半萜苷两类。它们在软电离状态下均产生一系列糖苷键丢失的碎片离子,最后脱去1分子葡萄糖和1分子水[19],其特征碎片离子为m/z531、529、401、399等。本研究以此作为诊断离子对无患子果皮中倍半萜苷进行快速筛查和鉴别,共鉴别了12种A型倍半萜苷类成分,5种B型倍半萜苷类成分,结果列于表1(化合物24~38)。
以倍半萜糖苷化合物34为例,说明其鉴别过程:
化合物34在总离子流图(TIC)的保留时间为4.97 min,高分辨质谱中显示的精确准分子离子峰为m/z677.337 59[M-H]-,根据元素组成分析,该化合物的分子式为C50H84O28(质量偏差为-0.44×10-6)。在CID裂解下,MS2图谱中产生了m/z545、531、399、307、247等碎片离子。m/z545的C8和C12位中性丢失1分子H2O,形成五元环结构,其相连的葡萄糖基进一步发生六元环上的跨环开裂,丢失C3H6O2形成m/z307碎片离子,m/z307进一步失去C2H4O2,形成m/z247碎片离子[6,19]。上述碎片离子具体归属为:m/z545[M-H-Ara]-,m/z531[M-H-Rha]-,m/z399[M-H-Rha-Ara]-,m/z307[M-H-H2O-Rha-C3H6O2]-,m/z247[M-H-H2O-Rha-C3H6O2-C2H4O2]-。结合相关文献[24],化合物34鉴别为Pyishiauoside Ⅱb,其二级质谱图和可能的裂解途径分别示于图5和图6。
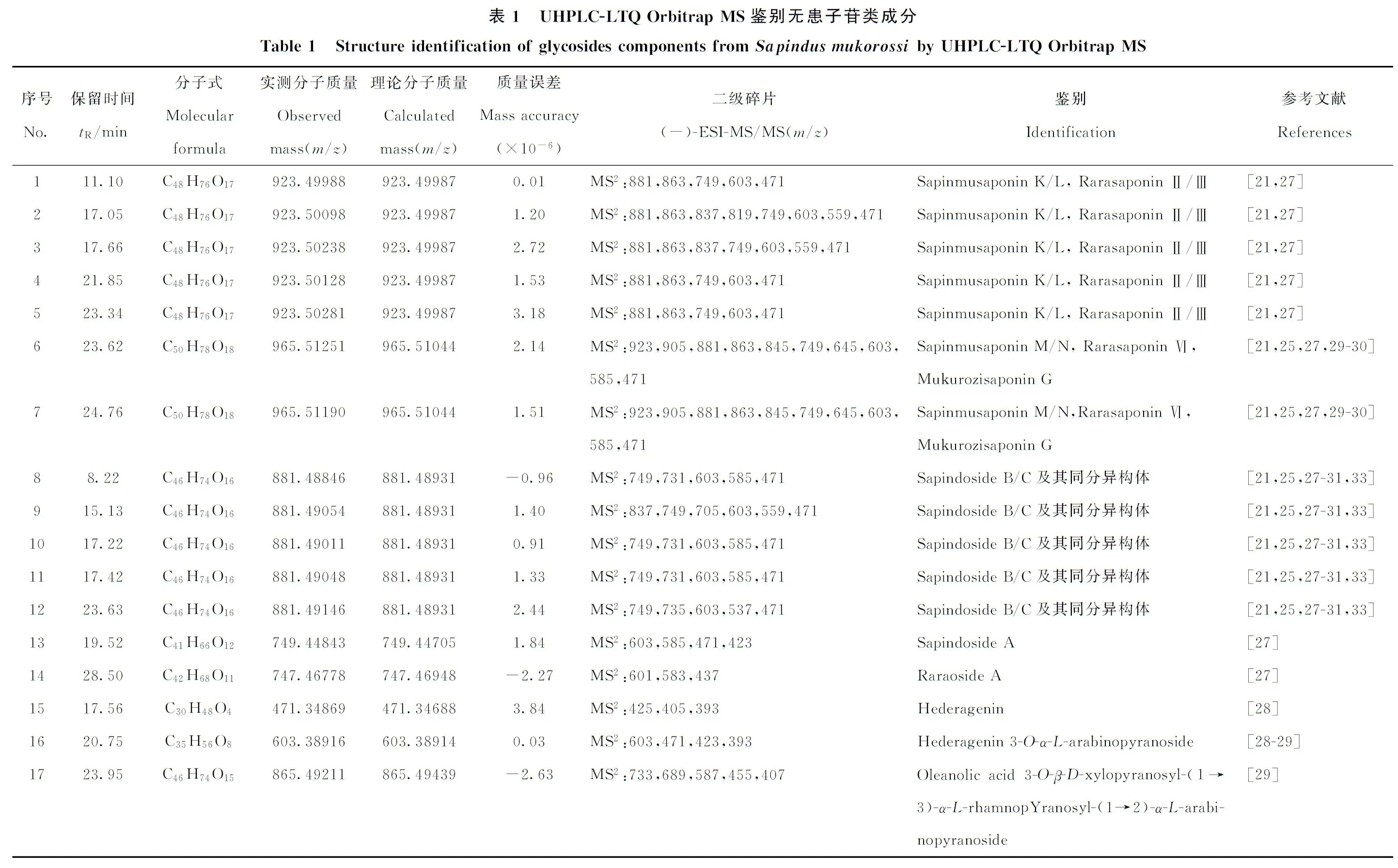


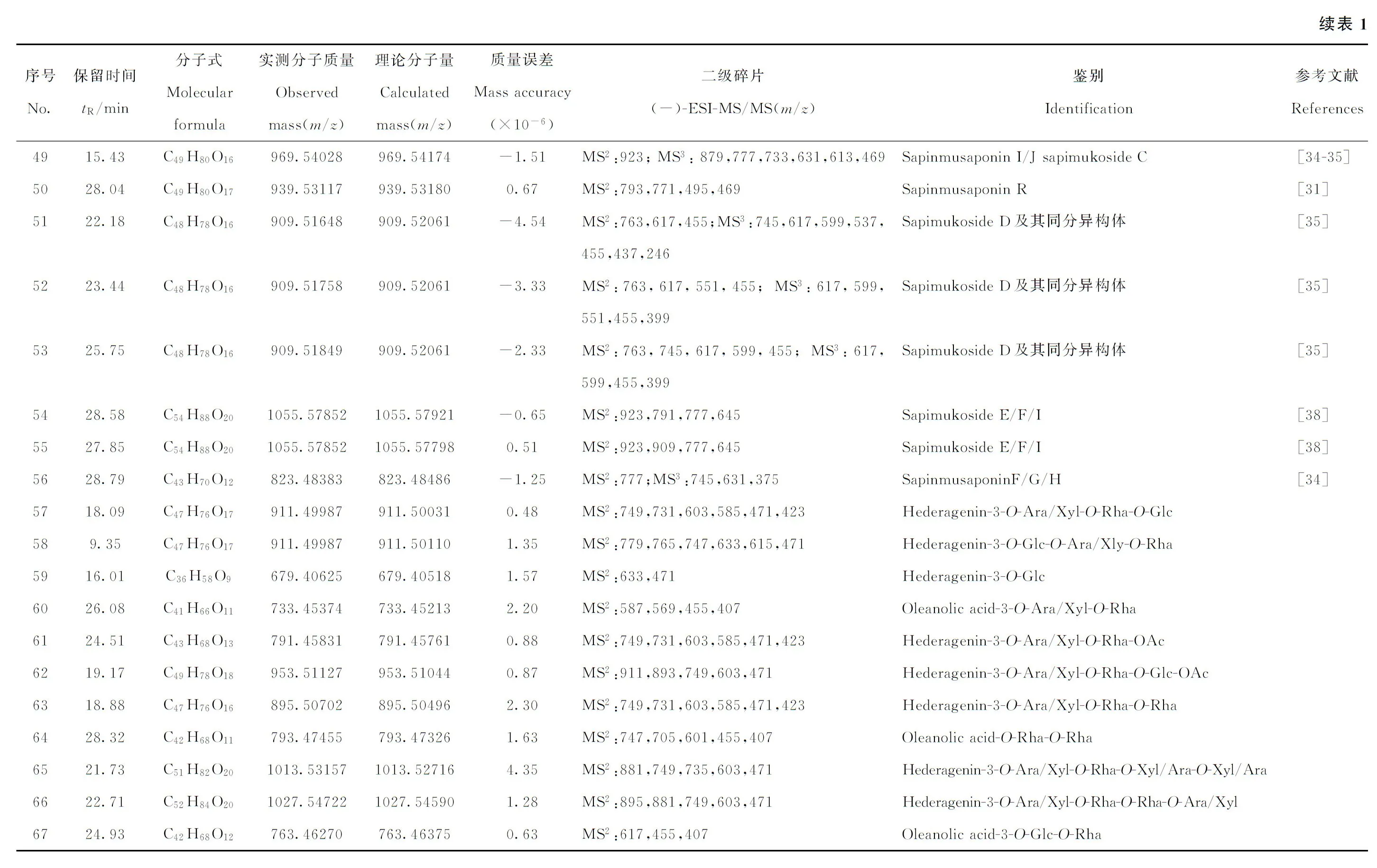

图5 化合物34的二级质谱图Fig.5 MS2 spectrum of compound 34
2.3 母核结构相近化合物的精细区分和结构鉴别
2.3.1HCD高能碰撞用于5种常春藤型皂苷的鉴别采用常规的数据依赖型数据采集DDA-MS2和源内CID裂解,发现一些分子质量较大的化合物裂解不完全,不能够提供准确的母核信息。以化合物39为例:在高分辨质谱中,保留时间为24.88 min,精确准分子离子峰为m/z1 007.522 64[M-H]-,根据元素组成分析,分子式为C52H80O19(质量偏差为1.63×10-6)。经源内CID裂解后,在MS2中呈现m/z965、947、923、791、687、645、603、585等碎
片离子,示于图7a。其中,m/z965碎片离子为准分子离子m/z1 007脱去乙酰基形成的,进一步脱去1分子H2O,形成m/z947 碎片离子;m/z965丢失乙酰基形成m/z923碎片离子;碎片离子m/z791与m/z923的质量数相差132 u,提示存在阿拉伯糖或木糖;同理,m/z645与m/z791相差146 u,提示糖链中存在鼠李糖;m/z687可能是由于鼠李糖发生环内裂解,丢掉-C4O3H而产生[23];m/z645进一步丢掉1分子乙酰基形成碎片离子m/z603,后者脱去1分子水形成m/z585碎片离子。由此推测,化合物39为1分子鼠李糖或阿拉伯糖和1分子鼠李糖的化合物,但是,由于缺少母核的碎片信息,无法鉴别其为哪种类型的苷类成分。使用高能碰撞HCD进行裂解,更易获得难以裂解成分的多级质谱图,并显著改善CID裂解中产生的低质量碎片丢失效应[18]。如在HCD中出现m/z471常春藤皂苷元诊断离子,示于图7b。结合文献[25],鉴别化合物39为Rarasaponin Ⅳ及其同分异构体,可能的裂解途径示于图8。使用该策略对另外4种常春藤型皂苷的鉴别结果列于表1(化合物40~43)。

图6 化合物34的裂解途径Fig.6 Fragmentation pathways of compound 34

注:a.CID裂解模式;b.HCD裂解模式图7 化合物39的二级质谱图Fig.7 MS2 spectra of compound 39

图8 化合物39的裂解途径Fig.8 Fragmentation pathways of compound 39
2.3.2PIL-MS2和PIL-MS3对13种甘遂烷型皂苷的鉴别四氢呋喃环甘遂烷型皂苷为无患子属植物特有的成分,其母核是由C21和C23通过醚键连接,C21一般为取代基,末端有4个碳链连接在C23上[26]。鉴别此类化合物时,发现一些化合物没有二级信息,并且一些化合物的母核与齐墩果酸分子式相同,需要进一步的裂解信息以确保鉴别的准确性。针对这两个问题,本实验采用了PIL-MS2,PIL-MS3的采集策略,13个甘遂烷型皂苷化合物得到了鉴别,结果列于表1(化合物44~56)。以化合物44为例:其在高分辨质谱中的保留时间为24.51 min,显示的精确准分子离子峰为m/z763.462 16[M-H]-,根据元素组成分析,该化合物的分子式为C42H68O12。在CID裂解下,MS2图谱中产生了与齐墩果酸质量数相同的m/z455
碎片离子,示于图9a,但其丰度比五环三萜皂苷裂解所产生的齐墩果酸苷元离子丰度大得多。采用PIL-MS2,PIL-MS3的采集策略,发现其进一步裂解产生了m/z437、373、339碎片离子,示于图9b,与齐墩果酸裂解产生的m/z409、407、391等特征碎片离子有本质区别。结合文献[24],确定化合物44的二级图谱中m/z455并非齐墩果酸苷元,而为甘遂烷三萜皂苷的母核。各碎片离子的归属为m/z617 [M-H-Rha]-,m/z599 [M-H-Rha-H2O]-,m/z455 [M-H-Rha-Glc]-,m/z437 [M-H-Rha-Glc-H2O],m/z373 [M-H-Rha-Glc-C5H6O],m/z339 [M-H-Rha-Glc-C5H6O-H2O-CH4]。结合文献[24],鉴别该化合物为Sapimukoside B或其同分异构体,可能的裂解途径示于图10。

图9 化合物44的二级(a)和三级(b)质谱图Fig.9 MS2 (a), MS3 (b) spectra of compound 44

图10 化合物44的裂解途径Fig.10 Fragmentation pathways of compound 44
2.4 基于In silico的高通量筛查对无患子果皮中新成分的推测
相对于大分子如蛋白质组,中药小分子的质谱数据深度解析十分有限,如实验中获得的无患子果皮质谱二级谱图约1 850张,95%以上的质谱数据无法得到解析。本研究主要整合了Mass Frontier的FISH和MS Tree Match技术,用于无患子果皮中未见报道成分的高通量筛查。
构建无患子果皮中三萜皂苷和倍半萜糖苷类成分的特征碎片模板,进行FISH高通量筛查,共筛选出30个目标化合物,示于图11a。对其二级质谱进行解析,推测出4个新成分,列于表1(化合物57~60)。

注:a.FISH;b.MS Tree Match图11 Mass Frontier筛选结果Fig.11 Screening results for Mass Frontier
将表1中化合物1~60的MSn信息导入Mass Frontier软件,构建无患子果皮苷类成分数据库。使用Dot-product算法对相同母离子下的相同水平(MSn)质谱图进行MS Tree Match的高通量匹配,并选取Match得分大于400作为匹配阈值,结果共得到153个目标化合物,示于图11b。对上述化合物进行二级谱图解析,推测出7个新成分,列于表1(化合物61~67)。对上述推测的11种新成分进行HCD碎裂验证,HCD除了具有高能碰撞的优势,还具有提供高质量分辨能力和精确质量数的二级谱图信息的能力,大大提高了新成分结构预测的准确性。
3 结论
本研究采用UHPLC-LTQ Orbitrap MS法建立了多种数据采集、挖掘策略用于无患子果皮中苷类成分的快速鉴别,对无患子果皮中母核结构相近化合物的精细区分以及新成分的预测和验证进行了探讨。该方法能够实现无患子果皮中67种苷类化合物的鉴别,可为无患子质量控制及药效学研究提供参考数据,有助于复杂中药成分的快速定性分析。
参考文献:
[1]中国植物志编辑委员会. 中国植物志:第47卷(第1分/册)[M]. 北京:科学出版社,1998.
[2]贾黎明,孙操稳. 生物柴油树种无患子研究进展[J]. 中国农业大学学报,2012,17(6):191-196.
JIA Liming, SUN Caowen. Research progress of biodiesel treeSapindusmukorossi[J]. Journal of China Agricultural University, 2012, 17(6): 191-196(in Chinese).
[3]孙洁如,陈孔常,周鸣方,等. 无患子表面活性物及其复配体系的性质研究[J].日用化学工业,2002,32(4):16-18.
SUN Jieru, CHEN Kongchang, ZHOU Mingfang, et al. Study on the properties ofSapindussurfactant and its complex system[J]. China Surfactant Detergent and Cosmetics, 2002, 32(4): 16-18(in Chinese).
[4]邵文豪,姜景民,董汝湘,等. 不同产地无患子果皮皂苷含量的地理变异研究[J]. 植物研究,2012,32(5):627-631.
SHAO Wenhao, JIANG Jingmin, DONG Ruxiang, et al. Geographic variation of Saponins contens inSapindusmukorossifrom different habitats[J]. Bulletin of Botanical Research, 2012, 32(5): 627-631(in Chinese).
[5]徐凯节,次旦扎西,丁立生. 无患子属植物的化学成分及生物活性研究进展[J]. 天然产物研究与开发,2013,25(2):267-273.
XU Kaijie, CIDAN Zhaxi, DING Lisheng. Research progress on chemical constituents and biological activities of Sapindus species[J]. Nat Pro Res Dev, 2013, 25(2): 267-273(in Chinese).
[6]李锐,周燕,杨永成,等. 无患子皂苷成分的串联质谱分析[J]. 高等学校化学学报,2006,27(1):52-54.
LI Rui, ZHOU Yan, YANG Yongcheng, et al. Tandem mass spectrometry analysis of Saponins fromSapindusmukorossi[J]. Chemical Journal of Chinese Universities, 2006, 27(1): 52-54(in Chinese).
[7]王小淳. 高效液相色谱-质谱联用分析无患子中的表面活性物质[J]. 色谱,2001,19(6):529-531.
WANG Xiaochun. Analysis of surface active substances inSpindusmukorossiby high performance liquid chromatography mass spectrometry[J].Chinese Journal of Chromatography, 2001, 19(6): 529-531(in Chinese).
[8]魏文峰,王昶,张树明,等. 串联质谱技术在中药化学成分分析中的应用研究进展[J]. 中国实验方剂学杂志,2013,19(14):351-354.
WEI Wenfeng, WANG Chang, ZHANG Shuming, et al. Research progress of tandem mass spectrometry and aits appplication in chemical components analysis of traditional Chinese medicines[J]. Chinese Journal of Experimental Traditional Medical Formulate, 2013, 19(14): 351-354(in Chinese).
[9]李雪,王倩倩,徐晨,等. 中药质谱分析方法及应用研究[J]. 中国科学,2014,44(5):701-709.
LI Xue, WANG Qianqian, XU Chen, et al. Study on methods and application of mass spectrometry in traditional Chinese medicine[J]. Science China Press, 2014, 44(5): 701-709(in Chinese).
[10] 赵超,李会军,陈君,等. 中药复杂成分解析与质量评价的研究进展[J]. 中国药科大学学报, 2012,43(3):283-288.
ZHAO Chao, LI Huijun, CHEN Jun, et al. Progress for chemical analysis and quality control of traditional Chinese medicines[J]. Journal of China Pharmaceutical University, 2012, 43(3): 283-288(in Chinese).
[11] 关天野,梁艳,李春竹,等. 液相色谱/质谱联用技术的新进展和中药研究的相关热点问题[J]. 中国天然药物,2011,9(5):385-400.
GUAN Tianye, LIANG Yan, LI Chunzhu, et al. Recent development in liquid chromatography/mass spectrometry and allied topics for traditional Chinese medicine research[J]. Chinese Journal of Natural Medicines, 2011, 9(5): 385-400(in Chinese).
[12] 孙明谦. 中药复杂成分样品的电喷雾质谱分析方法研究[D]. 北京:北京中医药大学,2009.
[13] 王勇为. LTQ-Obitrap Velos双分压线性阱和静电场轨道阱组合式高分辨质谱性能及应用[J]. 现代仪器,2010,(5):15-19.
WANG Yongwei. The performance and featured applications of ltq orbitrap velos, a hybrid high resolution mass spectrometer using electrostatic orbital mass analyzer coupled with dual pressure ion trap[J]. Modern Instruments, 2010, (5): 15-19(in Chinese).
[14] 周建良,周哲,陈碧莲,等. UHPLC/LTQ Orbitrap MS法解析一种未知西地那非衍生物[J]. 质谱学报,2016,37(5):422-430.
ZHOU Jianliang, ZHOU Zhe, CHEN Bilian, et al. Identification of an unknown derivative of sildenafil by UHPLC/LTQ Orbitrap MS[J]. Journal of Chinese Mass Spectrometry Society, 2016, 37(5): 422-430(in Chinese).
[15] 谢彤,徐健亚,沈存思,等. 基于UPLC/LTQ-Orbitrap-MS的黄芩中黄酮碳苷的结构表征及同分异构体的区分[J]. 中草药,2015,46(22):3 318-3 325.
XIE Tong, XU Jianya, SHEN Cunsi, et al. Structural characterization of C-glycosyl flavonoids inScutellariabaicalensisand differentiation of isomers by UPLC/LTQ-Orbitrap-MS[J]. Chinese Traditional and Herbal Drugs, 2015, 46(22): 3 318-3 325(in Chinese).
[16] REN Y, WANG P Y, WU C S, et al. Identification of the metabolites after oral administration of extract of ziziphi spinosae semen to rats or dogs by high-performance liquid chromatography/linear ion trap FTICR hybrid mass spectrometry[J]. Biomed Chromatogr, 2013, 27(1): 17-26.
[17] 刘颖,蔡伟,李宁,等. UHPLC-LTQ-Orbitrap MS结合高能碰撞诱导裂解技术快速鉴定大鼠口服麦冬甾体皂苷后的血中移行成分[J]. 药学学报,2016,51(11):1 751-1 758.
LIU Ying, CAI Wei, LI Ning, et al. Rapid characterization of constituents absorbed into blood after oral administration of steroidal saponins from Radix Ophiopogonis using UHPLC-LTQ-Orbitrap MS coupled with higher energy collision induced dissociation[J]. Acta Pharmaceutica Sinica, 2016, 51(11): 1 751-1 758(in Chinese).
[18] 王子健,刘颖,刘思燚,等. UPLC-HRMSn结合高能诱导裂解快速鉴定麦冬中高异黄酮类成分[J]. 质谱学报,2016,37(6):481-491.
WANG Zijian, LIU Ying, LIU Siyi, et al. Rapid Identification of homoisoflavonoids in Ophiopogonjaponicas based on UPLC-HRMSncombined HCD method[J]. Journal of Chinese Mass Spectrometry Society,2016, 37(6): 481-491(in Chinese).
[19] 李锐. 有机质谱裂解规律及智能解析方法研究[D]. 成都:中国科学院成都生物研究所,2007.
[20] 郭宜城,欧阳辉,何明珍,等. UPLC/Q-TOF-MS/MS鉴定西南银莲花中的皂苷类成分[J]. 中草药,2014,45(10):1 378-1 387.
GUO Yicheng, OUYANG Hui, HE Mingzhen, et al. Identification of saponins in rhizomes of Anemonedavidii by UPLC/Q-TOF-MS/MS[J]. Chinese Traditional and Herbal Drugs, 2014,45(10): 1 378-1 387(in Chinese).
[21] HUANG H C, WUB M D, TSAI W J, et al. Triterpenoid saponins from the fruits and galls ofSapindusmukorossi[J]. Phytochemistry, 2008, 69(7): 1 609-1 616.
[22] KUO Y H, HUANG H C, YANG L M, et al. New dammarane-type saponins from the galls ofSapindusmukorossi[J]. J Agric Food Chem, 2005, 53(12): 4 722-4 727.
[23] 赵静. 三七中皂苷类成分的裂解规律探究及其化学特征的道地性研究[D]. 北京:北京中医药大学,2015.
[24] TENG R W, NI W, HUA Y, et al. Two new tirucallane-type triterpenoid sapoins fromSapindusmukorossi[J]. Acta Botanica Sinica, 2003, 45(3): 369-372.
[25] ASAO Y, MORIKAWA T, XIE Y Y, et al. Structures of acetylated oleanane-type triterpene saponins, rarasaponins Ⅳ, Ⅴ and Ⅵ, and anti-hyperlipidemic constituents from the pericarps ofSapindusrarak[J]. Chem Pharm Bull, 2009, 57(2): 198-203.
[26] 张耀,汪俊松,孔令义. 甘遂烷型三萜的研究进展[J]. 中草药,2010,41(10):1 733-1 739.
ZHANG Yao, WANG Junsong, KONG Lingyi. Advances in studies on tirucallane-type triterpenoids[J]. Chinese Traditional and Herbal Drugs, 2010, 41(10): 1 733-1 739(in Chinese).
[27] MORIKAWA T, XIE Y Y, ASAO Y, et al. Oleanane-type triterpene oligoglycosides with pancreatic lipase inhibitory activity from the pericarps ofSapindusrarak[J]. Phytochemistry, 2009, 70(9): 1 166-1 172.
[28] NAKAYAMA K, FUJINO H, KASAI R, et al. Sapions of percarps of ChineseSapindusdelavayi(Pyi-shiau-tzu), a source of natural surfactants[J]. Chem Pharm Bull, 1986, 34(5): 2 209-2 213.
[29] HUANG H C, LIAO S C, CHANG F R, et al. Molluscicidal saponins fromSapindusmukorossi, inhibitory agents of golden apple snails,Pomaceacanaliculata[J]. J Agric Food Chem, 2003, 51(17): 4 916-4 919.
[30] SAHA S, WALIA S, KUMAR J, et al. Screening for feeding deterrent and insect growth regulatory activity of triterpenic saponins fromDiploknemabutyraceaandSapindusmukorossi[J]. J Agric Food Chem, 2010, 58(1): 434-440.
[31] HUANG H C, TSAI W J, LIAW C C, et al. Anti-platelet aggregation triterpene saponins from the galls ofSapindusmukorossi[J]. Chem Pharm Bull, 2007, 55(9): 1 412-1 415.
[32] NI W, HUA Y, LIU H Y, et al. Tirucallane-type triterpenoid saponins from the roots ofSapindusmukorossi[J]. Chem Pharm Bull, 2006, 54(10): 1 443-1 446.
[33] WONG W H, KASAI R, CHOSHI W, et al. Acyclic sesquiterpene oligoglycosides from pericarps ofSapindusdelavayi[J]. Phytochemistry, 1991, 30(8): 2 699-2 702.
[34] HUANG H C, TSAI W J, MORRIS-NATSCHKE S L, et al. Sapinmusaponins F-J, bioactive tirucallane-type saponins from the galls ofSapindusmukorossi[J]. J Nat Prod, 2006, 69(5): 763-767.
[35] NI W, HUA Y, TENG R W, et al. New tirucallane-type triterpenoid saponins fromSapindusmukorossigaetn[J]. Journal of Asian Natural Products Research, 2004, 6(3): 205-209.
[36] MORIKAWA T, XIE Y Y, NINOMIYA K, et al. Inhibitory effects of acylated acyclic sesquiterpene oligoglycosides from the pericarps ofSapindusrarakon tumor necrosis factor-a-induced cytotoxicity[J]. Chem Pharm Bull, 2010, 58(9): 1 276-1 280.
[37] ZHANG X M, YANG D P, XIE Z Y, et al. Two new glycosides isolated fromSapindusmukorossifruits:effects on cell apoptosis and caspase-3 activation in human lung carcinoma cells[J]. Natural Product Research, 2016, 30(13): 1 459-1 463.
[38] NI W, HUA Y, LIU H Y, et al. Tirucallane-type triterpenoid saponins from the roots ofSapindusmukorossi[J]. Chem Pharm Bull, 2006, 54(10): 1 443-1 446.
