UHPLC-LTQ-Orbitrap分析硫磺熏蒸麦冬中高异黄酮硫酸酯和亚硫酸酯
2018-04-02尚展鹏王子健赵文靖梅晓丹卢建秋张加余
尚展鹏,王 菲,王子健,赵文靖,梅晓丹,卢建秋,张加余
(1.北京中医药大学中药学院,北京 100029;2.北京中医药大学,北京中医药研究院,北京 100029;3.北京中医药大学图书馆,北京 100029)
硫磺熏蒸法常应用于食品、农产品以及中药材等产品门类的储藏养护和加工过程,具有防虫蛀、防腐、防霉变、灭菌等诸多作用[1],且有利于干燥和改善中药材外观色泽等[2-4]。据文献[5-6]报道,硫磺熏蒸会造成中药材化学成分种类及含量的改变,甚至会影响药材的整体性味,从而导致药效物质的转变和流失。此外,硫磺熏蒸还会导致SO2残留,以及砷、汞等重金属超标,可能对人体肝、肾等脏器造成严重危害。因此,从2000年版《中国药典》以来,收录的硫磺熏蒸中药材数目逐年减少;2010年版《中国药典》增加了中药材及其饮片的SO2残留限量标准。然而,在实际的中药材加工贮藏和炮制过程中,由于其简便易行且成本低,硫磺熏蒸现象仍然屡见不鲜,这不仅扰乱了中药材市场的秩序,也带来了很多用药安全隐患。
麦冬为百合科(Liliaceae)沿阶草属(Ophiopogon)植物麦冬Ophiopogonjaponicus(L. f.) Ker-Gawl.的干燥块根,作为临床常用的著名中药,其始载于《神农本草经》,列为上品,具有养阴生津、润肺清心之功效。麦冬的主要有效成分为甾体皂苷、高异黄酮和多糖等,常用于各中药复方制剂的生产中[7]。基于美化外观的目的,硫磺熏蒸也常被用于麦冬药材的前处理过程中[8-10],但相关的有效成分变化情况却未见报道。
超高效液相色谱-高分辨质谱法(UHPLC-HRMS)结合了超高效液相色谱的快速分离能力和高分辨质谱的高灵敏度、高质量精度、高专属性的检测能力,现已成为中药化学成分及其体内代谢过程研究的常用方法[11-13]。线性离子阱-静电场轨道阱质谱(LTQ-Orbitrap MS)可提供高分辨率(最高达100 000)的相对分子质量和丰富的碎片离子信息,能够为中药复杂物质体系的快速解析提供更可靠的依据[14-15]。
基于前期研究的基础[16],本研究拟采用UHPLC-LTQ-Orbitrap高分辨质谱法筛选鉴定硫磺熏蒸麦冬中高异黄酮的含硫衍生物,以期为阐明麦冬在硫磺熏蒸过程中主要成分的转变机制提供参考。
1 实验部分
1.1 仪器
Thermo Fisher DIONEX Ultimate 3000超高效液相色谱仪和LTQ-Orbitrap XL线性离子阱-静电场轨道阱质谱仪:美国Thermo Fisher公司产品,配有电喷雾离子源(ESI),Xcalibur 2.1工作站;R200D型电子分析天平(十万分之一):德国Sartorius公司产品;Milli-Q Synthesis超纯水纯化系统:美国Millipore公司产品;热恒温鼓风干燥箱:上海一恒科技有限公司产品;KQ-250DE型超声波清洗器:昆山市超声仪器有限公司产品。
1.2 材料与试剂
4批次新鲜麦冬药材:由四川代为本农业科技有限公司麦冬种植基地提供,经北京中医药大学中药学院乔延江教授鉴定为百合科植物麦冬Ophiopogonjaponicus的块根;固相萃取小柱(200 mg/3 mL,59 μm,70 Å):美国Grace Davison Discovery Science公司产品;甲醇、乙腈和甲酸:均为质谱级,美国Thermo Fisher公司产品;实验用水:由Millipore超纯水机制备;其余试剂均为分析纯。
1.3 麦冬药材的模拟硫磺熏蒸
取新鲜川麦冬药材洗净,粉碎成粗粉,混匀,每批次称取20 g,备用;点燃10 g硫磺放入干燥器底部,药材置于带孔隔离板上,密闭熏蒸24 h[4,17];之后置于50 ℃烘箱中鼓风干燥12 h,得干燥的硫磺熏蒸麦冬药材[18]。
1.4 供试品溶液的制备
将硫磺熏蒸麦冬药材粉碎,过筛,精密称取3.0 g,加入25 mL 70%甲醇溶液,超声处理(功率250 W,频率40 kHz)30 min,混匀,静置至室温;过滤,收集滤液,于50 ℃水浴中烘至近干,加2 mL水使之溶解,通过预平衡的固相萃取C18-Low小柱,依次用2 mL水和2 mL甲醇洗脱,收集洗脱液,以0.22 μm微孔滤膜过滤,取续滤液,即得供试品溶液。
1.5 实验条件
1.5.1色谱条件色谱柱:Acquity UHPLC HSS T3柱(2.1 mm×100 mm×1.7 μm);柱温25 ℃;流动相:A为0.1%甲酸-水溶液,B为乙腈-甲醇溶液(3∶1,V/V);梯度洗脱条件:0~2 min(10%B);2~10 min(10%~20%B);10~28 min(20%~26%B);28~31 min(26%B);31~45 min(26%~32%B);45~55 min(32%~46%B);55~90 min(46%~67%B);90~93 min(67%~80%B);流速0.30 mL/min;进样量2 μL。
1.5.2质谱条件电喷雾离子源(ESI),负离子检测模式,毛细管温度350 ℃,鞘气流速30 L/h,辅助气流速10 L/h,喷雾电压3 kV,毛细管电压-35 V,管透镜电压-110 V。采用高分辨傅里叶(FTHM)对样品进行一级和二级扫描,分辨率分别为30 000(一级)和15 000(二级),质量扫描范围m/z100~800,隔离宽度2 u;二级和三级质谱采用数据依赖性扫描(data dependent scan, DDS),选取上一级丰度最高的2个峰进行碰撞诱导解离(CID)碎片离子扫描,激活能量单位0.25 q,激活时间30 ms,归一化碰撞能量(normalized collision energy)为35%。
2 结果与讨论
对硫磺熏蒸麦冬中含硫衍生物类成分进行色谱分析,设定高分辨质谱数据处理参数如下:最大分子质量误差为5×10-6,C、H、O和S原子数目的范围分别为16~30、12~40、4~17和1~5。结合高分辨质谱数据及多级质谱碎片离子信息,从4批硫磺熏蒸麦冬中共筛选出41个高异黄酮含硫衍生物,包括18个硫酸酯和23个亚硫酸酯。负离子模式下的提取离子流图(EIC)示于图1,3种可能的母核结构示于图2,各化合物的保留时间、高分辨质谱质量数理论值与实测值、误差以及多级碎片离子信息列于表1。
2.1 高异黄酮硫酸酯的结构鉴定
结合多级质谱信息、保留时间及特征碎片离子,本研究共从硫磺熏蒸麦冬药材供试品溶液中筛选了18个高异黄酮硫酸酯类成分。在其二级质谱图中,均出现[M-H-SO3]-特征碎片离子峰,可作为硫酸酯类成分的快速筛选依据。
在负离子检测模式下,化合物23和26的保留时间分别为45.24 min和49.05 min,其理论准确相对分子质量为377.032 5 [M-H]-,根据Xcalibur软件推测其分子式为C17H13O8S(误差<±5×10-6)。在二级质谱中,二者均产生m/z297.055 8 [M-H-SO3]-的特征碎片离子峰,由此推断它们为硫酸酯类衍生物。在三级质谱中,出现了m/z204 [M-H-SO3-B ring+CH]-和m/z191 [M-H-SO3-B ring]-的高异黄酮特征性的裂解碎片,可推断B环上有1个羟基取代,而A环上有1个羟基和1个甲基取代。根据色谱保留行为以及文献报道[16],8位甲基取代相对于6位甲基取代的ClogP值越小,在反向色谱柱上的保留时间越短。因此,将二者分别鉴定为5,7,4’-三羟基-8-甲基高异黄酮硫酸酯和5,7,4’-三羟基-6-甲基高异黄酮硫酸酯,其多级质谱图及裂解规律示于图3。

图1 4个批次硫磺熏蒸麦冬中高异黄酮含硫衍生物的提取离子流图Fig.1 Extracted ion chromatograms (EIC) of homoisoflavonid sulfated derivatives in sulfur fumigated Ophiopogon japonicus for 4 batchs

图2 硫磺熏蒸麦冬中高异黄酮含硫衍生物可能的3种母核结构Fig.2 Three parent structures of homoisoflavonid sulfated derivatives in sulfur fumigated Ophiopogon japonicas
化合物32和35,其准确理论相对分子质量为m/z421.022 4(C18H13O10S,误差<±5×10-6)。二级碎片离子m/z341.065 3(C18H13O7)为母核特异性脱去SO3基团生成;三级碎片离子m/z204及m/z191则与化合物23和26相似。但是,与化合物23和26相比,化合物32和35的B环上多了44 u,推测B环上存在亚甲二氧基取代。结合文献报道[19]及ClogP值大小,将它们分别鉴定为5,7,2’-三羟基-3’,4’-亚甲二氧基-8-甲基高异黄酮硫酸酯及5,7,2’-三羟基-3’,4’-亚甲二氧基-6-甲基高异黄酮硫酸酯。化合物36和38,除了产生[M-H-SO3]-的特征性碎片离子外,还产生了m/z204及m/z191的特征碎片离子,说明它们与化合物32和35的结构类似。但是,与化合物32和35相比,化合物36和38的B环少了1个羟基取代,依据色谱保留行为及前期研究基础,将其推断为5,7-二羟基-3’,4’-亚甲二氧基-8-甲基高异黄酮硫酸酯及5,7-二羟基-3’,4’-亚甲二氧基-6-甲基高异黄酮硫酸酯。

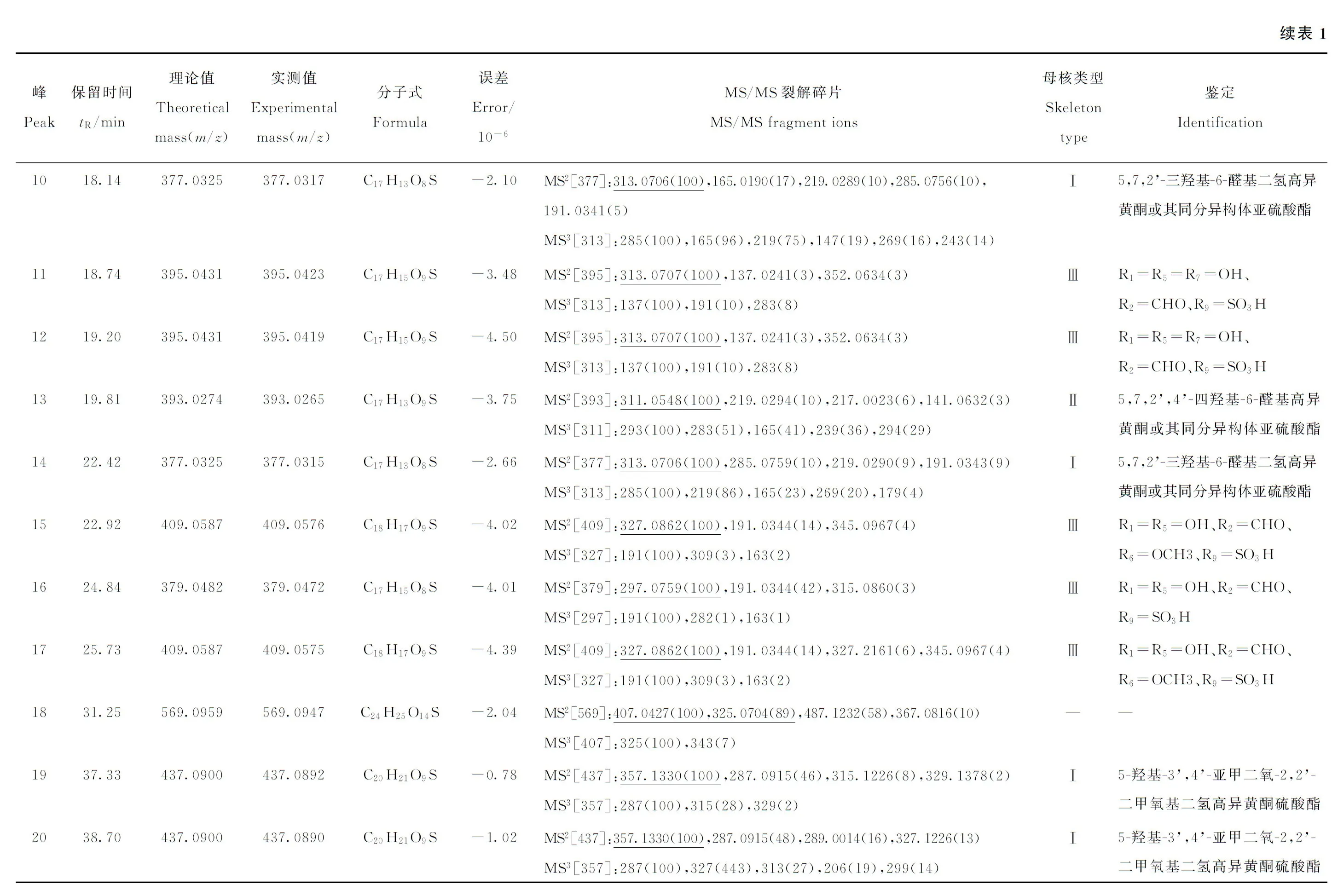
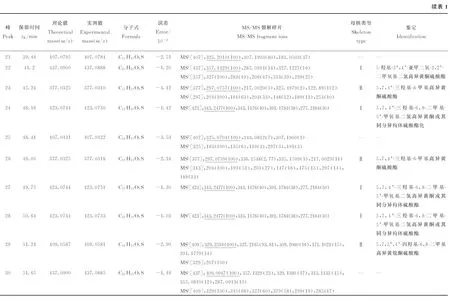
化合物29、33和34均产生m/z421.022 4 [M-H]-的准分子离子峰,根据精确的相对分子质量可推测其分子式为C18H17O9S(误差<±5×10-6)。在三级质谱图中,只出现了m/z207 [M-H-SO3-B ring]-的碎片离子。根据前期研究结果[16],推断其可能属于高异黄酮类,且B环上有2个羟基取代,A环上除了有2个羟基取代之外,还应有2个甲基取代。因此,将其鉴定为5,7,3’,4’-四羟基-6,8-二甲基-高异黄酮硫酸酯。
化合物40产生m/z407.043 12 [M-H]-的准分子离子峰,推断其分子式可能为C18H15O9S(误差-4.58×10-6)。在三级质谱中出现了m/z191碎片离子,据此推断B环上的取代基可能是甲氧基。而m/z312 [M-H-SO3-CH3]-及m/z297 [M-H-SO3-2CH3]-的出现证实了上述推断,同时A环也有1个甲氧基取代。根据文献报道[13],将其鉴定为5-羟基-3’,4’-二甲氧基-8-甲基二氢高异黄酮硫酸酯。
高异黄酮硫酸酯类化合物的结构可依据上述特征碎片离子进行鉴定。但是,有部分化合物虽然产生了脱硫酸根的特征碎片离子峰[M-H-SO3]-,如在化合物3和30的多级质谱中虽然都产生了80 u的中性丢失,但是由于碎片离子结构信息不足,难以进一步确定其母核结构。
2.2 高异黄酮亚硫酸酯的结构鉴定
本研究共筛选了23个亚硫酸酯类成分。根据它们的多级质谱裂解规律,将其分为两类:一类是特异性中性丢失64 u(SO2),另一类是除了中性丢失64 u外,还产生中性丢失82 u(H2SO3)的碎片离子。结合文献报道[20],推断前者是亚硫酸根与酚羟基发生酯化反应,因此可产生[M-H-SO2]-特征离子;后者是二氢高异黄酮A环中的醚键在硫磺熏蒸过程中与亚硫酸发生加成反应,因此除了生成[M-H-SO2]-离子外,还可继续脱水产生相对强度更高的[M-H-SO2-H2O]-特征离子。
2.2.1特异性中性丢失64 u高异黄酮硫酸酯的结构鉴定结合上述分析,共筛选出3个此类化合物(化合物7、10和14)。化合物7产生m/z393.027 4 [M-H]-的准分子离子峰,推断其分子式可能为C16H11O8S(误差-5×10-6)。在CID裂解过程中,其准分子离子峰产生m/z329.065 5 [M-H-SO2]-的特征碎片离子,表明其分子结构中存在亚硫酸根。从分子式、不饱和度和碎片离子信息可初步推断其为二氢高异黄酮亚硫酸酯。但是,由于其他碎片离子的信息不足,难以推断其分子结构。
在负离子检测模式下,化合物10和14的[M-H]-准分子离子峰理论质荷比为m/z377.032 6,根据Xcalibur软件推断它们的分子式为C17H13O8S(误差< ±5×10-6)。经进一步的CID裂解,根据产生的m/z313.070 6 [M-H-SO2]-特征碎片离子,可推断二者属于亚硫酸酯;根据m/z285.075 6 [M-H-SO2-CO]-碎片离子,可推断其母核结构中含有醛基取代。除此之外,m/z219.029 0 [M-H-SO2-C6H6O]-等碎片离子表明,在B环上只有1个羟基取代,而在A环上除了1个醛基取代,还有2个羟基取代。结合文献报道[19],化合物10和14被鉴定为5,7,2’-三羟基-6-醛基二氢高异黄酮或其同分异构体的亚硫酸酯。
2.2.2特异性中性丢失82 u的高异黄酮硫酸酯的结构鉴定结合多级质谱信息、保留时间以及特征碎片离子信息,共检测到20个具有此类裂解规律的化合物,并对其中的15个化合物进行结构解析。在此类化合物的二级质谱图中,除[M-H-SO2]-碎片离子外,还产生[M-H-H2SO3]-特征碎片离子,且相对离子强度更大。
化合物5和13均产生m/z393.027 4 [M-H]-的准分子离子峰,依据Xcalibur软件推测其分子式可能为C17H13O9S(误差<-5×10-6)。在二级质谱图中,产生了m/z311.065 0 [M-H-H2SO3]-的特征碎片离子,由此推断它们为亚硫酸酯类衍生物;而m/z219.029 4 [M-H-H2SO3-C6H4O]-碎片离子的产生,从不饱和度上说明脱水反应即亚硫酸酯化反应可能发生在B环。在三级质谱图中,m/z283 [M-H-H2SO3-CO]-碎片离子的产生说明A环上具有醛基取代。结合以上推断过程,将化合物5和13鉴定为5,7,2’,4’-四羟基-6-醛基高异黄酮或其同分异构体的亚硫酸酯[20]。
化合物1、15和17均产生m/z409.058 8 [M-H]-的准分子离子峰,推测其分子式为C18H17O9S(误差<±5×10-6)。在二级质谱图中,除生成m/z327.086 1 [M-H-H2SO3]-的特征碎片离子外,还生成m/z191.034 4 [M-H-H2SO3-C8H8O2]-的碎片离子,可推断在B环上有1个羟基和1个甲氧基取代。在三级质谱图中,特征性碎片离子m/z163(C9H7O3-)的产生证明了A环上存在醛基取代。根据以上推断,脱水反应可能发生在C环。据文献报道,目前只从麦冬中分离得到2个2位羟基取代的高异黄酮,而本实验中检测到了数量较多的特征中性丢失82 u的化合物,且具有与化合物1、15和17相似的质谱裂解途径。因此,推测部分高异黄酮的母核结构在硫磺熏蒸过程中发生了变化,具体途径为1,2位化学键断裂,与H2SO3发生加成反应。据此,化合物1、15和17的结构经初步推断,母核变化规律示于图4。
化合物3、6和8均产生m/z541.100 2 [M-H]-的准分子离子峰,推测其分子式为C23H25O13S(误差<-5×10-6)。在二级质谱图中,除产生m/z379.047 8 [M-H-H2SO3]-的特征碎片离子外,还产生了m/z297.075 7 [M-H-H2SO3-Glc]-的碎片离子,证明了亚硫酸根及葡萄糖配基的存在。此外,m/z191.034 4 [M-H-H2SO3-Glc-C7H6O]-的产生说明了B环上有1个羟基取代,其可能的结构列于表1。

图4 麦冬高异黄酮硫磺熏蒸过程中可能存在的母核变化规律及质谱裂解特征Fig.4 Potential transformation pathways and fragmentation behaviors of homoisoflavonids during sulfur fumigation
同时,从分子式、不饱和度和碎片离子信息可初步推断,化合物4、9、21、37和41为二氢高异黄酮的亚硫酸酯,而且产生了中性丢失82 u的碎片离子,但是依据其他碎片离子信息尚难以推断其结构,有待后续更深入的研究。
3 结论
本研究应用UHPLC-LTQ-Orbitrap高分辨质谱法快速筛选鉴定硫磺熏蒸麦冬药材中的高异黄酮含硫衍生物,并阐明了麦冬高异黄酮在硫磺熏蒸中的转变过程。通过分析高分辨质谱数据、多级质谱碎片离子及色谱保留时间等信息,并结合相关文献报道,从硫磺熏蒸麦冬药材中共筛选出41个高异黄酮含硫衍生物,鉴定了其中31个化合物。根据质谱裂解行为,将其分为硫酸酯化产物和亚硫酸酯化产物。其中,比较特殊的一类亚硫酸酯化产物特征性丢失82 u,经初步推断,其可能的母核结构在硫磺熏蒸过程中发生了变化,C环醚键与亚硫酸发生加成反应,生成了开环亚硫酸酯;且在二级质谱图中,此类化合物优先生成特征中性丢失82 u的碎片离子。该结果揭示了麦冬药材在硫磺熏蒸过程中发生的一系列化学变化,也初步阐明了高异黄酮类成分的变化规律,为后续硫磺熏蒸麦冬药材中化学成分的体内ADME过程、药效学以及毒理学等研究奠定了基础。
参考文献:
[1]JIANG X, HUANG L F, ZHENG S H, et al. Sulfur fumigation, a better or worse choice in preservation of traditional Chinese medicine[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2013, 20(2): 97-105.
[2]朱敏丰. 硫熏中药材中有效成分含量变化及二氧化硫残留的研究进展[J]. 海峡药学,2012,24(8):55-56.
ZHU Minfeng. Research progress on content change of active ingredients and residual sulfur dioxide in Chinese herbal medicine cured with sulfur fumigated[J]. Strait Pharmaceutical Journal, 2012, 24(8): 55-56(in Chinese).
[3]彭月,李雪莲,银玲,等. 中药材硫熏法加工的研究现状及其二氧化硫残留检测方法[J]. 中药与临床,2012,3(5):5-8.
PENG Yue, LI Xuelian, YIN Ling, et al. Study on the research situation of sulfur fumigated processing and detection method of sulfur dioxide residues in traditional Chinese medicine[J]. Pharmacy and Clinics of Chinese Materia Medica, 2012, 3(5): 5-8(in Chinese).
[4]MA X Q, LEUNG A K, CHAN C L, et al. UHPLC UHD Q-TOF MS/MS analysis of the impact of sulfur fumigation on the chemical profile of Codonopsis Radix (Dangshen)[J]. Analyst, 2014, 139(2): 505-516.
[5]毛春芹,季琳,陆兔林,等. 中药材硫磺熏蒸后有害物质及其危害研究进展[J]. 中国中药杂志,2014,39(15):2 801-2 806.
MAO Chunqin, JI Lin, LU Tulin, et al. Research development of harmful substances and its harm of traditional Chinese medicine after sulfur fumigation[J]. China Journal of Chinese Materia Medicia, 2014, 39(15): 2 801-2 806(in Chinese).
[6]翁运腾. 中药材、中药饮片用硫磺熏蒸存在问题及对策[J]. 海峡药学,2011,23(8):62-63.
WENG Yunteng. Problems and countermeasures of sulfur fumigation in Chinese herbal medicine pieces[J]. Strait Pharmaceutical Journal, 2011, 23(8): 62-63(in Chinese).
[7]江洪波,黄静,郭明娟,等. 天然高异黄酮的研究进展[J]. 药学学报,2007,42(2):118-126.
JIANG Hongbo, HUANG Jing, GUO Ming-juan, et al. Recent advances in the study of natural homoislflavonids[J]. Acta Pharmaceutica Sinica, 2007, 42(2): 118-126(in Chinese).
[8]席啸虎,刘瑢,刘霞. 基于化学成分变化优化麦冬硫熏工艺[J]. 中草药,2017,48(7):1 327-1 333.
XI Xiaohu, LIU Rong, LIU Xia. Optimization of processing technology for sulfur smokedOphiopogonjaponicasbased on changes in chemical composition[J]. Chinese Traditional and Herbal Drugs, 2017, 48(7): 1 327-1 333(in Chinese).
[9]李敬安. 贮藏与加工对麦冬品质影响的实验研究[D]. 成都:西南交通大学,2009.
[10] 李宁. 麦冬化学成分研究[D]. 北京:北京大学,2011.
[11] ZHANG J Y, CAI W, ZHOU Y, et al. Profiling and identification of the metabolites of baicalin and study on their tissue distribution in rats by ultra-high-performance liquid chromatography with linear ion trap-Orbitrap mass spectrometer[J]. Journal of Chromatography B, 2015, (985): 91-102.
[12] SHANG Z P, WANG F, DAI S Y, et al. Profiling and identification of (-)-epicatechin metabolites in rats using ultra-high performance liquid chromatography coupled with linear trap-Orbitrap mass spectrometer[J]. Drug Testing and Analysis, 2017. doi: 10.1002/dta.2155.
[13] ZHANG J Y, WANG Z J, ZHANG Q, et al. Rapid screening and identification of target constituents using full scan-parent ions list-dynamic exclusion acquisition coupled to diagnostic product ions analysis on a hybrid LTQ-Orbitrap mass spectrometer[J]. Talanta, 2014, (124): 111-122.
[14] ZHANG J Y, ZHANG Q, LI N, et al. Diagnostic fragment-ion-based and extension strategy coupled to DFIs intensity analysis for identification of chlorogenic acids isomers inFlosLoniceraeJaponicaeby HPLC-ESI-MSn[J]. Talanta, 2013, 104(2): 1-9.
[15] ZHANG J Y, WANG Z J, LI Y, et al. A strategy for comprehensive identification of sequential constituents using ultra-high-performance liquid chromatography coupled with linear ion trap-Orbitrap mass spectrometer, application study on chlorogenic acids inFlosLoniceraeJaponicae[J]. Talanta, 2016, 147(62): 16-27.
[16] 王子健,刘颖,刘思燚,等. UPLC-HRMSn结合高能诱导裂解快速鉴定麦冬中高异黄酮类成分[J]. 质谱学报,2016,37(6):481-491.
WANG Zijian, LIU Ying, LIU Siyi, et al. Rapid identification of homoisoflavonids inOphiopogonjaponicusbased on UPLC-HRMSncombined HCD method[J]. Journal of Chinese Mass Spectrometry Society, 2016, 37(6): 481-491(in Chinese).
[17] LI S L, SHEN H, ZHU L Y, et al. Ultra-high-performance liquid chromatography-quadrupole/time of flight mass spectrometry based chemical profiling approach to rapidly reveal chemical transformation of sulfur-fumigated medicinal herbs, a case study on white ginseng[J]. Journal of Chromatography A, 2012, 1 231(1): 31-45.
[18] 王菲,尚展鹏,马志国,等. 不同干燥方法对川麦冬甾体皂苷和高异黄酮的影响[J]. 中国中药杂志,2016,41(23):4 393-4 399.
WANG Fei, SHANG Zhanpeng, MA Zhiguo, et al. Influence of different drying methods on steroidal saponins and homoisoflavonoids inOphiopogonjaponicus[J]. China Journal of Chinese Materia Medica, 2016, 41(23): 4 393-4 399(in Chinese).
[19] YANG M, ZHOU Z, GUO D A. A strategy for fast screening and identification of sulfur derivatives in medicinalPuerariaspecies based on the fine isotopic pattern filtering method using ultra-high-resolution mass spectrometry[J]. Analytica Chimica Acta, 2015, 894: 44-53.
[20] XIE T, LIANG Y, HAO H P, et al. Rapid identification of ophiopogonins and ophiopogonones inOphiopogonjaponicusextract with a practical technique of mass defect filtering based on high resolution mass spectrometry[J]. 2012, 1 227(5): 234-244.
