人尿液蛋白质N-糖肽富集和质谱鉴定的新方法研究
2018-04-02黄俊杰焦丰龙王和平朱丽华秦伟捷钱小红
黄俊杰,焦丰龙,王和平,朱丽华,秦伟捷,钱小红
(1.华北理工大学基础医学院,河北 唐山 063200;2.军事医学科学院放射与辐射医学研究所,国家蛋白质科学中心(北京),蛋白质组学国家重点实验室,北京蛋白质组研究中心,北京 102206;3.河北省慢性疾病重点实验室,河北 唐山 063000)
N-糖基化修饰作为一种重要的蛋白质翻译后修饰,在细胞粘附、信号转导、细胞凋亡、免疫应答等生物学过程及生理机能的调节中发挥着关键的作用[1-4]。异常的糖基化修饰与人类多种重大疾病,如肿瘤、炎症以及神经退行性疾病等密切相关[5]。因此,N-糖蛋白作为重要的生物标志物,目前已被广泛应用于疾病的诊断、预警和药效评价[6]。为了更好地了解这些生物学过程,发现疾病的生物标记物,需要规模化、深入地鉴定生物体内的N-糖蛋白,并且确定糖基化位点。目前,生物质谱技术是分析和鉴定蛋白质糖基化最重要、最有效的工具。但是,由于N-糖蛋白本身的丰度有限,糖基化修饰比例较低,并具有高度微不均一性,在质谱分析中易受高丰度非糖基化蛋白质、肽段的干扰[7]。因此,对N-糖肽进行高效、高选择性地富集是实现高灵敏质谱鉴定的必要前提。
目前,常用的N-糖肽富集方法主要有凝集素法[8-9]、硼酸富集法[10-13]、酰肼富集法[14-15]及亲水相互作用色谱法[16-19]等。凝集素作为一类糖亲和蛋白质,能够识别糖蛋白或者糖肽连接的特定聚糖结构或者末端某些特定单糖,并与之非共价结合,对不同糖型的专一性较好,但分析成本高,难以实现各类糖型的全面富集。酰肼富集法对糖链不存在歧视效应,以共价结合的方式富集效率高,在高通量的糖基化位点鉴定中得到了广泛的应用,但步骤繁琐、易造成样品损失且破坏糖链结构,不利于完整糖肽的分析。硼酸富集法可以实现对糖蛋白和糖肽的非破坏性富集,但对糖蛋白和糖肽的亲和性较低,且易与非糖蛋白、肽段发生非特异性吸附,容易导致富集效率低、特异性差。亲水相互作用色谱(HILIC)利用糖肽与色谱固定相的亲水、极性等一系列相互作用,可实现糖肽的有效保留、分离和富集,且富集效果不受糖型的影响,具有较好的广谱性,可保持糖链结构完整、操作简单,与质谱兼容性好、易实现在线分析。
人的尿液是研究疾病标记物的理想来源,部分尿液蛋白质来源于血液的肾脏滤过物,因此尿液蛋白质组不仅能够反映泌尿系统的功能状态,还能在一定程度上反映血液和整个机体的状态[20-21]。
本工作拟利用巯基-烯点击化学法[22-24]将[3-(甲基丙烯酰氨基)丙基]二甲基(3-硫代丙基)氢氧化铵内盐亲水化合物键合于硅胶填料表面,制备兼具离子功能化修饰的HILIC富集材料(SPP-SiO2)。对所合成的HILIC富集材料进行扫描电镜、红外光谱和元素分析表征,并使用人免疫球蛋白G(IgG)酶解肽段作为标准品,对HILIC富集材料的N-糖肽富集效率和选择性进行评价。为进一步考察所制备HILIC填料的富集效果,将该富集材料应用于健康成人尿液蛋白质N-糖肽的富集和质谱鉴定。
1 实验部分
1.1 仪器和试剂
Nicolet 5700傅里叶红外光谱仪:美国Thermo公司产品;TGA Q500热重分析仪:美国TA公司产品;UltrafleXtreme基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF MS):德国Bruker公司产品,用于IgG酶解产物N-糖肽检测时,采用正离子反射模式,加速电压20 kV,质量扫描范围m/z1 000~5 000,并使用FlexAnalysis软件(版本3.3)进行分析;Orbitrap Fusion Lumos轨道离子阱质谱仪:美国Thermo公司产品;分析柱(120 mm×150 μm×1.9 μm):日本Dr. Maisch公司产品,用于复杂生物蛋白酶解产物肽段的检测;预柱(2 cm×100 μm×3 μm):日本DR.Maisch公司产品;数据采集模式为正离子模式,电压2 000 V,一级检测使用Orbitrap,分辨率120 000,质量扫描范围m/z300~1 400,二级检测使用离子阱,扫描范围模式为Normal,扫描速率模式为Rapid;使用PD2.0软件进行数据分析。
胰蛋白酶(Trypsin),肽N-糖苷酶F(PNGase F):英国New England Biolabs公司产品;IgG(免疫球蛋白G)、2,5-二羟基苯甲酸(DHB)、三氟乙酸(TFA)、甲酸(FA)、甲醇、3-巯基丙基三甲基硅烷:美国Sigma公司产品;[3-(甲基丙烯酰氨基)丙基]二甲基(3-硫代丙基)氢氧化铵内盐:深圳瑞吉特生物技术有限公司产品;偶氮二异丁腈(AIBN)、甲苯、二氯甲烷、4A型分子筛:国药集团化学试剂有限公司产品;球形硅胶(粒径3 μm,孔径100 Å):日本Osaka soda公司产品;去离子水:由Millipore纯水系统制备;18O水:由上海化工研究院提供;健康人中段晨尿:由志愿者提供。
1.2 实验方法
1.2.1SPP-SiO2的制备向粒径3 μm的硅胶颗粒中加入1 mol/L盐酸(1 g硅胶颗粒中加入10 mL盐酸),超声处理30 min,浸泡12 h后,用去离子水洗涤若干次,直至pH为中性。离心去除液体,并将所得的硅胶颗粒置于 80 ℃真空干燥箱,过夜。
称取5 g硅胶颗粒于三颈圆底烧瓶中,120 ℃干燥过夜。然后加入40 mL无水甲苯,在氮气氛围中搅拌均匀后,加入3 mL 3-巯基丙基三甲氧基硅烷,于110 ℃回流24 h。反应完毕后,用玻璃砂芯漏斗抽滤,依次用20 mL甲苯、二氯甲烷、甲醇、水、甲醇洗涤,于80 ℃干燥过夜,得到巯基丙基硅胶。
量取20 mL甲醇水溶液于50 mL三颈圆底烧瓶,依次加入500 mg [3-(甲基丙烯酰氨基)丙基]二甲基(3-硫代丙基)氢氧化铵内盐(SPP)、500 mg巯基丙基硅胶以及4 mg偶氮二异丁腈,升温至60 ℃,在氮气氛围中回流搅拌过夜。反应完毕后,用玻璃砂芯漏斗抽滤,依次用30 mL水和甲醇洗涤,于80 ℃干燥过夜,得到SPP-SiO2亲水填料。
1.2.2肽段制备标准蛋白:将1 mg IgG 进行超滤辅助样品制备法(FASP)酶解。将蛋白转移至30 kD超滤管中,以12 100 r/min离心10 min,然后加入200 μL UA(含8 mol/L尿素,0.1 mol/L Tris-HCl,pH 8.5),以12 100 r/min离心10 min,重复3次。然后加入10 mmol/L二硫苏糖醇(DTT),于37 ℃烘箱中变性4 h;以12 100 r/min离心10 min除去DTT,再加入UA重复离心清洗2次。接着加入200 μL 50 mmol/L碘乙酰胺(IAA),室温避光放置40 min,还原烷基化,然后以12 100 r/min离心10 min除去IAA。加入200 μL 50 mmol/L NH4HCO3溶液,并以12 100 r/min离心10 min,重复清洗5次后,更换新的套管,加入200 μL 50 mmol/L NH4HCO3溶液和Trypsin(1∶50),于37 ℃培养箱酶切16 h,收集肽段,干燥待用。
人尿蛋白:将人尿液于4 ℃以11 600 r/min离心20 min,取10 mL上清液于离心管中,并加入3倍体积的预冷丙酮,于-20 ℃放置沉淀4 h。将沉淀蛋白转移至EP管中,加入UA溶解,涡旋、超声后,以12 100 r/min离心10 min,取上清液进行FASP酶解。
1.2.3SPP-SiO2HILIC富集N-糖肽标准蛋白:取1 mg填料,溶于1 mL binding buffer(88% ACN+0.1% TFA+11.9% H2O),活化10 min。取20 μL该溶液,分别与1 μg IgG
肽段、IgG肽段与BSA肽段混合液(1∶100,W/W)孵育30 min,离心,弃去上清液,加入100 μL binding buffer,清洗3次。使用洗脱液(30% ACN+0.1% TFA+69.9% H2O)洗脱2次。蒸干收集的洗脱液,复溶后加入100 U PNGase F酶,37 ℃水浴16 h,进行质谱分析。
人尿蛋白:各取1 mg 3个批次的填料,分别溶于60 μL binding buffer(88% ACN+0.1% TFA+11.9% H2O),各加入40 μg人尿蛋白酶解肽段孵育1 h。用binding buffer清洗3次,洗脱液(30% ACN+0.1% TFA+69.9% H2O)洗脱2次,蒸干洗脱液,用25 mmol/L NH4HCO3的18O重水溶液复溶后,加入100 U PNGase F酶,进行质谱分析。
2 结果与讨论
2.1 SPP-SiO2的表征
分别采用扫描电镜、傅里叶转换红外光谱分析法以及有机元素分析对合成的SPP-SiO2亲水材料进行表征。
扫描电镜图示于图1,SPP修饰前、后的形貌和分散程度无明显变化。SPP修饰的硅胶填料形状完整,粒径均匀,未见颗粒交联,保持了良好的分散性。
SPP修饰前、后的红外谱图示于图2。图中,463、796、1 090 cm-1分别是Si—O—Si摇摆振动、对称伸缩振动和反对称伸缩振动对应的吸收峰;950 cm-1是Si—OH伸缩振动的吸收峰;1 640、3 450 cm-1分别是O—H弯曲振动和伸缩振动的吸收峰。SPP修饰后,在1 550 cm-1处出现了一个新的特征峰,是SPP中N—H弯曲振动,表明SPP两性离子亲水单体成功地键合到硅胶颗粒表面。

图1 未经修饰的硅胶颗粒(a)和SPP-SiO2颗粒(b)的扫描电镜图Fig.1 SEM images of bare silica microparticles (a) and SPP-SiO2 microparticles (b)
元素分析表征结果列于表1。结果表明,巯基丙基硅胶(SH-SiO2)的硫含量为2.45%,高于裸硅球的硫含量(0.52%),说明巯基丙基硅胶制备成功。两性亲水材料SPP-SiO2的碳含量为15%,氮含量为2.58%,均明显高于巯基丙基硅胶,证明了SPP亲水单体成功地键合到硅胶表面,而且基于巯基-烯的键合方法具有较高的修饰效率。
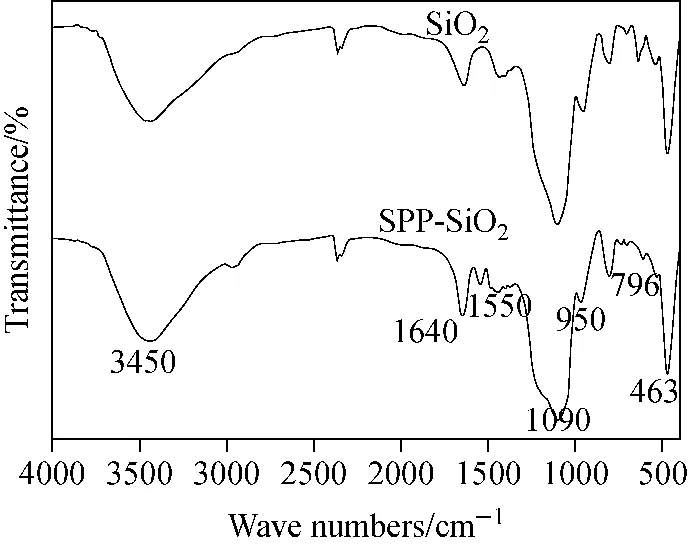
图2 未经修饰的硅胶填料和SPP-SiO2两性离子修饰亲水填料的红外光谱图Fig.2 FT-IR spectra of bare silica microparticles and SPP-SiO2 microparticles

材料Material氮含量Ncontent/%碳含量Ccontent/%氢含量Hcontent/%硫含量Scontent/%SiO2001.1790.521SH-SiO203.721.4232.471SPP-SiO22.5815.043.2934.274
2.2 SPP-SiO2对糖肽的富集效果考察
使用标准糖蛋白IgG酶解后的肽段,评价SPP-SiO2亲水材料在N-糖肽HILIC富集和质谱鉴定中应用的可能性,结果示于图3a~3c。在未经富集的IgG肽段谱图中,可观察到大量的非糖肽,而且信号强度较高,仅鉴定到6条信号强度较低的完整N-糖肽。经SPP-SiO2富集后,绝大部分非糖肽被有效除去,可鉴定到36条不同糖型高信噪比的完整N-糖肽[25-26],数量和信号强度均得到明显提高,且鉴定的N-糖肽数目高于文献报道[20]。
为进一步确认SPP-SiO2对N-糖肽的富集效果,使用PNGase F酶对富集的N-糖肽进行去糖基化处理,通过MALDI-TOF MS检测到2个去糖基化肽段(m/z1 159,1 191),结果示于图3d。完整N-糖肽的质谱信号峰全部消失,表明图3b和3c中的信号峰属于N-糖肽。
为进一步提高富集难度并更加真实地模拟实际生物样本的复杂程度,将IgG和BSA混合(1∶100,W/W),再使用SPP-SiO2对混合肽段进行富集,质谱分析结果示于图4。未富集前,谱图中全部是高丰度的非糖肽信号,检测不到任何N-糖肽信号。富集后,绝大部分非糖肽被有效除去,能够检测到8条完整的N-糖肽。证明了SPP-SiO2材料对糖肽富集的高效性。
2.3 SPP-SiO2在正常人尿蛋白N-糖肽的富集和质谱鉴定中的应用
对于某些疾病,特定的标记物在尿液中比在血液中具有更好的诊断意义。如尿液中的Angiostation浓度与肾病相关[27],ADAM12浓度与乳腺癌相关[28],Desmosine浓度与慢性阻塞性肺疾相关[29]等。因此,对人尿液蛋白质和糖基化蛋白质进行深入鉴定和研究,有利于发现多种疾病的诊断生物标记物,这为疾病的临床研究及药物研发提供了有价值的数据。本研究使用3个不同批次的SPP-SiO2材料对正常人尿蛋白酶解产物中的N-糖肽进行HILIC富集和质谱分析,分别鉴定到959、837和877个N-糖基化位点,选择性分别为75%、76%和73%,合计鉴定1 065个N-糖基化位点,对应633个N-糖蛋白。与文献[30]报道的949个N-糖基化位点相比,鉴定规模提高了12.2%。实验重现性示于图5,73.9%N-糖基化位点和75.5%N-糖蛋白至少在2次实验中重复富集鉴定到。说明该材料具有较好的制备稳定性和富集重现性。
为进一步研究这些N-糖基化蛋白功能,使用生物信息学工具DAVID对鉴定到的N-糖基化蛋白进行GO注释分析。这些N-糖基化修饰的尿蛋白的分子功能(molecular function, MF)主要包括结合功能(binding)、蛋白质同二聚化活性(protein homodimerization activity)、受体(receptor activity)和内肽酶活性(endopeptidase activity)等。N-糖基化修饰的尿蛋白主要参与的生物过程(biological process, BP)按反应程度依次为细胞粘附(cell adhesion)、信号转导(signal transduction)、蛋白水解(proteolysis)、细胞外基质的组成(extracellar matrix organization)及免疫反应(immune response)等。上述结果与已知的N-糖蛋白主要功能相符,证明了此富集、鉴定方法的可靠性。

图3 富集前的IgG酶解肽段(a),SPP-SiO2富集后的IgG酶解肽段(b),富集后m/z 2 200~3 500的局部放大图(c),使用PNGase F酶切糖后(d)的MALDI-TOF MS谱图Fig.3 MALDI-TOF MS spectra of tryptic digest of human IgG in direct analysis before (a) and after enrichment by SPP-SiO2(b), enlarged region of m/z 2 200-3 500 (c) and after deglycosylation by PNGase F (d)

图4 IgG和BSA混合肽段富集前(a)和富集后(b)的MALDI-TOF MS谱图Fig.4 MALDI-TOF MS spectra of tryptic digest of human IgG and BSA in direct analysis before (a) and after enrichment (b)

序号No.质荷比m/z多糖成分Glycancomposition肽序列Peptidesequence12237.4[Hex]3[HexNAc]2[Fuc]1EEQFN#STFR22268.8[Hex]3[HexNAc]2[Fuc]1EEQYN#STYR32398.8[Hex]3[HexNAc]3[Fuc]1EEQFN#STFR42431.5[Hex]3[HexNAc]3[Fuc]1EEQYN#STYR52456.4[Hex]3[HexNAc]4EEQFN#STFR62488.4[Hex]3[HexNAc]4EEQYN#STYR72561.8[Hex]4[HexNAc]3[Fuc]1EEQFN#STFR82593.2[Hex]4[HexNAc]3[Fuc]1EEQYN#STYR92602.5[Hex]3[HexNAc]4[Fuc]1EEQFN#STFR102618.7[Hex]4[HexNAc]4EEQFN*STFR112634.8[[Hex]3[HexNAc]4[Fuc]1EEQYN*STYR122650.9[HexNAc]4[HexNAc]4EEQYN#STYR132765[Hex]4[HexNAc]4[Fuc]1EEQFN#STFR142780.6[Hex]5[HexNAc]4EEQFN*STFREEQFN*STFR152796.4[Hex]4[HexNAc]4[Fuc]1EEQYN*STYR162806.8[Hex]3[HexNAc]5[Fuc]1EEQFN#STFR172812[Hex]5[HexNAc]4EEQYN#STYR182838.3[Hex]3[HexNAc]5[Fuc]1EEQYN*STYR192853.9[Hex]4[HexNAc]5EEQYN#STYR202927.5[Hex]5[HexNAc]4[Fuc]1EEQFN#STFR212959.6[Hex]5[HexNAc]4[Fuc]1EEQYN#STYR222969[Hex]4[HexNAc]5[Fuc]1EEQFN#STFR232999.8[Hex]4[HexNAc]5[Fuc]1EEQYN*STYR243057.4[Hex]4[HexNAc]4[Fuc]1[NeuAc]1EEQFN#STFR253085.3[Hex]4[HexNAc]4[Fuc]1[NeuAc]1EEQYN#STYR263105.7[Hex]5[HexNAc]4[NeuAc]1EEQYN#STYR273130.9[Hex]5[HexNAc]5[Fuc]1EEQFN#STFR283162.9[Hex]5[HexNAc]5[Fuc]1EEQYN#STYR293219.1[Hex]5[HexNAc]4[Fuc]1[NeuAc]1EEQFN#STFR303235.9[Hex]5[HexNAc]4[Fuc]1[NeuAc]1EEQFN#STYR313247.5[Hex]4[HexNAc]4[Fuc]1TKPREEQFN#STFR323251.7[Hex]5[HexNAc]4[Fuc]1[NeuAc]1EEQYN#STYR333279.6[Hex]4[HexNAc]4[Fuc]1TKPYEEQYN#STYR343409.6[Hex]5[HexNAc]4[Fuc]1TKPREEQFN#STFR353441.8[Hex]5[HexNAc]4[Fuc]1TKPYEEQYN#STYR363452[Hex]5[HexNAc]5[Fuc]1[NeuAc]1EEQYN#STYR
注:N#表示N-连接的糖基化位点
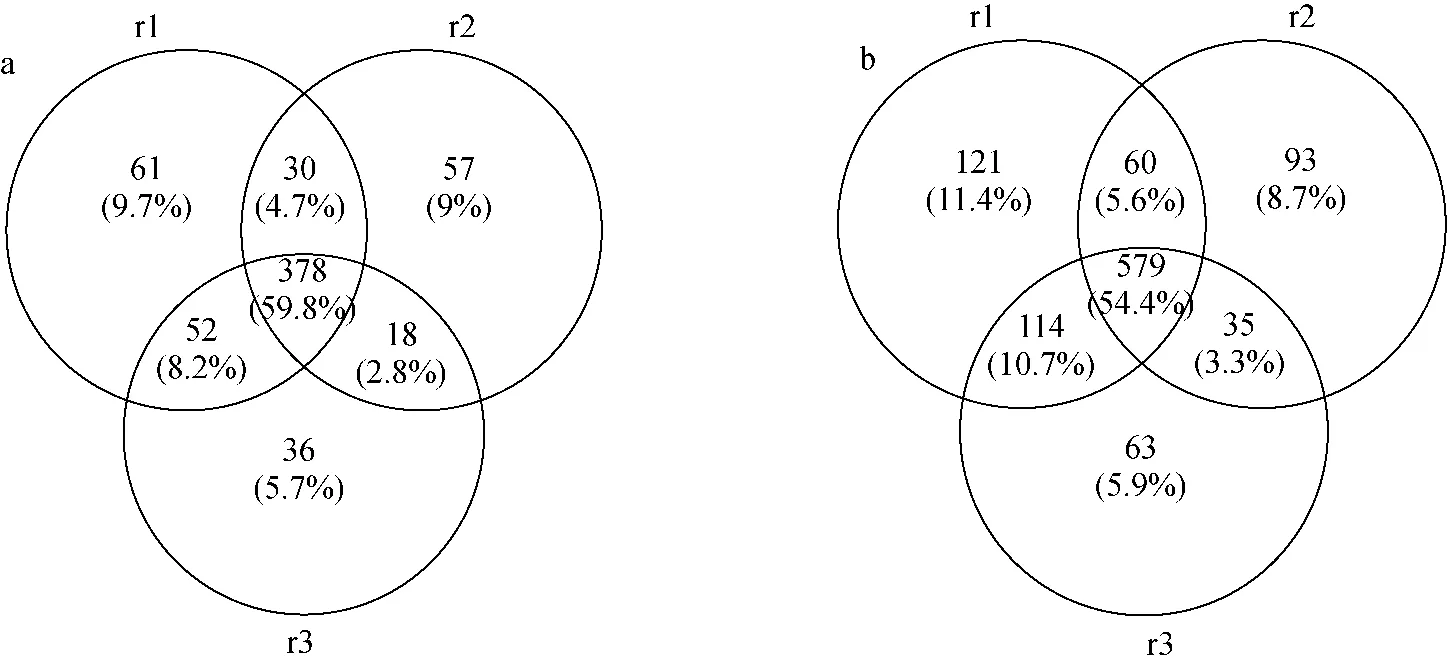
注:r1、r2、r3分别代表3个不同批次样品图5 三个不同批次SPP-SiO2材料富集鉴定N-糖蛋白(a)和N-糖基化位点(b)的重现性Fig.5 Repeatability of enrichment and identification of N-glycopeptide (a) and N-glycosylation site (b) by three batches of SPP-SiO2
3 结论
利用巯基-烯点击化学法将SPP两性离子亲水单体键合于硅胶表面,成功地制备了具有高亲水性的HILIC富集材料。该材料具备两性离子的强亲水性和硅胶的高机械强度,制备重现性高、操作简便。并将该亲水材料成功地应用于富集标准糖蛋白和复杂生物样本蛋白质酶解产物的N-糖肽,从正常人尿蛋白中共鉴定出1 065个N-糖基化位点,比文献报道的鉴定规模提高了12.2%,这说明SPP-SiO2材料在糖蛋白质组学研究中具有很大潜力。
参考文献:
[1]SONG X, LASANAJAK Y, XIA B, et al. Shotgun glycomics: a microarray strategy for functional glycomics[J]. Nature Methods, 2011, 8(1): 85-90.
[2]WELLS L, VOSSELLER K, HART G W. Glycosylation of nucleocytoplasmic proteins: signal transduction andO-GlcNAc[J]. Science, 2001, 291(5 512): 2 376-2 378.
[3]HART G W, COPELAND R J. Glycomics hits the big time[J]. Cell, 2010, 143(5): 672-676.
[4]RUDD P M, ELLIOTT T, CRESSWELL P, et al. Glycosylation and the immune system[J]. Science, 2001, 291(5 512): 2 370-2 376.
[5]PAN S, CHEN R, AEBERSOLD R, et al. Mass spectrometry based glycoproteomics-from a proteomics perspective[J]. Molecular & Cellular Proteomics, 2011, 10(1): 1-14.
[6]CHEN R, TAN Y, WANG M, et al. Development of glycoprotein capture-based label-free method for the high-throughput screening of differential glycoproteins in hepatocellular carcinoma[J]. Molecular & Cellular Proteomics, 2011, 10(7): 1-13.
[7]ANDERSON N L, ANDERSON N G. The human plasma proteome history, character, and diagnostic prospects[J]. Molecular & Cellular Proteomics, 2002, 1(11): 845-867.
[8]RUIZ-MAY E, HUCKO S, HOWE K J, et al. A comparative study of lectin affinity based plantN-glycoproteome profiling using tomato fruit as a model[J]. Molecular & Cellular Proteomics, 2014, 13(2): 566-579.
[10] WANG M, ZHANG X, DENG C. Facile synthesis of magnetic poly (styrene-co-4-vinylbenzene-boronic acid) microspheres for selective enrichment of glycopeptides[J]. Proteomics, 2015, 15(13): 2 158-2 165.
[11] LIU J, YANG K, SHAO W, et al. Boronic acid-functionalized particles with flexible three-dimensional polymer branch for highly specific recognition of glycoproteins[J]. ACS Applied Materials & Interfaces, 2016, 8(15): 9 552-9 556.
[12] LI Q, TU X, YE J, et al. Nanoconfining affinity materials for pH-mediated protein capture-release[J]. Chemical Science, 2014, 5(10): 4 065-4 069.
[13] WANG Y, LIU M, XIE L, et al. Highly efficient enrichment method for glycopeptide analyses: using specific and nonspecific nanoparticles synergistically[J]. Analytical Chemistry, 2014, 86(4): 2 057-2 064.
[14] HUANG G, SUN Z, QIN H, et al. Preparation of hydrazine functionalized polymer brushes hybrid magnetic nanoparticles for highly specific enrichment of glycopeptides[J]. Analyst, 2014, 139(9): 2 199-2 206.
[15] LIU L, YU M, ZHANG Y, et al. Hydrazide functionalized core-shell magnetic nanocomposites for highly specific enrichment ofN-glycopeptides[J]. ACS Applied Materials & Interfaces, 2014, 6(10): 7 823-7 832.
[16] LIU J, YANG K, SHAO W, et al. Synthesis of zwitterionic polymer particles via combined distillation precipitation polymerization and click chemistry for highly efficient enrichment of glycopeptide[J]. ACS Applied Materials & Interfaces, 2016, 8(34): 22 018-22 024.
[17] WU R, XIE Y, DENG C. Thiol-ene click synthesis ofL-cysteine-bonded zwitterionic hydrophilic magnetic nanoparticles for selective and efficient enrichment of glycopeptides[J]. Talanta, 2016, (160): 461-469.
[18] CHEN Y, XIONG Z, ZHANG L, et al. Facile synthesis of zwitterionic polymer-coated core-shell magnetic nanoparticles for highly specific capture ofN-linked glycopeptides[J]. Nanos-cale, 2015, 7(7): 3 100-3 108.
[19] LIANG Y, WU C, ZHAO Q, et al. Gold nanoparticles immobilized hydrophilic monoliths with variable functional modification for highly selective enrichment and on-line deglycosylation of glycopeptides[J]. Analytica Chimica Acta, 2015, 900(4): 83-89.
[20] SHAO C, WANG Y, GAO Y. Applications of urinary proteomics in biomarker discovery[J]. Science China Life Sciences, 2011, 54(5): 409-417.
[21] SUN W, CHEN Y, LI F, et al. Dynamic urinary proteomic analysis reveals stable proteins to be potential biomarkers[J]. Proteomics-Clinical Applications, 2009, 3(3): 370-382.
[22] HOYLE C E, BOWMAN C N. Thiol-ene click chemistry[J]. Angewandte Chemie International Edition, 2010, 49(9): 1 540-1 573.
[23] CHEN Y, WU M, WANG K, et al. Vinyl functionalized silica hybrid monolith-based trypsin microreactor for on line digestion and separation via thiol-ene “click” strategy[J]. Journal of Chromatography A, 2011, 1 218(44): 7 982-7 988.
[24] WANG K, CHEN Y, YANG H, et al. Modification of VTMS hybrid monolithviathiol-ene click chemistry for capillary electrochromatography[J]. Talanta, 2012, 91(6): 52-59.
[25] MA W, XU L, LI Z, et al. Post-synthetic modification of an amino-functionalized metal-organic framework for highly efficient enrichment ofN-linked glycopeptides[J]. Nanoscale, 2016, 8(21): 10 908-10 912.
[26] ZOU X, JIE J, YANG B. A facile and cheap synthesis of zwitterion coatings of the CS@ PGMA@ IDA nanomaterial for highly specific enrichment of glycopeptides[J]. Chemical Communications, 2016, 52(15): 3 251-3 253.
[27] WU T, DU Y, HAN J, et al. Urinary angiostatin-a novel putative marker of renal pathology chronicity in lupus nephritis[J]. Molecular & Cellular Proteomics, 2013, 12(5): 1 170-1 179.
[28] PORIES S E, ZURAKOWSKI D, ROY R, et al. Urinary metalloproteinases: noninvasive biomarkers for breast cancer risk assessment[J]. Cancer Epidemiology Biomarkers & Prevention, 2008, 17(5): 1 034-1 042.
[29] HUANG J T, CHAUDHURI R, ALBARBARAWI O, et al. Clinical validity of plasma and urinary desmosine as biomarkers for chronic obstructive pulmonary disease[J]. Thorax, 2012, 67(6): 502-508.
[30] PAN L, AGUILAR H A, WANG L, et al. Three-dimensionally functionalized reverse phase glycoprotein array for cancer biomarker discovery and validation[J]. Journal of the American Chemical Society, 2016, 138(47): 15 311-15 314.
