质谱定量蛋白质组学技术筛选结直肠癌外周血单个核细胞差异表达蛋白
2018-04-02逄雪超纪丽云
逄雪超,徐 燕,纪丽云
(上海交通大学系统生物医学研究院,上海 200240)
结直肠癌是一种发于结肠或者直肠的癌症,属于消化系统,又称为胃肠消化道癌症,是世界高发恶性肿瘤之一。据统计,2015年发展中国家新增病例超过77.7万例,死亡人数达35万人[1]。结直肠癌(CRC)早期治疗生存率高,但由于缺乏足够特异性和敏感性的肿瘤标志物,大多数患者在结直肠癌晚期才被确诊,延误了最佳治疗时间。在组织癌变过程中,机体的免疫系统功能极有可能受到CRC发生、发展的影响,产生相应的变化。外周血单个核细胞(PBMC)作为免疫系统的重要组分,包括单核细胞、T细胞、B细胞及自然杀伤细胞,是研究免疫变化的理想材料。近年来,大量研究表明,癌症的发生、发展与PBMC息息相关[2-3]。
为了找到CRC患者PBMC中的差异表达蛋白,以及研究CRC的发生对免疫系统的影响,本研究拟采用最新的经典数据非依赖性质谱扫描技术(DIA),将整个MS1的扫描范围等分为若干窗口,每个窗口依次选择、碎裂、采集窗口内所有母离子的全部子离子信息。运用Skyline软件对DIA的采集结果进行处理,以实现蛋白的定量分析,并比较结直肠癌患者与良性肠病患者PBMC蛋白的差异表达,以期找到CRC的早期标志物并阐明PBMC的变化,为CRC的诊断或免疫治疗奠定基础。
1 实验部分
1.1 仪器
QE-plus质谱仪、EASY-nLC-1000 UPLC纳升液相色谱仪、-80 ℃超低温冰箱、低温离心机:均为美国Thermo公司产品;酶标仪:美国Bio-Tek公司产品;Newclassic MF分析天平:瑞士Mettler-Toledo公司产品;除盐系统:美国Supelco公司产品。
1.2 试剂
碳酸氢铵、氢氧化钠、尿素、氯化铵、氯化钙、碘乙酰胺:均为化学纯,生工生物工程(上海)股份有限公司产品;甲酸(FA):德国CNW公司产品;酸不稳定表面活性剂(ALS):美国系统生物研究所产品;TCEP(tris(2-carboxyethyl) phosphine):美国Fluka公司产品;HEPES(tris-(2-carboxyethyl) phosphine):生工生物工程(上海)股份有限公司产品;乙腈(ACN):美国Sigma Aldrich公司产品;蛋白酶抑制剂(protease inhibitor cocktail tablets):德国Roche公司产品。
1.3 病例信息
收集2016年3月至4月上海新华医院样本11例,其中6例结直肠癌患者术前样本,5例肠道其他疾病(非瘤或良性瘤)样本。取血后4 h内用人类淋巴细胞分离管收集PBMC,于-80 ℃保存,备用。
1.4 样品准备
1.4.1细胞裂解将200 μL预冷的细胞裂解液(0.2%ALS,20 mmol/L HEPES,1X蛋白酶抑制剂)加入装有PBMC的EP管中,吹散细胞并在冰上振荡裂解25 min,低温4 ℃,以13 000 r/min离心20 min,取上清液,于-80 ℃保存,备用。
1.4.2蛋白酶解采用蛋白浓度测定试剂盒(BCA)法确定蛋白质浓度后,取30 μg蛋白,在37 ℃下,6 mol/L尿素中变性30 min;在5 mmol/L TCEP中还原,55 ℃下反应30 min;加入碘乙酰胺(IAA)使终浓度为6.25 mmol/L,室温下避光反应1 h。用6倍样品体积的50 mmol/L AMBIC稀释,使尿素浓度低于1 mol/L。加入CaCl2使终浓度为1 mmol/L,用NaOH调至pH 8;加胰酶(胰酶质量∶蛋白质量= 1∶100),于37 ℃过夜反应16 h。用C18填料的96孔除盐柱除盐,冷冻离心机干燥,于-20 ℃保存,等待上样。
1.5 数据采集
1.5.1谱图库的建立采用数据依赖性(DDA)模式对11个样本进行数据采集,每份样品采用Easy-LC 1000 UPLC串联Q-Exactive Plus进行分离和检测,上样量1 μg。流动相:A相为0.1%FA-H2O,B相为0.1%FA-80%ACN;洗脱梯度:0~5 min(3%~7%B),5~55 min(7%~22%B),55~65 min(22%~35%B),65~68 min(35%~80%B),68~75 min(80%B)。正离子扫描模式,质量扫描范围m/z400~1 200。DDA数据采用Trans-Proteomic Pipeline(TPP) 软件进行数据库搜索,数据库为Uniport非冗余库(2 014.9),胰酶漏切位点设为0;固定修饰半胱氨酸烷基化(57.021 46 u),非固定修饰甲硫氨酸氧化(15.994 9 u);母离子误差范围控制在10-5内,二级碎片误差控制在0.02 u内。用TPP将11个搜库结果整合建库导入Skyline,用于DIA的数据分析。
1.5.2DIA-MS数据获取及处理采用与DDA采集一致的液相分离梯度,对11个样本进行DIA数据采集,将质量扫描范围m/z400~1 200等分成32个连续的25 u窗口,每个窗口内依次选择、碎裂、采集所有母离子的全部子离子信息用于定量,重复2次。采用Skyline(Skyline-daily 3.5.1.9283)软件进行非标记蛋白质组学定量分析。将DIA数据导入,进行蛋白定量信息的筛选和提取。采用Skyline自动辅助功能筛选合适的色谱峰,方法参考Skyline官网数据非依赖采集数据处理教程,只考虑+1和+2价子离子,用肽段特征碎片离子提取面积之和对肽段进行定量,导出包含蛋白名称、多肽序列及子离子面积的信息。
采用R(version 3.2.2)软件对两次DIA定量数据用总离子强度(TIC)进行归一化处理,取两次结果的平均值用于后续分析。分别删除癌症组和对照组中样本间超过20%的子离子定量信息为0的子离子,保留两组样本中子离子定量相关性大于0.6的肽段。将同一肽段子离子面积加和归到肽段水平,在肽段水平进行双尾t检验,筛选具有显著差异的肽段(p<0.05),然后归到蛋白水平,找到差异表达蛋白。
DAVID是一个旨在从大批量的基因数据或蛋白数据中系统提取生物信息,整合完整生物数据的分析工具[4]。它是研究蛋白质功能及生物信号通路的有力手段,应用DAVID从蛋白质的生物过程(biological process)、分子功能(molecular function)、细胞组分(cellular component)3个方面分别对上调和下调的蛋白进行基因富集分析,分类严格等级设为高。使用Reactome对上调和下调的差异蛋白做通路分析。
2 结果与讨论
2.1 差异蛋白分析
11个样本DDA数据建库,共得到11 657条肽,2 585个蛋白,其中用Skyline软件定量到760个蛋白。对定量到的760个蛋白进行t检验,共得到113个差异蛋白(p<0.05),其中结直肠癌症组相比于良性结直肠疾病组,包含上调差异蛋白23个,下调差异蛋白90个。用这些差异蛋白聚类分析可以将结直肠癌组与良性结直肠疾病组明显的分成两类,示于图1。然后进行GO聚类分析,采用Benjamini校正法校正p值,导出校正后p<0.05的结果进一步探究。细胞组分分析结果显示,下调蛋白多为胞外组分,包括胞外外泌体、胞外膜结构、胞外囊泡和胞外体等;生物过程分析显示,下调差异蛋白主要参与的生物过程有血小板脱颗粒、调控细胞外泌、胞外分泌、囊泡调控的转运过程及细胞分泌过程等;分子功能分析结果显示,下调的差异蛋白多与细胞黏附、胞间粘着、钙粘蛋白参与的细胞间黏附等作用有关。这些结果表明,癌症患者的外周单核细胞的蛋白合成、蛋白分泌等可能发生了变化;并且细胞间信号转导也可能发生了变化,暗示着免疫细胞及免疫系统受到了调控。上调蛋白GO聚类分析结果经校正后p值均大于0.05。用Reactome对差异蛋白做通路分析发现,上调差异蛋白主要涉及SRP-依赖的翻译蛋白靶向膜通路;而下调差异蛋白涉及通路主要包括MAP2K和MAPK激活、一系列整合素相关通路、纤维蛋白凝血通路、RHOGTPase激活PAKs 及激活PKNs通路,其结果列于表1。
2.2 差异蛋白中与免疫直接相关的蛋白
本研究共筛选出113个差异蛋白(p<0.05),其中差异倍数≥2的差异蛋白67个,上调蛋白23个,下调蛋白44个,分别列于表2和表3。在发现的差异表达蛋白中,Galectin-1、Dok-2、AHNAK1等蛋白与机体的免疫功能息息相关,它们参与巨噬细胞、T细胞、树突细胞等多种外周免疫细胞的免疫活动。
Galectin-1(P09382, LEG1)是最早发现的Gal家族二聚体分子[5],在免疫系统中,Gal一般存在于激活的巨噬细胞、B细胞、树突细胞以及T细胞[6-8]中。随着各种生物技术的发展,越来越多的研究证明这种内源性的凝集素是一种非常重要的调节固有及获得性免疫的调控分子[9-14]。本实验研究发现,在结直肠癌症患者的外周血单个核细胞中,Galectin-1蛋白发生了极其显著的高表达现象,说明患者体内免疫细胞被激活,即在CRC的发生发展过程中,机体可能发生了相应的免疫反应。Rabinovich等[9]研究证明,Galectin-1在人类的单核细胞中可以通过触发MAPK中ERK1/2信号通路调节免疫细胞的生理机能,从而影响机体的固有免疫和获得性免疫功能。这些研究都说明,该蛋白过表达与机体免疫息息相关,结合本研究的信号通路分析结果,差异蛋白被富集到MAPK通路,暗示在结直肠癌发生发展过程中,PBMC中Galectin-1蛋白发生显著变化的分子原理,Galectin-1很有可能成为CRC的分子标志物。
Dok-2(O60496, DOK2)是DOK(downstream of tyrosine kinase)家族成员,目前已发现该家族包含7个蛋白[15],在众多免疫细胞中,Dok-2蛋白多在T细胞及髓系细胞中表达[16-17],大量研究报道Dok-2蛋白与Dok-1蛋白共同作用负调控T细胞的免疫活动[16,18-19]。同时,Yamanashi等[20]通过测定敲除Dok-1和Dok-2基因的小鼠活化巨噬细胞分泌物,证明了Dok-1和Dok-2蛋白在巨噬细胞的TLR4信号活动中起负调控作用,从而推测其可能影响机体的固有免疫功能。结合本实验该蛋白在癌症组明显下调的结果,说明在癌症发生发展过程中,免疫细胞可能做出了免疫响应以应对癌症的发生,Dok-2蛋白在结直肠癌患者的PBMC中明显低表达,其有望成为结直肠癌患者外周血单个核细胞中的诊断标志物。
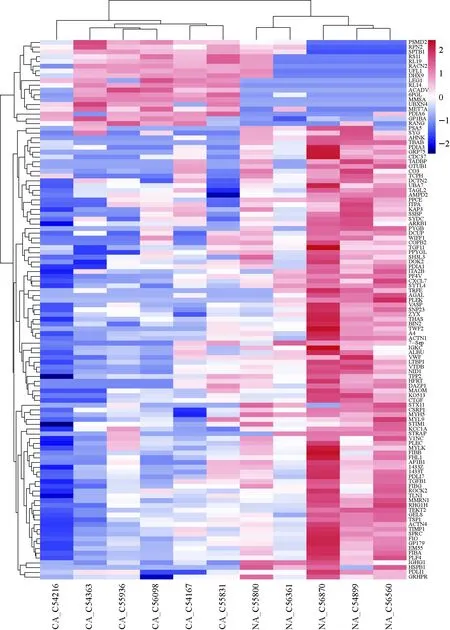
注:CA代表蛋白结直肠癌患者;NA代表良性肠类疾病患者图1 113个差异蛋白聚类分析Fig.1 Unsupervised hierarchical clustering of 113 differentially expressed proteins

通路序号PathwayID名称Name数目Count百分比Percent/%校正后结果BenjaminiDown-regulatedR-HSA-114608Plateletdegranulation2122.111.895×10-20R-HSA-5674135MAP2KandMAPKactivation88.422.459×10-6R-HSA-354194GRB2:SOSprovideslinkagetoMAPKsignalingforintegrins66.325.587×10-6R-HSA-372708P130CaslinkagetoMAPKsignalingforintegrins66.325.587×10-6R-HSA-354192IntegrinalphaIIbbeta3signaling66.324.467×10-5R-HSA-140875Commonpathwayoffibrinclotformation55.260.0010291R-HSA-216083Integrincellsurfaceinteractions66.320.0206406R-HSA-5627123RHOGTPasesactivatePAKs44.210.0258562R-HSA-5625740RHOGTPasesactivatePKNs44.210.0356186Up-regulatedR-HSA-1799339SRP-dependentcotranslationalproteintargetingtomembrane422.200.034
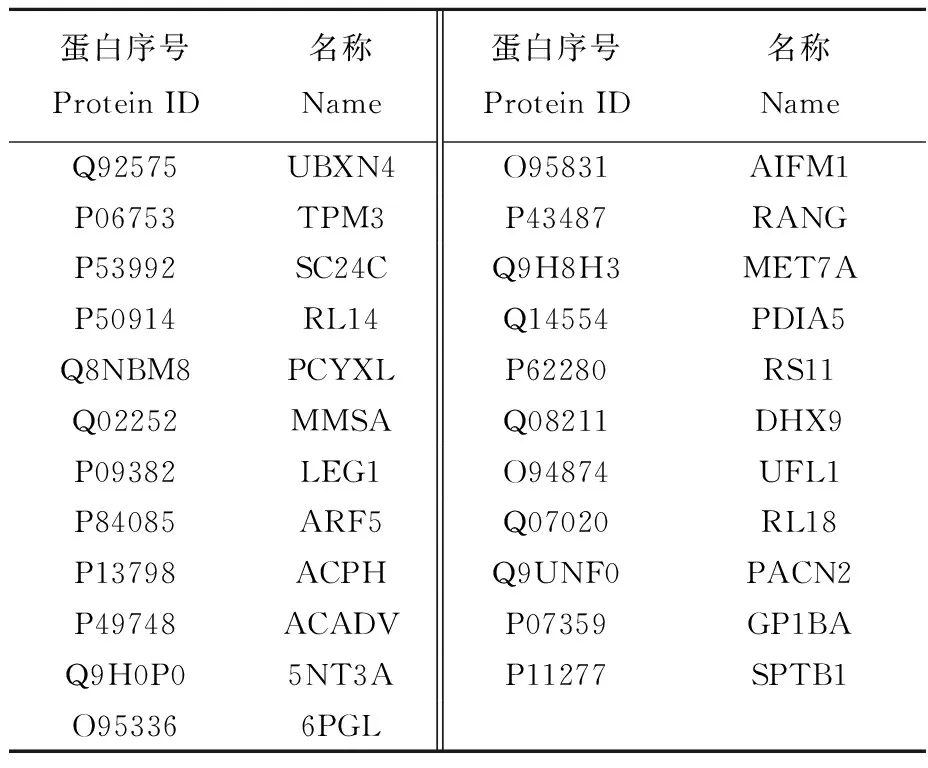
表2 结直肠癌患者外周血单个核细胞上调蛋白Table 2 Up regulated proteins in PBMC of CRC
AHNAK1(Q09666, AHNK)是一个分子质量接近700 u的蛋白,在CD4+T细胞中高表达,参与调控Ca2+-calcineurin-NFAT信号通路[21],是该通路中的重要组分,该信号通路调节T细胞的激活、增殖以及细胞因子的分泌等免疫活动[22]。Matza等[21]研究表明,钙离子信号通路对于T细胞的激活发挥了重要作用。为研究该蛋白对T细胞功能的影响,对比了AHNAK1基因敲除鼠和普通小鼠在发生感染时,CD4+T细胞的IFN-γ分泌情况,发现AHNAK1基因敲除鼠IFN-γ的分泌受到了严重损害,这表明AHNAK1蛋白对Th1免疫应答具有重要的调节作用,这是因为Th1的免疫应答主要是通过分泌IFN-γ来发挥作用的。结合本研究癌症组AHNAK1蛋白低表达的结果,推测癌症组T细胞Th1活性可能受到了抑制,AHNAK1具有成为结直肠癌标志物的潜力。
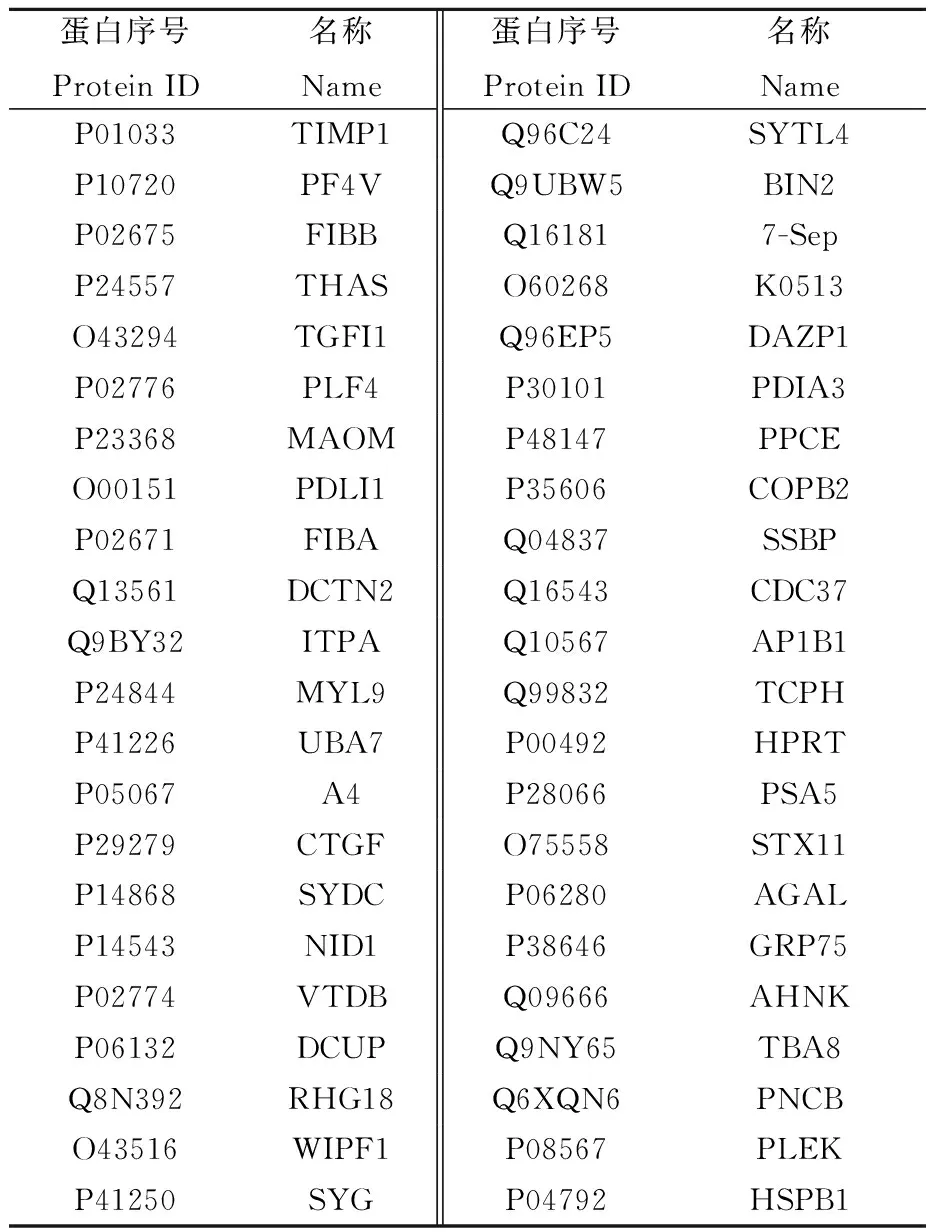
表3 结直肠癌患者外周血单个核细胞下调蛋白Table 3 Down regulated proteins in PBMC of CRC
3 结论
目前,LC/MS已成为复杂样本中通量分析蛋白和小分子的主流工具[23]。本研究采用的DIA-MS定量技术相比于DDA相对定量技术及MRM-MS定量技术,无需指定目标肽段、通量无上限、扫描点数均匀,可获得固定质量范围内母离子的全部子离子信息,利用谱图库即可实现定性确证和定量离子筛选,同时可实现数据随时回溯和生物样本信息数字化[24-25]。但DIA数据采集亦有一定的局限性,比如:难以使用超高分辨率扫描模式、大窗口引入较大干扰、依赖DDA形成的谱图库才能实现蛋白的定性、定量[24,26]。本研究在Q-Exactive plus平台上完成了经典DIA数据采集,借助Skyline软件完成了通量蛋白的定量,并找到一系列结直肠癌患者外周血单个核细胞差异蛋白。结直肠癌的形成是一个长期的先天与后天、机体与内分泌相互作用的复杂过程[27]。在这个复杂而漫长的疾病发生发展过程中,机体的很多方面发生了变化,包括基因、代谢、蛋白等。因此,理解结直肠癌发生的分子机制对于诊断和治疗该疾病具有重要的意义[28]。当癌症发生时,机体的免疫系统会因为识别癌变或癌症入侵免疫系统而发生变化。近年来,许多研究证实,当恶性肿瘤或恶性疾病发生时,机体的PBMC会发生显著变化,包括基因组[29]、转录组[3]、蛋白组[30]等,但对癌症发生时的PBMC蛋白组研究未见报道。因此,本实验采用DIA蛋白定量方法对结直肠癌患者外周血单个核细胞蛋白进行初步探究,筛选得到一批在结直肠癌发生发展过程中发生显著变化的蛋白,这些蛋白有望成为CRC的疾病诊断标志物或癌症免疫治疗的靶点,但这仍需要进一步的大样本分析验证、靶向定量或生物学验证。并应用DIA-MS在外周血单核细胞中寻找到CRC与非恶性肠病的差异表达蛋白,可以基于以上结果进行后续研究。同时,随着质谱技术的发展,谱图库更加完整,DIA数据可随时被回溯分析,从历史样本中可分析得到新的有价值的信息。
参考文献:
[1]FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. International Journal of Cancer, 2015, 136(5): E359-E386.
[2]BAINE M J, CHAKRABORTY S, SMITH L M, et al. Transcriptional profiling of peripheral blood mononuclear cells in pancreatic cancer patients identifies novel genes with potential diagnostic utility[J]. PloS One, 2011, 6(2): e17014.
[3]BURCZYNSKI M E, TWINE N C, DUKART G, et al. Transcriptional profiles in peripheral blood mononuclear cells prognostic of clinical outcomes in patients with advanced renal cell carcinoma[J]. Clinical Cancer Research, 2005, 11(3): 1 181-1 189.
[4]HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nature Protocols, 2009, 4(1): 44-57.
[5]贺雪明,唐丽,贺福初. 半乳糖凝集素1的免疫功能[J]. 生物技术通讯,2012,23(6):896-899.
HE Xueming, TANG Li, HE Fuchu. The immune function of galectin 1[J]. Letters in Biotechnology, 2012, 23(6): 896-899(in Chinese).
[6]BLASER C, KAUFMANN M, MULLER C, et al. Galactoside-binding protein secreted by activated T cells inhibits antigen-induced proliferation of T cells[J]. European Journal of Immunology, 1998, 28(8): 2 311-2 319.
[7]RABINOVICH G A, IGLESIAS M M, MODESTI N M, et al. Activated rat macrophages produce a galectin-1-like protein that induces apoptosis of T cells: biochemical and functional characterization[J]. The Journal of Immunology, 1998, 160(10): 4 831-4 840.
[8]RABINOVICH G A, BAUM L G, TINARI N, et al. Galectins and their ligands: amplifiers, silencers or tuners of the inflammatory response?[J]. Trends in Immunology, 2002, 23(6): 313-320.
[9]BARRIONUEVO P, BEIGIER-BOMPADRE M, ILARREGUI J M, et al. A novel function for galectin-1 at the crossroad of innate and adaptive immunity: galectin-1 regulates monocyte/macrophage physiology through a nonapoptotic ERK-dependent pathway[J]. The Journal of Immunology, 2007, 178(1): 436-445.
[10] CHUNG C D, PATEL V P, MORAN M, et al. Galectin-1 induces partial TCRζ-chain phosphorylation and antagonizes processive TCR signal transduction[J]. The Journal of Immunology, 2000, 165(7): 3 722-3 729.
[11] HE J, BAUM L G. Presentation of galectin-1 by extracellular matrix triggers T cell death[J]. Journal of Biological Chemistry, 2004, 279(6): 4 705-4 712.
[12] RABINOVICH G, RAMHORST R, RUBINSTEIN N, et al. Induction of allogenic T-cell hyporesponsiveness by galectin-1-mediated apoptotic and non-apoptotic mechanisms[J]. Cell Death and Differentiation, 2002, 9(6): 661-670.
[13] ILARREGUI J M, CROCI D O, BIANCO G A, et al. Tolerogenic signals delivered by dendritic cells to T cells through a galectin-1-driven immunoregulatory circuit involving interleukin 27 and interleukin 10[J]. Nature Immunology, 2009, 10(9): 981-991.
[14] GAR N M I, CHU C C, GOLSHAYAN D, et al. Galectin-1: a key effector of regulation mediated by CD4+CD25+T cells[J]. Blood, 2007, 109(5): 2 058-2 065.
[15] MASHIMA R, HISHIDA Y, TEZUKA T, et al. The roles of Dok family adapters in immunoreceptor signaling[J]. Immunological Reviews, 2009, 232(1): 273-285.
[16] YASUDA T, BUNDO K, HINO A, et al. Dok-1 and Dok-2 are negative regulators of T cell receptor signaling[J]. International Immunology, 2007, 19(4): 487-495.
[17] YASUDA T, SHIRAKATA M, IWAMA A, et al. Role of Dok-1 and Dok-2 in myeloid homeostasis and suppression of leukemia[J]. The Journal of Experimental Medicine, 2004, 200(12): 1 681-1 687.
[18] DONG S, CORRE B, FOULON E, et al. T cell receptor for antigen induces linker for activation of T cell-dependent activation of a negative signaling complex involving Dok-2, SHIP-1, and Grb-2[J]. The Journal of Experimental Medicine, 2006, 203(11): 2 509-2 518.
[19] GERARD A, FAVRE C, GARCON F, et al. Functional interaction of RasGAP-binding proteins Dok-1 and Dok-2 with the Tec protein tyrosine kinase[J]. Oncogene, 2004, 23(8): 1 594-1 598.
[20] SHINOHARA H, INOUE A, TOYAMA-SORIMACHI N, et al. Dok-1 and Dok-2 are negative regulators of lipopolysaccharide-induced signaling[J]. The Journal of Experimental Medicine, 2005, 201(3): 333-339.
[21] MATZA D, BADOU A, KOBAYASHI K S, et al. A scaffold protein, AHNAK1, is required for calcium signaling during T cell activation[J]. Immunity, 2008, 28(1): 64-74.
[22] SHAW A S, FILBERT E L. Scaffold proteins and immune-cell signalling[J]. Nature Reviews Immunology, 2009, 9(1): 47-56.
[23] BILBAO A, VARESIO E, LUBAN J, et al. Processing strategies and software solutions for data-independent acquisition in mass spectrometry[J]. Proteomics, 2015, 15(5/6): 964-980.
[24] 张伟,江峥,陈伟. 创新数据非依赖性采集用于复杂基质目标蛋白质的定量分析[J]. 分析化学,2014,42(12):1 750-1 758.
ZHANG Wei, JIANG Zheng, CHEN Wei. Quantitation of targeted proteins in complex matrix by applying data independent acquision of mass spectrometry creatively[J]. Chinese Journal of Analytical Chemistry, 2014, 42(12): 1 750-1 758(in Chinese).
[25] 张伟. 定量蛋白质组学质谱采集技术进展[J]. 分析化学,2014,42(12):1 859-1 868.
ZHANG Wei. Advances in proteomics quantitation technologies of mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2014, 42(12): 1 859-1 868(in Chinese).
[26] LAW K P, LIM Y P. Recent advances in mass spectrometry: data independent analysis and hyper reaction monitoring[J]. Expert Review of Proteomics, 2013, 10(6): 551-566.
[27] SAKAI E, FUKUYO M, OHATA K, et al. Genetic and epigenetic aberrations occurring in colorectal tumors associated with serrated pathway[J]. International Journal of Cancer, 2016, 138(7): 1 634-1 644.
[28] LIANG B, LI C, ZHAO J. Identification of key pathways and genes in colorectal cancer using bioinformatics analysis[J]. Medical Oncology, 2016, 33(10): 111.
[29] NICHITA C, CIARLONI L, MONNIER-BENOIT S, et al. A novel gene expression signature in peripheral blood mononuclear cells for early detection of colorectal cancer[J]. Alimentary Pharmacology & Therapeutics, 2014, 39(5): 507-517.
[30] WANG L, DAI Y, QI S, et al. Comparative proteome analysis of peripheral blood mononuclear cells in systemic lupus erythematosus with iTRAQ quantitative proteomics[J]. Rheumatology International, 2012, 32(3): 585-593.
