SGK1在血清和母胎界面的表达及其与稽留流产的关系
2018-04-02顾文婷刘福民韩秋峪
顾文婷,刘福民,韩秋峪
(1.徐州医科大学研究生学院,江苏 徐州 221000;2. 徐州医科大学附属医院妇产科,江苏 徐州 221000)
稽留流产是因各种因素使胚胎停止发育或死亡滞留宫腔的一种自然流产形式。目前稽留流产在我国的发生率高达13.4%,并且呈逐年增加的趋势。尽管已有许多相关研究,但稽留流产的发生机制尚不十分明确。血清和糖皮质激素诱导蛋白激酶-1(serum-and glucocorticoid-regulated kinase,SGK1)是丝氨酸/苏氨酸蛋白激酶的亚家族成员,已被证实在中枢神经系统、心血管系统等多种系统疾病的发生发展中发挥作用。其参与子宫内膜容受性的维持,与人类妊娠有密切关系。Toll样受体(toll-like receptors,TLRs)是机体内重要的免疫受体。TLR4(Toll-like receptor 4)是第一个在人类中被发现的Toll样受体家族成员,其不仅介导先天性免疫,还介导获得性免疫应答,并参与妊娠的维持和妊娠疾病的发生。研究显示TLR4转导来自革兰阴性菌毒素脂多糖(lipopolysaccharide,LPS)的信号,随后激活核因子-κB(nuclear factor-κB,NF-κB)以诱导促炎细胞因子的表达,不利于妊娠[1]。而SGK1活化可抑制脂多糖(lipopolysaccharide,LPS)/TLR4介导的细胞凋亡,并促进了母胎界面的Th2反应[2]。目前SGK1与稽留流产相关性的研究少有报道,其机制亦不清楚。因此,本研究旨在通过检测稽留流产患者血清SGK1与TLR4的水平,同时检测绒毛和蜕膜组织中SGK1、TLR4和NF-κB的表达,探讨SGK1与稽留流产的相关性及其与流产发生的可能机制。
1资料与方法
1.1临床资料
选择2017年2至7月期间于徐州医科大学附属医院妇产科住院行清宫术的稽留流产患者及正常早孕妇女为研究对象,患者年龄18~46岁,平均29.66±5.91岁。稽留流产组入组条件:①孕8~12周通过超声发现胚胎停止发育,无心管搏动;②夫妇双方和(或)胚胎染色体正常;③月经周期正常;④性激素、甲状腺功能、血糖、胰岛素等内分泌检查均正常;⑤排除生殖道感染性疾病,如霉菌、支原体、衣原体等感染;⑥巨细胞病毒、弓形虫等病原体检查IgM均为阴性;⑦检查抗磷脂抗体为阴性排除抗磷脂综合征。正常早孕组入组条件:①此次妊娠期间无阴道流血、腹痛等先兆流产症状和体征;②超声证实胚胎发育正常,有心管搏动。排除标准:①既往有自然流产、死胎、死产史;②有家族遗传病史;③妇科检查、超声检查器质性病变和生殖器官解剖畸形遗传;④有与入组条件不符合的情况。经严格纳入排除标准筛选后留取稽留流产组32例、正常早孕组30例,两组患者间年龄、停经天数、孕次、产次比较,差异均无统计学意义(均P>0.05)。患者均知情同意,并签署知情同意书,本研究经医院伦理委员会审核同意。
1. 2研究方法
1.2.1标本制备
所有研究对象入院24h内空腹采集其肘静脉血3mL,室温静止1h后,3 000 r/min离心10min,取上清,-80℃冰箱保存。所有研究对象在清宫术后取新鲜蜕膜及绒毛组织置于10%中性甲醛固定24~48h后常规石蜡包埋、切片、烤片,切片厚度4μm,进行免疫组化染色。
1.2.2 血清中 SGK1、TLR4表达检测
采用酶联免疫吸附试验(试剂购自武汉华美生物工程公司)检查研究对象血清中SGK1与TLR4的水平,所有实验操作均严格按照试剂盒说明书进行。
1.2.3绒毛及蜕膜组织中 SGK1、TLR4和NF-κB的表达检测
采用免疫组化方法(SGK1免疫组化试剂盒购自Abcam公司,TLR4和NF-κB免疫组化试剂盒购自武汉华美生物工程公司),具体方法为:石蜡切片脱蜡至水,加入500mL柠檬酸盐缓冲液,置于微波炉加热修复抗原,PBS冲洗,室温冷却;加入3%过氧化氢溶液阻断内源性过氧化物酶活性,室温孵育20min,PBS冲洗;滴加适当比例稀释的一抗(SGK1 1:100,TLR4 1:150,NF-κB 1:150),4℃孵育过夜,PBS冲洗,滴加适量二抗,PBS冲洗DAB,DAB显色,苏木素复染,水冲洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。实验中用PBS取代一抗作为阴性对照。
1.3结果判定
1.3.1 ELISA结果判定
每个标准品和样本的OD值与空白孔的OD值相减后作图,以OD值为横坐标,以标准品的浓度为纵坐标,绘制出标准曲线图,根据样品OD值的大小,依据标准曲线查出对应的浓度,再乘以稀释之后的倍数即是样品实际的浓度。
1.3.2免疫组化结果判定
每张切片随机观察5个400倍视野,采用染色强度与阳性细胞百分率法相结合的方法来判读结果,二者相乘的结果作为最后得分:A.阳性细胞的染色强度按照着色强度进行评分:无着色、淡黄色、棕黄色以及棕褐色分别计分为 0~3分;B.染色细胞的数量评分标准:当染色结果为阳性的细胞数<5%时为 0分;5%~25%时为1分,>25%~50% 时为2分,>50% 为3分。A×B得分结果判断:0~3分为阴性,4分及以上为阳性,计算每组切片的阳性率。
1.4统计学方法

2结果
2.1两组实验对象临床资料的比较
对正常早孕组及稽留流产组的临床一般资料进行统计学分析,两组患者在年龄、停经天数、孕次及产次均无统计学意义(均P>0.05),见表1。

表1 正常早孕组和稽留流产组临床资料比较Table 1 Comparison of clinical data of normal pregnancy group and missed abortion group
2.2 SGK1和TLR4在患者血清中的表达
SGK1和TLR4两种蛋白在正常早孕妇女血清中的表达量分别为(54.20±15.92)pg/mL和(8.31±2.75)ng/mL,在稽留流产患者血清中的表达量分别为(25.23±7.78)pg/mL和(15.88±6.11)ng/mL。与正常早孕组相比,SGK1在稽留流产组中的表达量显著降低(t=8.145,P<0.05);TLR4在稽留流产组中的表达量显著升高(t=4.919,P<0.05),差异均具有统计学意义。
2.3血清中SGK1和TLR4表达的相关性分析
Pearson相关性分析结果显示,在稽留流产组的血清中,SGK1和TLR4的表达呈负相关(r=-0.358,P= 0.016<0.05)。
2.4 SGK1、TLR4和NF-κB在绒毛和蜕膜组织中的表达部位
免疫组化结果显示,SGK1主要表达于绒毛合体滋养细胞的细胞质、蜕膜基质细胞细胞质和细胞膜,少数表达于细胞核。TLR4主要表达于绒毛合体滋养细胞和蜕膜基质细胞的细胞质,血管内皮细胞和绒毛间质细胞的细胞质内也有表达,少数见于细胞核。NF-κB主要表达于绒毛合体滋养细胞和蜕膜基质细胞的细胞质、细胞膜,少数见于细胞核,见图1、图2。
2.5 SGK1、TLR4和NF-κB在绒毛和蜕膜组织中的表达水平
在32例稽留流产中,SGK1表达阳性者11例,阳性率为34.38%(11/32)。30例正常早孕中,SGK1表达表达阳性者21例,阳性率为70.00%(21/30)。稽留流产组中SGK1表达阳性率明显低于正常妊娠组,两组SGK1表达阳性率比较差异有统计学意义(χ2=7.869,P<0.05)。
在32例稽留流产中,TLR4表达阳性者20例,阳性率为62.50%(20/32)。30例正常早孕中,TLR4表达阳性者6例,阳性率为20.00%(6/30)。稽留流产组中TLR4表达阳性率明显高于正常妊娠组,两组TLR4表达阳性率比较差异有统计学意义(χ2=11.486,P<0.05)。
在32例稽留流产中,NF-κB表达阳性者23例,阳性率为71.88%(23/32)。30例正常早孕中,NF-κB表达阳性者7例,阳性率为23.33%(7/30)。稽留流产组中NF-κB表达阳性率明显高于正常妊娠组,两组NF-κB表达阳性率比较差异有统计学意义(χ2=14.609,P<0.05)。
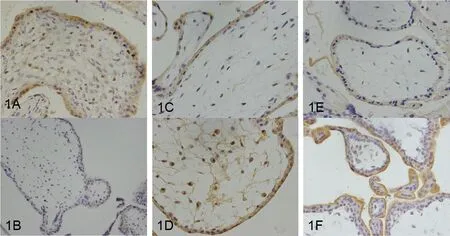
注:1A正常早孕组绒毛中SGK1的表达;1B稽留流产组绒毛中SGK1的表达;1C正常早孕组绒毛中TLR4的表达;1D稽留流产组绒毛中TLR4的表达;1E正常早孕组绒毛中NF-κB的表达;1F稽留流产组绒毛中NF-κB的表达。
图1 SGK1、TLR4、NF-κB在正常早孕组和稽留流产组绒毛组织中的表达(免疫组化×400)
Fig.1 The expressions of SGK1, TLR4 and NF-κB in villi(免疫组化×400)

注:2A正常早孕组蜕膜中SGK1的表达;2B稽留流产组蜕膜中SGK1的表达;2C正常早孕组蜕膜中TLR4的表达;2D稽留流产组蜕膜中TLR4的表达;2E正常早孕组蜕膜中NF-κB的表达;2F稽留流产组蜕膜中NF-κB的表达。
图2 SGK1、TLR4、NF-κB在正常早孕组和稽留流产组(免疫组化×400)
Fig. 2 The expressions of SGK1, TLR4 and NF-κB in decidua (免疫组化×400)
2.6绒毛蜕膜组织中SGK1、TLR4和NF-κB三者的相关性分析
Spearman等级相关分析结果显示:在稽留流产组的绒毛蜕膜组织中,SGK1和TLR4的表达呈负相关(r= -0.527,P=0.003),SGK1与NF-κB的表达呈负相关(r=-0.662,P=0.000),TLR4与NF-κB的表达呈正相关(r=0.520,P=0.002)。
3讨论
3.1 SGK1与母胎界面免疫微环境
SGK1参与妊娠的多个过程,包括维持子宫内膜容受性、促进囊胚植入与滋养细胞侵袭、调节母胎界面细胞分化和增殖与存活等[3]。有研究发现,与月经期子宫内膜相比,在人类早期妊娠蜕膜中,SGK1浓度明显升高[4]。也有研究表明,在早期自然流产患者的蜕膜中,SGK1的表达减少[5]。本研究结果显示稽留流产患者绒毛和蜕膜组织中SGK1的表达均明显低于正常早孕组,提示SGKl低表达与胚胎停止发育有关。
妊娠期母胎界面的免疫细胞与细胞因子参与免疫网络构成,维持免疫微环境的平衡。其中Thl/Th2平衡是维持正常妊娠的重要因素之一。早期适量的 Th1 类细胞因子如干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等有利于滋养细胞形成, 并在着床期促进血管生成,但Th1 类细胞因子也为促炎性细胞因子,可介导细胞免疫、急性排斥反应和炎症反应等,过度表达时则会影响胚胎的存活,导致流产的发生[6]。
SGK1在免疫与炎症反应中具有重要的作用。研究显示SGK1能够诱导分化和稳定Th2细胞,抑制 Th1 细胞的分化[7]。殷辉等[8]在研究小鼠脓毒血症时,用脂多糖刺激SGKl抑制剂预处理过的小鼠,发现白介素-12(interleukin -12,IL-12)和TNF-α的表达较未使用SGKl抑制剂预处理的小鼠明显升高,说明SGK1能够抑制Th1类细胞因子的表达。
3.2 SGK1参与稽留流产发生的可能机制
国内外已有多项研究证明TLR4参与妊娠的维持和妊娠疾病的发生[9]。TLR4被激活后,通过一系列跨膜信号转导激活NF-κB,诱导Th1型细胞因子分泌增加,抑制Th2型细胞因子分泌,破坏Thl/Th2平衡[10],导致流产的发生[11]。本研究中稽留流产组绒毛和蜕膜组织中TLR4、NF-κB的表达水平均高于正常早孕组,相关性分析显示TLR4与NF-κB的表达成正相关,与以往结果研究一致。Zhou等[12]研究内毒素所致器官衰竭时提出SGK1可能通过抑制TLR4下游的转化生长因子β激酶1(transforming growth factor β kinase 1,TAK1),阻止I-κB激酶(I- kappa B kinase,IKK)磷酸化,抑制NF-κB活性,负调控TLR4介导的炎性活动。本研究中稽留流产患绒毛蜕膜组织中SGK1的表达均明显低于正常早孕组,并与TLR4、NF-κB的表达水平均呈负相关,提示SGK1低表达可能通过TLR4/NF-κB信号通路活化,导致母胎界面Th1/ Th2平衡向Th1偏倚,参与了流产的发生。
本研究同时检测了稽留流产患者血清中SGK1和TLR4的表达及其相关性,结果显示血清中SGK1的表达与绒毛和蜕膜组织一致,较正常早孕组明显下降(P<0.05),而TLR4的表达较正常早孕组明显上升(P<0.05),且二者在血清中的表达呈负相关(P<0.05),提示稽留流产患者血清中SGK1与母胎界面的表达具有一致性。检测孕妇血清中SGK1的水平可能成为判断流产的指标。但本研究样本量较小,仍需大样本研究来证实其实用性。
综上所述,与正常早孕组相比,稽留流产患者的血清、绒毛和蜕膜组织中SGK1表达均降低,提示SGK1与稽留流产的发生具有相关性,其机制可能与SGK1表达减少,对TLR4介导的炎症反应的负调节减弱,母胎界面免疫微环境失衡有关。SGK1有可能成为临床检测流产的指标或治疗靶点。
[1]Xue P,Zheng M,Gong P,etal.Single administration of ultra-low-dose lipopolysaccharide in rat early pregnancy induces TLR4 activation in the placenta contributing to preeclampsia[J].PLoS One,2015,10(4):e0124001.
[2]Lou Y,Hu M,Wang Q,etal.Estradiol suppresses TLR4-triggered apoptosis of decidual stromal cells and drives an anti-inflammatory TH2 shift by activating SGK1[J].Int J Biol Sci,2017,13(4):434-448.
[3]Lou Y,Hu M,Mao L,etal.Involvement of serum glucocorticoid-regulated kinase 1 in reproductive success[J].FASEB J,2017,31(2):447-456.
[4]Lv Y,Gao S,Zhang Y,etal.miRNA and target gene expression in menstrual endometria and early pregnancy decidua[J].Eur J Obstet Gynecol Reprod Biol,2016,197:27-30.
[5]Wang Y,Lv Y,Wang L,etal.MicroRNAome in decidua: a new approach to assess the maintenance of pregnancy[J].Fertil Steril,2015,103(4):980-989.
[6]李莉,乔杰,王海燕.不明原因复发性流产免疫学发病机制的研究进展[J].中华生殖与避孕杂志,2017, 37(2):160-165.
[7]Heikamp E B,Patel C H,Collins S,etal.The AGC kinase SGK1 regulates TH1 and TH2 differentiation downstream of the mTORC2 complex[J].Nat Immunol,2014,15(5):457-464.
[8]殷辉,宁会彬,曾艳丽,等.血清和糖皮质激素调节蛋白激酶1通过核因子-κB抑制Toll样受体4介导的炎性反应[J].中华传染病杂志,2016,34(4):242-247.
[9]Koga K,Izumi G,Mor G,etal.Toll-like receptors at the maternal-fetal interface in normal pregnancy and pregnancy complications[J].Am J Reprod Immunol,2014,72(2):192-205.
[10]Wei C B,Tao K,Jiang R,etal.Quercetin protects mouse liver against triptolide-induced hepatic injury by restoring Th17/Treg balance through Tim-3 and TLR4-MyD88-NF-κB pathway[J].Int Immunopharmacol,2017,53:73-82.
[11]赵先兰,李莎.稽留流产患者绒毛组织中TLR4、NF-κB和HBD2的表达及其相关性[J].中华妇产科杂志,2011,46(11):864-866.
[12]Zhou H,Gao S,Duan X,etal.Inhibition of serum- and glucocorticoid-inducible kinase 1 enhances TLR-mediated inflammation and promotes endotoxin-driven organ failure[J].FASEB J,2015,29(9):3737-3749.
[专业责任编辑:于学文]
