婴儿全身运动质量评估的神经学基础及其临床应用
2018-04-02帖利军刘黎明
帖利军,刘黎明
(西安交通大学第一附属医院,陕西 西安 710061)
全身运动(general movements,GMs)质量评估是奥地利发育神经学之父Heinz Prechtl于1990年创立的一种针对儿童发育障碍性疾病早期诊断的评估技术。GMs出现在胎儿早期,当婴儿校正年龄3~5月龄,有目标定向的手臂运动时消失,它是一种全身各部分均参与的自发运动。典型的GMs具有复杂性、多变性和流畅性的特征。本文主要目的是阐述早期脑发育,GMs产生的神经学基础、发育历程以及该评估技术在儿科的临床应用。
1脑组织的早期发育
人类大脑的发育是基因与环境长期相互作用的复杂过程,发育的高峰在胎儿期和生后两年。胎儿脑发育开始于孕母停经后(postmenstrual age,PMA)第5周的神经管形成,继之神经元产生。神经元的迁移发生在孕中期,在神经元迁移的过程中,神经元开始分化,产生轴突、树突、突触和神经递质。有趣的现象是,第一代神经元并未迁移到皮质板(cortical plate,CP)而是阻滞在皮质板下层(cortical subplate,SP)。SP在灵长类特别是哺乳动物人类的发育脑中是一个暂时性的结构,在PMA9~10周时SP神经元有突触活性,是神经元分化和突触发生的重要部位,也是皮质板传入纤维塑形的场所[1]。SP在PMA28~34周时最厚,是CP厚度的4倍多。胎儿功能磁共振的研究显示:PMA20周时,SP脑活动最多,伴随着SP发育达高峰,该区域的神经元会逐渐发生凋亡,这不仅可以重塑神经元集群,而且可以调整轴突、突触的数目[2]。从PMA26周开始,丘脑皮质的传入纤维到达终点—CP。因此,大脑皮层在妊娠晚期的胎儿存在“两个”独立但相互交织的环路,一个是暂时性的胎儿环路,中心在SP;另一个是虽不成熟但逐渐会发展成为永久的环路,中心在CP。在大脑皮质的不同部位,“双环路”时期并不相同。例如,出生后3个月,运动、感觉、视觉皮质环路完成,而前额叶皮质则大约在1岁时完成[3]。
脑组织不仅包括神经元,而且有大量的神经胶质细胞。少突胶质细胞与轴突髓鞘化有关,髓鞘化在胎儿后期及生后1年较为活跃。从PMA8周到10周,在大脑皮层神经组织中发现儿茶酚胺、5-羟色胺、γ-氨基丁酸以及兴奋性氨基酸包括谷氨酸神经递质;脑白质中的去甲肾上腺素α2受体、多巴胺及脑干核暂时性高表达在围生期,这时含血清素的轴突也会穿透皮质各层,随之的几周会快速下降。γ-氨基丁酸在胎儿早期是兴奋功能,而在晚期则表现为抑制功能。谷氨酸N-甲基-D-天冬氨酸受体则有两个高表达期,分别在PMA13~21周之间以及足月期[3]。
因此,早期脑发育在胎儿晚期及足月后3个月活性最高,此期SP开始消失,永久的皮质环路开始出现;原始的运动、感觉、视觉皮质到达CP;去甲肾上腺素α2受体、谷氨酸N-甲基-D-天冬氨酸受体暂时性的过度表达以及血清素神经分布增高、多巴胺成倍增高。
2正常的GMs
2.1正常GMs的发育历程
在PMA7周时,胎儿运动出现,主要是幅度小的、频率慢的头和/或躯干的弯曲运动,继之有小的、慢的及简单的手臂和腿的运动。具有复杂性和多变性的GMs则出现在PMA第9~10周。GMs包括一系列强度、速度和力量方面具有高低起伏的变化的全身运动,运动的开始和结束都具有渐进性,但无顺序性。GMs的复杂性常代表运动空间的改变,如弯曲-伸展、外展-内收、内旋-外旋组成了各方向上的运动,而多变性则代表时间的改变。复杂性和多变性是相互交织在一起的,可变性是发育脑的标志[3]。
GMs的观察遵循视觉格式塔(Gestalt)知觉理论。该理论是上世纪初,奥地利及德国的心理学家创立的,它强调经验和行为的整体性。因此,GMs观察时,需要关注婴儿运动的整体性,而非注意运动的局部。
正常的GMs发育历程有明显的年龄特异性。由于大部分的GMs研究集中在出生后,因此,孕早期的GMs了解的很少。从妊娠28周至36~38周为足月前GMs,其特征为运动有明显的复杂性和多变性,躯干运动较多,沿四肢长轴的旋转使整个GMs 流畅。早产儿阶段的GMs可出现大幅度运动,多见于双下肢,速度通常偏快,偶尔可出现肢体的抖动。PMA36~38周时,GMs发生第1次转变,由变异较大的“足月前GMs”转变为速度较慢但强有力的“扭动运动”,躯干的参与不如以前明显。10周后GMs发生第2次转变,“扭动运动”被“不安运动”所取代。“不安运动”是指连续不断的细小、优美的运动,不规则地流动于身体所有的部位。“不安运动”是3~5月龄婴儿的主要运动形式,之后逐渐被有意识的、抗重力的运动所替代。GMs的两次转变与PMA相关,而与出生后日龄无关。
2.2正常GMs产生的神经学基础
胎儿运动出现在PMA 7周脊髓反射弧完成之前,且这种运动主要在头部和躯干,是由脊髓和脑干中的“中枢模式发生器”网络产生的。该运动是SP通过投射纤维直接或间接传递调控信息到脑干或脊髓网络,从而调控全身运动的复杂性和多变性。伴随着“双环路”的出现,SP引导的GMs逐步转移到CP。当胎儿PMA26~28周时,通过皮质-脊髓连接,CP的调控信息迅速增多。PMA40周左右的“扭动”运动则与脑白质中的去甲肾上腺素α2受体、多巴胺以及血清素的轴突暂时性高表达有关。“稀疏”的感觉运动皮质和相应的传入纤维输入增加则导致不安运动的出现,这意味着皮质板网络强度降低,仅发生在有限的神经元群,为全身运动向特定的目标定位发展铺平道路。GMs相应的神经学改变详见图1[3]。
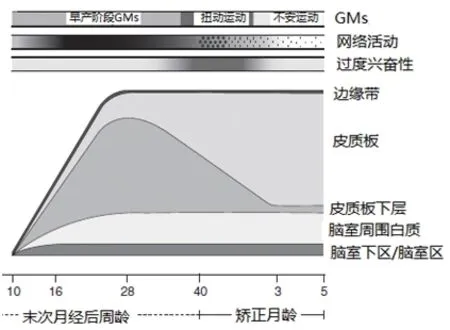
图1 GMs与神经发育变化对应图
Fig.1 Schematic presentation of GMs and neural development
3异常的GMs
3.1异常GMs的特征
当胎儿、小婴儿出现脑损伤或脑功能障碍时,GMs将失去复杂性和多变性,运动的空间和时间变异性降低甚至消失,取而代之以刻板、僵硬的运动。异常GMs分为足月前GMs 及扭动运动阶段和不安运动阶段的异常GMs类型[3]。
3.1.1早产/扭动运动阶段的异常GMs类型
①单调性GMs(poor repertoire GMs,PR):指运动顺序单调,运动成分稀少、重复,在复杂性和多变性方面存在不足;②痉挛-同步性GMs(cramped-synchronized GMs,CS):表现为运动僵硬,失去正常的流畅性,所有肢体和躯干肌肉几乎同时收缩和放松;③混乱性GMs(chaotic GMs,Ch):表现为运动的突然爆发,顺序混乱、不连贯。
3.1.2不安运动阶段的异常GMs 类型
①不安运动缺乏:(absence of fidgety movements,F-)指在整个阶段观察不到不安运动;②异常性不安运动(abnormal fidgety movements,AF):看起来与正常不安运动相似,但在动作幅度、速度以及不平稳性方面中度或明显夸大。
3.2异常GMs产生的神经学基础
异常GMs常提示发育脑的完整性有损伤。不安运动的异常与原始感觉运动皮质向CP永久环路迁移的时间一致。异常GMs运动不仅在早产儿可以预测脑瘫,而且同样可以用来预测足月儿的运动发育异常。然而,对足月儿的预测效度要低得多,这是由于GMs的复杂性和多变性产生于SP,并逐渐迁移至CP。复杂性和多变性的降低意味着SP和/或CP以及脑室周围白质传出纤维的损伤或机能障碍。早产儿脑损伤的部位常常在脑室周围白质和SP,表现为异常GMs和不良的预后;而足月儿的脑损伤部位有很大的异质性,大脑皮质、基底节以及丘脑均是损伤常见部位,Ferrari等[4]研究了缺氧缺血性脑病足月儿的GMs质量,结果显示GMs质量与丘脑、基底节及白质损伤相关,说明GMs质量是基于SP和CP广泛的神经网络的完整性的;同时也说明GMs质量不仅可以预测脑瘫,而且与认知功能、注意缺陷多动障碍、轻微脑损伤综合征相关。
4 GMs的临床应用
4.1预测高危儿不同年龄时的神经发育结局
国外大量研究已表明,早产和足月阶段的痉挛-同步性GMs是痉挛型脑瘫特异的预测指标,3~5月龄的不安运动缺乏是预测脑瘫的敏感指标。GMs不仅可以超早期地预测早产儿和小婴儿的神经发育结局特别是脑性瘫痪,而且可以预测学龄期儿童的认知、行为损害[3,5]。GMs预测高危儿不同年龄神经发育的结局主要表现在以下方面:
4.1.1预测早产儿3岁内的神经发育结局,评价早期干预的效果
在一个为期2年的前瞻性早产儿神经发育结局的研究中,47例孕周24~30周的早产儿在PMA50~55周时评估婴儿的GMs并采集足月时的头颅MRI数据,2岁时采用贝利婴幼儿发展量表Ⅲ评估神经发育结局。有9例婴儿GMs不正常,MRI-TBSS(纤维束追踪的空间统计)分析提示这些婴儿在胼胝体、下纵束、额枕束、内囊、视辐射的各项异向分数(FA)值明显降低,而且这些婴儿的认知、语言、运动技巧与其GMs相关[6]。在更大样本、多中心的研究中,535例孕周小于32周的早产儿中有81%的婴儿在校正年龄3月时,GMs正常,19%的婴儿显示不正常GMs。不安运动缺乏预测2岁时脑瘫的比数比(OR)为8.9(95%CI:为4.1~17.0),不安运动缺乏对早产儿脑瘫的预测性高。如GMs与颅脑B超联用,可提高预测脑瘫的OR值达17.8[7]。Brogna等[8]研究了574例晚期早产儿的GMs,扭动运动阶段与婴儿2岁时脑瘫的相关系数为0.68,不安运动阶段为0.78;校正年龄3月时对脑瘫预测的敏感性为100%,特异度为97%,提示GMs质量评估是一种可靠而有效的工具,可以区分婴儿面临脑瘫发育结局的高风险,为早期干预提供“时间窗”。最新的系统综述表明,在婴儿矫正年龄5个月时,能够预测神经发育结局的MRI检查的敏感度为86%~89%,GMs评估为98%,而Smith婴儿神经检查为90%[5]。Ma等[9]用GMs质量评估研究了285例早产儿的早期干预效果,结果表明:在干预前,干预组与对照组婴儿的孕周/出生体重与CS呈负相关(r值分别为0.988和0.95),而与PR无关;干预后,婴儿的不安运动两组婴儿明显不同,早期干预可以明显地促进婴儿不安运动的发育。
4.1.2预测新生儿缺氧缺血性脑病的神经发育结局
1项纳入15例围产期缺氧和新生儿缺血缺氧性脑病的婴儿GMs研究中,GMs对12~18个月婴儿神经发育结局预测的敏感性为0.80(95%CI:0.44~0.96),特异度为1.00(95%CI:0.47~1.00),正确性为0.87(95%CI:0.57~1.00)[10]。
4.1.3预测糖尿病母亲婴儿的神经发育结局
1997年,Kainer等研究了16例1型糖尿病母亲胎儿和婴儿的GMs,发现所有胎儿16周的GMs是正常的,而从20周到出生时,5例胎儿GMs不正常,糖尿病评分在异常GMs的胎儿明显降低,说明1型糖尿病对胎儿晚期GMs有负性作用。
4.1.4为孕期服用抗癫痫药物婴儿的神经发育结局提供补充信息
2003年Parisi前瞻性地用GMs质量评估研究了11例母亲孕期服用抗癫痫药物的婴儿精神运动发育结局,发现在婴儿9个月及12个月时,传统的神经学检查不能识别婴儿发育迟缓,而早期的婴儿GMs评估可以预测婴儿的发育迟缓,特别是婴儿4周的GMs与30个月的Brunet-Lezine评分明显相关。GMs质量评估可以给癫痫母亲的婴儿精神运动发育结局提供补充信息。
4.1.5预测学龄前儿童认知、行为损害
一项216例婴儿参加的前瞻性队列研究,婴儿PMA42周时的GMs质量评估结果为严重异常的婴儿,发育至18月龄和4周岁时,40%的儿童诊断为轻微脑功能障碍(minor neurological dysfunction,MND);3月龄进行的不安运动阶段GMs评估结果为轻度异常的婴儿,在18月龄时8%的儿童诊断为复杂性MND,在4周岁时25%的儿童诊断为复杂性MND。由此可见,GMs评估有助于预测儿童复杂性MND[11]。
4.1.6预测学龄期儿童神经发育结局
2010年Bouwstra在一个GMs预测神经发育结局的纵向研究中,有28例青少年参与了此项研究,18例在婴儿时有猝死高风险,而另外10例低风险,研究结果提示婴儿异常不安运动与MND无关,但与青少年精细动作能力显著相关。另一项有40例儿童参与的研究表明:有6例儿童罹患脑瘫,10例儿童参加特殊教育,8例儿童有行为问题,其中不安运动缺乏与脑瘫明显相关,而运动僵硬与儿童期参加特殊教育相关,GMs的复杂性和多变性与儿童期性行为问题相关[12]。
4.2 GMs与孤独症
孤独症谱系障碍(autism spectrum disorders,ASD)是一类儿童发育障碍性疾病,发病率约为1/88,早期诊断面临极大挑战。较早期的研究提示ASD婴儿肌张力较低、活动少,而且有异常的姿势。Zappella等[13]回顾性地分析了18例婴儿出生到6个月的视频,其中10例婴儿后来确诊为ASD,8例婴儿在3岁时无孤独样行为,所有后来确诊为ASD的婴儿的GMs均为异常GMs,除1例婴儿外,暂时性孤独行为的儿童其婴儿期GMs均为正常GMs运动,提示对GMs异常儿童应密切观察婴儿的行为问题。
4.3 GMs与Rett综合征
Rett综合征(rett syndrome,RTT)是一种严重影响儿童精神运动发育的疾病,发病率为1/10 000~1/15 000。临床特征为女孩起病,呈进行性智力下降,孤独症行为,手的失用,刻板动作及共济失调。其病因及遗传方式尚不清楚。研究表明:RTT婴儿的运动表现为忽起忽停、不协调[14]。GMs在2个月内表现为PR,失去了多变性及复杂性;而在不安运动阶段,16例后来确诊的RTT婴儿期视频无一例为不安运动正常,全部表现为不安运动缺失或不正常不安运动,这提示RTT婴儿脑干的“中枢模式发生器”受累。
4.4 GMs与遗传代谢病及基因病
尽管唐氏综合征(down syndrome,DS)是最常见的引起智力障碍的染色体病,发病率为20/10 000~22/10 000,但是有关其早期发育的研究非常少。Herrero等[15]的对47名DS婴儿PMA50~59周的GMs视频多中心的研究结果表明:DS婴儿的不安运动有很大的异质性,GMs详细评分为13分(10~28分),明显低于正常发育儿童的26分,但是高于后来确诊为脑瘫的婴儿(6分)。DS婴儿14例视频显示正常不安运动,13例不安运动缺失,20例为不正常不安运动,运动速度过快或过慢。同时,观察到DS婴儿中线运动较少,且可见异常姿势。德朗热综合征是一种精神发育阻滞伴有多种先天畸形的,为常染色体显性遗传性疾病,发病率为0.6/100 000,常见基因变异为NIPBL基因突变。Marschik等[16]研究了1例患德朗热综合征的婴儿GMs,结果为异常GMs,推测GMs异常可能是基因变异产生婴儿怪异运动表现的根源。
4.5 GMs与儿童语言发育
大部分有关GMs的研究集中在中枢发育的预测价值上,而GMs与儿童语言的发育几乎无涉及。近期Salavati等[17]采用前瞻性、队列研究的方法,招募了62名足月儿、适于胎龄儿、单种语言的婴儿,最后有22例儿童完成了此项研究。分别记录婴儿3个月和5个月的GMs,并随访至4岁7个月和10岁5个月的语言发育。在3个月时,GMs正常的婴儿,在语言测试的两个时间点,儿童的语言表达能力非常好(betas 0.363和0.628);5个月GMs详细评分高的儿童,语言表达非常好;5个月的姿势模式与语言表达不良结局相关,提示GMs与儿童语言发育明显相关。
4.6 GMs与婴儿母子互动
虽然GMs是目前公认的评估婴儿神经系统发育的诊断工具,但是Lev-Enacab等[18]评估了39例早产儿(年龄14.59±2.21周)的GMs质量与他(她)们的母子互动质量的关系(包括母亲在婴儿运动模式、发声及眼睛接触的模式以及婴儿正向参与时母亲的敏感性),令人有趣的结果是婴儿GMs质量与婴儿运动模式、婴儿正向参与时母亲的敏感性相关,而与发声及眼睛接触的模式的母亲敏感性无关。婴儿GMs质量可以解释早产儿与母亲互动的可变性。
5总结与展望
GMs是一种经济、非侵入性的实用儿童神经发育测评工具。它不仅可以超早期地预测早产儿和小婴儿的神经发育结局特别是脑性瘫痪,而且可以预测学龄期儿童的认知、行为损害;不仅与儿童发育相关性疾病ASD、RTT相关,而且与儿童语言发育相关密切。但是,由于GMs遵循视觉Gestalt 知觉理论进行评估,常常会受到评估者的经验、疲劳以及重新校准等多种因素的影响,结果分析不易掌握[19],目前该技术尚未得到广泛推广应用。相信未来会有更多的医务人员掌握该项评估技术,造福儿童。
[1]Kostovic I, Sedmak G, Vukšic M,etal. The relevance of human fetal subplate zone for developmental neuropathology of neuronal migration disorders and cortical dysplasia[J]. CNS Neurosci Ther, 2015,12(2): 74-82.
[2]Schöpf V, Kasprian G, Brugger P C,etal. Watching the fetal brain at 'rest' [J]. Int J Dev Neurosci, 2012, 30(1):11-17.
[3]Hadders-Algra M. Neural substrate and clinical significance of general movements: an update[J]. Dev Med Child Neurol[J]. Dev Med Child Neurol,2018,60(1):39-46.
[4]Ferrari F, Todeschini A, Guidotti I,etal. General movements in full-term infants with perinatal asphyxia are related to basal ganglia and thalamic lesions[J]. J Pediatr,2011,158(6): 904-911.
[5]Novak I, Morgan C, Adde L,etal. Early, accurate diagnosis and early intervention in cerebral palsy: advances in diagnosis and treatment[J]. JAMA Pediatr,2017,171(9):897-907.
[6]Peyton C, Yang E, Msall M E,etal. White matter injury and general movements in high-risk preterm infants[J]. Am J Neuroradiol,2017,38(1):162-169.
[7]Datta A N, Furrer M A, Bernhardt I,etal. Fidgety movements in infants born very preterm: predictive value for cerebral palsy in a clinical multicentre setting[J]. Dev Med Child Neurol, 2017,59(6):618-624.
[8] Brogna C, Romeo D M, Cervesi C,etal. Prognostic value of the qualitative assessments of general movements in late-preterm infants[J]. Early Hum Dev, 2013,89(12):1063-1066.
[9]Ma L, Yang B, Meng L,etal. Effect of early intervention on premature infants’ general movements[J].Brain Dev, 2015,37(4):387-393.
[10]Soleimani F, Badv R S, Momayezi A,etal. General movements as a predictive tool of the neurological outcome in term born infants with hypoxic ischemic encephalopathy[J]. Early Hum Dev,2015, 91(8):479-482.
[11]Bennema A N, Schendelaar P, Seggers J,etal. Predictive value of general movements' quality in low-risk infants for minor neurological dysfunction and behavioural problems at preschool age [J]. Early Hum Dev,2016,94:19-24.
[12]Hamer E G, Bos A F, Hadders-Algra M. Specific characteristics of abnormal general movements are associated with functional outcome at school age[J]. Early Hum Dev, 2016,95:9-13.
[13]Zappella M, Einspieler C, Bartl-Pokorny K D,etal. What do home videos tell us about early motor and socio-communicative behaviours in children with autistic features during the second year of life-an exploratory study[J]. Early Hum Dev, 2015,91(10):569-575.
[14]Einspieler C, Freilinger M, Marschik P B. Behavioural biomarkers of typical Rett syndrome: moving towards early identification[J]. Wien Med Wochenschr, 2016,166(11-12):333-337.
[15] Herrero D, Einspieler C, Panvequio Aizawa C Y,etal. The motor repertoire in 3- to 5-month old infants with Down syndrome[J]. Res Dev Disabil, 2017,67:1-8.
[16] Marschik P B, Soloveichick M, Windpassinger C,etal. General movements in genetic disorders: A first look into Cornelia de Lange syndrome[J]. Dev Neurorehabil, 2015,18(4):280-282.
[17]Salavati S, Einspieler C, Vagelli G,etal. The association between the early motor repertoire and language development in term children born after normal pregnancy[J]. Early Hum Dev, 2017,111:30-35.
[18]Lev-Enacab O, Sher-Censor E, Einspieler C,etal. The quality of spontaneous movements of preterm infants: associations with the quality of mother-infant interaction[J].Infancy, 2015,20(6): 634-660.
[19]帖利军,岳婕,吕敏,等.婴儿全身运动质量评估的重测信度研究[J].中国妇幼健康研究,2017,28(12):1525-1528.
[专业责任编辑:古桂雄]
