基质金属蛋白酶检测在非小细胞肺癌中的意义*
2018-03-30杨军峰
赵 璞,杨军峰,何 苡
(河南省人民医院胸外科一区,郑州 450000)
肺部肿瘤是目前危害人类生命健康的重要病因之一,会产生巨大的医疗负担和经济压力。随着人口老龄化程度加剧及空气质量的不断恶化,肺癌发病率呈现逐年上升趋势,目前已与肝癌、消化系统肿瘤共同成为城市居民死亡的重要病因[1]。癌症细胞的局部浸润和远处转移是肿瘤危害人体健康的主要手段,目前研究证实基质金属蛋白酶(MMP)-2,-9,-14及调控MMP家族相关蛋白的信号素3A和FoxM1对肿瘤的局部浸润和远端转移有明确的调控作用[2]。本研究将应用免疫组织化学技术,对非小细胞肺癌(NSCLC)患者手术切除的癌症组织中MMP-9和MMP-14的表达水平进行检测,同时对患者进行为期5年的临床随访,探讨MMP-9和MMP-14表达水平和患者预后的相关性,现报道如下。
1 资料方法
1.1一般资料 收集2010年6月16日至2011年8月9日于本院胸外科癌症病房,接受肺癌根治性手术治疗的NSCLC患者84例,纳入患者均未接受术前放化疗治疗,其中男61例,女23例;年龄55~79岁;手术标本经病理切片认定为NSCLC,其中鳞状细胞癌53例,腺癌29例,大细胞癌2例;结合薄层高分辨率CT诊断,并根据国际抗癌联盟(UICC)制订的第8版肺癌TNM分期标准[3]:本研究纳入患者中T1a期15例,T1b期22例,T1c期15例,T2a期16例,T2b期7例,T3期7例,T4期2例;N0期68例,N1期12例,N2期4例,M0期84例;TNM分期ⅠA期41例,ⅠB期15例,ⅡA期5例,ⅡB期16例,ⅢA期7例。免疫组织化学检测用兔抗人MMP-9和MMP-14多克隆抗体购置于Sigmaaldrich公司,免疫组织化学试剂盒购置于武汉谷歌生物技术有限公司。
1.2方法
1.2.1病理标本采集 患者行薄层高分辨率CT检查确定病变部位及病变分期,待术前检查完善,一般情况稳定后行肺癌根治性手术治疗。完整切除病变后取10%切缘组织进行术中冰冻病理切片检查,取10%癌组织甲醛固定,常规进行石蜡包埋处理以备后续实验,剩余组织于液氮中保存。另收集良性肺部病变接受手术切除组织作为阴性对照,收集病例分型为鳞癌和腺癌的胃癌标本作为阳性对照。患者术后常规接受化疗,每半年随访一次并复查CT,记录手术至死亡时间,计算生存率。本研究纳入患者全部签署知情同意书,治疗过程依从性良好,无患者失访。
1.2.2实验方法 根据免疫组织化学试剂盒相关说明,并结合文献[4]进行操作,癌症组织经石蜡包埋后以4 μmol/L厚度连续切片,常规进行脱蜡、脱水后,用枸橼酸进行抗原修复5 min,用3%甲醇过氧化氢液阻断20 min。兔抗人MMP-9和兔抗人MMP-14多克隆抗体1∶200稀释,一抗37 ℃孵育60 min,二抗37 ℃孵育30 min,二氨及联苯胺(DAB)显色、苏木素复染并用透明树胶封片。阴性对照及阳性对照组织采用相同处理。
1.2.3判定标准 抗原抗体相结合将产生棕黄色颗粒状免疫复合物定义为阳性产物。于高倍镜下观察细胞,可见阳性产物多聚集于细胞表面或细胞质内,较少见于细胞核。根据每个细胞中的阳性产物的染色强度及出现范围确定阳性细胞,当400倍镜若干视野中,每200个细胞中阳性细胞数量大于50个,即阳性肿瘤细胞数大于25%时,记为该组织中MMP-9或MMP-14呈阳性表达。
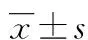
2 结 果
2.1MMP-9与MMP-14表达与患者性别和病理分型的关系 在性别方面,MMP-9与MMP-14表达差异无统计学意义。MMP-9和MMP-14阳性表达率与组织分型无关,见表1。
2.2MMP-9表达与癌细胞TNM分期的相关性 在T2和T3~4期与T1期细胞中MMP-9表达量对比差异有统计学意义;N0组中MMP-9阳性率(48.5%)明显低于N1~3期阳性率(87.5%); MMP-9在Ⅱ期和Ⅲ期细胞中表达量也明显较Ⅰ期细胞高。在TNM分期的组间对比中,MMP-14差异无统计学意义。MMP-14与细胞N分期不具有相关性,见表2。
2.3MMP-9与癌症复发及生存率的相关性 5年内癌症复发患者MMP-9阳性率明显高于未复发患者;MMP-14的表达差异在患者5年内复发方面差异有统计学意义;在复发患者MMP-14阳性率明显高于未复发患者,在出现转移病灶患者中高达100%,且MMP-14表达率与患者5年生存率无相关性,MMP-9与癌症复发及生存率有相关性,见表3。
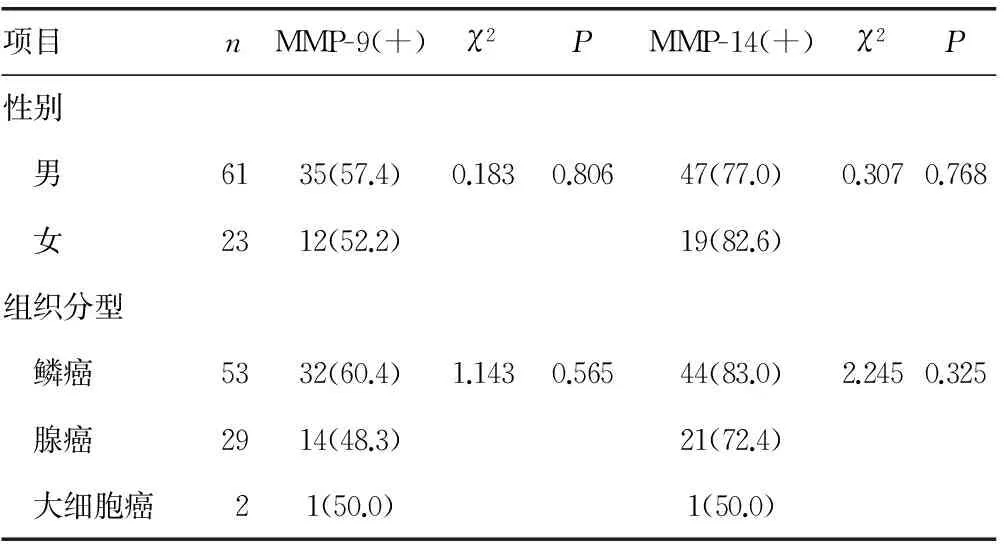
表1 MMP-9及MMP-14蛋白表达与患者性别及组织分型的关系[n(%)]
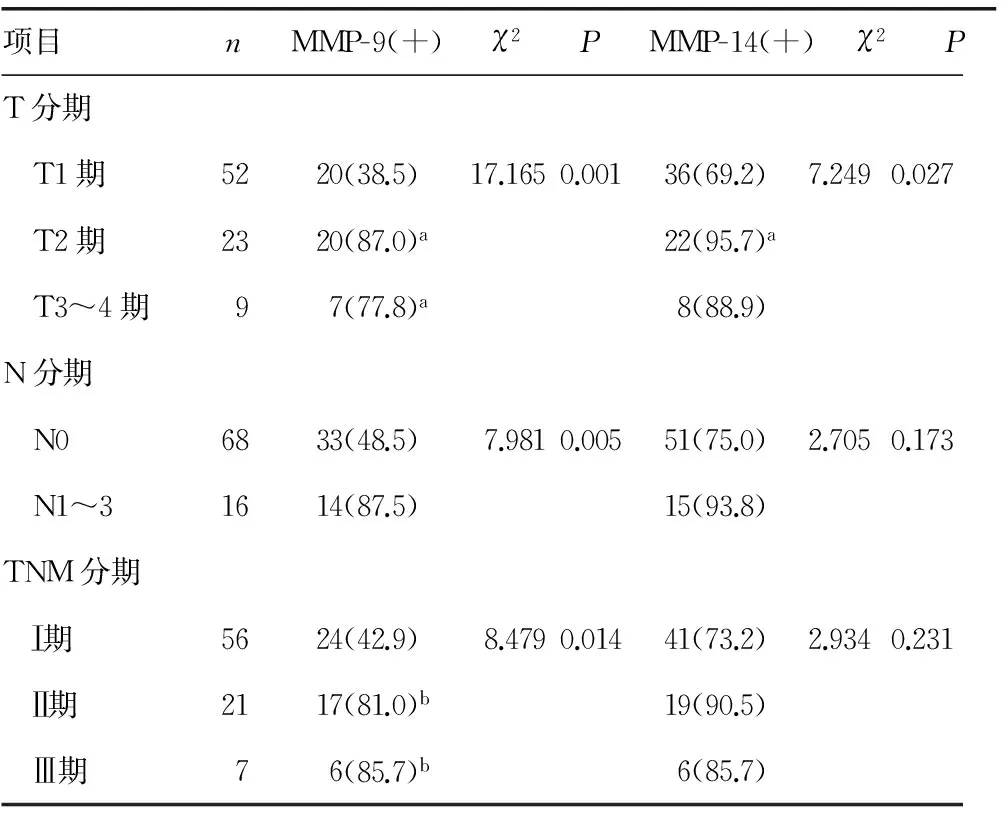
表2 MMP-9及MMP-14蛋白表达与TNM分期的关系[n(%)]
a:P<0.05,与T1期比较;b:P<0.05,与Ⅰ期比较
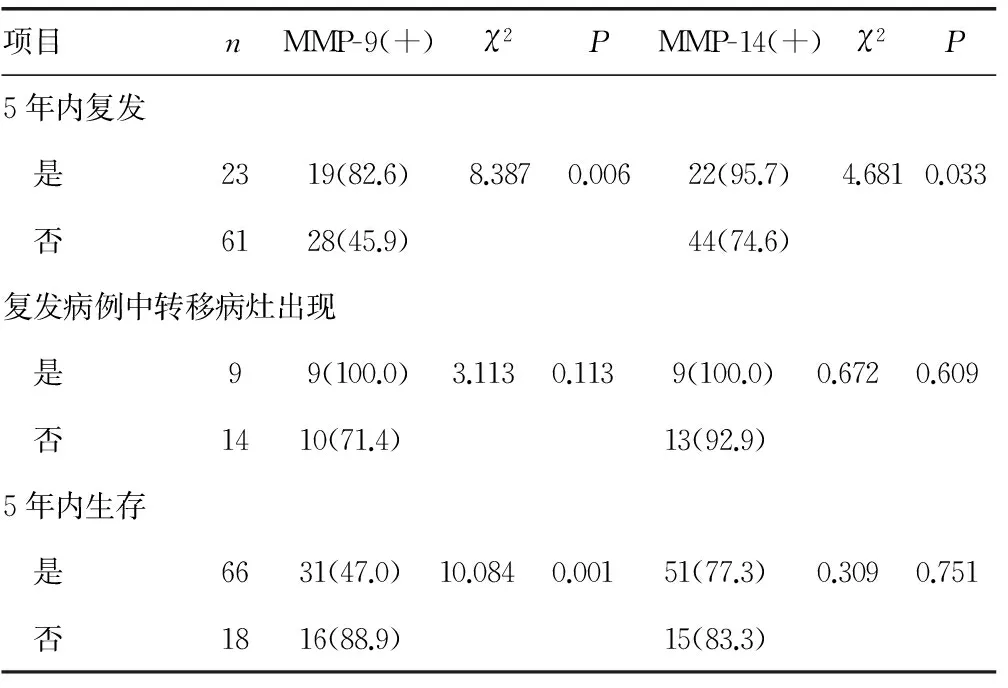
表3 MMP-9及MMP-14蛋白表达与癌症复发及患者生存率的关系[n(%)]
3 讨 论
基质金属蛋白酶家族(MMPs)目前已经分离鉴定出26种亚型,分为胶原酶、活化型MMP、分泌性MMP、明胶酶、基质降解素和基质溶解素6大类[5],MMP-9属于金属蛋白酶家族中明胶酶,该家族蛋白在保持生物活性时需要锌离子的存在,同时钙离子也可以有效维持其稳定性,因该蛋白需要金属离子的辅助作用而得名。该蛋白家族内部结构相似,主要由5个不同的功能结构域组成,包括疏水信号肽区、前肽区、催化活性区、铰链区和羟基末端,其中前肽区是MMP蛋白酶原被外源性切酶激活的主要位点,而催化活性区则具有高度的保守性。MMP家族成员虽然在基础结构方面有较大差异,但都以细胞外基质为主要消化底物,同一种MMP对多种细胞外基质有效,但酶解效率有较大差异,因该蛋白具有降解细胞外基质蛋白的功能,能够有效破坏癌症细胞浸润和远端转移的组织屏障,因此在肿瘤的侵袭中起到了至关重要的作用。
细胞外基质(ECM)是存在于细胞外,主要维持细胞正常生理活性,由胶原和蛋白聚糖等生物大分子构成的网络框架,这些大分子通过细胞表面的特异性受体,与细胞骨架相连接,参与细胞生理活动。MMP-9因属于明胶酶,对细胞外基质中明胶,Ⅳ和Ⅴ型胶原蛋白极强的水解作用,MMP-14则属于Ⅳ膜型MMPs蛋白,主要的水解产物是酶原型MMP-2,可以有效激活细胞表面MMP-2蛋白,MMP-2属于Ⅱ型明胶原酶,对Ⅰ、Ⅳ、Ⅴ型胶原蛋白和弹性蛋白有强烈的水解作用[6]。总而言之,MMP-9和MMP-14的激活,对细胞外基质可以产生严重的破坏作用,损伤正常组织对肿瘤的屏障功能,是癌症细胞侵袭力增加,导致肿瘤组织转移的重要因素。有研究显示,乳腺癌细胞脑转移与MMP-2和MMP-9表达增高有关,肺癌的局部浸润与MMPs表达增高也有明显相关性[7]。在本研究中也发现,MMP-14在T2期癌细胞中表达的阳性率为95.7%,明显高于T1组细胞,可以说肿瘤细胞的大小与MMP-14 表达有明显相关性,但与癌症细胞是否出现淋巴结转移则无明显统计学相关性,可以说明,MMP-14主要激活MMP-2,增强了对局部组织的破坏程度,更有利于肿瘤组织的局部侵害性[8]。但由于大细胞癌比例较小,仍需要大样本研究证实该结果。
MMPs表达升高有利于肿瘤侵袭和转移的另一个重要原因是,MMPs对细胞外基质进行降解的同时,有效清除了血管内皮细胞向正常组织中浸润的有效屏障,而血管生成则是肿瘤细胞快速生长,向远端组织侵袭并定植的主要推动者[9-11]。在本研究中发现,MMP-9的表达,与肿瘤的T分期有明显相关性,T2期和T3~4期的肿瘤组织中表达明显高于T1期肿瘤组织,且淋巴结转移患者的肺癌组织中,MMP-9表达也明显升高,术后5年内复发的患者中,11例出现了远端转移的新病灶,而组织张MMP-9表达阳性率明显增高,也说明MMP-9对细胞外基质的破坏作用。MMP-9和MMP-14的表达增高对患者的预后也有判断价值,5年内复发的23例病例中,MMP-9阳性率为82.6%,MMP-14阳性率为95.7%,都明显高于未复发患者中的表达,而出现远端病灶的患者中,MMP-9和MMP-14表达阳性率高达100.0%,尽管与未出现MMP-9和MMP-14阳性表达的患者比例差异无统计学意义,但也高于其71.4%和92.9%的比例,可以说,MMP-9与MMP-14对非小细胞肺癌患者的预后预测有临床意义[12]。
MMPs活性受金属基质蛋白酶组织抑制因子(TIMPs)的抑制作用,但由于其体外提纯难度较大和体内合成有收到多种蛋白信号通路调控,作为药物用于临床抑制癌症侵袭仍有较大难度[13]。目前已知的具有抑制MMPs生物功能的物质有长链不饱和脂肪酸,其长链结构对MMP-2与纤维蛋白原结合域有干扰作用;多酚和黄酮类化合物也对MMP-2,-7,-9和-14抑制作用明显,并可以参与细胞信号转导,调控细胞迁移能力,其中具有代表性的就是咖啡酸,一种广泛存在于橄榄油、咖啡、水果和蔬菜中的多酚类化合物[14-15]。健康丰富的饮食习惯也可以从一定程度上预防癌症的发生和进展。
[1]许红,毛德强,王燕.重庆市女性肿瘤发病率及年龄特征分析[J].重庆医学,2010,39(11):1422-1423,1447.
[2]周海英,吴爱萍,李岩,等.信号素3A和基质金属蛋白酶-14在非小细胞肺癌中的表达及意义[J].中华胸心血管外科杂志,2014,30(9):550-553.
[3]杨龙海,叶波,魏星,等.最新国际肺癌TNM分期标准[J].中国医刊,2016,51(9):22-25.
[4]张新宇,王绍清.叉头盒蛋白M1和基质金属蛋白酶-2在非小细胞肺癌中的表达及意义[J].中国老年学杂志,2014(11):2922-2924.
[5]李雯,常颖,李星,等.基质金属蛋白酶降解胞外基质致未足月胎膜早破研究进展[J].国际妇产科学杂志,2016,43(1):8-10.
[6]庄培涛.基质金属蛋白家族中明胶酶在原发性肝癌诊断与治疗中的研究进展[J].临床普外科电子杂志,2015,3(2):49-54.
[7]张卫强,林华,周勇安,等.基质金属蛋白酶-2和基质金属蛋白酶-9在非小细胞肺癌组织中的表达及临床意义[J].中国现代医学杂志,2006,16(6):833-835,839.
[8]舒筱灿,王喜梅,王蕾.基质金属蛋白酶及其抑制物与肿瘤转移研究进展[J].医学研究杂志,2009,38(11):113-114.
[9]房学迅,杨金刚,史秀娟.来源于天然产物的基质金属蛋白酶(MMPs)抑制剂[J].化学进展,2007,19(12):1991-1998.
[10]高锋,冯一中.COX-2、MMP-9和CD31在非小细胞肺癌的表达及其意义[J].江苏医药,2014,40(9):1067-1070.
[11]刘芳,诸兰艳.脂联素在非小细胞肺癌组织中的表达及其与基质金属蛋白酶-9和肿瘤血管生成的关系[J].中南大学学报(医学版),2015,40(6):579-584.
[12]梁乃超,万晓年.基质金属蛋白酶MMP-9、TIMP-1及VEGF的表达情况与非小细胞肺癌组织侵袭的相关性[J].昆明医科大学学报,2016,37(10):67-70.
[13]余雪君,刘欣艳,李彩荣,等.血管内皮细胞生长因子、基质金属蛋白酶-2和基质金属蛋白酶抑制因子-2在非小细胞肺癌中的表达及意义[J].中国医药导报,2017,14(8):107-110.
[14]王鑫,邢国宏.核心蛋白聚糖、基质金属蛋白酶-2在非小细胞肺癌的表达及其与临床特征的关系[J].临床内科杂志,2015,32(1):20-22.
[15]罗磊,王永坤,李世康.香芹酚诱导非小细胞肺癌1299细胞凋亡的实验研究[J].天津医药,2016,44(12):1418-1422.
