胃癌患者外周血常规指标与肿瘤淋巴结转移关系分析*
2018-03-30邓显伦冯立波徐建伟向继勇
邓显伦,冯立波,徐建伟,向继勇,夏 冬△
(1.西南医科大学附属医院普外科,四川泸州 646000;2.中江县人民医院普外科,四川德阳 618100)
胃癌仍是我国最常见的恶性肿瘤之一,近年来发病率呈上升趋势[1]。淋巴结转移是影响胃癌患者预后及选择治疗方式的重要因素[2]。对于无淋巴结转移的患者,过度的淋巴结清扫,不仅增加了手术的创伤也降低了患者术后的生存质量。因此如何在术前预测是否存在淋巴结转移具有重要的临床意义。国内外有大量研究证实一些临床上常用的血常规指标如中性粒细胞/淋巴细胞比值(NLR)、血小板/淋巴细胞比值(PLR)等在胃癌患者明显升高且与预后相关[3-4]。提示血常规指标可能与胃癌淋巴结转移相关。故本研究回顾性全面分析了血常规指标与胃癌淋巴结转移的关系,探讨这些指标对胃癌淋巴结转移的预测价值。
1 资料与方法
1.1一般资料 收集2014年7月至2016年4月于西南医科大学附属医院普外科及中江县人民医院普外科住院的胃癌患者。所有入组患者均经手术治疗,并且由病理组织学检查明确诊断为原发性胃癌。排除标准:(1)近2个月内有活动性出血或者输注血制品;(2)近2个月内接受过抗血小板治疗、抗凝治疗、升白细胞治疗、升红细胞治疗;(3)合并严重感染;(4)伴发甲状腺功能亢进或减退、结缔组织病等影响血液系统的疾病;(5)伴有严重心、肝、肾等其他器官障碍。本研究为回顾性分析。最终入组病例共315例,其中男197例,女118例;平均年龄(55.37±10.07)岁。所有患者均进行标准的D2胃癌根治性切除术,术中所有患者淋巴结清扫数量不少于15枚。清扫淋巴结进行HE染色,由病理科医生判断是否有淋巴结转移。按照第13版日本《胃癌处理规约》标准判断患者淋巴结转移情况。根据是否发生淋巴结转移,将患者分为转移组(n=231)和非转移组(n=84)。 转移组男143例,女88例,平均年龄(58.82±11.13)岁,非转移组男54例,女30例,平均年龄(52.59±13.47)岁。
1.2方法 收集患者临床资料,包括年龄、性别、肿瘤组织学分化程度、病理类型、发病部位等。术前清晨空腹采集患者外周静脉血2 mL, 乙二胺四乙酸二钾(EDTA-K2)抗凝,采用SYSMEX XE-2000血液细胞分析仪检测白细胞计数(WBC)、中性粒细胞计数(NE)、淋巴细胞计数(LY)、红细胞计数(RBC)、血红蛋白(Hb)水平和血小板计数(PLT)。计算NLR和PLR。
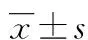
2 结 果
2.1两组患者人口学及临床特征 转移组年龄(P=0.032)、低分化及未分化水平(P=0.019)、肿瘤浸润深度(P=0.001)均高于非转移组,肿瘤发生部位在两组间差异无统计学意义(P=0.796),见表1。
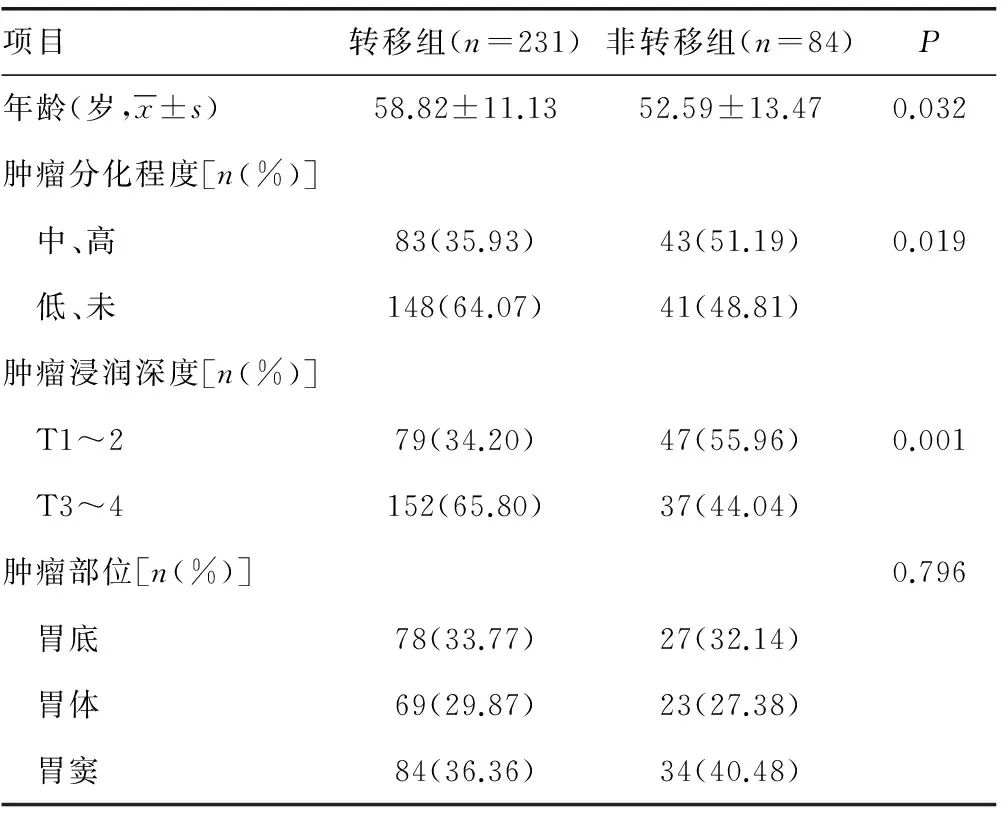
表1 两组患者人口学及临床特征比较
2.2转移组淋巴结转移情况 有淋巴结转移的231例胃癌患者中,发生第1站淋巴结转移126 例,第1站淋巴结转移以胃小弯淋巴结和胃短血管、胃网膜淋巴结转移频次最高,发生第2站淋巴结转移105 例,第2站淋巴结转移以胃左动脉淋巴结和肝总动脉前、后淋巴结转移频次最高。本文纳入分析所有患者均未清扫第3站淋巴结。见表2。
2.3两组患者血常规指标的比较 与非转移组患者比较,转移组患者WBC、NE、PLT、NLR及PLR均升高(P<0.05)。LY、RBC及Hb水平及在两组间差异无统计学意义(P>0.05),见表3。
2.4血常规指标与肿瘤淋巴结转移的关系 将上述两组间差异有统计学意义的指标一起进行多因素Logistic 回归分析,结果表明术前NLR(P=0.002,OR=3.681)和PLT计数(P=0.014,OR=0.841)是胃癌患者发生肿瘤转移的独立预测因素,见表4。
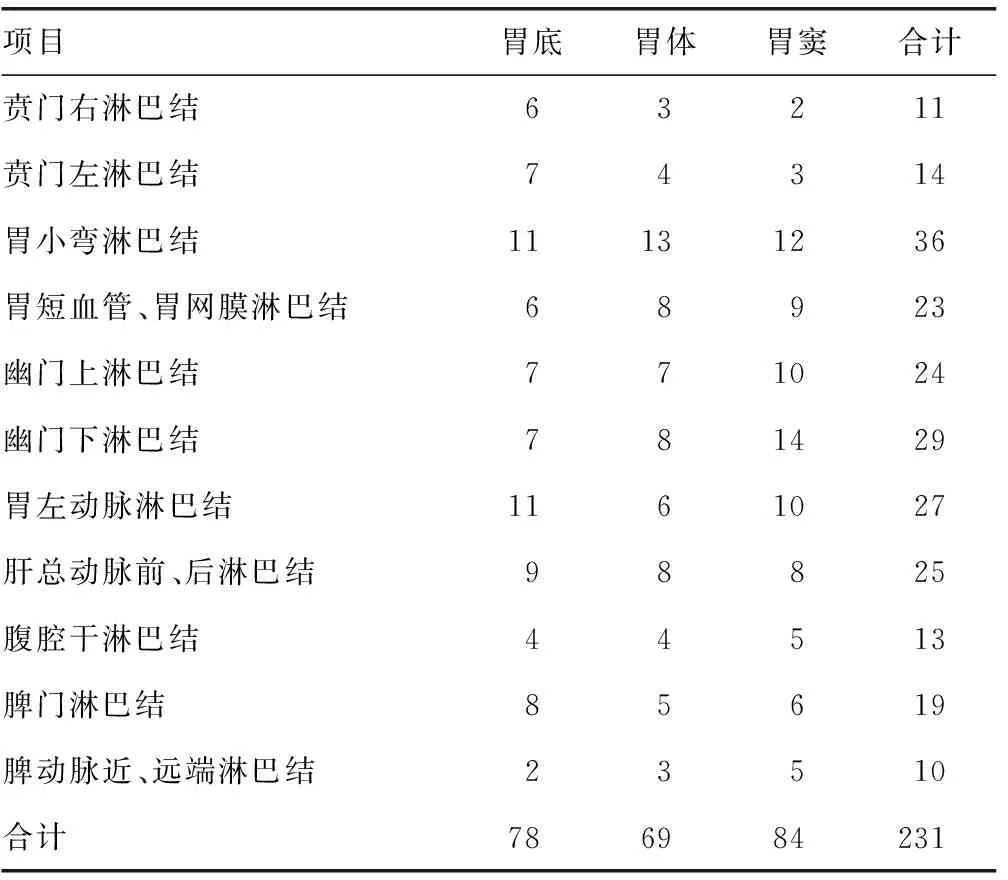
表2 转移组患者淋巴结转移情况(n)
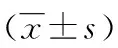
表3 两组患者血常规指标比较

表4 胃癌患者血常规指标与淋巴结转移多因素Logistic 回归分析结果
3 讨 论
胃癌是全球最常见的消化道恶性肿瘤,在导致癌症相关性死亡疾病中排第3位[5]。近年来我国胃癌发病率呈上升趋势,城乡居民胃癌发病率为36.21/10万[1]。大多数胃癌患者可出现淋巴转移、血源转移和直接侵袭等转移,其中淋巴结转移是胃癌最常见的转移方式,可明显影响治疗方式的选择、疗效和预后[6]。而且近年来对于早期胃癌患者,内镜下黏膜剥离术(ESD)和内镜下黏膜切除术(EMR)日渐受到关注[7]。但对于存在淋巴结转移的患者,这种微创手术存在复发风险,影响治疗效果。故准确预测胃癌患者是否存在淋巴结转移在目前日益重要。
近年来,炎症和恶性肿瘤的关系逐渐被阐明。恶性肿瘤的表型异常及肿瘤引起的组织破坏可以引起广泛的炎性反应,刺激炎细胞浸润,故而恶性肿瘤患者,尤其是晚期肿瘤患者常常表现出NE增高,淋巴细胞相对减少[8]。恶性肿瘤也可以通过诱导促血板生成素(TPO)增加,产生IL-1等血小板激活物、释放组织因子启动外源性凝血系统等机制激活并诱导血小板聚集,从而在外周血中表现出血小板增加[9]。本研究发现,与非转移组患者比较,转移组患者WBC、NE、PLT、NLR和PLR均显著升高。提示发生淋巴结转移的胃癌患者对机体具有更强的侵袭能力,刺激较多的炎症间质产生,从而引起NE、PLT等的增高。在本研究中转移组患者和非转移组患者间淋巴细胞计数无明显差异,提示在淋巴结转移的胃癌患者淋巴细胞只是相对减少。
恶性肿瘤的侵袭及转移与肿瘤微环境密切相关,肿瘤微环境中的炎性细胞可以通过释放炎症介质介导细胞损伤、DNA突变等,改变肿瘤微环境,促进肿瘤细胞的增殖、侵袭、迁移及血管生成[10]。NE是循环中血管内皮细胞生长因子(VEGF) 的主要来源,VEGF是强烈的促进胃癌血管及淋巴管新生的因子[11]。NE升高导致VEGF表达增加,进而有利于促进胃癌细胞经淋巴管转移。胃癌患者中性粒细胞的升高导致NLR升高,NLR可以更好地反映肿瘤患者体内炎症和免疫状态,NLR升高提示胃癌患者体内炎性反应增强,而抑制肿瘤能力相对低下。多项研究表明NLR是胰腺癌、肺癌、结直肠癌、乳腺癌等多种肿瘤的独立预后因素[12-13]。李书梅等[3]发现外周血NLR在胃癌患者显著升高,可能是影响胃癌患者预后的独立因素。本研究的研究表明术前NLR是胃癌患者发生肿瘤转移的独立预测因素。提示术前NLR可以用于协助判断胃癌患者是否存在淋巴结转移。
本研究发现转移组胃癌患者PLT计数较非转移组患者明显升高,且血小板计数是胃癌患者发生肿瘤转移的独立预测因素。近年来研究发现PLT在食管癌、结直肠癌、肺癌、肝癌等多种实体肿瘤中增高,并且是判断癌症预后的一个重要参考指标。沈淑蓉等[14]也证实在胃癌患者存在继发性PLT增多,且与肿瘤直径、浸润深度、分期有关,PLT增多可以作为胃癌患者预后不良的参考指标。PLT可释放转化生长因子(TGF)、血小板衍化生长因子(PDGF)等[15],上述因子均可直接刺激肿瘤细胞生长。此外,PLT还可与纤维蛋白一起包裹肿瘤细胞,保护肿瘤细胞免予机体的免疫清除。血小板也可表达血管假性血友病因子、选择素等多种黏附分子,这协助肿瘤细胞黏附于血管、淋巴管内皮形成癌栓[16]。故在胃癌患者PLT增加可以促进胃癌细胞的生长、增加淋巴结转移的风险。
本研究表明术前NLR和PLT升高是胃癌患者发生肿瘤转移的独立预测因素。NLR和PLT是临床上最常用的指标,廉价且易于获得。故可方便地用于帮助临床医生术前判断是否存在淋巴结转移。
[1]陈万青,张思维,郑荣存,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤,2013,22(1):7-8.
[2]AJANI J A,D′AMICO T A,ALMHANNA K,et al.Gastric cancer,version 3.2016,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2016,14(10):1286-1312.
[3]李书梅,徐小莉,梁迪,等.外周血中性粒细胞与淋巴细胞比值以及血小板与淋巴细胞比值评估胃癌患者预后的价值[J].中华肿瘤杂志,2014,36(12):910-915.
[4]XU Z,XU W,CHENG H,et al.The prognostic role of the platelet-lymphocytes ratio in gastric cancer:A Meta-analysis[J].PLoS One,2016,11(9):e0163719.
[5]THRUMURTHY S G,CHAUDRY M A,HOCHHAUSER D,et al.The diagnosis and management of gastric cancer[J].BMJ,2013,4:347.
[6]ZHAO B W,CHEN Y M,JIANG S S,et al.Lymph node metastasis,a unique independent prognostic factor in early gastric cancer [J].PLoS One,2015,10(7):e0129531.
[7]OMAE M,FUJISAKI J,HORIUCHI Y,et al.Safety,efficacy,and long term outcomes for endoscopic submueosal dissection of early esophagogastric junction cancer [J].Gastric Cancer,2013,16(2):147-154.
[8]KAO S C,PAVLAKIS N,HARVIE R,et al.High blood neutrophil-to-lymphocyte ratio is an indicat or of poor prognosis in malignant mesothelioma patients undergoin systemic therapy[J].Clin Cancer Res,2010,16(23):5805-5813.
[9]GOUBRAN H A,STAKIW J,RADOSEVIC M,et al.Platelet-cancer interactions[J].Semin Thromb Hemost,2014,40(3):296-305.
[10]LJ G,WANG Z,YE J,et a1.Uncontrolled inflammation induced by AEG-1 promotes gastric cancer and poor prognosis [J].Cancer Res,2014,74(19):5541-5552.
[11]RAPISARDA A,MELILLO G.Role of the VEGF/VEGFR axis in cancer biology and therapy[J].Adv Cancer Res,2012,114:237-267.
[12]ASAOKA T,MIYAMOTO A,MAEDA S,et al.Prognostic impact of preoperative NLR and CA19-9 in pancreatic cancer[J].Pancreatology,2016,16(3):434-440.
[13]ZHANG H,ZHANG L,ZHU K,et al.Prognostic significance of combination of preoperative platelet count and neutrophil-lymphocyte ratio(COP-NLR) in patients with non-small cell lung cancer:based on a Large Cohort Study[J].PLoS One,2015,10(5):e0126496.
[14]沈淑蓉,郑文球,黄颖鹏,等.胃癌伴继发性血小板增多症患者的临床病理特征和生存分析[J].肿瘤学杂志,2014,20(10):823-828.
[15]HUANG F,WANG M,YANG T,et al.Gastric cancer-derived MSC-secreted PDGF-DD promotes gastric cancer progression[J].J Cancer Res Clin Oncol,2014,140(11):1835-1848.
[16]ULGER Z,AKSU S,AKSOY D Y,et al.The adhesion molecules of L-selectin and ICAM-1 in thrombocytosis and thrombocytopenia[J].Platelets,2010,21(1):49-52.
