阿瑞匹坦治疗顺铂方案化疗引起的呕吐临床分析*
2018-03-30姚二华郑银燕林连兴黄河澄吴发胜刘嘉毅
姚二华,郑银燕,林连兴△,黄河澄,梁 平,吴发胜,刘嘉毅
(1.中山大学附属汕头医院/汕头市中心医院肿瘤放疗科,广东汕头 515031;2.中山大学附属汕头医院预防保健科,广东汕头 515031;3.广西中医药大学附属瑞康医院肿瘤放疗科,广西南宁 530011)
化疗相关性恶心和呕吐是肿瘤患者在化疗过程中一种常见的不良反应,临床应用表明顺铂属于高度致吐化疗药,其所引起的胃肠道反应恶心呕吐发生率高,导致患者对化疗的依从性下降。常规采用5-HT3受体拮抗剂联合应用糖皮质激素用于化疗止呕后疗效显著,但仍有一部分化疗患者恶心、呕吐难以控制,需要加强止吐治疗,阿瑞匹坦是首个神经激肽1(neurokinin-1,NK-1)受体拮抗剂,通过中枢机制抑制化疗引起的恶心、呕吐[1],其作用机制与5-HT3受体拮抗剂不同,已有研究显示阿瑞匹坦联合5-HT3受体拮抗剂和地塞米松三联止呕疗效显著[2],但阿瑞匹坦用于止吐和5-HT3受体拮抗剂的比较的研究亦较少,本研究对比了阿瑞匹坦和格拉司琼的疗效,现报道如下。
1 资料与方法
1.1一般资料 选取中山大学附属汕头医院/汕头市中心医院 2014年12月1日至2016年12月1日收治的恶性肿瘤患者,均采用以顺铂为基础的化疗,联合低催吐风险的紫杉醇或者5-Fu,化疗第1天常规采用格拉司琼联合应用糖皮质激素止吐,每日1次,当每日呕吐次数为3次及以上时采用进一步止吐策略,入组共61例,按随机数字表法分为阿瑞匹坦组30例,年龄33~76岁,格拉司琼组31例,年龄34~74岁,见表1。纳入标准:(1)经病理学确诊为恶性肿瘤,具体病理类型不作要求;(2)年龄在19~70岁;(3)美国东部肿瘤协作组体力状态评分(ECOG)≤2分;(4)预计生存期大于3个月;(5)首程化疗的患者,并且采用顺铂为基础的方案,联合低催吐风险的紫杉醇或5-FU;(6)在化疗期间单日呕吐次数在3次及以上,同意采用进一步呕吐措施;(7)化疗前血常规、肝肾功能、电解质、心电图等检查无明显异常;(8)化疗前1周无恶心、呕吐,未应用任何止吐药物;(9)患者知情,并签署同意书。排除标准:(1)伴有严重的心、脑、消化道疾病及脑转移的患者;(2)化疗前1周有应用苯二氮卓等镇静剂、糖皮质激素或胃肠动力药物的患者;(3)化疗前存在恶心呕吐的患者。
1.2方法
1.2.1治疗方法 所有患者均采用以顺铂(80 mg/m2,分3 d用完,江苏豪森)为基础的化疗,联合低催吐风险的紫杉醇(135 mg/m2,山东鲁抗辰欣)或者5-Fu(首次静脉推注500 mg,持续400 mg·m-2·d-1泵入,连用5 d,吉林万通),化疗第1天采用格拉司琼(3 mg,中国医药集团)联合应用糖皮质激素(地塞米松5 mg,天津药业焦作)止吐,每日1次,当每日呕吐次数为3次及以上时采用进一步止吐策略,阿瑞匹坦组采用阿瑞匹坦(意美,澳大利亚)口服,首日125 mg第1日,80 mg第2、3日,联合地塞米松5 mg静脉滴注,每日1次,格拉司琼组3 mg 第1、2、3日联合地塞米松5 mg静脉滴注,每日1次,从应用开始记录患者小于24 h、24~72 h、>72~144 h临床反应。对于采用阿瑞匹坦或格拉司琼进一步呕吐后144 h仍有呕吐的患者,考虑加用多巴胺受体拮抗剂和(或)镇静治疗,避免将来出现预期性呕吐和难治性呕吐,加重后续化疗的困难。
1.2.2疗效评价 参照国际肿瘤化疗药物不良反应评价系统(CTCAE)4.03版,定义恶心:以反胃和(或)急需呕吐为特征的状态。分为5个等级。程度分级,0级:无恶心;Ⅰ级:食欲下降,不伴进食习惯改变;Ⅱ级:经口摄食减少不伴明显体质量下降、脱水或营养不良;Ⅲ级:经口摄食能量和水分不足,需要鼻饲,全肠外营养或住院。呕吐定义为:胃内容物经口吐出的反射动作。程度分级,0级:24 h内无呕吐;Ⅰ级:24 h内1~2次发作,间隔5 min;Ⅱ级:24 h内发作3~5次;Ⅲ级:24 h发作大于或等于6次,间隔5 min;Ⅳ级:危及生命,需要紧急治疗;Ⅴ级:死亡。完全有效(CR)定义为恶心、呕吐 0级(无恶心、呕吐),进一步止吐措施后恶心呕吐持续时间定义为采用阿瑞匹坦或格拉司琼联合地塞米松挽救性治疗后患者在144 h内存在大于或等于Ⅰ级恶心、呕吐反应的时间总和。
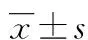
2 结 果
2.1止吐效果 <24 h、24~72 h、>72~144 h比较见表2。<24 h阿瑞匹坦组与格拉司琼组的CR率,差异无统计学意义(P=0.232);24~72 h CR率阿瑞匹坦组显著优于格拉司琼组(P=0.036)。>72~144 h CR率阿瑞匹坦组优于格拉司琼组(P=0.045),见表2。
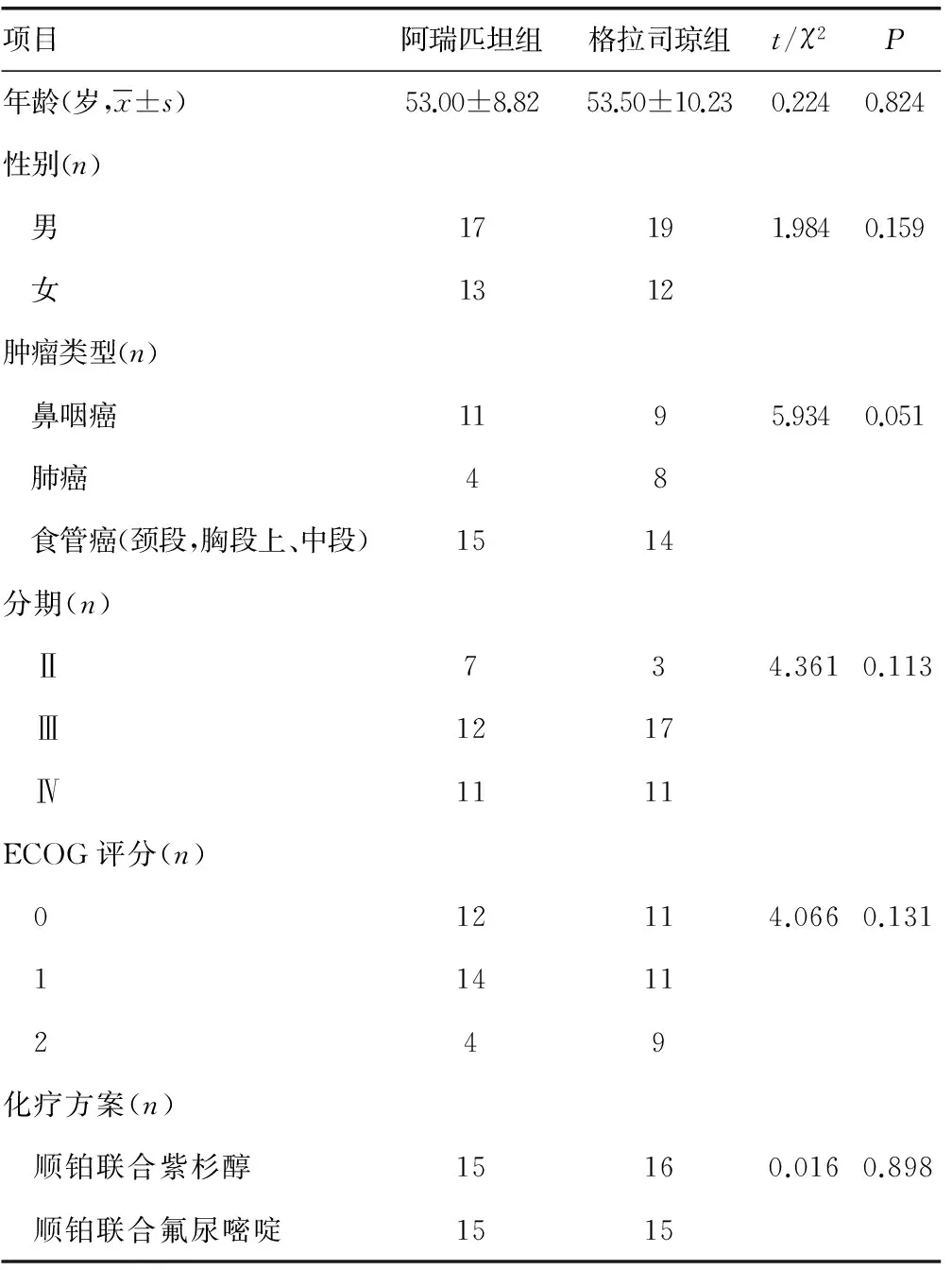
表1 两组患者一般资料比较
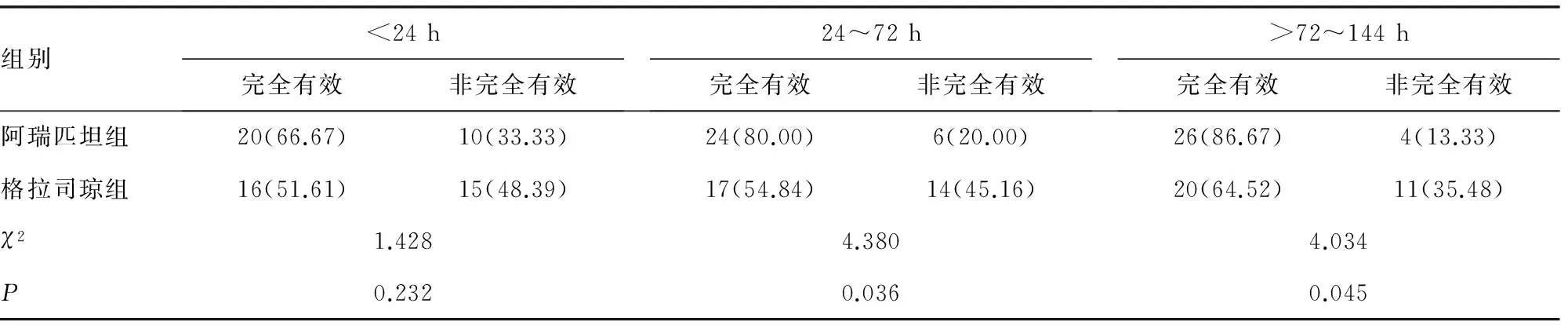
表2 两种止吐方案的疗效比较[n(%)]
2.2两种方案恶心、呕吐持续时间比较 两组患者在144 h内存在大于或等于Ⅰ级恶心、呕吐反应的时间总和采用Kaplan-Meier法作图(图1),阿瑞匹坦组和格拉司琼组的平均数分别为16.5 h(1~52 h)和28.0 h(1~99 h),二者持续时间差异有统计学意义(P=0.022)。
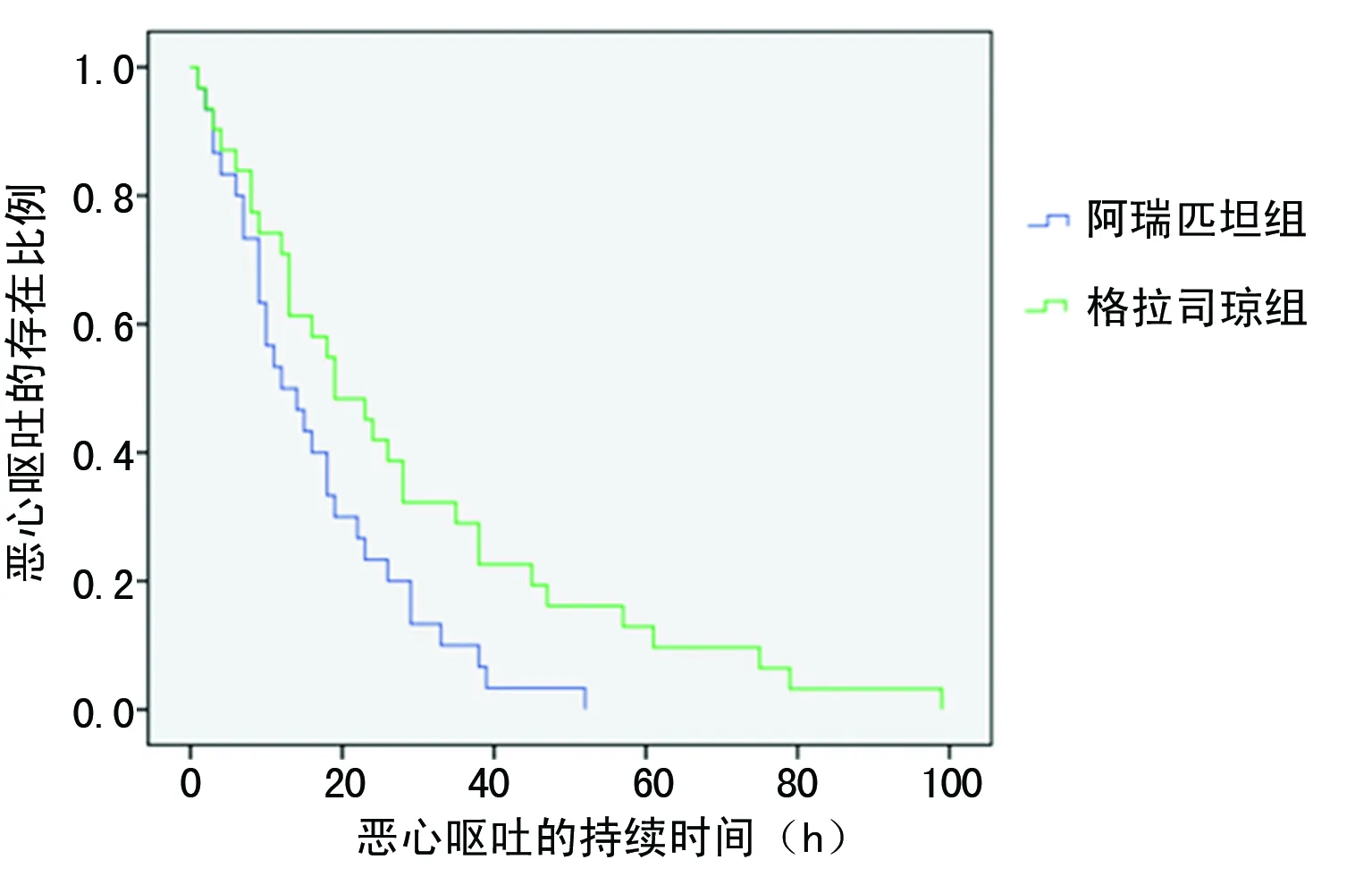
图1 两种止吐方案在144 h内恶心呕吐持续时间比较
2.3止吐相关性不良事件 两种止吐方案的不良反应如便秘、腹泻、荨麻疹、疲乏、焦虑差异无统计学意义(P>0.05),阿瑞匹坦组总的不良反应发生率为23.33%,而格拉司琼组为25.81%,差异无统计学意义(P>0.05),见表3。
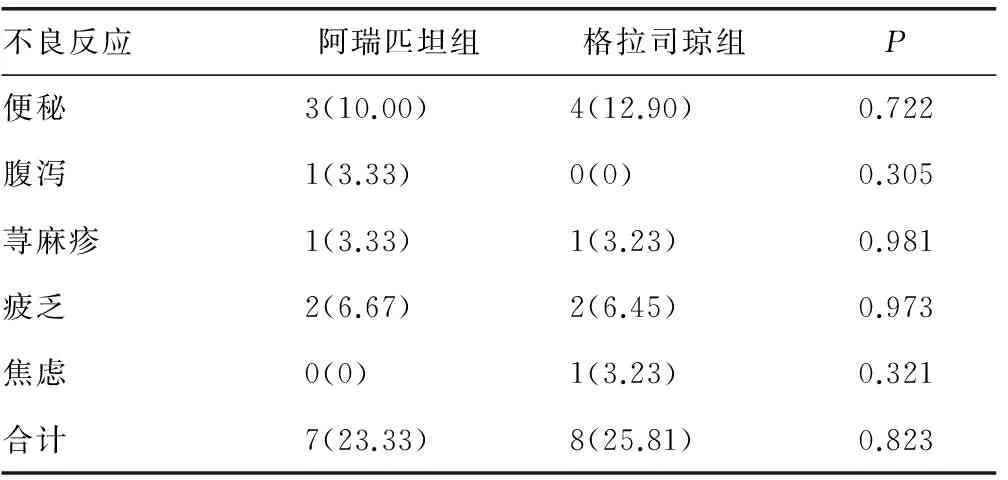
表3 两种止吐方案不良反应比较[n(%)]
3 讨 论
化疗引起的相关性恶心呕吐很大程度上影响肿瘤患者化疗的依从性[3]。格拉司琼作为5-HT3受体拮抗剂,是临床常用的止吐药物,可以阻滞中枢和外周神经元的突触前5-HT3受体兴奋,又能直接作用于中枢神经系统的5-HT3传递[4]。阿瑞匹坦作为第一个NK-1受体拮抗剂,可以拮抗P物质的呕吐效应,于2003年研发上市,标志着新一代药物用于化疗相关恶心呕吐的应用[5-6]。
既往已有很多研究是联合阿瑞匹坦、5-HT3受体拮抗剂和地塞米松3种药物对比5-HT3受体拮抗剂和地塞米松2种药物,结果显示三联用药较二联用药在迟发性恶心呕吐的CR中更有优势[7-9]。本研究探索不同止吐机制对化疗相关恶心呕吐不同时相的影响,尤其是对顽固性呕吐患者,可为临床应用参考。
本研究结果初步提示在止吐小于24 h时间内,阿瑞匹坦组和格拉司琼组二者疗效无显著差别,在24~72 h、>72~144 h时间段内二者差异有统计学意义。阿瑞匹坦的对延迟性呕吐的效果胜于格拉司琼,和既往报道的阿瑞匹坦对多日化疗的止吐疗效研究结果类似[10-11]。本研究发现止吐前期二者无明显差异,随着口服阿瑞匹坦的吸收释放,阿瑞匹坦组较格拉司琼组恶心呕吐持续时间明显缩短,表明采用阿瑞匹坦治疗后的患者有较长无恶心呕吐时间。二者不同的疗效表现考虑和两者不同的药代动力学和作用机制有关:(1)阿瑞匹坦半衰期长,代谢较慢。其血浆清除率在60~90 mL/min,比5-HT3低,其血浆清除半衰期为9~13 h[12],明显长于格拉司琼血浆清除半衰期3.1~5.9 h;阿瑞匹坦在体内主要通过CPY3A4代谢,健康受试者服用14C标记的本品72 h后在血浆中仍可检测到24%的放射活性;格拉司琼通过肝细胞色素P-450药物代谢酶迅速进行代谢,在体内很少蓄积。(2)阿瑞匹坦血浆蛋白结合率高,释放缓慢。药物入血后和血浆蛋白结合,而只有游离型药物才具有药物活性,药物与血浆蛋白结合成为结合型药物,暂时失去药理活性,并“储存”于血液中,起到药库的作用,阿瑞匹坦血浆蛋白结合率为95%,而格拉司琼只有约65%,维持时间不同。(3)对呕吐中枢的作用更显著。阿瑞匹坦稳态时平均表观分布体积为70 L,可穿透血脑屏障,其125 mg达到的脑NK-1受体占有率大于95%[13],可见它具有较长的中枢活性持续时间。(4)对NK-1受体高亲和性、高选择性阻断。选取前期采用5-HT3拮抗剂仍呕吐的患者可能5-HT3受体已经被消耗,需要不同的止吐机制才能更好地发挥作用,所以在延迟性呕吐中表现优异。
对比两种止吐方案的不良反应发现便秘、腹泻、荨麻疹、疲乏、焦虑无显著差异,阿瑞匹坦组总的不良反应发生率与格拉司琼组比较,二者无明显差异,这和国内外的一些研究结论类似[7,11]。凌明珠等[14]报道阿瑞匹坦预防顺铂3 d方案的化疗方案所致恶心呕吐的疗效良好,能提高接受高致吐化疗方案肺癌患者的生存质量,但阿瑞匹坦药物不良反应如便秘等明显高于5-HT3组,本研究为二联用药且样本量较少,尚未见此现象,也有报道指出阿瑞匹坦三联用药可能增加疲乏发生率[13],有关阿瑞匹坦的不良反应尚需进一步观察。
本研究认为和格拉司琼相比其主要优势在于延迟性呕吐的治疗,以及常规采用5-HT3拮抗剂效果欠佳的患者,是否对于高致吐风险的患者用于一线治疗尚存争议[15],
[1]CHAPELL R,AAPRO M S.Efficacy of aprepitant among patients aged 65 and over receiving moderately to highly emetogenic chemotherapy:A Meta-analysis of unpublished data from previously published studies[J].J Geriatr Oncol,2013,4(1):78.
[2]李爱洁,陶海涛,汪进良,等.阿瑞匹坦预防顺铂化疗所致恶心和呕吐的疗效分析[J].中国药物应用与监测,2015,12(2):73-75.
[3]孙媛媛,谢军,鲍健,等.托烷司琼联合地塞米松预防顺铂化疗所致恶心呕吐的临床研究[J].安徽医学,2014,35(3):282-284.
[4]RAHIMIAN R,DEHPOUR A R,FAKHFOURI G,et al.Troprisetron uptregulates cannabinoid CB1 recetpors in cerebellar granule cells:Possible involvement of calcineurin[J].Brian Res,2011,14(17):1-8.
[5]JIN Y,WU X,GUAN Y,et al. Efficacy and safety of aprepitant in the prevention of chemotherapy-induced nausea and vomiting:A pooled analysis[J].Support Care Cancer,2012,20(8):1815-1822.
[6]NISHIMURA J,SATOH T,FUKUNAGA M,et al.Combination antiemetic therapy with aprepitant/fosaprepitant in patients with colorectal cancer receiving oxaliplatin-based chemotherapy(SENRI trial):a multicentre,randomised,controlled phase 3.Trial[J].Eur J Cancer,2015,51(10):1274-1282.
[7]ALBANYC,BRAMESMJ,FAUSELC,etal.Randomized,doubleblind,placebo-controlle,phaseⅢcross-overstudyevaluatingtheoralneurokinin-1antagonistaprepitantincombinationwitha5-HT3receptorantagonist
and dexamethasone in patients with germcell tumors receiving 5-day cisplatin combination chemotherapy regimens:a hoosier oncology group study[J].J Clin Oncol,2012,30(32):3998-4003.
[8]SAITO H,YOSHIZAWA H,YOSHIMORI K,et al. Efficacy and safety of single-dose fosaprepitant in the prevention of emotherapy-induced nausea and vomiting in patients receiving high-dose cisplatin:a multicentre,randomised,double-blind,placebo-controlled phase 3 trial[J].Ann Oncol,2013,24(4):1067-1073.
[9]TAKAHASHI T,HOSHI E,TAKAGI M,et al.Multicenter,phase Ⅱ,placebo controlled,double-blind, randomized study of aprepitant in Japanese patients receiving high-dose cisplatin[J].Cancer Sci,2010,101(11):245-261.
[10]JIN Y,WU X,GUAN Y,et al.Efficacy and safety of aprepitant in the prevention of chemotherapy-induced nausea and vomiting:a pooled analysis[J].Support Care Cancer,2012,20(8):1815-1822.
[11]黄鲁众,张晓晔,刘艳,等.阿瑞匹坦联合5-HT3受体拮抗剂和地塞米松预防化疗相关性恶心和呕吐的Meta分析[J].现代肿瘤医学,2015,23(15):2198-2203.
[12]ROJAS C,RAJE M,TSUKAMOTO T,et al. Molecular mechanisms of 5-HT3 and NK1 receptor antagonists in prevention of emesis[J].Eur J Pharmacol,2014,722(2014):26-37.
[13]HU Z,CHENG Y,ZHANG H,et al.Aprepitant triple therapy for the prevention of chemotherapy-induced nausea and vomiting following high-dose cisplatin in Chinese patients:a randomized,double-blind,placebo-controlled phase Ⅲ trial[J]. Support Care Cancer,2014,22(4):979-987.
[14]凌明珠,宋正波,娄广媛,等.阿瑞匹坦预防含顺铂化疗方案所致恶心和呕吐的临床观察[J].临床肿瘤学杂志,2016,21(3):247-250.
[15]陈诚,王晓华,邓荣,等.阿瑞匹坦预防中重度致吐性方案所致化疗相关性呕吐的临床研究[J].临床肿瘤学杂志,2015,20(8):718-721.
