槲皮素对人肝星状细胞Ⅰ、Ⅲ型胶原蛋白表达的影响与其细胞周期研究
2018-03-30邓治林李福昌
蒋 炜,邓治林,李福昌
(四川省简阳市中医医院外科 641400)
肝星状细胞(hepatic stellate cell,HSC),也称肝贮脂细胞(fat-storing cell,FSC),主要分布于肝窦周隙。目前认为,FSC可以合成和分泌胶原蛋白及产生细胞外基质,在肝纤维化、肝硬化发展过程中起着主要作用[1-3]。槲皮素(quercetin)属黄酮类化合物,存在于许多植物的花、叶、果实中,如洋葱、苹果、绿茶、芦丁、连翘及抗肝病植物药赶黄草等植物中含量较高。目前认为,槲皮素具有较好的祛痰、止咳、平喘、抗肿瘤等作用[4-5]。本研究通过用体外培养人HSC的方法为基础,用槲皮素进行干扰,检测槲皮素对HSC细胞周期的影响,以及对其Ⅰ、Ⅲ型胶原蛋白表达的影响,分析HSC参与肝纤维化的机制及槲皮素的意义,为星状细胞的功能调控、调控机制的研究,及肝纤维化、肝硬化的防治研究奠定基础。
1 材料与方法
1.1细胞来源及主要试剂 人HSC株:广州市十环医药科技有限公司;槲皮素:美国Sigma公司,批号PHR1488,相对分子质量302.24;量子点标记试剂盒:武汉珈源量子点技术开发有限责任公司;免疫组织化学试剂盒:北京博奥森生物技术有限公司;BX51荧光显微镜:日本奥林巴斯(Olympus)公司;Leica-DM6000光学显微镜Leica-DFC295系统:徕卡(Leica)仪器(德国)有限公司;BD FACSCalibur流式细胞仪:美国BD公司。
1.2方法
1.2.1细胞培养及分组干扰 将购买的细胞株(广州市十环医药科技有限公司)复苏,制成细胞悬液,细胞浓度约1.0×108/L,接种于24孔培养板(铺垫圆形盖玻片)。培养条件为:37 ℃、10%小牛血清、DMEM培养基、5% CO2。取培养第4天作后续实验。培养细胞分为对照组和实验组。槲皮素以二甲基亚砜为溶剂溶解稀释,分别给予0 μmol/L(对照组)、50 μmol/L(50-实验组)、100 μmol/L(100-实验组)、500 μmol/L(500-实验组)干扰,48 h后终止干扰。取出盖玻片,4%甲醛固定30 min,进入后续实验。
1.2.2染色及检测 (1)HE染色:取出细胞爬片,苏木精染色,盐酸乙醇分色,氨水返蓝,伊红染色,梯度乙醇脱水,二甲苯透明,树脂封片。采用盲法将细胞核体积由大至小分为3类进行半定量计数。(2)免疫组织化学染色(SABC法):细胞爬后片PBS冲洗,0.1% Triton-X 100处理,3%H2O2灭活内源性过氧化物酶,滴加1∶100稀释的一抗孵育过夜,PBS洗涤,二抗孵育,PBS洗涤,SABC酶标,DAB(棕色)显色,梯度乙醇脱水,二甲苯透明,树脂封片。(3)量子点标记[6-8]:细胞爬片后0.1% Triton-X 100通透处理,3% H2O2灭活内源性过氧化物酶,正常山羊血清封闭,滴加1∶100稀释的Ⅰ胶原蛋白一抗(鼠抗鼠)37 ℃ 4 h,滴加1∶100稀释的Ⅲ胶原蛋白一抗(兔抗鼠)37 ℃ 4 h,PBS洗涤,量子点标记二抗(抗鼠、抗兔)复合物37 ℃孵育20 min,PBS洗涤,甘油封片。荧光显微镜下观察成像并照相,记录观察结果。
1.2.3流式细胞仪检测细胞周期 0.25%胰蛋白酶消化细胞成细胞悬液,离心,冰乙醇固定。离心,调整细胞浓度为5×105/mL,加入碘化丙啶(PI)染液,孵育。以488 nm氩离子激光激发,应用BD CSCalibur(美国 BD公司)流式细胞仪FACStation、CellQUEST Pro数据处理软件进行细胞周期检测和分析。
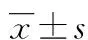
2 结 果
2.1细胞形态学 普通光学显微镜观察培养HSC,各样本均表现为细胞密度及细胞形态无明显的差异。细胞贴壁生长,有突起,细胞直径约25~35 μm。核位于中央,体积大,嗜碱性;细胞质呈弱嗜碱性,细胞质内可见大量细小嗜碱性细小颗粒(图1)。槲皮素干扰48 h,细胞核大小不均匀,细胞核越小,嗜碱性越强。HSC经HE染色细胞核计数4组之间差异有统计学意义(P<0.05),见表1。
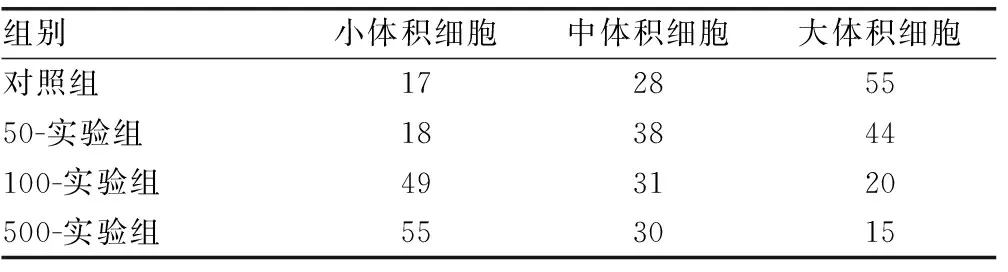
表1 肝星状细胞HE染色细胞核计数(n=100)
2.2免疫组织化学结果 各组均可见大量HSC,细胞内均有Ⅰ、Ⅲ型胶原蛋白阳性产物,分布在细胞质内,呈棕黄色颗粒(图1)。图像分析吸光度值和阳性面积比值(PN-area)结果所示,与对照组比较,实验组Ⅰ型胶原蛋白表达明显降低,差异有统计学意义(P<0.05),Ⅲ型胶原蛋白表达无明显变化,差异无统计学意义(P>0.05),见表2。
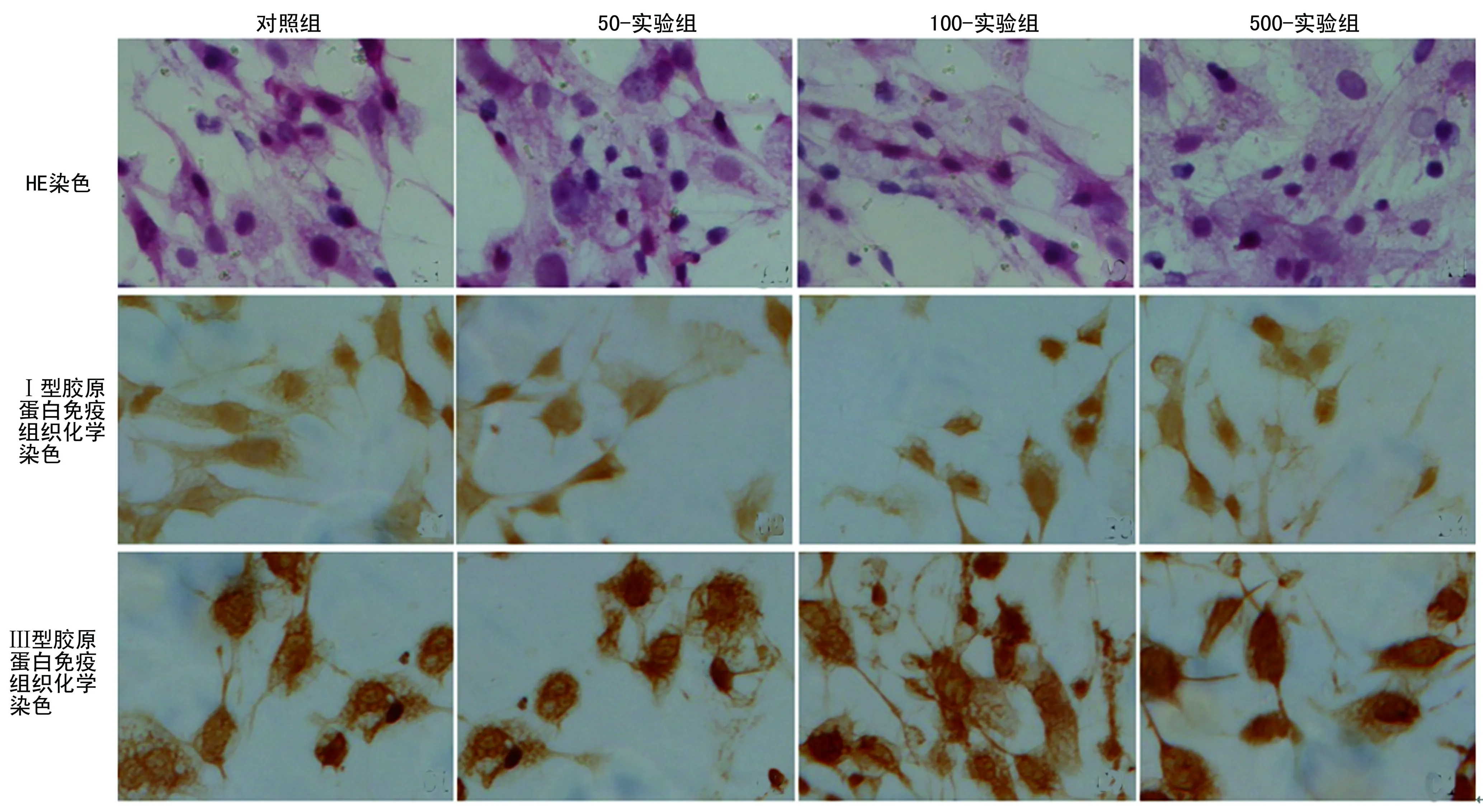
图1 HE染色、免疫组织化学染色HSC(×200) 表2 各组Ⅰ、Ⅲ型胶原蛋白免疫组织化学染色吸光度与PN-area比较

组别nⅠ型胶原吸光度PN-areaⅢ型胶原吸光度PN-area对照组240.135±0.00427.36±6.470.216±0.11822.15±4.2750-实验组240.117±0.003a18.29±2.34a0.209±0.09821.69±2.48100-实验组240.112±0.004a15.48±2.51a0.221±0.12420.46±3.52500-实验组240.097±0.003a14.69±1.22a0.224±0.04122.36±4.42
a:P<0.05,与对照组比较
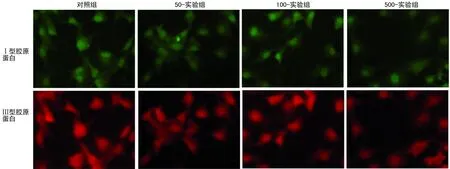
图2 免疫荧光染色结果(×200)
2.3免疫荧光结果 干扰48 h后,Ⅰ、Ⅲ型胶原蛋白经双标显示,对照组和各实验组Ⅰ胶原蛋白阳性产物显示为绿色荧光,Ⅲ胶原蛋白阳性产物显示为红色荧光(图2)。显微镜荧光强度定量分析结果显示,实验组Ⅰ型胶原蛋白表达明显降低,与对照组之间差异有统计学意义(P<0.05);Ⅲ型胶原蛋白表达无明显变化,与对照组之间差异无统计学意义(P>0.05),见表3。
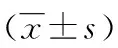
表3 各组Ⅰ、Ⅲ型胶原蛋白免疫染色荧光强度
a:P<0.05,与对照组比较
2.4肝星状细胞流式细胞仪细胞周期检测结果 干扰48 h后,对照组和实验组G1期细胞比例比较,差异有统计学意义(P<0.05);S期细胞比例,G2期细胞比例各组之间比较,无明显变化规律(图3,表4)。
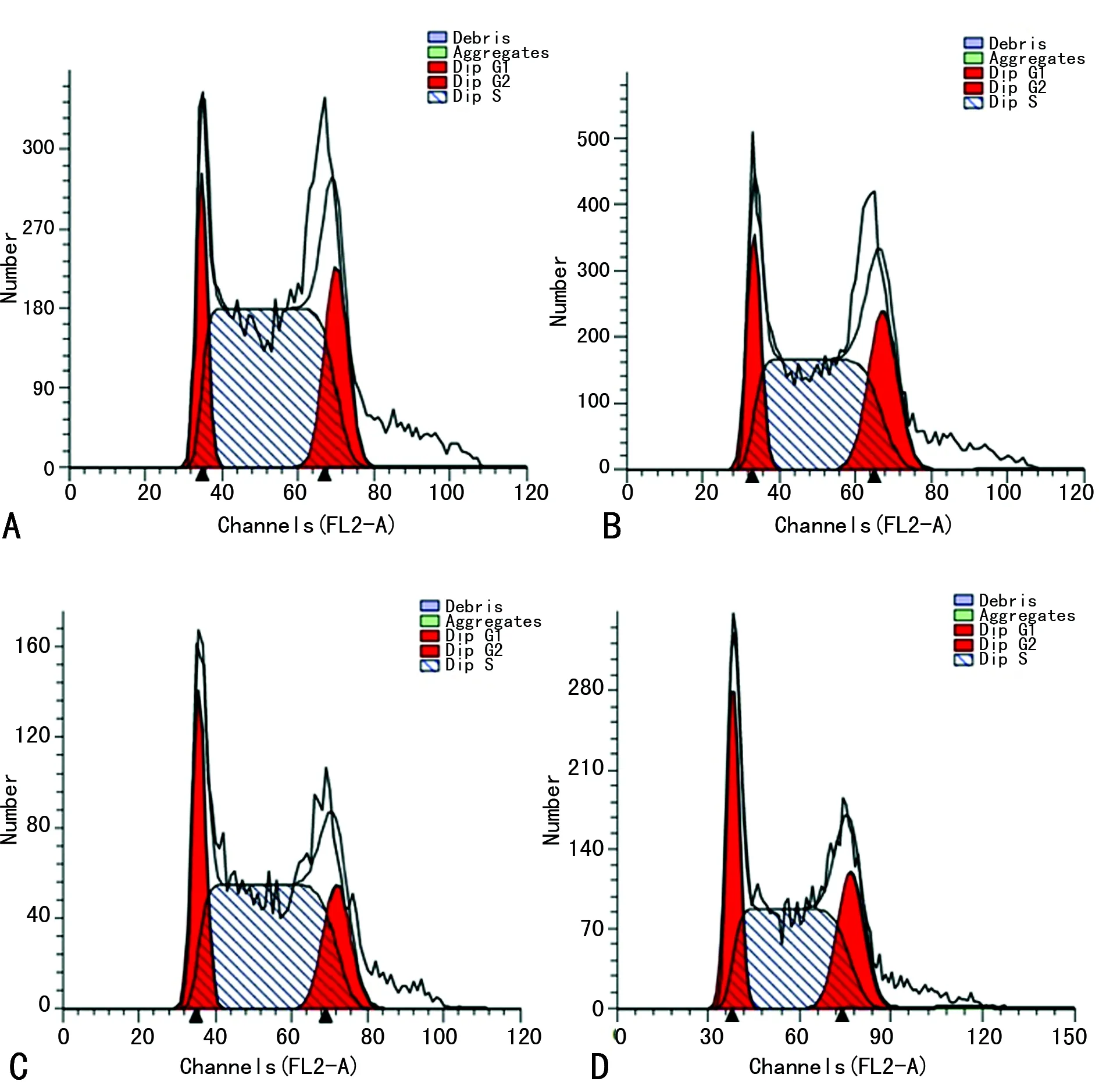
A:对照组;B:50-实验组;C:100-实验组;D:500-实验组

图3 肝星状细胞流式细胞仪细胞周期检测结果表4 流式细胞仪细胞周期检测结果(%)
a:P<0.05,与对照组比较
3 讨 论
肝脏疾病是目前威胁人类健康的一个巨大问题。临床上在各种慢性病致病因子的作用下,肝内纤维成分异常增生,胶原纤维过度沉淀,引起肝纤维化,继续发展则成为肝硬化。文献报道表明,HSC具有产生细胞外基质及纤维的能力,因此认为,HSC与肝纤维化及肝硬化直接相关[9-11]。本研究采用现有的HSC株培养技术,用临床上使用极为广泛的赶黄草等中药的提纯品槲皮素对细胞进行干扰,在体外实验对HSC的形态结构及Ⅰ、Ⅲ型胶原蛋白的合成功能进行初步研究。由于HSC固有的生物特性,其Ⅰ、Ⅲ型胶原蛋白基因会表达而产生胶原纤维的主要构成成分:Ⅰ、Ⅲ型胶原蛋白。通过检测培养HSC形态结构、细胞周期及Ⅰ、Ⅲ型胶原蛋白,反应HSC的功能状态和产生胶原纤维的能力,为肝纤维化、肝硬化的基础研究奠定实验基础。
实验结果显示,体外肝星状细胞呈贴壁生长,有多个突起,细胞质内可见大量嗜碱性细小颗粒。细胞核体积统计结果显示,槲皮素干扰后,大细胞核的细胞比例减少,小细胞核的细胞比例增高。细胞核大小及嗜碱性可以一定程度反应细胞的功能状态,一般细胞核体积越小,嗜碱性越强,说明细胞的活性程度越低,功能相对静止,反之亦然。结果说明,槲皮素对肝星状细胞的活性有抑制作用。
免疫组织化学及免疫荧光检测显示,肝星状细胞在常规培养下细胞内均有Ⅰ、Ⅲ型胶原蛋白阳性产物,阳性产物分布在细胞胞质内,免疫组织化学切片中表现出呈棕黄色颗粒。荧光显微镜下,免疫产物呈现荧光,通过采用不同种属一抗分别标记,在同样的细胞内Ⅰ、Ⅲ型胶原蛋白呈现出不同的绿色荧光和红色荧光。用中药有效成分提纯品槲皮素进行培养干扰后,细胞内仍然有Ⅰ、Ⅲ型胶原蛋白的表达,但Ⅰ型胶原蛋白表达强度明显降低,Ⅲ型胶原表达强度未见明显改变。说明槲皮素对体外培养HSC Ⅰ、Ⅲ型胶原蛋白具有调节作用。
有研究也证实,血清Ⅲ型胶原蛋白浓度与肝炎症、坏死和肝纤维化有关,但以肝纤维化相关为主,肝硬化患者明显升高,但肝硬化晚期,Ⅲ型胶原蛋白反而低于早期[12-13]。胶原纤维中以Ⅰ、Ⅲ型胶原蛋白为主,在炎症及损伤修复过程中,伴随着旧胶原的降解和新胶原的产生、重新排列沉积。在胚胎皮肤损伤修复中有无瘢痕愈合现象[14],无瘢痕愈合以Ⅲ型胶原蛋白为主,无瘢痕愈合可能与细胞外基质的Ⅰ、Ⅲ型胶原蛋白比例有直接关系,即:Ⅲ型胶原蛋白浓度高相对Ⅰ型胶原蛋白浓度高更容易降解,相对更不容易形成瘢痕组织及胶原纤维沉积。在肝纤维化及肝硬化的发展中,其实本质就是炎症导致肝细胞损伤,HSC受刺激产生胶原纤维,胶原纤维不能充分降解,从而导致胶原纤维沉积的过程。本实验结果显示,槲皮素可以降低Ⅰ型胶原蛋白的产生,说明其可以抑制星状细胞产生胶原纤维沉积;另外,槲皮素对Ⅲ型胶原蛋白表达强度未见明显影响,说明槲皮素可以降低Ⅰ型胶原蛋白与Ⅲ型胶原蛋白的比例,可以使其产生的胶原更容易降解,可能是赶黄草等中药可以抑制肝纤维化、肝硬化的发展速度、甚至缓解肝纤维化及肝硬化的主要机制。
流式细胞仪是检测细胞周期的经典方法。实验中,肝星状细胞保持不断增殖状态,细胞总是处于从G1、S、G2和M期的连续的细胞周期中。在细胞周期的各阶段,细胞分别进行着DNA复制、蛋白质合成及细胞分裂等重要的生理活动[12,15]。实验结果显示,槲皮素有明显升高G1期星状细胞比例的作用,对照组和实验组G1期细胞比例比较有明显差异,而S期、G2期细胞比例无明显影响。其结果说明,槲皮素对星状细胞的增殖具有抑制作用,在细胞周期中,其抑制作用的时间点G1期。其G1比例增高,则说明细胞在G1停留时间延长、细胞向G0发展的可能性增大、细胞出现功能相对停滞的可能性增大,则出现而不被活化的可能性增大,这可能是赶黄草等含槲皮素的中药可以抑制肝纤维化、肝硬化的发展的作用机制之一[16]。
综上所述槲皮素对体外培养HSC有明显调控作用,可以抑制Ⅰ型胶原蛋白的合成,改变Ⅰ、Ⅲ型胶原蛋白的比例。同时,槲皮素可以延长肝星状细胞G1期,从而影响细胞的增殖及活性,可能是赶黄草等富含槲皮素的中药可以达到临床控制肝纤维化、肝硬化的发展的作用机制之一。但中药的作用机制研究极为复杂,关于槲皮素对肝脏疾病的作用机制研究需大量的基础实验和临床研究进行进一步深入的研究和探讨。
[1]解强,付文广,雷正明.肝星状细胞对肝再生的调控作用[J].现代医药卫生,2016,32(19):2990-2993.
[2]LIONETTI L,MOLLICA M P,LOMBARDI A,et al.From chronic overnutrition to insulin resistance:the role of fat-storing capacity and inflammation[J].Nutr Metab Cardiovasc Dis,2009,19(2):146-152.
[3]SHIMIZU K.Mechanisms of pancreatic fibrosis and applications to the treatment of chronic pancreatitis[J].J Gastroenterol,2008,43(11):823-832.
[4]高蔚娜,郭长江,韦京豫,等.槲皮素对氧化应激大鼠肝细胞的保护作用[J].中国临床营养杂志,2007,15(4):209-213.
[5]张继红,梁力建,黄洁夫.bcl-2基因表达变化在槲皮素抑制肝细胞癌生长中的作用[J].中国普外基础与临床杂志,2009,16(6):455-459.
[7]李梦华,褚先锋,豆小文,等.基于量子点标记的适配体技术在分析检测中的研究进展[J].分析科学学报,2016,32(1):119-126.
[8]黄慧,郑芳,彭俊,等.量子点标记间接免疫荧光技术在雌激素受体检测中的应用[J].国际检验医学杂志,2011,32(11):1215-1216.
[9]张国.肝星状细胞与肝纤维化的现代治疗进展[J].内科,2008,3(5):749-751.
[10]马腾飞,华赟鹏,李巧,等.miR-200c促进肝星状细胞活化诱导肝纤维化的机制[J].中山大学学报(医学科学版),2016,37(4):497-501.
[11]唐桂连.肝星状细胞与肝纤维化[J].实用医技杂志,2007,14(1):116-117.
[12]陆明海,张军艳,杨宏伟.乙型肝炎肝硬化血清纤维化指标和肝功能相关性研究[J].医学综述,2015,21(24):4544-4546.
[13]杨青,马静,夏炜,等.皮肤创伤后无瘢痕愈合的研究进展[J].中国美容整形外科杂志,2014,25(9):569-571.
[14]王改平,李晓芳,陈莎莎,等.肝脏炎症反应与肝再生关系的研究进展[J].中国免疫学杂志,2015,31(8):1115-1119.
