熊果酸对肝纤维化大鼠NOX2/ROS/NLRP3炎性小体活化的影响
2018-03-29黄晨恺甘达凯罗方云汪安江李弼民
黄晨恺,甘达凯,张 望,罗方云,陈 江,汪安江,李弼民*,朱 萱*
(1.南昌大学第一附属医院 消化内科;2.江西省消化研究所, 江西 南昌 330006)
核苷酸结合寡聚化结构域样受体家族吡啉结构域蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)炎性小体与肝纤维化相关[1]。NADPH氧化酶(NADPH oxidase,NOX)产生的活性氧簇(ROS)作为NLRP3炎性小体活化的重要因素之一,参与了肝纤维化的发生发展[2]。熊果酸(ursolic acid,UA)是从药用植物中提炼出的一种天然三萜类化合物,具有抗菌、抗病毒和保护肝损伤等药理活性。本课题组前期体外实验证实,UA能抑制肝脏中TGF-β的表达,下调HSC-T6细胞中的NOX各亚基的表达,抑制NOX活性,进而下调下游促纤维化信号通路,减少I型胶原的产生[3- 4]。但UA是否通过抑制肝脏NOX2/ROS/NLRP3炎性小体活化而减少肝内胶原沉积尚无文献报道。因此,本文将进一步探讨UA减少肝内胶原沉积是否与其抑制肝脏NOX2/ROS/NLRP3炎性小体活化有关。
1 材料与方法
1.1 材料
1.1.1 主要试剂:熊果酸(ursolic acid,UA,Sigma公司);蛋白提取试剂盒(贝博生物有限公司);ALT检测试剂盒和ROS检测试剂盒(南京建成生物工程研究所); mRNA引物(上海捷瑞生物工程有限公司);天狼星红(Sirius-Red)染色试剂盒(北京索莱宝生物科技有限公司);总RNA提取试剂盒、cDNA第一链合成试剂盒、荧光定量PCR试剂盒(Tiangen公司); 兔抗鼠NLRP3多克隆抗体(CST公司);兔抗鼠NOX2多克隆抗体(Abcam公司)、兔抗鼠caspase- 1多克隆抗体(Abcam公司);兔抗鼠caspase- 1 p10多克隆抗体、兔抗鼠IL- 1β多克隆抗体(Santa-cruz公司);小鼠抗大鼠β-actin单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG(中杉金桥有限公司)。
1.1.2 实验动物:SPF级雄性纯系8周龄SD大鼠18只,体质量250~300 g[莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2013- 0004]。将大鼠饲养于适宜环境中,自由采食和饮水。
1.2 方法
1.2.1 大鼠分组与处理:分为对照组(CON,n=6,2 mL/kg橄榄油灌胃8周,结束后继续给予0.9%氯化钠溶液灌胃4周),肝纤维化组(CCl4,n=6,2 mL/kg 20% CCl4灌胃8周,每周2次,结束后继续给予0.9%氯化钠溶液灌胃4周)[5]及熊果酸治疗组(UA-T,n=6,完成肝纤维化造模后每天用40 mg/kg剂量熊果酸混悬液灌胃4周)。各组药物处理结束72 h后,用真空采血管留取门脉血待用;取下肝脏,留取新鲜肝脏组织待用,将其余组织固定于10%甲醛固定液中,常规脱水包埋。
1.2.2 大鼠血清谷丙转氨酶(ALT)的测定:按试剂盒说明书步骤操作,设置测定管与对照管,使用分光光度计在波长505 nm处测定各管吸光度(A)值。绝对(A)值=测定管(A)值-对照管(A)值。查标准曲线,求得各组样本血清中谷丙转氨酶(alanine aminotransferase,ALT)含量(U/L)。
1.2.3 HE及天狼星红染色:控制切片厚度为6 μm,常规脱蜡。将切片进行HE染色,中性树胶封固,显微镜下观察,采用Ishak肝纤维化评分系统[6]对切片进行评分;天狼星红染色液滴染1 h。流水冲洗。Mayer苏木精染色液染细胞核8 min。流水冲洗10 min。常规脱水透明,中性树胶封固。显微镜下观察肝内胶原沉积。
1.2.4 RT-qPCR检测Nox2、Nlrp3、caspase- 1及IL- 1β mRNA表达:分别取肝纤维化组及对照组小鼠的肝组织100 mg用吸附柱法提取肝组织总RNA,琼脂糖凝胶电泳鉴定RNA完整性,并用分光法测定RNA 含量。用反转录试剂盒将RNA 反转录成cDNA。随后以cDNA为模板进行qPCR反应。步骤严格按说明书操作。每个样本设3个复孔,以每个组织样本各指标的循环数计作Ct值,最终以2-ΔΔCt值评估相对表达量。引物序列见表1。

表1 RT-qPCR引物序列Table 1 Gene primer sequence for RT-qPCR
1.2.5 Western blot检测NOX2、NLRP3、caspase- 1、及IL- 1β蛋白表达:提取肝脏组织总蛋白后采用8% SDS-聚丙烯酰胺凝胶进行电泳,条件为浓缩胶60 V、1 h,分离胶100 V、2 h。电泳完成后将凝胶中的蛋白通过湿法电转移方法转移到硝酸纤维素(NC)膜上;将NC膜于5%脱脂奶粉中室温封闭1 h。将NC膜分别与抗NOX2 (1∶1 000)、抗NLRP3 (1∶1 000)、抗caspase- 1 p10(1∶1 000)和p45(1∶400)及抗IL- 1β(1∶200)多抗稀释液或抗β-actin单抗(1∶1 000)稀释液4 ℃孵育过夜。次晨将膜取出,用TBST洗膜3次,每次5 min。洗膜结束后与辣根过氧化物酶标记羊抗兔IgG稀释液(1∶2 000)4 ℃孵育4 h,化学发光显色系统显色。用Image lab分析系统进行曝光及灰度值扫描,将每组所测的蛋白条带吸光度值分别与相对应的β-actin的吸光度值相比较,计算出两者的吸光度值比。
1.2.6 免疫组化检测NLRP3、caspase- 1及IL- 1β蛋白表达:切片常规脱蜡、水化,对各组肝脏组织切片进行预处理,柠檬酸盐热修复;运用3% H2O2阻断内源性过氧化物酶,孵育8 min;分别滴加兔抗鼠NLRP3、caspase- 1或IL- 1β多抗,4 ℃孵育过夜;滴加山羊抗兔IgG 37 ℃孵育30 min;在显微镜下进行DAB显色,控制反应;双蒸水冲洗终止反应;漂洗,复染,封片。在胞质内发现黄、棕色颗粒判定为阳性细胞。每组任取6张切片,每张切片任意选取5个视野,将结果输入image-proplus软件,如阳性细胞少于5%,记0分;5%~25%,记1分;26%~50%,记2分;51%~75%,记3分;大于75%,记4分[7]。
1.2.7 肝脏组织中ROS的测定:取新鲜肝脏组织300 mg配制蛋白上清液;按10 nmol/L DCFH-DA∶PBS=1∶9的比例配制成1 mmol/L DCFH-DA工作液,加入配制好的蛋白上清液,用等量PBS溶液设置对照孔。移液枪吸打混匀,37 ℃孵育30 min,激发波长485 nm,发射波长525 nm,测定其荧光强度。测定结果以荧光强度/毫克蛋白表示。ROS(荧光强度/毫克蛋白)= 荧光强度/(蛋白浓度×0.19)。
1.3 统计学分析
2 结果
2.1 UA对肝纤维化大鼠ALT的影响
CCl4模型组血清ALT含量显著高于对照组(P<0.05);UA治疗组血清ALT含量明显低于CCl4模型组(P<0.05)(表2)。

表2 各组大鼠血清ALT含量Table 2 Serum ALT analysis of each n=6)
*P<0.05 compared with control group;#P<0.05 compared with CCl4group.
2.2 UA对肝纤维化大鼠肝脏病理形态及胶原沉积的影响
与对照组相比,CCl4模型组肝脏内有纤维间隔形成,胶原沉积明显;与CCl4模型组相比,UA治疗组肝脏内纤维间隔明显减少,Ishak’s肝纤维化评分降低,胶原沉积减轻(P<0.05)(图1,2)。
2.3 UA对肝纤维化大鼠NOX2及NLRP3炎性小体mRNA表达的影响
CCl4模型组,Nox2、Nlrp3、caspase1和IL- 1β mRNA表达均较对照组明显上升(P<0.05);UA治疗组Nox2、Nlrp3、caspase1和IL- 1β mRNA表达量均较CCl4模型组显著下降(P<0.01)(图3)。
2.4 UA对肝纤维化大鼠NOX2/NLRP3炎性小体活化的影响
各组WB吸光度值比较见图4A。CCl4模型组肝组织内NOX2蛋白的含量显著高于对照组(P<0.01),UA治疗组NOX2的表达量出现明显下降(P<0.01)(图4B);CCl4模型组NLRP3(P<0.01)及caspase- 1 p10(P<0.05)亚基的表达出现显著上升;UA治疗组两者的表达均较模型组显著下降(P<0.05)(图4C,D); CCl4模型组的IL- 1β蛋白表达量也较正常组也出现显著上升(P<0.01)(图4F)。各组caspase- 1 P45结果并无差异(P>0.05)(图4E)。各组肝脏免疫组化结果显示,UA治疗组NLRP3、caspase- 1及IL- 1β的表达均较CCl4模型组减少(P<0.05)(图5)。

HE (×100) and sirius-red staining (×200) were used to analysis the liver pathological characteristics and the collagen deposition in liver tissues, respectively
图1肝组织HE及天狼星红染色
Fig1HEandsirius-redstainingoflivertissues

*P<0.05 compared with CCl4 model group图2 各组大鼠肝纤维化Ishak评分Fig 2 Ishak’s fibrosis score of each group

*P<0.05 compared with control group;#P<0.01 compared with CCl4model group
图3肝组织中Nox2、Nlrp3、caspase-1及
IL-1βmRNA的表达


A-F are Western blot of NOX2, NLRP3, caspase- 1 (p10 & p45), and IL- 1β protein levels;*P<0.05,**P<0.01 compared with control group;#P<0.05,##P<0.01 compared with CCl4model group
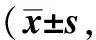

NLRP3 & IL- 1β were identified(×200); caspase- 1 was identified(×400)图5 免疫组化检测各组肝组织中NLRP3、caspase- 1及IL- 1β的表达Fig 5 Immunohistochemistry analysis of NLRP3, caspase- 1 and IL- 1β expression in each group
2.5 UA对肝纤维化大鼠肝组织中ROS的影响
CCl4模型组大鼠肝组织中ROS的水平显著高于对照组(P<0.05);而与CCl4模型组相比,UA治疗组中ROS水平显著减少(P<0.05)(图6)。

*P<0.05 compared with control group; #P<0.05 compared with CCl4 model group图6 各组新鲜肝组织内ROS的荧光强度Fig 6 ROS fluorescence intensity of liver tissue
3 讨论
UA对肝脏损伤有保护作用,但具体机制尚未阐明[8]。早期肝纤维化过程中细胞外基质过度沉积是肝纤维化的标志之一,主要表现为肝内纤维间隔的产生和胶原沉积[9]。本课题组大量前期研究发现熊果酸可以抑制肝星状细胞中JAK2/STAT3[10]、PI3K/Akt[3]及ERK1/2信号通路[11],激活蛋白1(AP- 1)和核因子-κB(NF-κB)的表达而抑制HSC活化。本次体内实验中,肝纤维化大鼠血清ALT水平显著上升,肝内有大量纤维间隔产生,Ishak纤维化评分升高,胶原沉积明显增多。在给予UA灌胃后肝纤维化大鼠血清ALT水平显著降低,肝内纤维间及胶原沉积得到明显改善,Ishak纤维化
评分下降。说明UA可以保护肝细胞,抑制肝内胶原沉积,改善肝纤维化。
NOX2/ROS/NLRP3炎性小体活化是肺纤维化发生发展过程中重要的信号通路之一[12],在肝纤维化中的作用尚未阐明。NLRP3炎性小体是一种NLRP3、CARD区域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,包括CARD,ASC)及半胱天冬酶1前体(pro-caspase- 1)组合而成的蛋白质复合体[13]。NOX2通过DAMP途径产生的ROS是导致NLRP3炎性小体活化的重要因子之一[14]。当胞内NLRP3受到胞内ROS刺激后会使无活性的caspase- 1前体(pro-caspase- 1)活化为有活性的caspase- 1,而caspase- 1可以将无活性IL- 1β前体(pro-IL- 1β)及IL- 18前体(pro-IL- 18)剪切为IL- 1β及IL- 18并释放到胞外,从而引发下游炎性效应[15]。实验显示,UA可以抑制NOX2产生的ROS,使下游NLRP3炎性小体中caspase- 1活化及释放受限,导致IL- 1β成熟及释放减少。这说明UA很可能通过NOX2/ROS/NLRP3炎性小体活化信号通路改善肝内胶原沉积。另一方面,在RT-qPCR实验中,肝脏内Nox2、Nlrp3、Il- 1β的mRNA水平与蛋白印记结果一致,但UA治疗组caspase1的mRNA水平被显著抑制,而caspase- 1 p45亚基(pro-caspase- 1)的蛋白印记结果各组间对比后并无统计学差异(图4E)。据此推测,UA不只在mRNA水平抑制caspase1的转录翻译过程,可能是在蛋白质水平抑制NLRP3炎性小体中caspase- 1的成熟活化过程。但这仍需要进一步验证。
综上所述,UA能发挥肝脏保护作用,改善肝纤维化,其机制可能是通过调控NOX2/ROS/NLRP3活化,减少IL- 1β的释放,保护肝细胞,减少肝内胶原沉积实现的。
[1] Jiang S, Zhang Y, Zheng JH,etal. Potentiation of hepatic stellate cell activation by extracellular ATP is dependent on P2X7R-mediated NLRP3 inflammasome activation [J]. Pharmacol Res, 2016, 117: 82- 93.
[2] Zhang LL, Huang S, Ma XX,etal. Angiotensin(1- 7) attenuated Angiotensin II-induced hepatocyte EMT by inhibiting NOX-derived H2O2-activated NLRP3 inflammasome/IL- 1beta/Smad circuit [J]. Free Radic Biol Med, 2016, 97: 531- 43.
[3] 施凤, 何文华, 朱萱,等. 熊果酸(UA)对大鼠活化型肝星状细胞(HSC)的NADPH氧化酶(NOX)亚基及PI3K/Akt、P38MAPK信号通路活化的影响[J]. 复旦学报(医学版), 2014, 41: 328- 334,39.
[4] 黄雯, 何文华, 朱萱,等. 熊果酸对活化型肝星状细胞信号通路的影响[J]. 中华消化杂志, 2015, 35: 110- 115.
[5] Liu Y, Yang X, Jing Y,etal. Contribution and mobiliz-ation of mesenchymal stem cells in a mouse model of carbon tetrachloride-induced liver fibrosis [J]. Sci Rep, 2015, 5: 17762- 17762.
[6] Ishak K, Baptista A, Bianchi L,etal. Histological grading and staging of chronic hepatitis [J]. J Hepatol, 1995, 22: 696- 699.
[7] 于萍, 步宏, 王华,等. 免疫组化结果的图像分析与人工计数方法的对比研究[J]. 生物医学工程学杂志, 2003, 20: 288- 290.
[8] Kim MH, Kim JN, Han SN,etal. Ursolic acid isolated from guava leaves inhibits inflammatory mediators and reactive oxygen species in LPS-stimulated macrophages [J]. Immunopharm Immunot, 2015, 37: 228- 235.
[9] Thompson AI, Conroy KP, Henderson NC. Hepatic stellate cells: central modulators of hepatic carcinogenesis [J]. BMC Gastroenterol, 2015, 15: 63- 63.
[10] 刘戈云, 何文华, 李弼民,等. 熊果酸对瘦素诱导的肝星状细胞JAK2-STAT3活化及活性氧产生的影响[J]. 第三军医大学学报, 2011,33: 2016- 2020.
[11] 张新华, 何文华, 朱萱,等. 熊果酸对活化型肝星状细胞NADPH氧化酶亚基p47Phox表达及ERK1/2信号通路活化的影响[J]. 第二军医大学学报, 2012, 33: 590- 594.
[12] Sun B, Wang X, Ji Z,etal. NADPH oxidase-dependent nlrp3 inflammasome activation and its important role in lung fibrosis by multiwalled carbon nanotubes [J]. Small, 2015, 11: 2087- 2097.
[13] Man SM, Kanneganti TD. Regulation of inflammasome activation [J]. Immunol Rev, 2015, 265: 6- 21.
[14] Yin Y, Zhou Z, Liu W,etal. Vascular endothelial cells senescence is associated with NOD-like receptor family pyrin domain-containing 3 (NLRP3) inflammasome activation via reactive oxygen species (ROS)/thioredoxin-interacting protein (TXNIP) pathway [J]. Int J Biochem Cell Biol, 2017, 84: 22- 34.
[15] Patel MN, Carroll RG, Galvan-Pena S,etal. Inflammasome priming in sterile inflammatory Disease [J]. Trends Mol Med, 2017, 23: 165- 180.
新闻点击
怀孕可能会刺激妇女的脑部变化
据美国WebMD医学新闻网(2016- 12- 20)报道,新手妈妈经常说她们自己是“婴儿大脑”,这似乎是伴随着怀孕与分娩的一种新想法,而新研究认为这是正确的。
西班牙研究者报告指出,怀孕引起妇女脑部的长期变化,或许是为了提高她保护和养育孩子的能力。
研究者使用MRI扫描比较25名妇女在第一次怀孕前后的脑部结构。
研究发现,分娩后,妇女脑部与社会互动有关的灰质区域显著减少,这些脑部区域与母亲看自己婴儿图像时活化的脑部区域重叠。
共同作者Erika Barba认为,这些变化的脑部区域,与面对当母亲的挑战所必需的功能相关。
虽然有些母亲预期会抱怨自己思维不清晰,研究者报告指出,孕妇在记忆或其他思考功能方面没有改变。这意味着,灰质的损失不会导致这些区域的问题。
研究作者认为,脑部的变化会持续到分娩后至少两年,或许可帮助她们适应母亲的角色。
研究共同负责人Oscar Vilarroya认为,研究结果指出一个适应过程,其帮助关乎更佳地辨识孩子的需要,如确定新生儿的情绪状态。此外,他们提供了有关母亲的神经基础、产期前后的心理健康和脑部的一般可塑性等主要线索。
研究的共同第一作者Elseline Hoekzema指出,这些变化至少有一部分可以反映出“突触修剪机制”,弱的突触被消除,将路径转给更有效和特定的神经网络。
无论妇女是自然怀孕还是通过生育治疗受孕,这些变化是相似的。
该研究发表于2016- 12- 19NatureNeuroscience。
