儿茶素对亚砷酸钠诱导心肌毒性的保护作用
2018-03-29吉杨丹余跃生臧贵勇黄勇攀
王 恒,吉杨丹,余跃生,臧贵勇,黄勇攀
(1.贵州医科大学 药理学教研室,贵州 贵阳 550004;2.黔南民族医学高等专科学校 药理学教研室,贵州 都匀 558003;3.湖南省中医药研究院中药研究所 药理学教研室,湖南 长沙 410006)
砷(arsenic,As)是一种毒性强且分布广泛的金属性元素,在机体内极易蓄积并引起砷中毒。新近研究发现,砷暴露常引起机体各系统疾病的发生,尤其是对心血管系统的影响,包括心肌电生理改变、心肌坏死等,但其发病机制尚不完全清楚。氧化应激损伤作为砷中毒组织损伤的重要机制已受到广泛关注[1-2]。砷进入机体诱导自由基的生成,诱发ROS爆发如H2O2等[3]以及细胞抗氧化防御体系的功能减弱或消失共同导致机体抗氧化/促氧化系统失衡。通过梳理大量的文献发现,砷中毒对心血管系统影响日益受到重视。儿茶素[(-)-epigallocatechin gllate,EGCG]具有广泛的药理学活性,如抗氧化、抗自由基、抗炎和抑制基质金属蛋白酶(MMPs)的活性等[4-5]。但其对砷暴露引起的心肌损伤的保护作用鲜见报道,本研究旨在探讨EGCG对砷中毒引起的心肌氧化应激损伤及其保护作用。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠,体重200~250 g,由贵州医科大学实验动物中心提供,动物生产许可证号:SCXK(黔)2012-001。
1.2 主要药品与试剂 EGCG由贵州医科大学药学院提供,纯度95%,用双蒸水配制成浓度为2%的溶液。维生素E(VE)由贵州医科大学附属医院药剂科提供。乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等检测试剂盒购自南京建成生物工程研究所,批号均为:20160930。心肌酶肌酸激酶(CK)批号:201609;同工酶(CK-MB)批号:201609;检测试剂盒购自北京鼎国昌盛生物科技有限责任公司(From Sigma)。心肌细胞H9c2株购自美国ATCC公司,DMEM培养基购自Millipor公司,Hoechst检测试剂盒购自碧云天。
1.3 动物分组及模型的建立 动物适应性喂养一周后,100只大鼠随机分为5组,分别为对照组(control,n=20)、As模型组(As 10 mg/kg,n=20)、低剂量组(As10 mg/kg +EGCG 25 mg/kg,n=20)、高剂量组(As 10 mg/kg+EGCG 50 mg/kg,n=20)、维生素E(VE)组(As 10 mg/kg+VE 75 mg/kg,n=20)。模型组每日亚砷酸钠灌胃10 mg/kg,连续30 d。低剂量组、高剂量组、VE组均每日亚砷酸钠10 mg/kg+相应药物灌胃,连续30 d。对照组灌胃等容积的生理盐水。
1.4 组织匀浆 LDH、SOD、MDA、CAT、GSH-Px、CK、CK-MB检测:实验结束后,取动物心肌组织,制成组织匀浆,12 000×g离心10 min,取上清备用,采用试剂盒检测。
1.5 病理组织学检查 动物处死后,取心肌组织经10%中性甲醛溶液固定,常规乙醇脱水,石蜡包埋,连续切片,厚度为5 μm。二甲苯脱蜡3次;无水乙醇、95%乙醇、80%乙醇及70%乙醇梯度脱水2~3 min,然后蒸馏水水洗3 min;苏木素液染色约5 min,之后水洗;0.5%盐酸酒精分化,水洗;0.5%氨水反蓝,5 s;伊红液染5~10 s,水洗;95%乙醇2次,无水乙醇2次,每次1~2 min;二甲苯2次,每次3~5 min;中性树胶封片。显微镜下观察心肌组织形态结构变化。
1.6 电镜观察 取米粒大小心肌,2.5%戊二醛和1%锇酸双重固定,丙酮脱水,树脂包埋,超薄切片,1%醋酸双氧铀及枸橼酸铅双重染色,透射电镜观察。
1.7 细胞培养及实验分组 37 ℃饱和湿度,5%CO2条件培养于含10%胎牛血清的低糖DMEM培养基中,将铺满90%的H9c2细胞用0.25%的胰蛋白酶消化传代,均匀接种于12孔或96孔培养板中。实验分组:Control组、As组(1 μmol/L)、As+EGCG(5 μmol/L)组[EGCG(5 μmol/L)预处理30min,之后加入As(1 μmol/L)],As+EGCG(As1 μmol/L + EGCG 10 μmol/L)组,VE组(As1 μmol/L +VE 5 μmol/L)。Hoechst33258染色检测心肌细胞凋亡:采用PBS或0.9%NaCl洗2遍,每次3 min,吸尽液体,手动晃动。加入0.5 mL Hoechst 33258染色液,染色5 min,手动晃动数次。去染色液,用PBS或0.9%NaCl 洗2遍,每次3 min,吸尽液体,手动晃动。小心将切片置于载玻片上,滴一滴抗淬灭封片液,盖上洁净的盖玻片,尽量避免气泡。荧光显微镜于波长460 nm处检测到呈蓝色的细胞核。
2 结果
2.1 心肌组织的形态学改变 对照组心肌细胞排列紧密,横纹清晰,核居中,间质未见明显的血管扩张及炎细胞浸润;模型组大鼠心外膜可见灶状坏死,部分心肌细胞变性,心肌纤维呈不规则波浪状,间隙增宽,心肌间质内及小血管附近可见间质内大量淋巴细胞、巨噬细胞弥漫性浸润,可见血管扩张充血。EGCG高,低剂量组心肌总体病变较模型组轻,仍可见部分心肌细胞变性,坏死不明显,心肌间质内及小血管附近可见间质内有程度不等的淋巴细胞及巨噬细胞浸润,但未见明显血管扩张。VE组部分心肌细胞出现变性,心肌间质内有少许淋巴细胞和巨噬细胞浸润,血管扩张不明显(见图1)。

A:control; B:As; C:As +EGCG组(25 mg/kg); D:As +EGCG组(50 mg/kg); E:VE组(75 mg/kg)。图1 EGCG对心肌组织病理学的影响(×400)
2.2 EGCG对砷中毒心肌酶的影响 CK、CK-MB、LDH通常被认为是心肌细胞损伤的标志物[6]。在心肌梗死的诊断过程中心肌酶类分析被证明是非常有价值的。从本实验反映心肌损伤的生化指标来看,EGCG明显降低前述酶类的作用(见图2,P<0.05)。
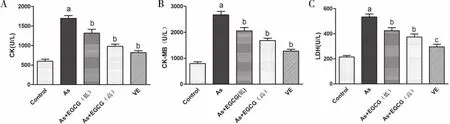
与Control组比较,aP<0.05;与NaAsO2组比较,bP<0.05, cP<0.01。图2 EGCG对CK、CK-MB、LDH的影响
2.3 EGCG对SOD、CAT、GSH-Px及MDA的影响 模型组心肌SOD、CAT、GSH-Px活性明显低于正常对照组(P<0.05),MDA含量明显升高。与模型组比较,EGCG高、低剂量组心肌SOD、CAT、GSH-Px活性明显增强,MDA含量降低,且呈浓度依赖(P<0.05,见图3)。
2.4 EGCG对心肌组织超微结构的影响 与正常组比较,模型组心肌组织超微结构损伤明显,部分肌丝排列紊乱,甚至部分出现溶解消失,部分线粒体肿胀。高、低剂量组线粒体肿胀明显改善,可见少数肌丝断裂,心肌损伤明显减轻。VE组与高、低剂量组类似心肌损伤较模型组明显减轻(见图4)。
2.5 EGCG对心肌细胞凋亡的影响 模型组心肌细胞凋亡率显著增加,EGCG和VE显著降低心肌细胞的凋亡率。这表明EGCG具有抗细胞凋亡的作用(见图5)。

与Control组比较,aP<0.05;与NaAsO2组比较,bP<0.05,cP<0.01。图3 EGCG对SOD、GSH-Px、CAT及MDA的影响

A:control;B:As;C:As+EGCG组(25 mg/kg);D:As+EGCG组(50 mg/kg);E:VE组(75 mg/kg);A、B、C、D:bar=1 μm;E:bar=0.5 μm。图4 EGCG对心肌组织超微结构的影响

与Control组比较,aP<0.05;与NaAsO2组比较,bP<0.05,cP<0.01。A:control;B:As;C:As +EGCG组(5 μmol/L);D:As +EGCG组(10 μmol/L);E:VE组(5 μmol/L)。图5 EGCG对心肌细胞凋亡的影响(×200)
3 讨论
大量研究发现儿茶素(epigallocatechin gllate,EGCG)具有广泛的药理学活性,如抗炎、抗肿瘤、抗氧化、清除自由基等,在人体内发挥强大的心血管保护作用[4-5]。长期砷暴露诱发机体细胞生成活性氧(Reactive oxygen species, ROS),大量的ROS产生,进而攻击心肌细胞,引起心肌细胞氧化损伤,造成胞内多种酶外漏,严重影响心肌纤维的舒缩功能[7-8]。文献报道心肌细胞损伤的心肌酶谱LDH、CK、CK-MB等生化指标可以反映砷中毒致心肌损伤的严重程度[6]。VE能够显著的抗氧化作用,故本实验选择VE作为阳性对照组。本实验通过建立经典自由饮水动物模型,发现模型组动物体重明显减轻,心肌组织匀浆心肌酶LDH、CK、CK-MB等水平显著升高。EGCG能明显降低LDH、CK、CK-MB水平,表明EGCG对砷诱导的心肌损伤具有明显的保护作用。
砷诱导产生的氧自由基对心肌组织的损害是造成心肌损伤的重要机制[1,2,9-10]。正常情况下SOD、CAT、MDA和GSH参与组成细胞内在的抗氧化防御系统,其活性高低反映机体清除氧自由基的能力。EGCG能明显降低大鼠心肌组织MDA含量, SOD、CAT、GSH活性升高,提示EGCG可能通过抑制心肌组织脂质过氧化过程,同时提高动物体内内源性抗氧化酶活性而减轻砷诱导的氧自由基对心肌的损伤。
砷诱导的氧化应激还会介导细胞凋亡。其支持的文献有:动物实验发现长期的砷暴露可致肾脏细胞凋亡[11-12];细胞实验发现砷能通过信号通路PKCδ-JNK抑制肝细胞凋亡[13];三氧化二砷能引起培养的心肌细胞凋亡[3]。本实验中EGCG,可明显降低心肌细胞的凋亡率;改善心肌细胞亚细胞结构的完整性,包括减轻线粒体肿胀,空泡样变性等。提示EGCG可能通过抑制心肌细胞凋亡发挥抗砷诱导的心脏毒性作用。综上所述,EGCG对NaAsO2诱导的心脏毒性有保护作用,可能通过抑制氧化应激和心肌细胞凋亡实现。
[1] Chen Y,McMillan-Ward E,Kong J,et al.Oxidativestress induces autophagic cell death independent of apoptosis in transformed and cancer cells [J].Cell Death Differ,2008,15(1):171-182.
[2] Ireneusz L,Tomasz B,Dorota D,et al. Oxidative stress and replication-independent DNA breakage induced by arsenic in saccharomyces cerevisiae[J].Plos Genet,2013,9(7):e1003640.
[3] Zhao X Y,Li G Y,Liu Y,et al.Resveratrol protects against arsenic trioxide-induced cardiotoxicity in vitro and in vivo[J].British Journal of Pharmacology,2008,154(1):105-113.
[4] Zeng X,Li Q,Zhang M,et al.Green tea may be benefit to the therapy of atrial fibrillation[J].J Cell Biochem,2011,112(7):1709-1712.
[5] Balentine D A,Wiseman S A,Bouwens L C.The chemistry of tea flavonoids [J].Crit Rev Food Sci Nutr,1997,37(3):693-704.
[6] Jiang Z S,Xia C F,Tian Q P,et al.Effect of batroxobin against dog heart ischemia/reperfusion injury [J].Acta Pharmacol Sin,2000,21(1):70 -74.
[7] Higaki Y,Mikami T,Fujii N,et al.Oxidative stress stimulates skeletal muscle glucose uptake through a phosphatidylinositol 3-kinase-dependent pathway [J].Am J Physiol Endocrinol Metab,2008,294(5):889-897.
[8] Katherine M,Eliseo G,Ana N A.Arsenic Exposure and cardiovascular disease:an updated systematic review [J].Curr Atheroscler Rep,2012,14(6):542-555.
[9] Pouyssegur J,Mechta-Grigoriou F.Redox regulation of the hypoxia-inducible factor [J].Biol Chem,2006,387 (10/11):1337-1346.
[10]Bharathi,Ravid R,Rao K S.Role of metals in neuronal apoptosis:challenges associated with neurodegeneration [J].Curr Alzheimer Res,2006,3(4):311-326.
[11]Francesca F,Liliana C,Fabrizio B,et al.Arsenic-induced genotoxicity and genetic susceptibility to arsenic- related pathologies [J].Int J Environ Res Public Health,2013,10(4):1527-1546.
[12]李远慧,金婷婷.bcl- 2 bax在砷中毒大鼠肾近端小管表达[J].中国公共卫生,2011,27(7):881-883.
[13]Joydeep D,Jyotirmoy G,Prasenjit M,et al.Protective role of taurine against arsenic-induced mitochondria- dependent hepatic apoptosis via the inhibition of PKCδ-JNK pathway[J].Plos One,2010,5(9):e12602.
