复旦中文版神经肌肉疾病运动功能评估量表在儿童和青少年中的信度和效度研究
2018-03-29李西华胡超平周水珍
史 惟 李 惠 李西华 翟 淳 赵 蕾 陆 恺 胡超平 周水珍
神经肌肉疾病(NMD)是指一组下运动神经元(前角细胞、周围神经、神经肌肉接头、肌肉)异常引起的神经肌肉功能障碍疾病,主要表现为肌无力、肌萎缩、肌肉肥大和肌肉疼痛等症状,还可能继发关节挛缩、骨骼畸形、感觉知觉障碍和呼吸衰竭等,从而导致严重残疾甚至死亡[1]。儿童NMD大多具有遗传因素,最为常见的有肌营养不良、先天性肌病、脊髓型肌萎缩和腓骨肌萎缩症等[2]。
随着基因检测技术和基因疗法的迅速发展,NMD越来越受到关注[3],如何全面精确地评价NMD患者障碍程度和干预疗效是临床首先需要解决的重要问题[4、5],除了肌肉力量外[6],NMD患者的活动能力,尤其是与运动相关的活动能力,同样是临床主要关注的评价指标[7]。
国际上针对不同NMD有各种不同的运动功能评估方法,例如针对可以步行的杜氏进行性肌营养不良(DMD)患儿的北极星移动评价量表(NSAA)[8],用于评价脊髓型肌萎缩的Hammersmith运动功能测试[9],用于腓骨肌萎缩症的腓骨肌检查量表(CMTES)等[10]。2005 年 Bérard 等[11]发布的NMD运动功能评估量表(MFM)可以用于测试各类NMD患者的运动能力,建立量表的样本由303例6~62岁各类NMD患者组成,包括肌营养不良、先天性肌病、脊髓型肌萎缩和遗传性感觉运动神经病变等。目前MFM量表共有MFM-32、MFM-20和Rs-MFM25CDM3个版本,MFM-32用于各年龄段和各类NMD患者,从MFM-32中删除12项相对难度较高测试项目,形成包含20个项目的MFM-20版本,适应年龄较小(2~7岁)的NMD患儿[12],在原来MFM-32版本基础上删除了7个项目,通过项目反应理论Rasch分析形成的Rs-MFM25CDM版本,适用于先天性肌营养不良和先天性肌病[13]。
NMD均为罕见病种,临床病例收集相对困难,因此,MFM发布至今,有关心理测量学特性的报道不多,除了原著者报告了MFM-32的内在信度、平行效度和反应度[11]以及 MFM-20的信度和效度外[12],仅 Ruiz-Cortes等[14]报告了在家庭环境中MFM评估的信度,De等[15、16]报告了MFM在面肩肱营养不良和强直性肌营养不良患者中应用特征和反应度。目前尚无中文版MFM的心理测量学报告。
本研究旨在验证复旦中文版MFM量表在中国儿童和青少年NMD中的心理测量学特性,为MFM在中国NMD中的使用提供更多临床依据。
1 方法
1.1 复旦中文版MFM 经MFM研发团队授权由复旦大学附属儿科医院(我院)1名儿童康复治疗师根据原版第3版(英语)进行翻译,另1名康复医师和1名作业治疗师进行校对和修改,再由我院另1名作业治疗师进行回译与英语原版比对,最终由本课题组人员集体讨论确定复旦中文版MFM。
MFM量表包括3个分区,D1区:站立和转移(MFM-32中的13个项目和MFM-20中的8个项目);D2区:躯干与近端运动功能(MFM-32中的12个项目和MFM-20中的8个项目);D3区:远端运动功能(MFM-32中的7个项目和MFM-20中的4个项目)。每项包括0、1、2和3四级评分,0分:不能启动任务或不能维持初始姿势;1分:启动任务;2分:部分完成任务,或全部完成任务但完成质量不高(代偿动作,姿势保持时间不足,缓慢,运动控制不良);3分:完全且以正确的方式完成任务,动作是可控、熟练、有方向的,且以恒定的速度完成。评估结果包括3个分区分值和总分,以百分比的形式分别表示相应分区和整体运动能力,由该区实际得分除以该区总分再乘以100。MFM-32得分是用32项的总分除以96,再乘以100。MFM-20的得分是用20项的得分除以60,再乘以100。以上各项分值越高,表示患儿的运动能力就越高。
1.2 纳入标准 2013年6月至2017年7月在我院神经科经基因检测或肌肉活检明确诊断为各类NMD且在康复科接受过复旦中文版MFM评估的>2岁患儿。
1.3 排除标准 ①1年内接受过手术;②具有严重认知障碍;③测试前3 d内从事过严重影响体力的活动。
1.4 伦理和知情同意 本研究经复旦大学医学院伦理委员会儿科专业组审核批准,所有患儿及其监护人知情同意并签署知情同意书。
1.5 信度和效度检测 参与MFM信度和效度测试的治疗师均具有5年以上工作经验,其中2名治疗师接受了MFM正式培训,其他参与MFM评估的治疗师接受了以上2名治疗师的培训并开展了至少2 d的自我相关培训,主要内容包括对MFM的项目理解保持一致和相互试验性评估。在开始本研究前,测试者对5名MFM患儿进行了预评估,以期获得对项目更佳的理解度。
1.6 关联效度
1.6.1 MFM 分值与 6 min步行距离(6MWT)、计时测试之间的关联效度 以6MWT和4项功能性计时测试为效度指标,通过MFM分值与之的相关系数确定关联效度。对所有研究对象在进行MFM评价的当天同时进行6MWT测试。坐位安静休息5~10 min后,令患儿以自身喜好的步速在往返50 m的步道上连续步行6 min,测定步行距离[17]。测试者在记录时间和距离的同时保护患儿的安全。4项功能性计时测试包括10 m快走时间,从地面站起时间,上、下4级台阶时间[18],10 m快走时间在6MWT测试前完成,其余项目均在MFM测试结束后完成。上述所有测试项目(包括MFM测试)在测试过程中均注意观察患儿是否疲劳,由于体力原因可分2 d完成。
1.6.2 DMD患儿MFM分值与NSAA分值之间的关联效度
通过分析DMD患儿的MFM分值与NSAA分值之间的相关性确定关联效度。在对DMD患儿进行MFM评估后再增加NSAA评估,如果患儿表现出疲劳,可以休息30 min,或安排次日进行。
NSAA量表包含17个项目,内容包括抬头、从地面坐起和站起、从椅子站起、保持站立、左右脚跨越、单腿站、足跟站、步行和跑跳等,此外还包括2项不纳入评分的计时测试(从地面站起和10 m跑)。在本研究中,与计时测试合并。每个项目评0~2分。0分:不能独立完成目标;1分:改变活动完成的方式,但未借助其他帮助能独立完成目标;2分:正常,无明显活动改变。原始分满分为34分。通过查询转换表可以把原始分转换为具有线性特性的分值(0~100分)。原始分和线性分的分值越高,表示患儿的运动能力越高[8]。
1.7 统计学方法 通过等级间相关系数(ICC)确定MFM-32和MFM-20各项分值的信度值。采用Pearson相关系数分析MFM各项分值与效度指标之间的相关性,0.2~0.4弱相关,~0.6中等相关,~0.8 强相关,~1.0 极强相关。所有分析均采用SPSS 19.0软件。
2 结果
2.1 一般资料 符合本文纳入和排除标准372例患儿进入本文分析,年龄 2.0~16.7(6.5±2.7)岁,222 例<7 岁,男338例、女34例。DMD 263例,贝克型进行性肌营养不良55例,中间型肌营养不良症6例,肢带型肌营养不良4例,面肩肱型肌营养不良1例,Emery-Dreifuss肌营养不良2例,脊髓型脊肌萎缩症9例,先天性肌营养不良10例,先天性肌病14例,先天性肌无力综合征1例,腓骨肌萎缩症5例,杆状体肌病1例,线粒体肌病1例。
2.2 信度检测 任意选取研究对象中的16例2~7岁和38例>7岁患儿,由同一评价者在第1次评价后间隔3~7 d进行第2次评价,测试均在上午实施,通过分析2次评价结果来检测重测信度。
任意选取研究对象中16例2~7岁和29例>7岁的患儿,由2名物理治疗师同时进行MFM-20和MFM-32测试。在整个测试过程相互不讨论,各自记录测试结果。分析不同测试者的评价结果来检测测试者之间的信度。
表1显示,MFM-32总分和各分区分值重测信度ICC=0.96~0.98,测试者间信度值 ICC=0.98~0.99;MFM-20 测试者间信度 ICC=0.91~0.97,重测信度 ICC=0.89~0.93。
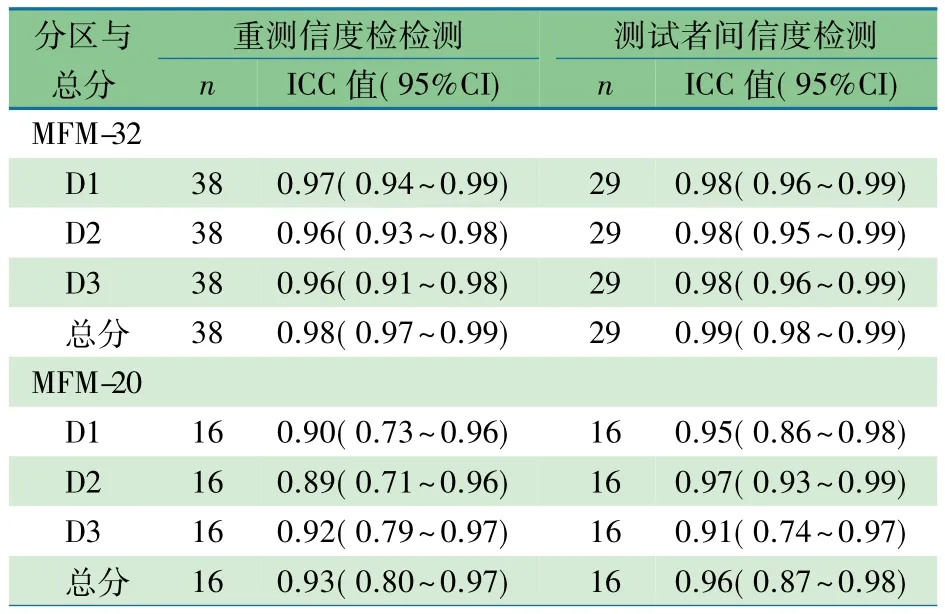
表1 MFM-32和MFM-20的信度值
2.3 效度
2.3.1 MFM分值与6MWT、计时测试之间的关联效度 表2显示,在纳入研究的 222例<7岁患儿中,86.5%~96.4%同时完成了MFM-20、6MWT和功能性计时测试,不能完成的主要原因为能力不足或体力不支。上述效度指标与MFM-20总分和D1分区分值之间具有中等程度的相关性(r=0.46~0.57),与 D2 分区分值之间具有弱相关性(r=0.30~0.41),与 D3 分区的相关性最小。
150例>7岁患儿中,除111例(74.5%)同时完成了从地面站起测试外,85%以上完成了MFM-32、6MWT和其他计时测试。与MFM-20相比,MFM-32与效度指标之间的相关系数略高一些,同样效度指标与总分和D1分区分值的相关性最高,与D3分值相关性最低。
2.3.2 DMD患儿MFM分值与NSAA分值间的关联效度纳入本研究的 263 例 DMD 患儿年龄2.0~14.1(6.6±2.5)岁,表3 显示,2~7 岁148例患儿全部完成了NSAA评估,NSAA分值与MFM-20总分和D1分区分值具有强相关性(r=0.68~0.69),与D2和D3分区分值的相关性相对较低。>7岁115例患儿中110例完成了NSAA评估,5例由于能力不足,NSAA评估没有获得分数。NSAA分值与MFM-32的总分和D1分区分值具有极强相关性,与D2和D3分区分值的 Pearson 相关系数在 0.50~0.68。

表2 全部对象MFM分值与6分钟步行距离、计时测试测试结果之间的相关系数
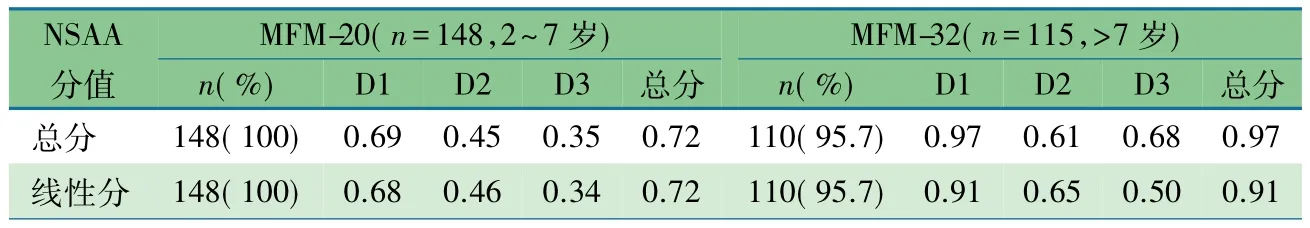
表3 DMD患儿MFM分值与NASS分值之间的关联效度
3 讨论
随着《国际功能残疾健康分类》日益推进,功能评估日趋精细化,针对不同疾病的功能评估工具大量涌现,单一病种的功能评估固然具有更强针对性,但是由于NMD均属罕见病且种类繁多,研发评估工具需要大样本数据,每种疾病逐一研发功能评估工具具有相当大的难度,因此基于NMD整组疾病而非某个特定疾病制定功能评估工具不失为一种理想的方法,并且可以通过这样相对通用的工具,比较不同NMD疾病的功能发展差异,MFM是目前国际上唯一的NMD通用活动功能评估工具[19]。
确定随机测试误差影响结果的程度,是测试工具编制者和使用者的必要责任,信度是确保测试工具可靠性的主要指标,影响MFM测试信度的因素包括测试者对测试项目的理解与实施能力、测试者配合程度和测试环境等。Bérard等报告,MFM-32总分以及各分区重测信度和测试者间信度 ICC 值为 0.96~0.99[11],MFM-20 则为 0.91~0.99[12]。Ruiz-Cortes 等报告了在医院与在家庭实施 MFM 评估一致性的ICC值为0.98[14]。本研究结果同样显示MFM-32和MFM-20都具有很好的重测信度和测试者间信度,信度值与其他研究结果保持一致。MFM-20重测信度相对低一些,可能由于接受MFM-20测试的患儿年龄较小(2~7岁),对测试项目理解能力相对较弱,导致部分项目前后测试时表现不一致。
效度是测试工具编制者或使用者收集证据,以支持根据测试结果所做出各种推论的过程,是心理测量学检验中最重要的考察因素,其中通过效标进行关联效度测试是最为常用的效度检验方法。通常使用具有相似内容效度且被证实具有良好心理测量学特性的测试工具作为效标,与效标之间的关联程度具有中等或强相关性是比较理想的状态,如果相关性较弱,说明测试工具可能需要进一步确认内容效度的可靠性,反之如果具有极强的相关性,则应该分析测试工具是否与效标具有同质性,需要探讨测试工具与效标的测试优劣或者是否有合并的可能性。
本研究采用6MWT和功能性计时测试为效标,这些指标是NMD患者目前最为常用的评价指标,通过测定患者移动和姿势转换的灵活度来评价运动能力,而MFM测试除了测定动作的敏捷性以外,还注重测定动作质量,例如可控性、熟练度以及代偿性,既可以全面整体测定NMD的运动功能,还可以分区测定站立、转移、躯干与近端和远端运动功能。由于NMD多为进行性疾病,大部分患儿早期运动功能处于上升阶段,到达一定功能水平后将逐步衰退[18],因此在2~7岁,86.5%~96.4%患儿可以完成6MWT和功能性计时测试,>7岁患儿完成率有所下降,尤其是从地面站起(Gower征)完成率下降至75%。从效度测试结果中可以看出,全部对象MFM-20和MFM-32的总分与D1分区分值与各项效标具有中等和强相关性,表明具有理想的关联效度。从运动学角度分析,6MWT和功能性计时测试与MFM的D1区涉及的站立和转移技能更为相关,所以两者之间表现出更高的相关性。
MFM-32建构样本人群为6~62岁,MFM-20建构样本人群为 2~7岁[11、12],由于 NMD 发病率和生存率具有很强的年龄特征,NMD中最为常见的 DMD[20],在 MFM-32 建构样本中约占24%,在 MFM-20中约占33%。最终纳入本研究样本的DMD占比为71%,与纳入年龄范围(2~16岁)正好处于DMD发病率和生存率最高的年龄段有关,我院神经科从2013年开始在临床收集NMD儿童和青少年的功能数据,DMD的占比始终很高,可能与临床医生相对易于识别NMD中的DMD,而对其他病种的NMD认知度相对较低有关。
为了进一步明确MFM在DMD患儿中的效度,本文选取了NSAA量表作为效标进行关联效度分析,发表于2006年的NSAA量表是目前临床使用较多的针对具有步行能力DMD患儿的测试工具[21],本研究团队曾经报告了中文版NSAA具有良好信度和效度[8]。NSAA主要评价DMD患儿的移动能力,尤其是基本身体姿势能力、保持身体姿势能力、步行和到处移动能力,与MFM尤其是MFM-32的D1项目具有较多的相似性,研究结果显示MFM-20的总分和D1、D2分区分值与NSAA具有中等和强相关性,在MFM-32中相关程度明显提升,尤其是MFM-32总分和D1分区分值与NSAA总分相关系数高达0.97,提示在>7岁的 DMD 患儿中MFM-32的D1区有可能可以完全替代NSAA评估。目前国际上在DMD临床研究或药物试验中,MFM和NSAA都是被推荐的运动功能测试工具[22、23],由于两种测试方法具有很强的相关性,可以通过项目反映理论中的积分等同方法建立两种测试方法的关联进行分值转换[24]。
本研究不足之处在于,由于研究机构的特性,研究对象为儿童和青少年,没有纳入>18岁的NMD患者,因此MFM量表在成人NMD患者中的心理测量学特性还有待于确定,此外有关反应度的研究还在进一步开展中。总之,本研究结果显示复旦中文版MFM量表在儿童和青少年NMD患者中具有令人满意的信度和效度,可以可靠有效地测定NMD患儿的运动功能状态。
[1]Deenen JC, Horlings CG, Verschuuren JJ, et al.The Epidemiology of Neuromuscular Disorders:A Comprehensive Overview of the Literature.J Neuromuscul Dis, 2015, 2(1):73-85
[2]Dowling JJ, Gonorazky HD, Cohn RD, et al.Treating pediatric neuromuscular disorders:The future is now.Am J Med Genet A,2017,4(4):1-13
[3]Long C, Amoasii L, Bassel-Duby R, et al.Genome editing of monogenic neuromuscular diseases:a systematic review.JAMA neurology, 2016, 73(11):1349-1355
[4]Rahmani N, Mohseni-Bandpei MA, Vameghi R, et al.Application of ultrasonography in the assessment of skeletal muscles in children with and without neuromuscular disorders:a systematic review.Ultrasound Med Biol, 2015, 41(9):2275-2283
[5]Morrow JM, Sinclair CD, Fischmann A, et al.MRI biomarker assessment of neuromuscular disease progression:a prospective observational cohort study.The Lancet Neurology, 2016, 15(1):65-77
[6]史惟,李惠,苏怡,等.定量等长肌力测定在Duchenne型和Becker型肌营养不良症患儿下肢肌力测定中的信度评价.中国现代神经疾病杂志,2015,15(5):387-392
[7]史惟.Duchenne型肌营养不良症运动功能评价及其临床应用研究进展.中国现代神经疾病杂志,2015,15(6):426-431
[8]史惟,李惠,李西华,等.中文版北极星移动评价量表在Duchenne型肌营养不良症患儿的信度和效度研究.中国循证儿科杂志,2017,12(4):246-250
[9] Montes J, Yong J, Babrowicz J.Awareness and utilization of the Hammersmith Functional Motor Scale-Expanded(HFMSE):A survey.Neuromuscul Disord, 2016, 26(S2):S103-S104
[10]Jerath NU, Shy ME.Charcot-Marie-Tooth Disease Type 1A:Influence of Body Mass Index on Nerve Conduction Studies and on the Charcot-Marie-Tooth Examination Score.J Clin Neurophysiol, 2017, 34(6):508-511
[11] Bérard C, Payan C, Hodgkinson I, et al.A motor function measure scale for neuromuscular diseases.Construction and validation study.Neuromuscul Disord, 2005, 15(7):463-470
[12]De LC, Payan C, Vuillerot C, et al.Motor function measure:validation of a short form for young children with neuromuscular diseases.Arch Phys Med Rehabil, 2013, 94(11):2218-2226[13]Vuillerot C, Rippert P, Kinet V, et al.Rasch analysis of the motor function measure in patients with congenital muscle dystrophy and congenital myopathy.Arch Phys Med Rehabil,2014,95(11):2086-2095
[14]Ruiz-Cortes X, Ortiz-Corredor F, Mendoza-Pulido C.Reliability of home-based,motor function measure in hereditary neuromuscular diseases.J Int Med Res, 2017, 45(1):261-271
[15]De LC, Rippert P, Hmaroun D, et al.The motor function measure(MFM)in the facio scapulo humeral dystrophy(FSHD)population:Description and responsiveness.Ann Phys Rehabil Med,2016, 59S:e84
[16]De L C, Rippert P, Bassez G, et al.The motor function measure(MFM)in the myotonic dystrophy type 1 population:Description and responsiveness.Ann Phys Rehabil Med, 2016,59S:e81
[17]Fischer D, Hafner P, Rubino D, et al.The 6-minute walk test,motor function measure and quantitative thigh muscle MRI in Becker muscular dystrophy:A cross-sectional study.Neuromuscul Disord,2016, 26(7):414-422
[18]Mcdonald CM, Henricson EK, Abresch RT, et al.The 6-minute walk test and other endpoints in Duchenne muscular dystrophy:longitudinal natural history observations over 48 weeks from a multicenter study.Muscle Nerve, 2013, 48(3):343-356
[19]Gargaun E, Seferian A, Quicke G, et al.Innovative home activity monitoring in non-ambulant patients with spinal muscular atrophy:a multicenter observational trial.Neuromuscul Disord,2017, 27(S2):S225
[20]李西华,赵蕾,胡超平,等.复旦大学附属儿科医院Duchenne型和Becker型肌营养不良症数据库的建立.中国现代神经疾病杂志,2015,15(5):360-368
[21]李惠,史惟,苏怡,等.ICF-CY在Duchenne型肌营养不良患儿家庭康复中的应用.中国康复理论与实践,2017,23(2):139-145
[22]Chabanon A, Annoussamy M, Daron A, et al.Longitudinal data of the European prospective natural history study of patients with type 2 and 3 spinal muscular atrophy.Neuromuscul Disord,2017, 27(S2):S134
[23]Domingos J, Manzur A, Ridout D, et al.The natural history of the North Star Ambulatory Assessment(NSAA)in patients with Duchenne muscular dystrophy with skippable mutations.Neuromuscular Disorders, 2016, 26(2):S185-S185
[24]James M, Mayhew A, Eagle M, et al.Development of a robust disease specific functional measure suitable for trials in ambulant and non-ambulant individuals with dysferlinopathy.Neuromuscular Disorders, 2016, 26:S93
