危重症儿童营养评估及支持治疗指南(2018,中国,标准版)
2018-03-29危重症儿童营养评估及支持治疗指南2018中国工作组
危重症儿童营养评估及支持治疗指南(2018,中国)工作组
钱素云1 陆国平2 许 峰3 祝益民4 王 莹5 刘春峰6 任晓旭7 张育才8 朱雪梅2 高恒淼1周 涛9 党红星3 张崇凡10
1 指南的目的
为推动中国危重症儿童营养支持治疗的普及和规范,并促进相关科研工作开展,中华医学会儿科分会急诊学组、中华医学会急诊分会儿科学组和复旦大学附属儿科医院临床指南制作和评价中心,基于临床问题,系统检索和评价国内外研究证据,制定了中国危重症儿童营养支持治疗指南。本指南仅是基于现有研究证据水平的推荐和建议,仅能回答危重症儿童营养支持治疗的若干问题,不能替代不同PICU条件下的个体化治疗。本指南不涉及特定疾病的营养支持治疗,如烧伤、外科相关疾病、肿瘤、糖尿病和肝功能衰竭等。
2 指南的目标人群
>28 d至<18岁住PICU危重症儿童。
3 指南的使用人群
儿童重症医学科医生和护士,儿科营养医师,儿科医生和护士,儿科药师。
4 指南涉及的部分术语及其缩略语
本指南主要为危重症专业人士使用,一些危重症专业常识性的定义将不具体列出,以下针对本指南的特定问题选择了9个概念,给出了具体参考文献,而不再对定义做出具体解释。
儿科Yorkhill营养不良评分(Paediatric Yorkhill Malnutrition Score,PYMS)[1]。
间接测热法(Indirect Calorimetry,IC)[2]。
营养发育状态风险筛查量表(Screening Tool Risk on Nutritional Status and Growth,STRONGkids)[3]。
儿科营养不良评估筛查量表(Screening Tool for the Assessment of Malnutrition in Paediatrics,STAMP)[4]。
儿童营养筛查量表(Pediatric Nutrition Screening Tool,PNST)[5]。
营养风险筛查(Nutrition Screening)[6]。
肠内营养(Enteral Nutrition,EN),肠外营养(Parenteral Nutrition,PN)[6]。
营养支持团队(Nutrition Support Service or Team,NST)[6]。
能量需求预测公式[7]:①Harris-Benedict equation;②Schofield equation;③World Health Organization/Food and Agriculture/United Nation Union equation(WHO/FAO/UNU);④Caldwell-Kennedy equation;⑤Maffeis equations;⑥Fleisch equation;⑦ Kleiber equation;⑧Dreyer equation;⑨Hunter equation;⑩Talbot tables equation;White equation。
5 指南问题、推荐意见和说明
问题1 营养状态对临床结局的影响
推荐意见 推荐以身高别体重Z值和BMI Z值评估营养状况;营养异常与病死率增加相关(1C~1D)。
推荐说明 1项美国的基于PICU系统网站数据库(VPS,LLC)的横断面调查[8],收集了 2009年 1月至 2013年3月331 057例患儿的人体测量数据,其中127 607(38.5%)例数据包含了身高和体重指标。根据CDC/WHO生长曲线计算年龄别体重(WFA)Z值,根据含身高数据计算身高别体重(WFH)Z值和体质量指数(BMI)Z值,将上述 Z 值分为 < -3.5、~ -2.51、~ -1.51、~ -0.51、~ 0.49、~1.49、~2.49、~3.5 和>3.5 共 9 个区间。图 1 显示,在调整儿童死亡指数评分2(PIM2)和并发症因素后,病死率与WFA Z值和WFH或BMI Z值均呈U型曲线关系,即WFA Z值或者WFH或BMI Z值过低和过高病死率均高,WFA Z值-0.5~1.49 区间病死率最低,WFH 或 BMI Z 值-0.5~0.49区间病死率最低,显示以WFH或BMI Z值为横坐标的病死率曲线较以WFA Z值为横坐标的病死率曲线左移,因此不含身高数据的WFA Z可能会低估轻度肥胖患儿(Z值为0.5~1.49)的病死率。
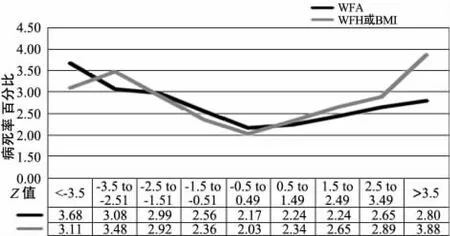
图1 WFA Z值和WFH或BMI Z值与病死率曲线图
1项美国的2个中心的队列研究[9],纳入2009年度和2011年度1月龄至18岁机械通气、住院或住PICU时间>3 d患儿(n=1 769,2009年 524例,2011年 1 245例),排除经口摄食、第3 d未进行人工喂养(EN+PN)、BMI Z值<-6或>6患儿,1 622例纳入分析,2个年度病例在年龄、性别、年龄别身高(HFA)Z值、BMI Z值、住院时间和60 d病死率方面差异无统计学意义。考察体重异常(体重过轻:BMI Z 值<-2,超重:1<BMI Z 值≤2、肥胖:BMI Z 值>2)对病死率、住院时间、无机械通气时间和PICU获得性感染的影响。调整了年龄、性别、研究年度、诊断分类、PICU规模、疾病严重度等因素后,与正常体重相比:①体重过轻组60 d病死率增加了 50%(OR=1.53,95%CI:1.24~1.89);②超重组(OR=1.44,95%CI:0.94 ~ 2.19) 和肥胖组(OR=1.55,95%CI:0.87~2.76)60 d病死率差异无统计学意义;③每多住院或PICU 1 d,60 d内出院概率,体重过轻组降低了29%(HR=0.71,95%CI:0.60~0.84),肥胖组降低了 18%(HR=0.82,95%CI:0.68~0.99);④体重过轻组和肥胖组 PICU 获得性感染风险分别增加了 88%(OR=1.88,95%CI:1.18~3.01)和 64%(OR=1.64,95%CI:1.33~2.03),超重组 PICU获得性感染风险差异无统计学意义(OR=1.42,95%CI:0.99~2.05)。控制了年龄、性别、研究年份、住院分类、疾病分类、疾病严重程度和PICU规模,营养状态是无机械通气时间(>1 d)的影响因素(χ2=20.4,p<0.001),无机械通气时间体重过轻组较体重正常组、超重组和肥胖组均减少1 d左右(MD=-1.3,95%CI:-2.1~ -0.6;MD= -1.6,95%CI:-2.4~-0.9;MD=-1.2,95%CI:-1.9~ -0.6),无机械通气时间超重组、肥胖组与正常体重组相比无减少。
1项中国单中心病例对照研究[10],纳入2010年11月至2011年1月PICU连续病例,排除新生儿、纠正胎龄不足41周的早产儿、>18岁、住院时间<24 h、再次入PICU患儿,以WFA Z值或HFA Z值或WFH Z值或BMI Z值<-2判断为营养不良,并以此分为营养正常组和营养不良组,营养正常组儿童死亡风险评分(PRISM)低于营养不良组2.5分(MD= -2.50,95%CI:-4.84~ -0.16)。营养正常组(n=153)与营养不良组(n=43)相比,28 d存活率增加了2.5 倍(OR=3.52,95%CI:1.20~10.36),住院时间差异无统计学意义(MD=-0.49,95%CI:-3.06~2.08)。
1项巴西单中心队列研究[11],纳入2年PICU住院患儿,排除早产儿、脑死亡、入PICU后24 h内死亡患儿,观察营养状态对PICU时间、机械通气时间的影响。385例患儿进入分析。多元回归模型显示,营养不良者(<2岁WFA Z值<-2、≥2岁BMI Z值<-2)机械通气>5 d的风险增加了76%(OR=1.76,95%CI:1.08~ 2.88),PICU 住院>5 d 的风险差异无统计学意义(OR=1.33,95%CI:0.85~2.08)。
本选题纳入1项横断面调查、2项队列研究和1项病例对照研究。营养不良病死率增高,PICU中超重和肥胖人群营养状况与病死率的关系亟需关注。
问题2 营养风险筛查量表的选择
推荐意见 建议营养风险筛查使用PYMS量表,也可使用STRONGkids或STAMP量表(2C~2D)。
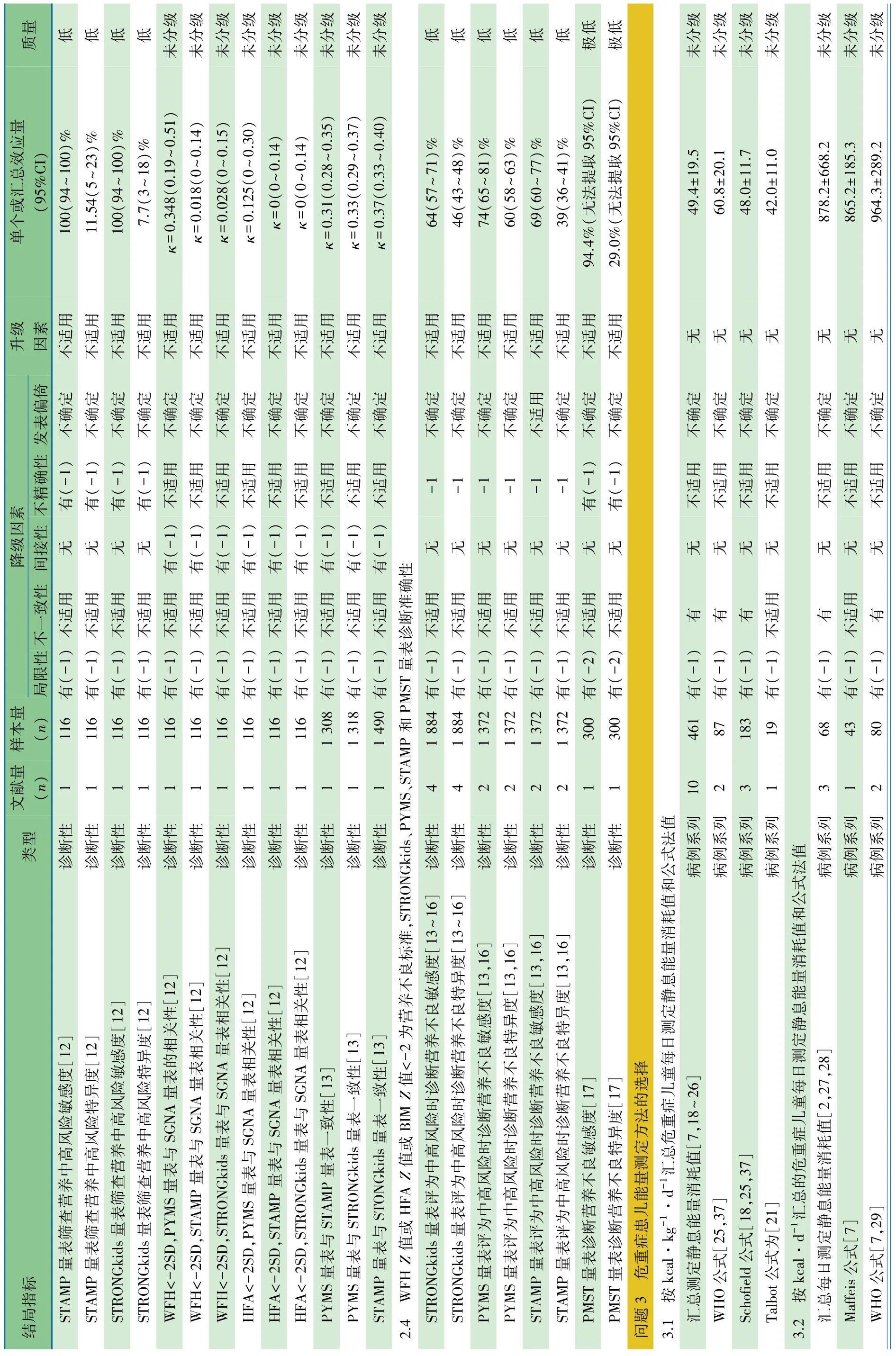
推荐说明 1项英国单中心的诊断准确性研究[1](n=247),将营养低和中风险合并为低风险:以营养师全面评估(饮食史、需要能量评估、体格测量和营养给予等)作为参照标准,医生和营养师以STAMP、主观全面营养评价(SGNA)、PYMS量表筛查营养高风险,敏感度分别为81%(95%CI:62%~94%)、15%(95%CI:4%~34%)和 85%(95%CI:66%~96%),特异度分别为 78%(95%CI:72%~83%),100%(95%CI:98%~100%)和 87%(95%CI:82%~91%);基于PYMS量表诊断准确性较STAMP、SGNA量表好,以PYMS量表为参照标准,STAMP和SGNA量表筛查营养高风险的敏感度分别为52.9%(95%CI:38%~66%)和 7.7%(95%CI:2% ~ 19%),特异度分别为 77.4%(95%CI:71%~83%)和100%(95%CI:98%~100%),STAMP量表与 PYMS量表具有中等一致性(κ=0.47,95%CI:0.34~ 0.61),SGNA 与 PYMS 具有较低的一致性(κ=0.12,95%CI:-0.11~-0.34)。筛查营养高风险的诊断准确性由高至低为PYMS、STAMP和SGNA。
1项印度尼西亚单中心诊断准确性研究[12](n=116),以SGNA量表为参照标准,以 PYMS、STAMP和STRONGkids量表筛查高营养风险的敏感度分别为95.3%(95%CI:87%~98%)、100%(95%CI:94%~100%)和100%(95%CI:94%~100%),特异度分别为 76.9%(95%CI:63%~86%)、11.5%(95%CI:5% ~23%)和 7.7%(95%CI:3%~18%)。以WFH<-2SD为急性营养不良诊断标准时,PYMS、STAMP和STRONGkids量表与SGNA量表相比的κ值分别为 0.348(95%CI:0.191~0.506)、0.018(95%CI:0~0.140)和 0.028(95%CI:0~0.149);以 HFA<-2SD 为慢性营养不良诊断标准时,PYMS、STAMP和STRONGkids量表与SGNA量表相比的 κ 值分别为 0.125(95%CI:0~0.299)、0(95%CI:0~0.140)和0(95%CI:0~0.144)。以 SGNA 量表为参照标准,PYMS量表筛查营养风险诊断准确性优于STAMP和STRONGkids量表。
1项欧洲多中心诊断准确性研究[13],采用配对比较,PYMS 与 STAMP 量表一致性 κ=0.31(95%CI:0.28~0.35),PYMS与 STRONGkids量表一致性 κ=0.33(95%CI:0.29~0.37),STAMP 与 STRONGkids 量表一致性 κ =0.37(95%CI:0.33~0.40)。
汇总4篇不同营养风险筛查量表的诊断准确性研究[13~16](n=1 884)的 Meta分析。以 WHO 标准(WFH Z 值或HFA Z值或BIM Z值<-2)作为诊断营养不良金标准,图2显示,STRONGkids量表评为营养中高风险时诊断营养不良敏感度为 64%(95%CI:57%~71%),I2=92.9%;图 3显示,特异度为46%(95%CI:43%~48%),I2=93.2%。图4显示,汇总 2 篇诊断准确性研究[13,16](n=1 372)行 Meta 分析,PYMS量表评为营养中高风险时诊断营养不良敏感度为 74%(95%CI:65%~81%),I2=97.0%;图 5 显示,特异度为60%(95%CI:58%~63%),I2=99.0%。图6显示,汇总 2篇诊断准确性研究行 Meta 分析[13,16](n=1 372),STAMP量表评为营养中高风险时诊断营养不良的敏感度为69%(95%CI:60%~77%),I2=97.0%;图 7显示,特异度为 39%(95%CI:36%~41%),I2=97.4%。各量表评估为营养中高风险时诊断营养不良的准确性由高至低为 PYMS、STRONGkids和STAMP。需要注意的是,合并的文献间均存在很大的异质性。
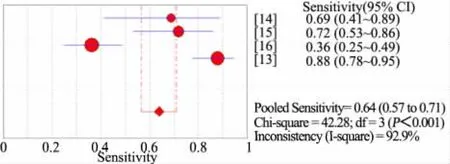
图2 STONGkids中高风险诊断营养不良敏感度
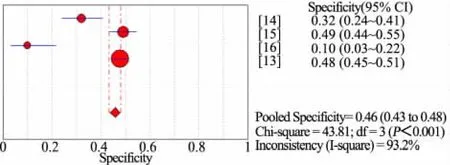
图3 STONGkids中高风险诊断营养不良特异度
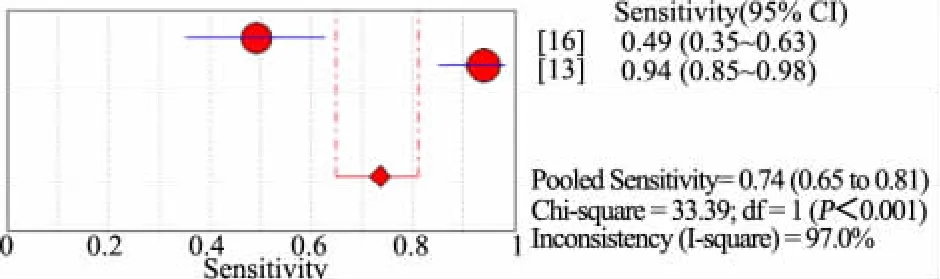
图4 PYMS中高风险诊断营养不良敏感度
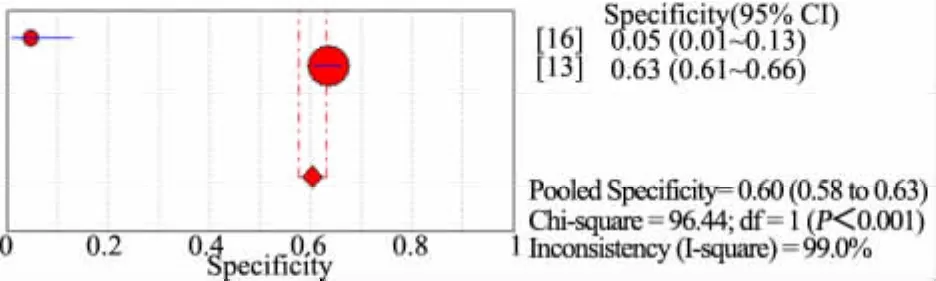
图5 PYMS中高风险诊断营养不良特异度

图6 STAMP中高风险诊断营养不良敏感度
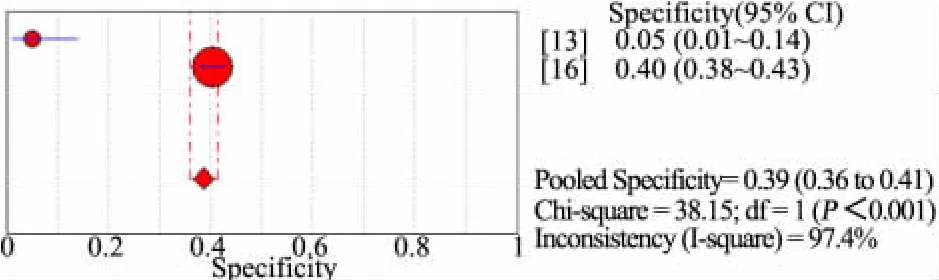
图7 STAMP中高风险诊断营养不良特异度
1项英国单中心诊断准确性研究[17](n=300),以HFA Z值或WFH Z值或BMI Z值<-2为诊断营养不良金标准:STAMP量表评为中高风险诊断营养不良敏感度为63.2%,特异度36.3%,STAMP 量表与WHO 标准一致性κ=-0.005;PMST(改良STAMP量表,将超重和肥胖作为营养不良风险因素)评为中高风险诊断营养不良敏感度为94.4%,特异度29.0%,PMST量表与 WHO 标准一致性 κ=0.177;PYMS量表评为中高风险诊断营养不良敏感度26.1%,特异度67.1%,PYMS量表与 WHO 标准一致性 κ=-0.71。需要说明的是,这项研究不能体现敏感度和特异度的95%CI。
本选题共纳入7篇诊断准确性研究。营养风险筛查量表的准确性由高至低为PYMS、STAMP和SGNA量表;营养中高风险时,诊断营养不良准确性由高至低为 PYMS、STRONGkids和STAMP量表;STAMP和STRONGkids量表的诊断价值近似。
问题3 危重症患儿能量测定方法的选择
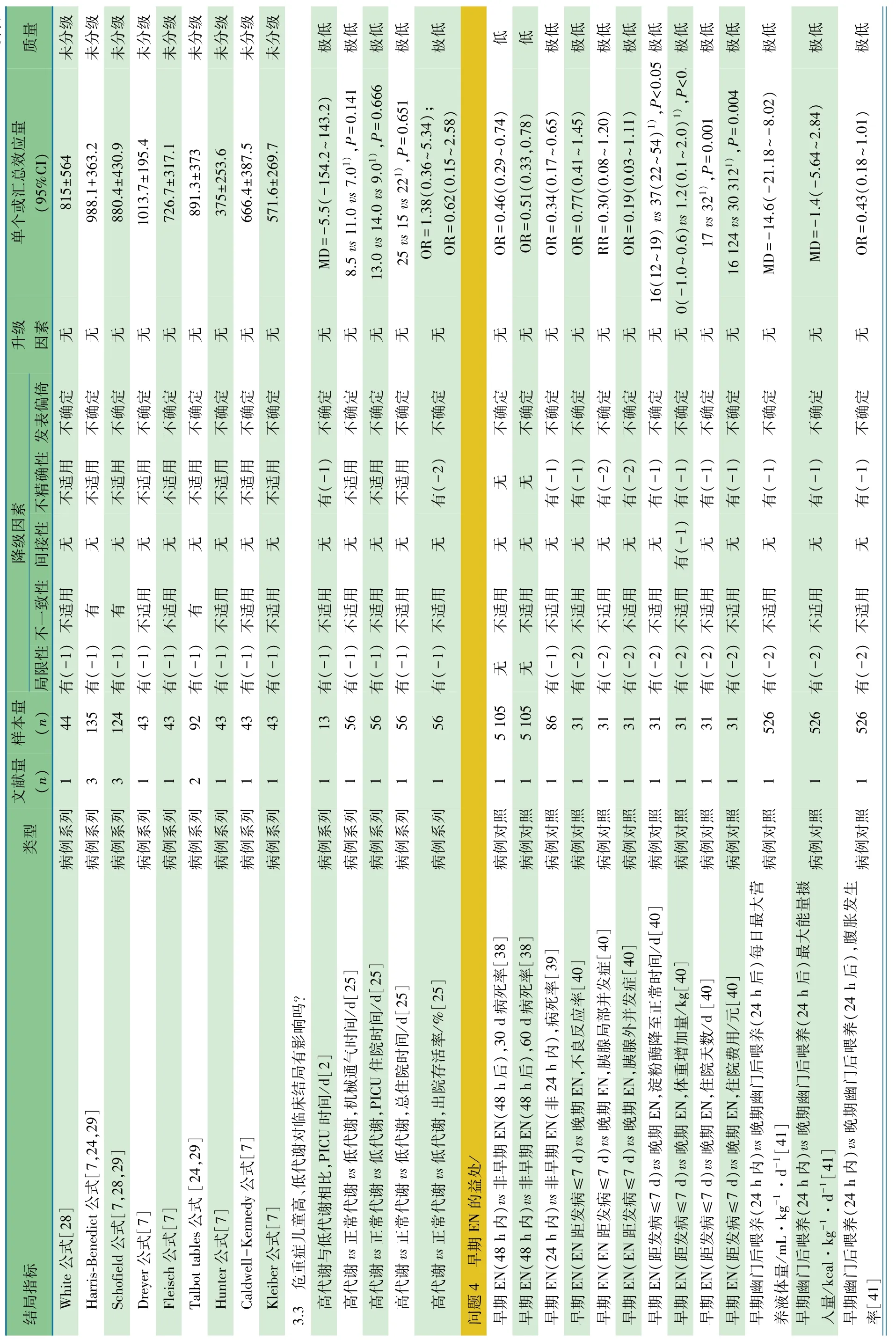
推荐意见 有条件时采用IC法测定静息能量消耗(REE);如果选用公式法,建议Schofield公式(1,未分级);建议 1~8 岁儿童 50 kcal·kg-1·d-1或 5~12 岁儿童880 kcal·d-1作为急性期预估能量消耗参考目标值(2,未分级)。
推荐说明 纳入文献中测定REE(MREE)单位主要为kcal·kg-1·d-1和 kcal·d-1,为此汇总 MREE 时以上述单位进行数据合并,采用Inverse Variance固定效应模型计算MD值及合并结果。需要说明的是,仅文献[7]采用理想体重和实际体重分别计算预计能量消耗(EEE),余文献均未明确公式中代入的体重值是理想体重还是实际体重。
基于 10 篇以 kcal·kg-1·d-1的文献[7,18~26],461 例危重症患儿(入PICU后1~298 d)汇总的MREE值为(49.4±19.5)kcal·kg-1·d-1,3 个公式 EEE 值与汇总 MREE 值偏倚见图8。①Schofield公式与之最接近;②Talbot tables公式易低估每日能量消耗,WHO公式易高估每日能量消耗。
基于 3 篇以 kcal·d-1的文献[2,27,28],68 例危重症患儿(入 PICU 后 1~298 d)汇总的 MREE 值为(878.2±668.2)kcal·d-1,11个公式 EEE值与汇总 MREE偏倚见图 9。Schofield公式、Maffeis公式、Talbot tables公式、White公式、WHO/FAO/UNU公式、Harris-Benedict公式等、Dreyer和Fleisch公式计算的EEE值与汇总MREE值递减相近。
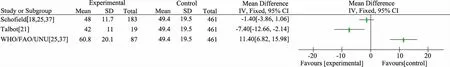
图8 汇总MREE值与公式法EEE值(kcal·kg-1·d-1)偏倚图
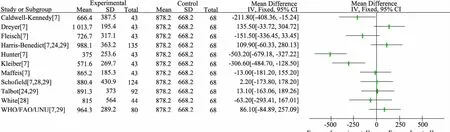
图9 汇总MREE值与公式法EEE值(kcal·d-1)偏倚
另有 5篇文献[30~34]报道的中位 MREE值范围为37.2~55 kcal·kg-1·d-1;文献[35]报道的中位 MREE 为 670 kcal·d-1;文献[36]报道的平均 MREE 为 44.7 kcal·kg-1·d-1;文献[29]报道的 MREE 为(968±206.3)kcal·m-2。
需要说明的是:①以上汇总的MREE值多来源于PICU上呼吸机的儿童;②不同研究MREE单位和统计量不尽相同,但以 kcal·d-1和 kcal·kg-1·d-1为主要方式;③MREE较公式法评估能量消耗更准确,但其测定条件苛刻(如吸入氧浓度<60%、机械通气漏气<10%、不能有气漏、需要获得稳定状态等)。鉴于PICU患儿病情重且变化快,测定MREE不易实施,本指南推荐1~8岁儿童50 kcal·kg-1·d-1或 5~12 岁儿童 880 kcal·d-1可作为急性期预估能量消耗参考目标值。
1项美国2个中心的诊断准确性研究[32],对纳入的94例机械通气患儿行MREE测定,以IC法作为金标准,以床旁二氧化碳清除率(VCO2-REE)衍生新公式计算能量消耗作为待测标准,BlandAltman分析显示,IC法与VCO2-REE偏倚为-0.65%(95%CI:-14.4%~13.1%)
1项美国单中心病例对照研究[37],在全 PN组(n=12)、EN组(n=7)和仅静脉葡萄糖和电解质组(n=12)的PICU患儿中,比较示踪剂标记NaH13CO3法、Schofield公式法和WHO推荐量3种方法得到的EEE(kcal·kg-1·d-1)。①全PN组:WHO推荐量高于NaH13CO3法(MD=29.1,95%CI:12.8~ 45.4),NaH13CO3法高于 Schofield 公式法(MD=10.4,95%CI:0.6~20.2);②EN 组和静脉葡萄糖电解质组:WHO推荐量均高于 NaH13CO3法(MD=25.7,95%CI:7.8~ 43.6;MD=21.9,95%CI:6.8 ~ 37.0),两组中NaH13CO3法与Schofield法差异均无统计学意义(MD=9.2,95%CI:-7.1~25.5;MD=7.7,95%CI:-4.7~20.1)。
1项单中心病例系列报告[2],对14例 PICU患儿行MREE测量,高代谢组(MREE/EEE>1.1)7例,低代谢组(MREE/EEE<0.9)6例,正常代谢 1例。高、低代谢组年龄、体重、BMI、呼吸商、EEE、MREE、实际能量摄入量、蛋白摄入量、吸入氧浓度、外科术后比例和测定MREE前在PICU时间差异均无统计学意义。高代谢组与低代谢组相比,PICU时间(d)差异无统计学意义(MD=-5.5,95%CI:-154.2~143.2)。
1项中国的单中心病例系列报告[25],对56例PICU机械通气患儿分别于上机第1、4、7和10天用 IC法测量MREE(kJ·kg-1·d-1),第 1 天(n=56)196.8±64.1,第 4 天(n=36)201.6±50.9,第 7 天(n=28)208.5±61.2,第 10 天(n=10)239.9±51.15,两两比较差异均无统计学意义,提示随PICU住院时间延长MREE变化不显著。第1天以代谢水平分组,高代谢组(MREE/EEE>1.1)24例,正常代谢13例,低代谢组(MREE/EEE<0.9)19 例,3 组体重、性别、营养不良比例、PRISM、病因和上机距入院时间差异均无统计学意义,3组中位数月龄(17 vs 35 vs 59)、中位数身高(92.5 cm vs 88.0 cm vs 120 cm)差异有统计学意义,提示年龄和身高可能影响代谢状态;3组机械通气时间中位数(8.5 d vs 11.0 d vs 7.0 d,P=0.141)、PICU 时间中位数(13.0 d vs 14.0 d vs 9.0 d,P=0.666)、总住院时间中位数(25 d vs 15 d vs 22 d,P=0.651)和出院存活率(OR=1.38,95%CI:0.36~5.34;OR=0.62,95%CI:0.15~2.58)差异均无统计学意义,提示不同代谢水平对临床结局影响不确定。
本选题共纳入22篇文献,涉及病例系列报告、病例对照研究和诊断准确性研究,其中仅1篇文献未涉及IC法。本指南利用统计软件汇总得出急性期REE参考值1~8岁儿童为 50 kcal·kg-1·d-1,5~12 岁儿童为 880 kcal·d-1。Schofield公式法与 IC法测得的 MREE最接近。床旁VCO2-REE测定静息能量与IC法接近,值得进一步研究。
问题4 EN的益处和早期EN
推荐意见 只要胃肠道可以利用,推荐尽早开始EN;早期EN对降低病死率有益(1C~1D)。使用血管活性药时行EN的不良反应多数是可接受的(2D)。
推荐说明 1项美国多中心(12个PICU)、大样本(n=5 105)的病例对照研究[38],入 PICU 48 h内开始 EN,以48 h内达到营养目标的25%作为早期EN(EEN)组,未达到作为非早期EN(NEEN)组,调整了倾向得分、PIM2得分、年龄和多中心因素后:30 d和60 d病死率EEN组较NEEN 组均降低约 50%(OR=0.46,95%CI:0.29 ~ 0.74;OR=0.51,95%CI:0.33~0.78)。
1项新加坡单中心病例对照研究[39],回顾性收集5年间PICU中ARDS连续病例107例,观察能量或蛋白摄入对病死率的影响,研究中医生根据病情选用早期EN(ARDS确诊后24 h内)或者PN,结果显示,早期EN组(n=28)比晚期 EN组(n=79)病死率下降66%(RR=0.34,95%CI:0.17~ 0.65)。
1项中国单中心的病例对照研究[40],收集PICU中实施鼻空肠喂养的急性胰腺炎的连续病例,根据EN开始时间分为早期组(EN距发病时间≤7 d)和晚期组,考察血清淀粉酶降至正常的时间、体重增加的量、住院天数、住院费用、不良反应、胰腺局部和胰腺外并发症。早期组(n=14)和晚期组(n=17)年龄、性别、入院时急性生理学及慢性健康状况评分、腹部症状体征、血清淀粉酶、EN成功率和置管耐受率差异无统计学意义。早期组与晚期组比较:血清淀粉酶降至正常的时间[16(12,19)d vs 37(22,54)d]、体重增加[0(-1.0,0.6)kg vs 1.2(0.1,2.0)kg]、住院天数[17(13,25)d vs 32(26,43)d]、住院费用[16 124(13 979,26 096)元vs 30 312(18 609,54 530)元]差异有统计学意义(P 均<0.05);胰腺局部并发症发生率(OR=0.30,95%CI:0.08~1.20)、胰腺外并发症发生率(OR=0.19,95%CI:0.03~1.11)和不良反应发生率(OR=0.77,95%CI:0.41~1.45)差异均无统计学意义。
1项西班牙单中心病例对照研究[41],根据幽门后喂养(TEN)时间分为早期 TEN组(入PICU 24 h内)和晚期TEN组,观察对能量摄入和临床结局的影响。526例PICU患儿中,早期TEN组(n=202)与晚期TEN组(n=324)相比,性别、体重、病因和TEN时间差异无统计学意义,每日营养液量(mL·kg-1·d-1) 减少(MD= -14.6,95%CI:-21.2~-8.0),最大摄入能量(kcal·kg-1·d-1)差异无统计学意义(MD=-1.4,95%CI:-5.6~2.8),低血钾和低血钙发生率均下降(OR=0.46,95%CI:0.29 ~ 0.71;OR=0.26,95%CI:0.11~0.60),两组病死率(OR=1.02,95%CI:0.56~1.86)、休克(OR=1.08,95%CI:0.64 ~ 1.84)、腹胀发生率(OR=0.43,95%CI:0.18 ~ 1.01)、肾功 能 衰 竭 发生率(OR=0.81,95%CI:0.43 ~ 1.53)、肝功能异常(OR=0.35,95%CI:0.07~ 1.64)、院内获得性肺炎发生率(OR=0.81,95%CI:0.43~ 1.53) 和低血磷发生率(OR=0.91,95%CI:0.38~2.22)差异均无统计学意义。
1项美国单中心病例系列报告[42],纳入109例8~18岁单一创伤性脑损伤(TBI)病例,其中19例死亡。90例在PICU期间获得全量喂养,83例实施了早期EN。开始EN时间 1.5(0.02 ~ 11.9)d,达全量能量目标时间 3.4(0.5~19.6)d。Speaman's分析显示,开始营养时间或达全量能量目标时间越早,PICU 时间越短(r分别为 0.49和 0.576,P均<0.05)。Mann-Whitney分析显示开始营养时间或达全量能量时间越早,出院时功能状态越好(P均<0.05)。
1项希腊病例系列报告[43],71例机械通气患儿入院12 h内实施鼻胃管EN,第1~5天根据能量摄入以达基础代谢率 0.5、1.0、1.25、1.5 和 1.5 倍的喂养方案进行喂养。喂养成功指第5 d能达目标能量(不考虑暂时性喂养中断的影响),喂养失败指因胃肠道并发症等因素而导致喂养持续中断。应激后 12 h内胃内喂养成功率为 94.4%(67/71),67例中,10例(15.5%)发生管饲喂养并发症,4 例(5.6%)出现腹泻,7 例(9.9%)发生胃排空障碍。
1项美国病例系列报告[44],24 h内接受了EN+血管活性药(多巴胺、多巴酚丁胺、肾上腺素、去甲肾上腺素和新福林)的52例(55例次)PICU患儿,观察使用血管活性药时EN的不良反应。4例胃肠出血,2例仅大便潜血阳性,2例有临床明显出血和凝血功能异常;16/55例次出现喂养不耐受(呕吐、腹胀、高胃残留量、腹泻、便秘),118个喂养中断原因中30个(25.4%)为胃肠相关原因。
1项巴西单中心历史对照研究[45],观察NST引入后对营养状况改善的效果,PICU中323例内、外科患儿在调整机械通气时间、年龄、PIM2和严重营养不良(WHA Z值≤-3)等因素后,使用EN超过50%住PICU时间的患儿可降低 83%死亡风险(OR=0.17,95%CI:0.07~0.41)。
1项西班牙的单中心病例对照研究[46],收集在PICU中TEN、PN和 TEN+PN病例,TEN组(n=21)与 PN组(n=168)相比,在未调整相关影响因素的情况下,病死率和住院时间差异无统计学意义(P>0.05),胆汁淤积发生率(OR=0.08,95%CI:0.01 ~ 0.59) 和高血糖发生率(OR=0.08,95%CI:0.01~0.64)下降。
本选题纳入1项历史对照研究、5项病例对照研究和3项病例系列报告。关于EN的益处,历史对照研究显示,EN使用时间超过PICU住院时间的一半,与死亡风险降低相关;胆汁淤积和高血糖发生率EN较PN明显降低。各研究所采纳早期EN的时间迥异,从12 h至1周,多篇研究证实了早期EN与临床结局改善的相关性,如入住PICU 48 h内通过EN提供目标能量的25%以上,与患儿30 d和60 d病死率降低密切相关;使用血管活性药物的危重患儿可以实施EN。
问题5 EN的蛋白供应
推荐意见 在降低PICU患儿病死率方面,EN蛋白供给量比能量更值得重视(1C~1D),建议蛋白 1.5 g·kg-1·d-1可作为最低摄入参考值(2D)。
推荐说明 1项多中心(15个国家,59个PICU)队列研究[47],纳入1月至18岁机械通气>48 h连续病例,记录PICU≤10 d的实际PICU天数的能量和蛋白摄入情况,分析不同的能量和蛋白摄入充分性与入PICU后60 d病死率的相关性。能量(蛋白)摄入充分性为[观察期间内实际摄入的能量(蛋白)/医嘱能量(蛋白)]×100%。入PICU后60 d病死率6.6%(82/1 245),调整PICU床位数、EN时间、PICU时间和疾病严重程度后,肠内蛋白摄入充分性与60 d病死率相关(Wald’s检验=9.52,p<0.001),肠内能量摄入充分性与 60 d病死率不相关(OR=1.01,95%CI:0.99~1.03)。与EN蛋白摄入充分性<20%组相比,20%~60%组和>60%组入PICU后60 d病死率均下降,OR分别为0.37(95%CI:0.17~0.76)和 0.14(95%CI:0.04~0.52)。
与文献[38]同一设计方案的队列研究[48],样本人群来源于8个国家31个PICU,分析不同的能量摄入充分性与入PICU后60 d病死率的相关性。入PICU后60 d病死率8.4%(42/500)。校正营养评估时间、年龄、疾病严重度、机械通气时间和促胃肠动力药等因素后,与EN能量摄入充分性<33.3%组相比,33.3%~66.7%组和>66.7%组 60 d 病死率均下降,OR 分别为 0.27(95%CI:0.11~ 0.76)和 0.14(95%CI:0.03~0.61)。
文献[39]回顾性收集5年间107例ARDS患儿,以能量摄入充足(ARDS的第3天能量摄入≥80%REE,n=93)与不充足(n=14)分组、蛋白摄入充足(ARDS的第3天蛋白摄入≥1.5 g·kg ·d-1,n=81)与不充足分组(n=26),在入PICU时体重和是否俯卧位机械通气基线均不一致的情况下,观察能量和蛋白摄入充足性对PICU期间病死率和住院时间的影响。多因素Logistic回归显示,蛋白摄入不充足、PIM2评分和氧合指数是PICU病死率增加的独立预测因素,调整疾病严重程度后,充足的蛋白摄入与病死率下降相关(OR=0.09,95%CI:0.01~0.94)。
1项中国单中心病例对照研究[49],观察EN充分性对脓毒症患儿28 d病死率的影响,以达到目标能量64 kcal·kg-1·d-1和蛋白 1.5 g·kg-1·d-1为摄入充分。分别以能量、蛋白摄入充分和不充分分组,62例[P509.4(P255.3,P7535)个月]脓毒症患儿进入分析,能量摄入不充分组(n=37)比摄入充分组(n=25)28 d病死率和机械通气率均增加 1 倍多(OR=2.06,95%CI:1.43 ~ 2.96;OR=2.36,95%CI:1.11~5.02),住院费用增加近 2 万元(MD=18 538,95%CI:2 234~34 841);蛋白摄入不充分组(n=33)与充分组(n=29)相比,28 d 病死率(OR=2.20,95%CI:0.46~10.48)、机械通气率(OR=1.49,95%CI:0.82~2.72)和总住院费用(MD=12 290,95%CI:-4 764~29 345)差异均无统计学意义。
1项瑞士单中心病例系列报告[50],纳入PICU内预计机械通气时间≥72 h的患儿,排除FIO2>60%、气管插管漏气>10%、乳糜胸、急慢性肾脏疾病、严重的胸腔或腹腔炎性液体丢失、渗出性肠道病变和亚低温治疗患儿。拔除气管插管或气管插管时间达15 d为观察终点。IC法测量REE,化学发光法测定总尿氮(TUN),观察患儿零氮平衡时最低蛋白质及能量摄入值。74例患儿(中位年龄21月)获得402 次 REE 和 TUN,最低蛋白摄入(g·kg-1·d-1)为 1.5(95%CI:1.4~1.6)、最低能量摄入(kcal·kg-1·d-1)为 58(95%CI:53~63)可达零氮平衡和能量平衡。
本选题纳入2项队列研究、2项病例对照研究和1项病例系列报告。入住PICU 1周内通过肠道供给>2/3的目标能量及10 d内>60%的目标蛋白质,可显著降低60 d病死率;EN蛋白供给量比能量更值得重视;最低蛋白质摄入量 1.5 g·kg-1·d-1是实现正氮平衡的保障。
问题6 EN制剂的选择
推荐意见 危重患儿选择水解配方奶粉较为常见(2D),未发现高能量、高蛋白配方奶粉能缩短机械通气时间和住PICU时间(2C~2D)。
推荐说明 1项巴西单中心病例对照研究[51]回顾性收集PICU中首选水解配方奶粉(n=85)或全蛋白配方奶粉(n=206)作为EN制剂的患儿,营养不良、使用α肾上腺素能药物和禁食时间>2 d病例首选水解配方粉分别是首选全蛋白配方粉的近 3 倍(OR=2.94,95%CI:1.60~5.39)、2 倍多(OR=2.31,95%CI:1.24~4.31)和 3 倍多(OR=3.46,95%CI:1.93~6.2)。
汇总同一中心在2009年和2011年发表的不同的氮平衡检测方法的 2 篇 RCT[52,53]进行 Meta 分析(n=36),高能量蛋白配方奶粉组(n=16)与标准配方奶粉组(n=20)相比,机械通气时间(MD=1.66 d,95%CI:0.16~3.15)和 PICU时间(MD=2.30 d,95%CI:0.49~4.11)均延长(图 10、11)。
本选题纳入1项病例对照研究和2项RCT汇总的Meta分析。营养不良、使用α肾上腺素能药物、禁食时间>2 d多首选水解配方奶粉;未发现高能量、高蛋白配方奶粉能缩短机械通气时间和住PICU时间。
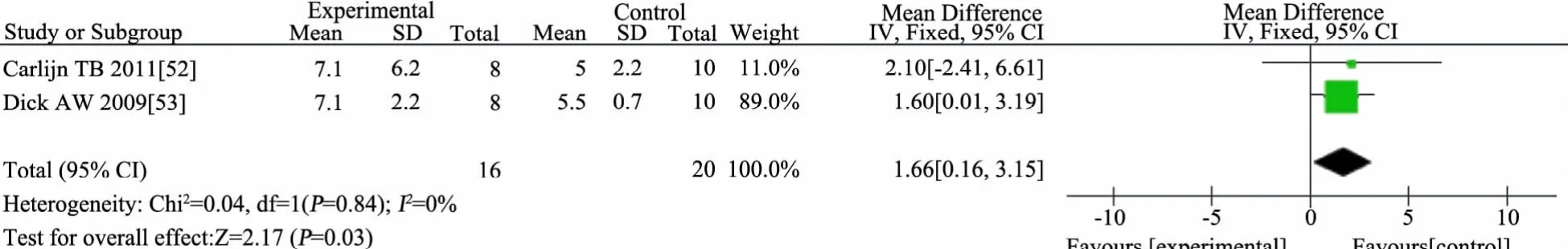
图10 高能量蛋白配方奶粉组与标准配方奶粉组机械通气时间比较森林图
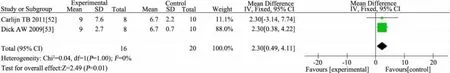
图11 高能量蛋白配方奶粉组与标准配方奶粉组住PICU时间比较森林图
问题7 EN途径
推荐意见 幽门后喂养与经胃喂养相比、持续喂养与间断喂养相比,幽门后喂养或持续喂养均更容易实现目标能量(1D),均不减少误吸或呼吸机相关肺炎的发生(1C~1D);经胃比经幽门后途径能更早实施EN(2C)
推荐说明 汇总2篇RCT的Meta分析[54,55],经胃喂养与经小肠喂养相比误吸风险差异无统计学意义(RR=0.79,95%CI:0.54 ~ 1.17),见 图 12。其 中 1 项RCT[54],纳入PICU接受机械通气<18周岁的危重症患儿,74例随机进入经胃喂养组(胃组,n=32)和经小肠喂养组(小肠组,n=42),小肠组12例因置管未成功不纳入分析,最终胃组32例和小肠组30例,两组年龄、性别、BMI、血清前白蛋白和PRISM评分差异无统计学意义,比较两组置管后连续14 d能量摄入量:胃组较小肠组日能量摄入量低17%(以达目标日能量百分比示,MD=-17.0,95%CI:-28.2~-5.8),两组每日呕吐、腹泻、腹胀、喂养中断(>1 h)比例、机械通气时间、ICU时间和总住院时间差异均无统计学意义。另 1项 RCT[55],纳入≤18岁、机械通气>72 h、需要EN的PICU患儿,排除消化道出血和胃肠手术后患儿,区组大小随机分配,鼻肠管TEN组24 h内置管不成功转入鼻胃管喂养组(2例),鼻胃管喂养组27例,TEN组17例,未行ITT分析,观察开始喂养时间:鼻胃管喂养组开始喂养中位数时间(h)短于TEN组[6(95%CI:6~12)vs 24(95%CI:18~24),p<0.001]。
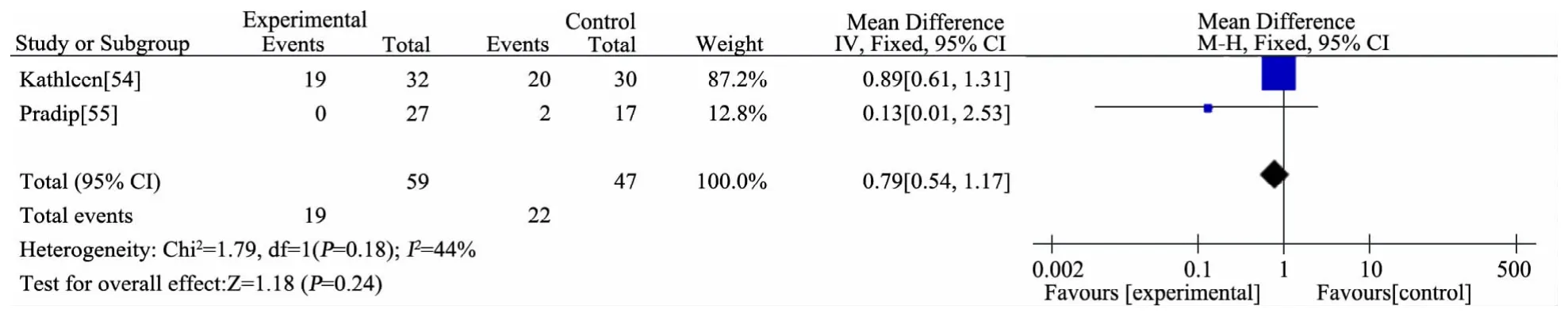
图12 经胃喂养与经小肠喂养误吸比较森林图
1项土耳其的单中心RCT[56],纳入PICU中机械通气>48 h的患儿,排除已知肺部感染、气管切开、胃肠道疾病和使用神经肌肉阻断剂者,干预措施分为经鼻胃管(NG)间断喂养和鼻肠管(ND)持续喂养并以此分组,主要观察指标为至撤离呼吸机时呼吸机相关肺炎(VAP)发生率,各20例进入分析,两组年龄、性别、基础疾病、并发症、营养时间、应激性溃疡预防性用药和病死率差异无统计学意义(P>0.05),ND持续喂养与NG间断喂养相比,VAP发生率差异无统计学意义(RR=2.0,95%CI:0.41~9.71)。
1项美国单中心RCT[57],研究PICU的TEN患儿在拔管日持续喂养或间断喂养对日能量摄入的影响,排除拔管前未达到70%目标能量者,持续喂养组29例,间断喂养组30例,考察不良事件和日能量摄入率。持续喂养组与间断喂养组比较:①不良事件发生率差异无统计学意义(RR=1.38,95%CI:0.34~5.63),②拔管日和撤机日能量摄入增加(以达目标能量百分比表示,MD=50.0%,95%CI:48.1%~51.9%;MD=16.0%,95%CI:14.2%~17.8%)。
同一作者于2003和2004年分别报告了1项澳大利亚单中心RCT以喂养并发症和胃残留量(GRV)为观察指标的 2 篇文献[58,59]。文献[58]排除了研究开始前 24 h 内存在呕吐、腹泻的PICU患儿,46例随机分为持续经胃管喂养组(持续喂养组,n=22)和间断经胃管喂养组(间断喂养组,n=24),间断喂养组1例退出(未行ITT分析)。持续喂养为24 h持续营养泵,间断喂养为每2 h一次重力法喂养20~30 min。持续喂养组(n=22)与间断喂养组(n=23)相比,观察期间平均腹泻次数(0.32 vs 0.52,P=0.30)和平均呕吐次数(0.64 vs 0.22,P=0.19)差异无统计学意义。文献[59]观察时间为 72 h,每 4 h 测定 GRV≥5 mL·kg-1为胃潴留,在观察期间每日排便≥3次稀便为腹泻,观察到胃内容物排出为呕吐。两组的年龄、性别、体重和主要诊断等差异无统计学意义,72 h内18次GRV测定中持续喂养组有15次胃潴留量多于间断喂养组,差异有统计学意义(P=0.008)。
本选题纳入6项RCT研究。经胃喂养可较早实现EN,经小肠喂养可缩短能量达标时间。不管是经胃喂养还是经小肠喂养,间断喂养还是持续喂养,都不能减少胃内容物吸入和呼吸机相关肺炎的发生。
问题8 影响EN实施的因素
推荐意见 EN中不合理的喂养中断常见,机械通气是EN中断的独立预测因素(2D);无创通气、有创通气、疾病严重程度、液体限制、临床操作和胃肠道并发症增加EN延迟的风险(2C~2D),急性肾功能衰竭及其接受持续性肾替代治疗影响EN蛋白和能量摄入(2D)
推荐说明 1项美国2010年单中心病例对照研究[60],纳入PICU≥24 h、EN>24 h的患儿80例。喂养中断定义为EN计划停止或延迟时间>30 min,中断原因包括:气管插管或拔管、放射科诊断和操作、床旁操作、手术室操作、喂养不耐受和喂养管路问题。58%(51/88)例次为不合理中断。多因素分析显示,EN时间和机械通气是喂养中断的独立预测因素,不合理中断组每增加1 d EN,喂养中断风险提升39%(OR=1.39,95%CI:1.20~1.60)。
1项美国多中心(6个PICU)病例对照研究[61],以入PICU 48 h开始EN分为早期EN组(n=356)和延迟EN组(n=88),采集延迟EN可能的相关因素。多因素分析显示,无创通气(OR=3.37,95%CI:1.69~ 6.72)、有创通气(OR=2.06,95%CI:1.15~3.69)、疾病严重程度(PIM2 每增加 0.1,OR=1.39,95%CI:1.14 ~ 1.71)、临床操作(OR=3.33,95%CI:1.67 ~ 6.64) 和胃肠道并发症(OR=2.05,95%CI:1.14~3.68)与延迟 EN 正相关,延迟 EN 与不能达到全量 EN 相关(OR=4.09,95%CI:1.97~8.53)。
1项法国单中心历史对照研究[62],2003年组为有NST支持,2000年组为无NST支持,两组在年度相同时段内(1~8月)分别纳入了PICU连续病例各41例。考察影响持续最佳能量摄入(SOCI)延迟达到的相关因素,PRISM>10 分(OR=0.58,95%CI:0.44~0.77)、液体限制(OR=0.51,95%CI:0.37~ 0.71)和 WFA<P3(OR=0.54,95%CI:0.41~0.72)易导致 SOCI延迟。
1项中国单中心病例系列报告[63],按EN有无中断(持续喂养者中断>30 min,或间断喂养者中断>1次)分为有中断组(n=50)和无中断组(n=10),比较两组临床预后的差异。两组年龄、性别、<12月龄人数比、PCIS分数和疾病种类等基线资料差异无统计学意义。中断组与无中断组相比,住院28 d病死率、有创机械通气时间、摄入能量及蛋白质差异均无统计学意义,中断组PICU时间(d)长于无中断组[(12±7)vs(7±4),P=0.03)]。
1项美国的基于网站登记儿童持续性肾替代治疗(ppCRRT)横断面调查[64],纳入2001至2005年12个中心CRRT、肾小球滤过率(eGFR)<75 mL·(min·1.73 m2)-1、需要营养支持的患儿,排除体外膜肺、因中毒或代谢障碍导致肾功能衰竭者,采集CRRT期间初始、最高的蛋白和能量摄入量,预测影响CRRT起始和最高蛋白、能量摄入的因素。195例CRRT患儿进入分析,①初始平均蛋白和能量摄入量分别为(1.3±1.5)g·kg-1·d-1和(37±27)kcal·kg-1·d-1,年龄更小(P=0.05)和 CRRT 治疗目的为液体限制(P=0.04)是CRRT高起始蛋白摄入的影响因素;②平均最大蛋白和能量摄入量分别为(2.0±1.5)g·kg-1·d-1和(48±32)kcal·kg-1·d-1,多因素分析显示,年龄更小(p<0.04)、更高的初始蛋白和能量摄入量(P均<0.001)、更长的CRRT治疗时间与CRRT时最大蛋白和能量摄入独立相关(P均<0.003)。
1项美国单中心病例对照研究[65],纳入首次入住PICU且>72 h、年龄<18岁的患儿,排除慢性肾功能衰竭(CKD)需要肾替代治疗、转入PICU前住院>48 h者。依据儿童RIFLE标准分为无肾功能障碍(无急性肾功能衰竭/危险因素)组(n=146)和有肾功能障碍(急性肾损伤/肾功能衰竭)组(n=21),采集两组一般资料、PICU 5 d内营养实施情况、住院时间、能量和蛋白摄入情况。有肾功能障碍组比无肾功能障碍组住院>15 d风险增加 2.2倍(OR=3.2,95%CI:1.2~8.7),禁食风险增加 1.3 倍(OR=2.3,95%CI:1.5~3.4),第 5 天摄入<90%预计能量风险增加 60%(OR=1.6,95%CI:1.0~2.6)。
1 项西班牙单中心的病例对照研究[66,67],同一作者2006和2008年分别发表了2篇同一基线数据的不同观察指标的文献。纳入10年9个月TEN连续危重患儿526例[66],依据有无胃肠并发症分为无并发症组(465例)和并发症组(61例,腹胀和/或过度胃残留、腹泻、胃肠出血、NEC、十二指肠穿孔),多因素Logistic回归分析显示,TEN胃肠并发症与休克(OR=2.2,95%CI:1.0 ~ 4.6)和大剂量肾上腺素(>0.3 μg· kg-1· min-1)(OR=3.7,95%CI:1.6~8.6)相关。依据有无急性肾功能衰竭分为无肾功能衰竭组(473例)和肾功能衰竭组(53例,肌酐水平急性上升达同年龄正常值上限2倍以上)[67],每日最大能量摄入量(kcal·kg-1·d-1)肾功能衰竭组低于无肾功能衰竭组(77 vs 85,P=0.03),胃肠并发症发生率肾功能衰竭组高于无肾功能衰竭组(OR=3.3,95%CI:1.7~6.6)。
本主题纳入5项病例对照研究、1项横断面调查和1项病例系列报告。EN中断影响目标能量的达标。导致EN延迟和中断的临床因素很多。其中有创和无创机械通气是重要的原因,急性肾损伤患儿禁食和EN能量摄入不足的风险增加。
问题9 EN免疫增强剂与临床结局
推荐意见 不推荐EN常规添加免疫增强剂(1C~1D)。
推荐说明 目前研究中涉及的EN免疫增强剂主要有L-谷氨酸、L-精氨酸、鱼油(ω3多不饱和脂肪酸)和膳食纤维等。①基于6 篇 RCT[68~73]的 Meta 分析,免疫增强剂组(n=279)与非免疫增强剂组(n=271)存活率差异无统计学意义(RR=0.96,95%CI:0.91~1.00),见图 13;②基于 4 篇 RCT[68,70,71,74]的 Meta 分析,免疫增强剂组(n=69)与非免疫增强剂组(n=66)住院时间(d)差异无统计学意义(MD=-0.46,95%CI:-1.64~ 0.73),见图 14;③基于 2 篇RCT[70,73]的 Meta分析,免疫增强剂组(n=74)比非免疫增强剂组(n=72)PICU 时间缩短 1.5 d(MD=-1.48,95%CI:-2.44~ -0.51),见图 15;④ 基于 3 篇 RCT[68,70,71]的 Meta 分析,免疫增强剂组(n=49)比非免疫增强剂组(n=47)机械通气时间(d)延长2 d(MD=2.20,95%CI:1.31~3.09),见图 16;⑤基于 5 篇 RCT[68~72],免疫增强剂组(n=223)与非免疫增强剂组(n=216)院内感染发生率差异无统计学意义(RR=1.01,95%CI:0.82 ~ 1.25),见图 17;⑥基于6 篇 RCT[68~72,74]的 Meta 分析,免疫增强剂组(n=242)与非免疫增强剂(n=230)腹泻发生率差异无统计学意义(RR=1.28,95%CI:0.80~2.06),见图 18;⑦ 基于 5 篇 RCT 的 Meta分析[68~71,74]免疫增强剂组(n=94)与非免疫增强剂组(n=91)腹胀/胃潴留发生率差异无统计学意义(RR=0.94,95%CI:0.56~1.57),见图 19;⑧ 基于 2 篇 RCT 的 Meta 分析[71,74],免疫增强剂组(n=40)与非免疫增强剂组(n=39)呕吐发生率差异无统计学意义(RR=0.77,95%CI:0.23~2.65),见图 20;⑨基于 2 篇 RCT 的 Meta分析[70,72],免疫增强剂组(n=162)与非免疫增强剂组(n=151)不良事件发生率差异无统计学意义(RR=1.03,95%CI:0.96~1.12),见图21;⑩单篇RCT[72],免疫增强剂组(肠内锌、硒、谷氨酰胺营养联合静脉甲氧氯普胺,n=149)与非免疫增强剂组(肠内乳清蛋白粉联合静脉生理盐水,n=144)心律失常发生率差异无统计学意义(RR=0.97,95%CI:0.32~2.93),肢体运动异常差异无统计学意义(RR=0.72,95%CI:0.17~ 3.18);单篇 RCT[74],免疫增强剂组(n=20)比非免疫增强剂组(n=19)住院费用减少1.4万元人民币(MD=-1.35,95%CI:-1.93~-0.77)。
本主题7项RCT的Meta分析结果显示,EN免疫增强剂对存活率、住院时间、机械通气时间和院内感染发生率等主要临床结局没有益处。
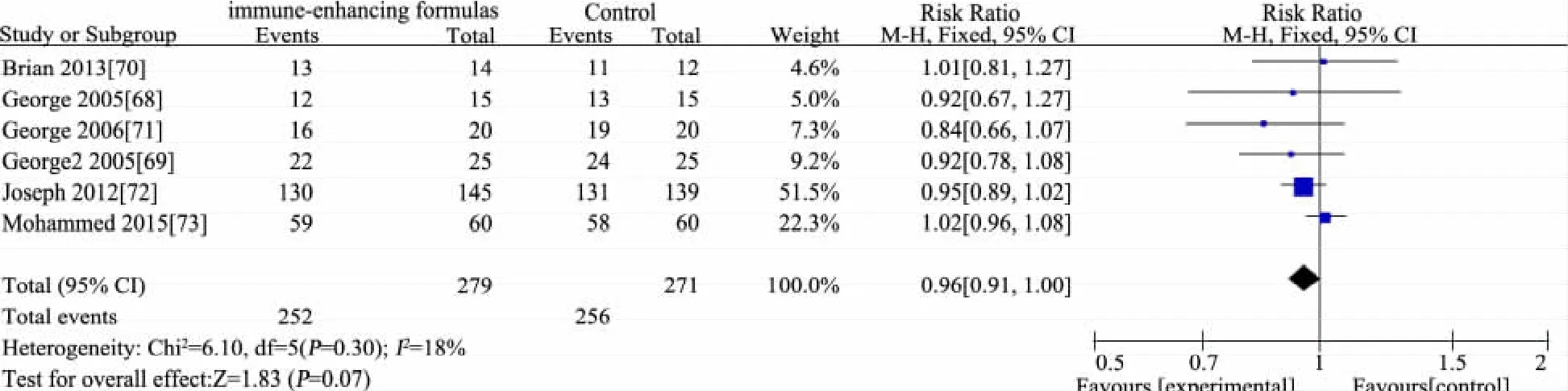
图13 免疫增强剂组与非免疫增强剂组存活率比较
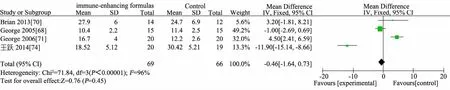
图14 免疫增强剂组与非免疫增强剂组住院时间比较
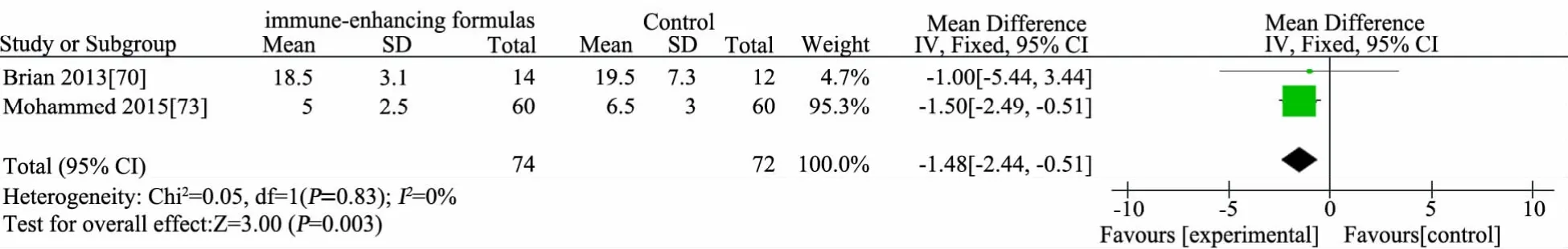
图15 免疫增强剂组与非免疫增强剂组PICU时间比较
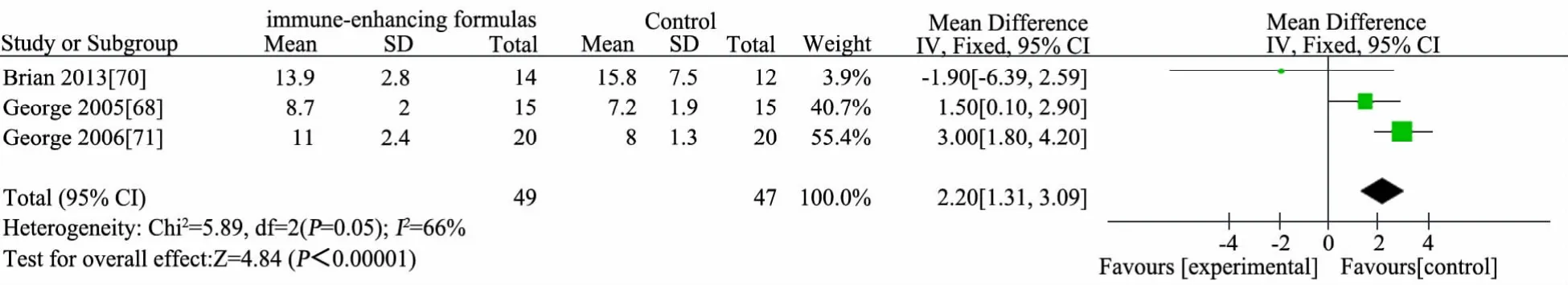
图16 免疫增强剂组与非免疫增强剂组机械通气时间比较
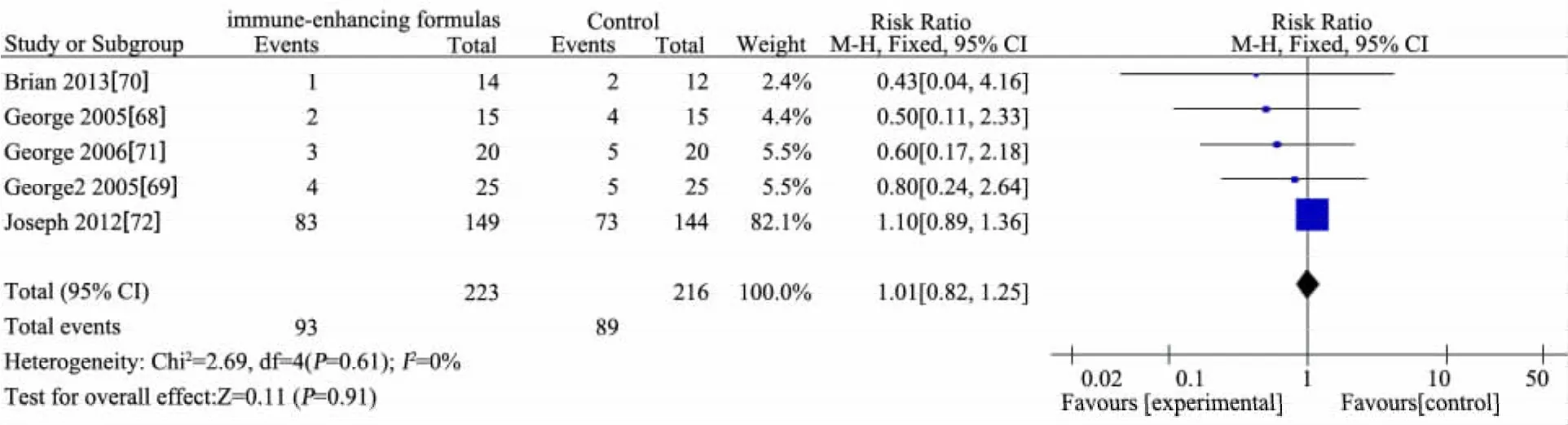
图17 免疫增强剂组与非免疫增强剂组院内感染发生率比较
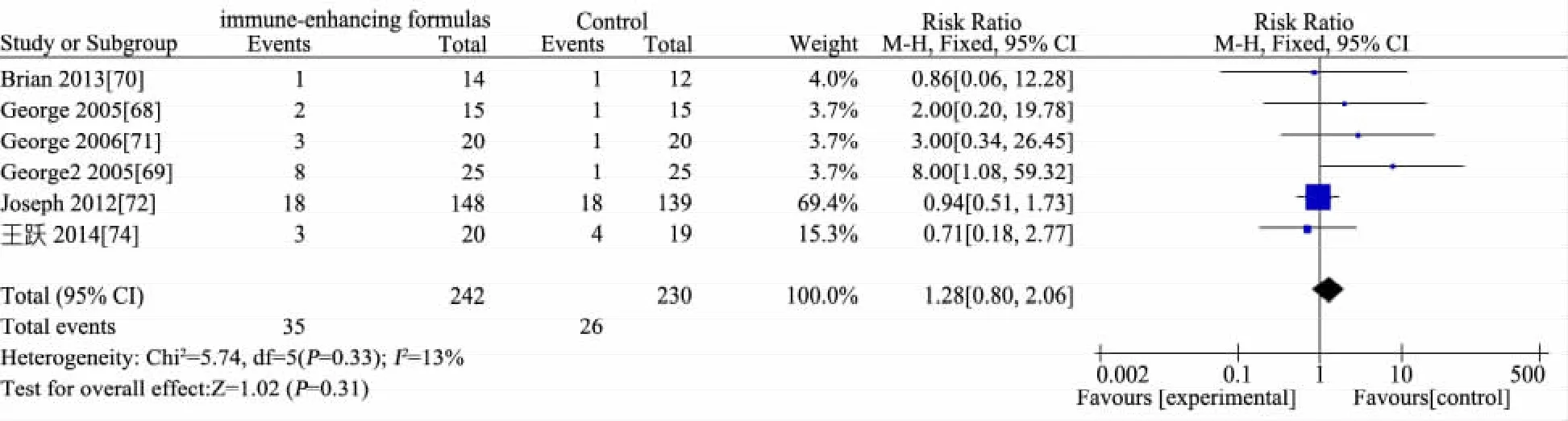
图18 免疫增强剂组与非免疫增强剂组腹泻发生率比较
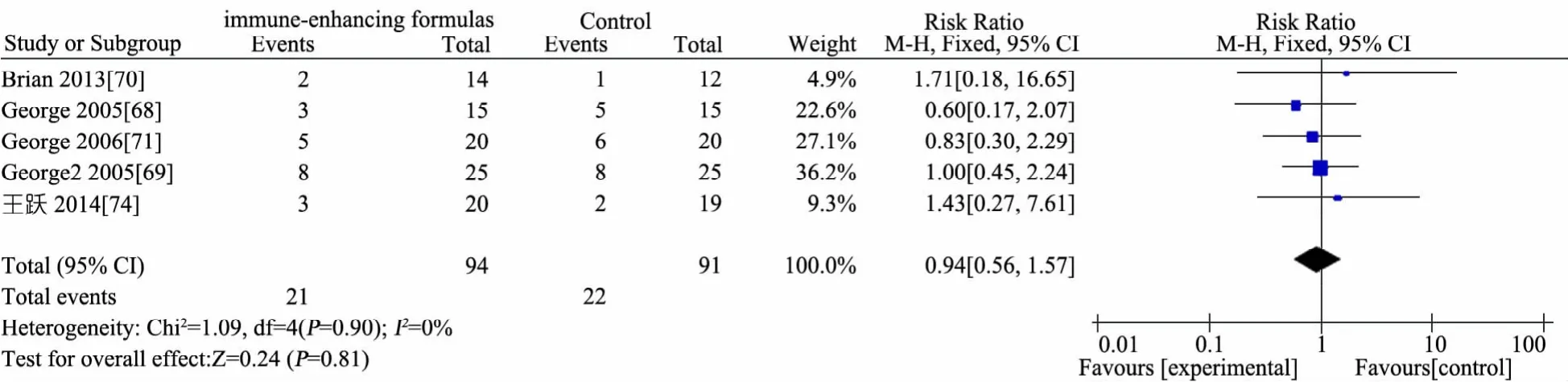
图19 免疫增强剂组与非免疫增强剂组腹胀/胃潴留发生率比较
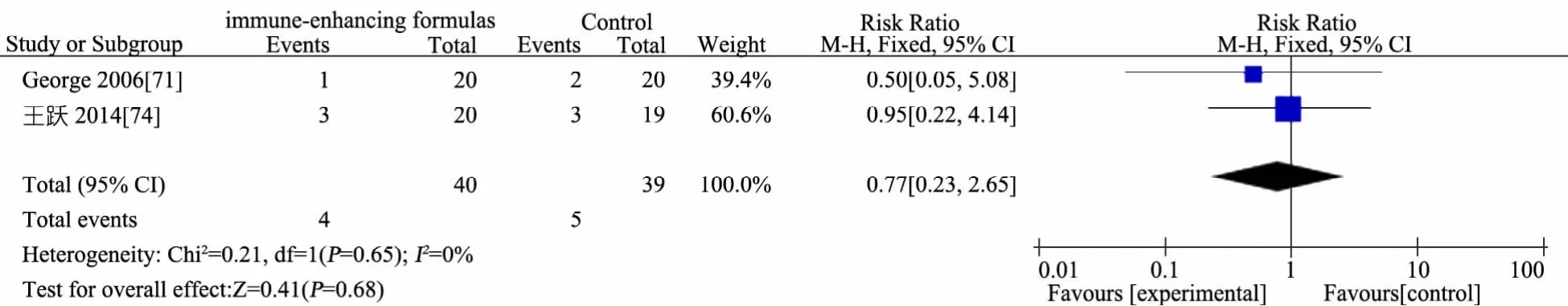
图20 免疫增强剂组与非免疫增强剂组呕吐发生率比较
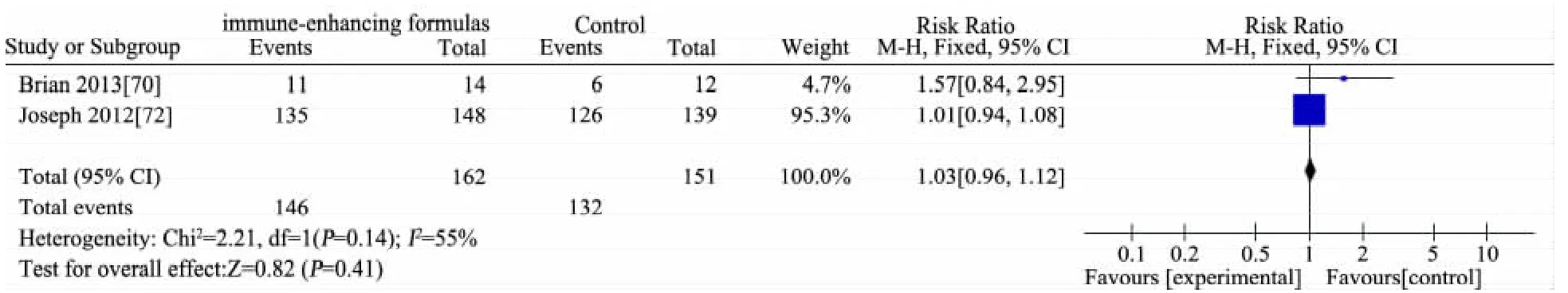
图21 免疫增强剂组与非免疫增强剂组不良事件发生率比较
问题10 EN并发症
推荐意见 EN并发症包括但不限于以下并发症[75]:误吸和吸入性肺炎;恶心、呕吐、腹胀、腹泻、便秘;肠坏死、肠黏膜萎缩;高血糖症和低血糖症、电解质紊乱、高碳酸血症、再喂养综合征(2D)。
推荐说明 报告EN并发症的文献是不少见的,多见于营养支持干预的次要结局指标或病例系列报告等,但碍于这方面文献检索的数量不确定,也碍于不适宜通过阅读文献标题和摘要进行初步筛选,因为要逐一从全文中提取并发症的工作量会很大,本指南选择经典教科书中的并发症作为主要来源。
问题11 补充性PN
推荐意见 营养风险不高、EN未达到目标能量,1周后添加PN不增加病死率,减少新发感染、缩短住PICU时间,但易发生低血糖事件(1A~1B)。
推荐说明 1项多中心 RCT[76],纳入预计 PICU住院≥24 h、STRONGkids评分>2的足月儿至17岁儿童,排除不需要营养支持、他院转入和再次住PICU、TPN、代谢性疾病和肿瘤等患儿,分为早期PN组(入PICU 24 h内行PN,723例)和晚期 PN组(入 PICU第 8天开始 PN,717例)。总中心按年龄和诊断区块化计算机1∶1产生随机序列。2组入组时给予EN,早期组同时给予PN,晚期组入组时予足够糖和液体至第8天再予PN。主要结局指标:PICU期间新发感染,PICU时间和PICU≥8 d的人数比例;次要结局指标:病死率、机械通气时间和PICU 7 d内血糖<2.2 mmol·L-1发生率。两组基线资料差异均无统计学意义,在所有病例营养充分性一致的基础上,晚期PN组与早期PN组比较:调整了不同中心、年龄组、入PICU 24 h儿童序贯器官功能障碍(PELOD)评分和STRONGkids评分后,PICU 新发感染率下降近 50%(OR=0.48,95%CI:0.35~0.66),PICU 时间减少约 1 d(MD= -1.23,95%CI:-1.11~-1.37),PICU 时间>8 d 的人数比例下降26%(RR=0.74,95%CI:0.62~ 0.89),PICU 8 d内病死率(HR=0.73,95%CI:0.34~1.51)、PICU 期间病死率(HR=0.73,95%CI:0.42~ 1.28)、住院期间病死率(HR=0.72,95%CI:0.43 ~1.19)和 90 d 内病死率(HR=0.64,95%CI:0.39~1.05)差异均无统计学意义,机械通气时间缩短约1 d(MD=-1.19,95%CI:-1.07~ -1.32),PICU 7 d 内低血糖发生率(<2.2 mmol·L-1)增加 87%(RR=1.87,95%CI:1.26~2.79)。
需要说明的是,本研究的PICU人群至少有如下特点:①入组时总体营养风险低(STRONGkids评分中度营养风险比例接近90%),②PICU 4 d内接受了约30 kcal·kg-1·d-1的EN,③8 d内离开PICU病例数达70%,④50%为外科患儿。
本选题仅纳入单项多中心RCT,EN未达到目标能量、第8天添加PN不增加病死率、减少新发感染、缩短住PICU时间,但易发生低血糖事件。但该研究纳入的研究对象主要为营养风险不高的患儿,对营养高风险的患儿,应根据病情个体化决定添加PN的时间。
问题12 PN添加免疫增强剂
推荐意见 不推荐PN常规添加谷氨酰胺(2B~2D)
推荐说明 1项西班牙单中心RCT[77],纳入PICU中1个月至14岁PN>5 d患儿,排除肝肾灌注不足、炎症性肠病、风湿性疾病、原发性免疫缺陷病、中度肝衰竭、心脏术后体外循环的患儿。分为PN组和PN+谷氨酰胺(Gln)组,观察指标包括院内感染发生率、机械通气时间、PICU时间和病死率等。PN组49例,PN+Gln组52例,其中1例死亡,2例基线数据不完整,未行ITT分析。进入分析的两组病例年龄、<2岁比例、体重、疾病诊断分类、PRISMⅡ评分、能量、蛋白量和脂肪乳量差异均无统计学意义。PN+Gln组(n=49)与PN组(n=49)相比,院内感染发生率(RR=1.4,95%CI:0.76~2.51)、病死率(RR=1.5,95%CI:0.26~8.59)、中位数机械通气时间(135.8 h vs 134.0 h,P=0.98)、中位数PICU 时间(10.4 d vs 14.3 d,P=0.062) 和总住院时间(14.3 d vs 16.7 d,P=0.098)差异均无统计学意义。
问题13 PN并发症
推荐意见 PN并发症包括但不限于以下[78]:高血糖及高渗性非酮症昏迷,低血糖,高脂血症及脂肪超负荷综合征,高氨血症,胆汁淤积性黄疸及肝功能异常,矿物质、微量元素缺乏或过量,长期施行全肠外营养(TPN)可有肠黏膜萎缩、肠腺分泌减少及胆汁黏稠、食欲低下(2D)。尸体肺病理显示TPN可能与肺纤维化相关(2D)。
推荐说明 同EN并发症。1项巴西单中心4年间回顾性病例对照研究[79],基于301例PICU死亡病例中取得家长对尸体肺病理检查知情同意的114例的19种病理诊断结果,以死亡前是否应用TPN分为TPN组(n=50)和非TPN组(n=64),2组基线[(性别、年龄、体重、临床诊断(脓毒症、肺炎、先天性心脏病、肠炎、肾功能衰竭、心力衰竭和窒息)]和治疗(血管活性药物)差异均无统计学意义,住院时间、早产和血制品应用差异有统计学意义,5/19种病理表现(弥漫性肺泡损伤、肺纤维化、肺细胞增生、微血栓和血栓性静脉炎)在TPN组和非TPN组组间比较差异有统计学意义,将组间比较有意义的因素住院时间、早产和是否应用TPN与5种病理类型行多因素Logistic回归分析,显示 TPN 与肺纤维化相关(OR=5.76,95%CI:1.30~25.48)。
基于PN的并发症选题与文献检索和文献阅读工作量的效益考虑,本指南采用经典的教科书作为主要参考。需要说明的是,1项分析死亡病例尸体肺病理检查结果与TPN关系的单中心回顾性病例对照研究显示,TPN可能与肺纤维化相关。
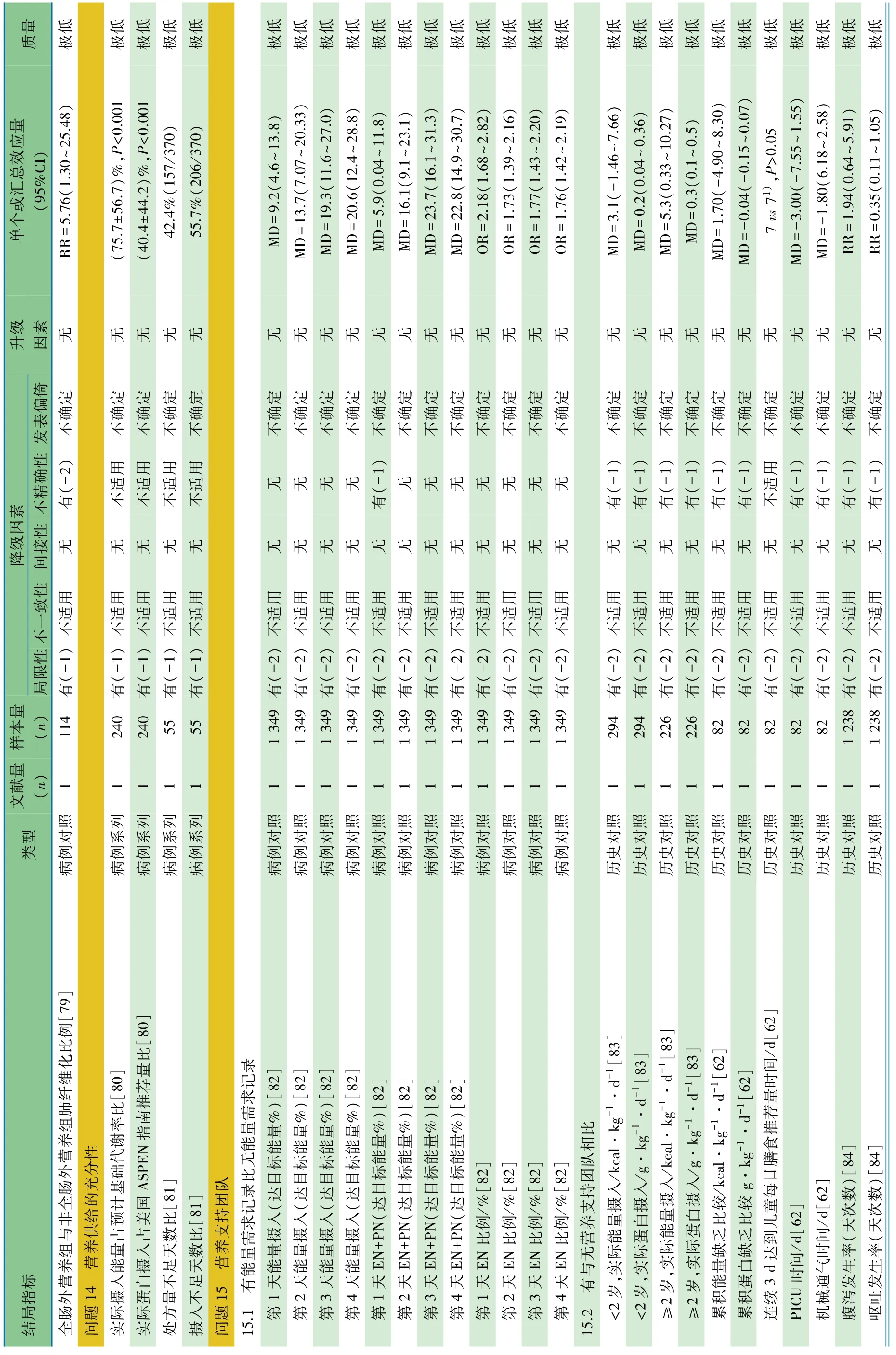
问题14 营养供给的充分性
推荐意见 重视PICU能量和蛋白供给不足的现象(1D)
推荐说明 1项美国单中心病例系列报告[80],纳入首次入住PICU且>72 h的36周至18岁患儿240例,采集PICU 8 d内蛋白和能量摄入情况,以Schofield公式法计算能量需求,以2009年美国肠外肠内营养协会制定的危重症儿童营养支持临床指南(简称ASPEN指南)蛋白推荐量为目标量,PICU前8 d实际能量摄入平均为预计基础代谢率(BMR)的(75.7±56.7)%,低于 BMR(p<0.001),实际蛋白摄入为ASPEN指南蛋白推荐目标量的(40.4±44.2)%,低于推荐目标量(p<0.001)。
1项巴西单中心病例系列报告[81],纳入EN>48 h且排除慢性腹泻、腹部手术、腹膜炎和胃肠出血的患儿,采集PICU 5 d内医生开具医嘱及实际摄入能量情况,以WHO公式基础代谢率(PBMR)为目标量,处方量不足(医生开具医嘱量/PBMR<90%)天数比例为 42.4%(157/370),摄入不足(实际能量摄入量/PBMR<90%)天数比例为 55.7%(206/370)。
问题15 营养支持团队(NST)
推荐意见 推荐有条件的医疗机构建立NST(1B~1D)。
推荐说明 1项2013年多中心(5个)病例对照研究[82],纳入2年PICU的连续患儿1 349例,以入院48 h内是否有能量需求记录分为无记录组(n=705)和有记录组(n=644),观察入院4 d内营养摄入情况,其中有记录组能量需求目标95.6%是由注册营养师制定。①第1~4天EN的能量摄入(以达到静息能量的百分数表示),有记录组平均高出无记录组 9%~20%(第 1天 MD=9.2%,95%CI:4.6%~13.8%;第 2 天 MD=13.7%,95%CI:7.1% ~ 20.3%;第 3天MD=19.3%,95%CI:11.6% ~ 27.0%;第 4 天 MD=20.6,95%CI:12.4%~28.8%);②第 1~4 天 EN+PN 的能量摄入,有记录组高出无记录组6%~23%(第1天 MD=5.9%,95%CI:0.04% ~ 11.8%;第 2 天 MD=16.1%,95%CI:9.1%~23.1%;第 3 天 MD=23.7%,95%CI:16.1% ~ 31.3%;第 4 天 MD=22.8%,95%CI:14.9%~30.7%);③第 1~4 天EN使用比例,有记录组是无记录组的1.5倍以上(第1天OR=2.18,95%CI:1.68 ~ 2.82;第 2 天 OR=1.73,95%CI:1.39~2.16;第 3 天 OR=1.77,95%CI:1.43 ~ 2.20;第 4 天OR=1.76,95%CI:1.42~2.19)。
1项美国单中心历史对照研究[83],以建立多学科NST制定营养支持方案前和后分为2组,观察组为2013年10~12月PICU连续病例(n=185),对照组为2012年8~12月PICU连续病例(n=335),以年龄<2岁和≥2岁行亚组分析,采集危重症儿童入PICU最初8 d实际能量和蛋白质摄入。两组年龄、性别、体重Z值、身高Z值、急性或慢性营养不良构成比、第1天机械通气人数、PICU时间和住院时间差异均无统计学意义,病种诊断为“其他”比例、PRISM-Ⅲ、PELOD、正性肌力药和生存率差异均有统计学意义。<2 岁亚组,实际能量摄入(kcal·kg-1·d-1)NST 引入后较引入前差异无统计学意义(MD=3.1,95%CI:-1.46~7.66),实际蛋白摄入 (g·kg-1·d-1) 增加 0.2(MD=0.2,95%CI:0.04~0.36);>2 岁亚组,NST 引入后较引入前实际能量摄入增加约 5(MD=5.3,95%CI:0.33~10.27),实际蛋白摄入增加 0.3(MD=0.3,95%CI:0.1 ~0.5)。
1项2007年法国单中心历史对照研究[62],以引入NST前(2000年)和后(2003年)分组,两组在相同时间内分别纳入了PICU连续病例41例。以法国同年龄、性别健康儿童每日膳食推荐量(RDA)为标准,计算入院最初14 d的累积能量(kcal·kg-1·d-1)和蛋白(g·kg-1·d-1)摄入量与RDA的差值,NST引入后较引入前累积能量摄入不足(MD=1.70,95%CI:-4.90~ 8.30) 和累积蛋白摄入不足(MD=-0.04,95%CI:-0.15~0.07)无改善;NST 引入后与引入前相比,达持续稳定能量时间(连续3 d达RDA标准)7 d vs 7 d、PICU 时间(MD=-3.0 d,95%CI:-7.6~1.6)和机械通气时间(MD=-1.8 d,95%CI:-6.18~2.58)差异均无统计学意义(P 均>0.05)。
1项荷兰单中心历史对照研究[84],以 NST引入前(2006年7月,84例患儿)和后(2010年11月,87例患儿)分组,两组均为住院时间>3 d的机械通气患儿,排除其他科室转入、入院时已接受EN和/或PN、早产儿和低出生体重儿。两组患儿年龄、性别、体重、PICU住院时间和机械通气时间差异均无统计学意义,PIM2评分差异有统计学意义。第1天EN比例由引入前的40%上升至引入后的78%(p<0.01)、第 2天由 60%上升至 92%(p<0.01);达 85%目标能量的时间引入前为第4天,引入后为第3天;NST引入后与引入前相比,呕吐(RR=0.35,95%CI:0.11~1.05)、腹泻(RR=1.94,95%CI:0.64 ~ 5.91) 和胃残留(RR=1.52,95%CI:0.94~2.46)发生率差异均无统计学意义。
1项巴西病例对照研究以1992至1993年为基线(P1)、持续质量改进为目标[45],逐段累加了不同的干预措施,分别在1994至1995年(P2)P1+针对PICU住院医师的培训、1996至1997年(P3)P2+针对全 PICU人员培训、1999至2000年(P4)P3+临床营养查房和2002至2003年(P5)P4+NST,每阶段均取连续15个月为观察时间窗,主要考察营养实施情况和临床预后指标。①内科患儿EN时间占总营养支持时间的百分比从P1阶段的25%升至P5阶段的67%,内科患儿PN从P1阶段的73%降至P5阶段的0,外科患儿PN从P1阶段69%降至P5阶段0,差异均有统计学意义(p<0.001);②内科患儿PICU病死率从P1~P3阶段 23%(48/203)降至 P4~P5阶段 7.5%(9/120),差异有统计学意义(p<0.001)。
1项涉及15个国家59个PICU的多中心大样本(n=1 245)队列研究[47],分析蛋白摄入充分性与病死率的相关性,PICU专职营养师是肠道蛋白摄入充分性的独立影响因素(β 系数为 6.5±2.8,P=0.02)。
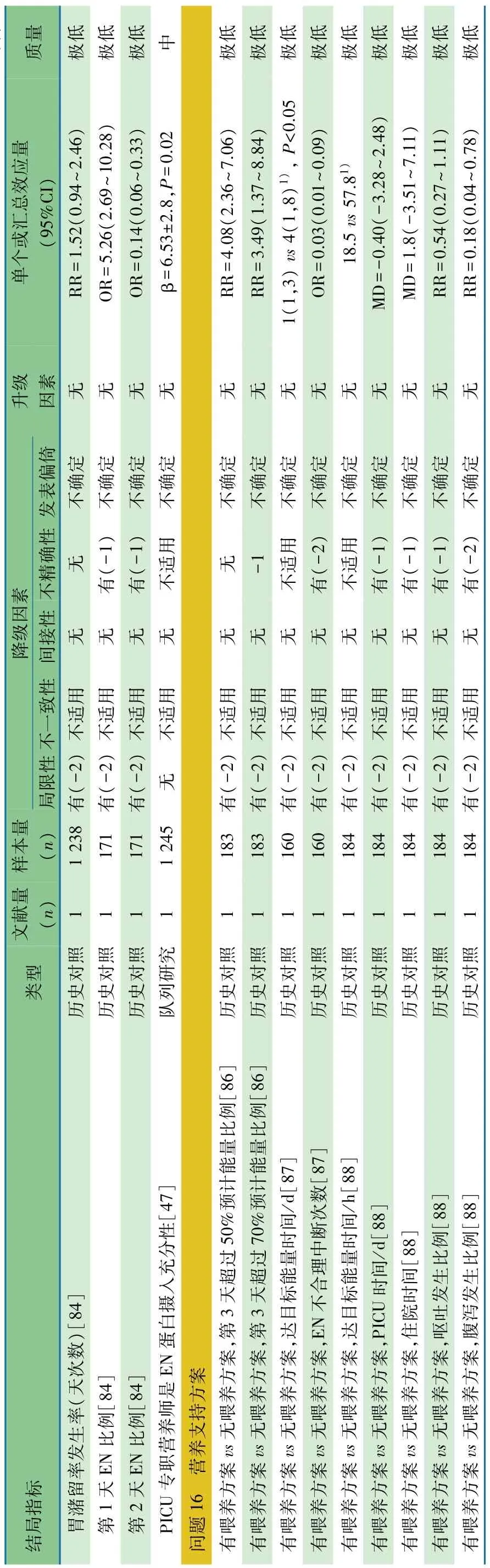
问题16 营养支持方案
推荐意见 推荐制定营养支持方案,有助于尽早达到目标能量、减少不合理喂养中断,提高每日能量摄入(1D)
推荐说明 1项2014年美国多中心(31个PICU)PICU机械通气患儿喂养流程和床旁营养策略实践情况的横断面调查[85],调查了 1个月至18岁 524例患儿。在2009年ASPEN指南发表和实施后,9个(29%)PICU有具体流程。尽管IC法是能量测定公认的金标准,但仅3.2%(1/31)的PICU使用了IC法。
1项英国单中心的质量持续改进的观察性研究[86],回顾性采集10年的全部的355例危重症儿童EN数据,以开始营养支持的时间、第3天能量摄入达目标量的50%和70%作为评估营养支持方案的指标。1994至1995年时段83例,1997至1998年时段72例,2001年时段100例,2005年时段100例。4个时段患儿年龄和性别差异均无统计学意义。①开始营养支持的时间(h):4个时段分别为15(2~74)、8(1~72)、5.5(1~43)和 4.5(1~38);②第 3 天能量摄入达50%目标量的人数比:4个时段分别为15%(12/83)、26%(19/72)、58%(58/100) 和 59%(59/100);③第3天能量摄入达70%目标量的人数比:4个时段分别为6%(5/83)、10%(7/72)、35%(35/100)和21%(21/100)。4个阶段3个评估指标1994至1995年时段与2005年时段相比差异均有统计学意义(P均=0.001)。
1项美国单中心的历史对照研究[87],观察组为2011年建立了喂养方案后的PICU患儿(n=80),对照组是基于2008[60]的1组在无喂养方案指导下的PICU患儿(n=80),观察喂养方案对达目标能量的时间和不合理中断次数的影响。有喂养方案组与无喂养方案组平均年龄、性别、机械通气比例和PICU时间差异均无统计学意义。有喂养方案组较无喂养方案组达目标能量早[1(1,3)dvs 4(1,8)d,p<0.05],EN 不合理中断比例低(OR=0.03,95%CI:0.01~0.09)。
1项美国单中心的历史对照研究[88],组建NST制定营养支持方案,并行2个月的预试验,采集了预试验后2002年93例PICU患儿实施方案的数据,以2000年PICU连续病例(91例)作为对照,采集EN数据、达目标能量时间、住院时间和并发症。2002年与2000年相比:①达目标能量时间缩短(18.5 h vs 57.8 h,p<0.0001),腹泻发生率下降(RR=0.18,95%CI:0.04~0.78);②住院时间(MD=1.8 d,95%CI:-3.51~7.11)和 PICU 时间(MD= -0.40 d,95%CI:-3.28~2.48) 均无缩短,呕吐发生率(RR=0.54,95%CI:0.27~1.11)无下降。
6 指南制作中需要说明的几个问题
①作为指南制作方法学团队,复旦大学附属儿科医院临床指南制作和评价中心全程参与指南的制作。②本指南是基于临床问题的循证指南,系统地进行了文献检索和文献筛选,制作过程中运用GRADE工具对证据进行质量评价和推荐分级,完整地实现了循证指南制定过程。③尽管在指南选题上总是担忧挂一漏万,但文献检索、筛选和评价后,回答选题的文献却是捉襟见肘,因此不得不对最初的选题做出调整。④本指南的选题更偏向于中国儿童危重症临床所思所想和所需。
7 指南的制定时间
2014年11月13日至2017年12月27日。
8 指南工作组
儿科急救专家群:首都医科大学附属北京儿童医院:钱素云、高恒淼,复旦大学附属儿科医院:陆国平、朱雪梅,重庆医科大学附属儿童医院:许峰、党红星,湖南省人民医院:祝益民,上海交通大学医学院附属上海儿童医学中心:王莹,中国医科大学附属盛京医院:刘春峰,首都儿科研究所:任晓旭,上海交通大学医学院上海儿童医院:张育才,广州南方医科大学附属中山博爱医院:周涛。对指南制定的选题、文献筛选原则、证据提取和推荐意见的把握负责。
指南制定方法学专家群:复旦大学附属儿科医院临床指南制作和评价中心:张崇凡、丁俊杰、张萍。对指南制定过程的把握、环节培训、质量控制和推荐意见负责。
文献检索专家:上海交通大学医学院仇晓春亲历和指导《中国循证儿科杂志》编辑部张萍共同完成。
文献筛选:①文献初筛由朱雪梅、周涛、方伯梁(首都医科大学北京儿童医院)、张鹏飞(首都医科大学北京儿童医院)、党红星、袁祝康(重庆医科大学附属儿童医院)、李菁菁(上海交通大学医学院上海儿童医学中心)和尹冰如(上海交通大学医学院上海市儿童医院)完成;②再次筛选由朱雪梅、周涛、方伯梁和党红星完成。
文献质量评价和证据提取:由朱雪梅、周涛、党红星和高恒淼完成。
根据指南制定的工作进度指南工作组召开了6次面对面的工作会议。①2014年11月13日在上海,听取指南制定方法和AGREEⅡ的培训,并启动指南的制定。②2014年12月27日在北京,讨论了预检索情况、指南的制定方向和选题。③2015年11月14日在辽宁省沈阳,讨论了指南的选题、确定了文献筛选标准和筛选人员。④2017年8月5日在陕西省榆林,讨论了对文献评价和证据提取中出现的问题。⑤2017年10月19日在江苏省苏州,对指南初稿进行讨论。⑥2017年12月15日在福建省厦门,对指南推荐意见进行讨论。
9 文献检索策略
本指南文献检索未纳入包括中医、中药和中西医结合研究的相关文献。
检索中文数据库:中国生物医学文献数据库(CBM),检索英文数据库:PubMed和EMBASE。
检索起止时间均从建库至2016年10月31日。
根据危重症儿童营养评估及支持治疗的主题,指南工作组首先确定了6个选题方向:①营养风险筛查,②营养评估,③能量需求,④营养素的推荐原则,⑤EN,⑥PN,并以此分别建立CBM、PubMed和EMBASE基本文献检索式。不同的选题方向下建立了18个分选题并建立相应的检索式,PubMed和EMBASE数据库检索方法为基本检索式+分选题检索式;CBM数据库检索方法为基本检索式。
以PubMed为例的基本检索式:
#1 nutrition* OR nutrient* OR nutritive OR nutritious OR nourishment OR nutriment* OR trophotherapy OR dietotherapy OR alimentotherapy OR"enteral nutrition"OR"enteral feeding"OR"Force Feeding*"OR"Tube Feeding*"OR"Gastric Feeding Tube*"OR"parenteral nutrition"OR"Parenteral Feeding*"OR"Intravenous Feeding"OR"intravenous nutrition"OR"vein nutrition"OR"nutrition support"OR"nutritional support"OR"nutrition supporting"OR"nutrition therapy"OR"Artificial Feeding*"
#2 "Enteral Nutrition"[Mesh] OR"Parenteral Nutrition"[Mesh] OR"Nutrition Therapy"[Mesh]OR"Nutritional Support"[Mesh]
#3 "critical ill"OR"critically ill"OR"critical illness"OR"critical disease"OR"critical diseases"OR"severe illness"OR"severe disease"OR"severe diseases"OR"intensive care unit"OR"intensive care units"OR*ICU OR"critical care"OR"critical care medicine"OR"intensive care"OR"intensive care medicine"
#4 "Critical Illness"[Mesh]OR"Intensive Care Units"[Mesh]OR"Intensive Care"[Mesh] OR"Intensive Care Units,Pediatric"[Mesh]OR"Critical Care"[Mesh]
#5 "cardiopulmonary arrest"OR"Cardiac Arrest"OR Asystole* OR"heart arrest"OR Apnea OR"Respiratory Failure"OR"Respiratory Depression" OR "RespiratoryInsufficiency" OR "Ventilatory Depression"OR"acute lung injury"OR"acute respiratory distress syndrome"OR ARDS OR"heart failure"OR"Cardiac Failure"OR"Heart Decompensation"OR"Myocardial Failure"OR"Right-sided cardiacdysfunction" OR "Leftventriculardiastolic dysfunction"OR"Cardiac dysfunction"OR"acute renal failure*"OR"acute kidney injury"OR"Renal Insufficiency"OR"Renal Insufficiencies" OR " Kidney Insufficiency" OR " Kidney Insufficiencies"OR"Kidney Failure*"OR"Renal Failure*"OR"cerebral edema"OR"brain edema"OR"Brain Swelling"OR"intracranial hypertension"OR"Intracranial Pressure Increase"OR"ICP Increase" OR "Intracranial Pressure Elevation" OR"ICP Elevation"OR"Elevated ICP"OR"Elevated Intracranial Pressure"OR"gastrointestinal failure"OR"acute liver failure"OR"Fulminating Hepatic Failure*"OR"Acute Hepatic Failure*"OR"Fulminant Hepatic Failure*"OR"Fulminating Liver Failure*"OR"Fulminant Liver Failure*"OR Sepsis OR Pyemia* OR Pyohemia* OR Pyaemia* OR Septicemia* OR"Blood Poisoning*"OR"severe sepsis"OR"septic shock"OR shock OR"Cardiogenic shock"OR"Circulatory Failure"OR"Circulatory Collapse"OR"multiple organ dysfunction syndrome"OR MODS OR"Multiple organ damage"OR"multiple organ failure"OR"disseminated intravascular coagulation*"OR"Intravascular Disseminated Coagulation*"OR"Consumption Coagulopath*"OR DIC OR"abdominal compartment syndrome*"OR"Intra-AbdominalHypertension*" OR "IntraAbdominal Hypertension*" OR "IntraabdominalHypertension*" OR Encephalitis OR "BrainInflammation" OR "hemolyticuremic syndrome"OR"Hemolytic-Uremic Syndrome"OR"Hemolytic crisis"OR"tumor lysis syndrome*"OR"Status epilepticus"OR"Fulminant myocarditis"OR ketoacidosis OR"Diabetic ketoacidosis"OR DKA OR"Severe malnutrition"OR"Traumatic brain injury"OR Trauma OR"Traumatic injuries"OR"Open abdomen"OR"Open peritoneal cavity"OR"Enterocutaneous fistula"OR"Intestinal Fistula"OR"Colovesical Fistula"OR"Enterocutaneous Fistula"OR"Cholecystoduodenal Fistula"OR Injury OR injuries OR Burn OR"Head injury"OR"Chest trauma"OR"Chest Injur*"OR"Thoracic Injur*"OR"Blunt multiple trauma"OR"Multiple injury"OR"Multiple Traumas"OR"Multiple Wound*"OR Polytrauma*OR"Abdominal trauma"OR"Abdominal Injur*"OR "Subarachnoid hemorrhage*"OR"intracranial hemorrhage*"OR"Brain Hemorrhage*"OR"diffuse axonal injur*"OR"car accident"OR"road accident"OR"traffic accident injury"OR"accidental injury"OR Wound OR"liver transplant*" OR"Hepatic Transplant*" OR"Multi-visceral transplantation"OR"intestinal transplantation"OR"small bowel transplant"OR"portal hypertension*"OR"Cruveilhier-Baumgarten Syndrome"OR"CruveilhierBaumgarten Syndrome"OR"Intestinal failure"OR"Parenchymal lung disease"OR"Invasive pulmonary aspergillosis"OR"Pulmonary Aspergillosis Invasive"OR"Chronic Necrotizing Pulmonary Aspergillosis"OR"Allergic Bronchopulmonary Mycosis"OR"Allergic Bronchopulmonary Mycoses"OR"Pulmonary candidiasis"OR"Pneumocystis carinii pneumonia"OR"Pneumocystis Pneumonias"OR Pneumocystosis OR Pneumocystoses OR"Respiratory viral infections"OR"pleural effusion*"OR pancreatitis OR"severe acute pancreatitis"OR"acute necrotizing pancreatitis"OR"liver dysfunction"OR"hepatic insufficiency"OR"liver malfunction"OR"hepatic dysfunction"OR dyshepatia OR"hepatic injury"OR"hyperacute liver failure"OR"cholestatic liver disease"OR"cholestatic disease" OR " biliary atresia" OR " intrahepatic cholestasis"OR"intrahepatic cholestasis"OR"intrahepatic biliary stasis"OR"intrahepatic biliary stasis"OR"parenteral nutritionassociated cholestasis"OR"extrahepatic biliary atresia* "OR"hepatic cirrhosis"OR"liver cirrhosis"OR"liver cirrhoses"OR"hepatic cirrhosis"OR"progressive familial intrahepatic cholestasis"OR"congenital heart surgery"OR Chylothorax OR"congenital heart disease"OR"congenital heart defect* "OR"congenital cardiac disease"OR"heart Abnormalit* "OR"pulmonary hypertension"OR"cardiac surgery"OR"protein-losing enteropath* "OR"protein losing enteropath* "OR"surgical abdominal disorder"OR"gastrointestinal bleeding"OR"gastrointestinal Hemorrhage* "OR Hematochezia* OR"intestinal dysmotility"OR"chyle leak"OR ileus OR"necrotizing enterocolitis"OR"short bowel syndrome"OR"extensive intestinal resection"OR"abdominal surgery"OR"intestinal dysmotility"OR"congenital diaphragmatic hernia"OR"mechanical obstruction"OR"hirschsprung disease"OR peritonitis OR"intestinal perforation" OR " immune dysfunction" OR Immunoparalysis OR " critical illness stress-induced immune suppression" OR CRISIS OR " compensatory anti-inflammatory response syndrome"OR"hematopoietic stem cell transplantation"OR"bone marrow transplantation"OR"bone marrow grafting"OR"bone marrow celltransplantation " OR " allogeneic stem cell transplantation"OR"chronic graft-versus-host disease"OR HSCT OR cachexia OR"sleep-disordered breathing"OR"obstructive hypopnea" OR " obstructive sleep apnea " OR " obesity hypoventilation syndrome" OR Immunocompromised OR hematooncology OR " moderately malnourished " OR " moderately malnutrition " OR " cardiopulmonary resuscitation " OR "extracorporeal membrane oxygenation"OR"mechanical ventilation"OR"blood purification"OR haemodiafiltration OR hemodialysis OR"peritoneal dialysis"OR"continuous renal replacement therapy"OR CRRT OR"continuous venovenous hemofiltration OR"intermittent hemodialysis"OR"mechanical ventilation through an endotracheal tube"OR"conventional mechanical ventilation"OR"high-frequency oscillatory ventilation"OR"continuous positive airway pressure"OR CPAP OR"bilevel positive airway pressure"OR BiPAP OR"Intensive insulin therapy"OR"Endotracheal intubation"OR"Intratracheal Intubation"OR"artificial liver support system"OR ALSS
#6 "Heart Arrest"[Mesh] OR"Apnea"[Mesh] OR"Respiratory Insufficiency"[Mesh] OR"Acute Lung Injury"[Mesh]OR"Heart Failure"[Mesh]OR"Renal Insufficiency"[Mesh]OR"Brain Edema"[Mesh]OR"Intracranial Hypertension"[Mesh]OR"Liver Failure,Acute"[Mesh] OR"Sepsis"[Mesh] OR"Shock"[Mesh] OR"Anaphylaxis"[Mesh] OR"Multiple Organ Failure"[Mesh]OR"Disseminated Intravascular Coagulation"[Mesh]OR"Intra-Abdominal Hypertension"[Mesh] OR"Adrenal Insufficiency"[Mesh] OR "Encephalitis"[Mesh] OR "Hemolytic-Uremic Syndrome"[Mesh]OR"Tumor Lysis Syndrome"[Mesh]OR"Status Epilepticus"[Mesh] OR"Diabetic Ketoacidosis"[Mesh] OR"Wounds and Injuries"[Mesh]OR"Intestinal Fistula"[Mesh]OR"Burns"[Mesh]OR"Craniocerebral Trauma"[Mesh] OR"Thoracic Injuries"[Mesh] OR"Multiple Trauma"[Mesh] OR"Abdominal Injuries"[Mesh]OR"Intracranial Hemorrhages"[Mesh]OR"Diffuse Axonal Injury"[Mesh] OR"Liver Transplantation"[Mesh] OR"Hypertension,Portal"[Mesh]OR"Invasive Pulmonary Aspergillosis"[Mesh] OR"Pneumonia,Pneumocystis"[Mesh] OR"Pleural Effusion"[Mesh]OR"Pancreatitis"[Mesh]OR"Pancreatitis,Acute Necrotizing"[Mesh] OR"Acute-On-Chronic Liver Failure"[Mesh]OR"Biliary Atresia"[Mesh]OR"Cholestasis,Intrahepatic"[Mesh]OR"Biliary Atresia"[Mesh] OR"Liver Cirrhosis"[Mesh] OR"Chylothorax"[Mesh]OR"Heart Defects,Congenital"[Mesh] OR"Hypertension,Pulmonary"[Mesh]OR"Protein-Losing Enteropathies"[Mesh] OR"Gastrointestinal Hemorrhage"[Mesh] OR"Ileus"[Mesh] OR"Enterocolitis,Necrotizing"[Mesh] OR"Short Bowel Syndrome"[Mesh]OR"Hernias,Diaphragmatic,Congenital"[Mesh]OR"Hirschsprung Disease"[Mesh]OR"Peritonitis"[Mesh]OR"Intestinal Perforation"[Mesh] OR "Hematopoietic Stem Cell Transplantation"[Mesh] OR"Bone Marrow Transplantation"[Mesh]OR"Cachexia"[Mesh]OR"Sleep Apnea Syndromes"[Mesh]OR"Obesity Hypoventilation Syndrome"[Mesh] OR"Cardiopulmonary Resuscitation"[Mesh] OR"Extracorporeal Membrane Oxygenation"[Mesh]OR"Respiration,Artificial"[Mesh]OR"Hemodiafiltration"[Mesh] OR"Peritoneal Dialysis"[Mesh] OR"Hemofiltration"[Mesh]OR"Continuous Positive Airway Pressure"[Mesh] OR"Intubation,Intratracheal"[Mesh]
#7 child* OR infant* OR infancy OR kid OR kids OR baby OR babies OR pediatric* OR paediatric* OR adolescen* OR teenage*OR puberty OR"school age"OR school-age*OR toddler*OR preschool* OR kindergarten
#8 "Child"[Mesh] OR"Infant"[Mesh] OR"Pediatrics"[Mesh] OR"Child,Preschool"[Mesh] OR"Adolescent"[Mesh]OR"Puberty"[Mesh] OR"Puberty"[Mesh]
#9 (#1 OR#2)AND(#3 OR#4 OR#5 OR#6)AND(#7 OR#8)
#10 #9 NOT(animals[mesh] NOT(animals[mesh] AND human[mesh]))
Filters:Clinical Trial;Clinical Trial,Phase I;Clinical Trial,Phase II;Clinical Trial, Phase III; Clinical Trial, Phase IV;Comparative Study;Observational Study;Journal Article;Guideline;Controlled Clinical Trial;Meta-Analysis;Multicenter Study;Systematic Reviews;Randomized Controlled Trial;Practice Guideline;English
AND((Clinical Trial[ptyp] OR Clinical Trial,Phase I[ptyp] OR Clinical Trial,Phase II[ptyp] OR Clinical Trial,Phase III[ptyp] OR Clinical Trial,Phase IV[ptyp] OR Comparative Study[ptyp] OR Observational Study[ptyp] OR Journal Article[ptyp] OR Guideline[ptyp] OR Controlled Clinical Trial[ptyp] OR Meta-Analysis[ptyp]OR Multicenter Study[ptyp] ORsystematic[sb] OR Randomized Controlled Trial[ptyp] OR Practice Guideline[ptyp])AND English[lang])
以营养风险筛查选题方向下的营养筛查的工具及其局限性分选题检索式为例:
将“营养筛查的工具及其局限性”转化为PICOS,P(对象):危重症患儿;I(待评价营养筛查工具):Screening tool for the assessmentofmalnutrition in Pediatrics,Simple pediatric nutrition screening tool,PNST,Subjective global nutrition assessment,SGNA,Pediatric yorkhill malnutrition score,PYMS,Screening Tool for Risk on Nutritional Status AND Growth,STRONGkids;C(金标准筛查工具及其界值):采用身高、体重和年龄指标,或组合为年龄别身高、或身高别体重、或BMI,以-2 SD~-3 SD Z值为界值诊断中度营养不良,<-3 SD Z值为界值诊断重度营养不良;O(考察指标):待评价筛查工具中、重度营养不良筛查的敏感度和特异度;S(文献类型):诊断准确性研究、横断面研究、队列研究、病例对照研究和病例系列报告。
以PubMed为例,营养筛查的工具及其局限性检索式如下。
#1 基本检索式AND"Screening tool for the assessment of malnutrition in pediatrics"OR"Simple pediatric nutrition screening tool"OR PNST OR"Subjective global nutrition assessment"OR SGNA OR"Pediatric yorkhill malnutrition score"OR PYMS OR"Screening Tool for Risk on Nutritional Status AND Growth"OR STRONGkids
#2 #1NOT(animals[mesh]NOT(animals[mesh]AND human[mesh]))
Filters:Clinical Trial;Clinical Trial,Phase I;Clinical Trial,Phase II;Clinical Trial,Phase III;Clinical Trial,Phase IV;Comparative Study;Observational Study;Journal Article;Guideline;Controlled Clinical Trial;Meta-Analysis;Multicenter Study; Systematic Reviews; Randomized Controlled Trial;Practice Guideline;English
检索结果:截止2015年8月 18日,基本检索式在PubMed共检索到7 779篇文献,EMBASE共检索到27 148篇文献;基本检索式分别+营养筛查的工具及其局限性检索式,查重后223篇;+营养评估的方法及其局限性检索式,查重后1 385篇;+能量需求的测定方法检索式,查重后1 715篇;+宏量营养素的推荐原则检索式,查重后2 603篇;+微量营养素的推荐原则检索式,查重后1 175篇;+免疫营养素检索式,查重后2 058篇;+所有的患儿都适合EN检索式,查重后1 941篇;+EN主要并发症及其管理检索式,查重后233篇;+EN制剂的类型检索式,查重后828篇;+早期EN的定义、时机和优点检索式,查重后508篇;+所有的患儿都适合PN检索式,查重后3 128篇;+谷氨酰胺、赖氨酸检索式,查重后618篇;+PN的主要并发症及其管理检索式,查重后602篇。2016年10月30日以相同检索策略补充检索并查重后纳入2 687文献。中文CBM数据库只以基本检索式检索,两次检索共5 972(5 616+356)篇文献。3个数据库共检索到25 673篇文献。文献筛选流程见图22。
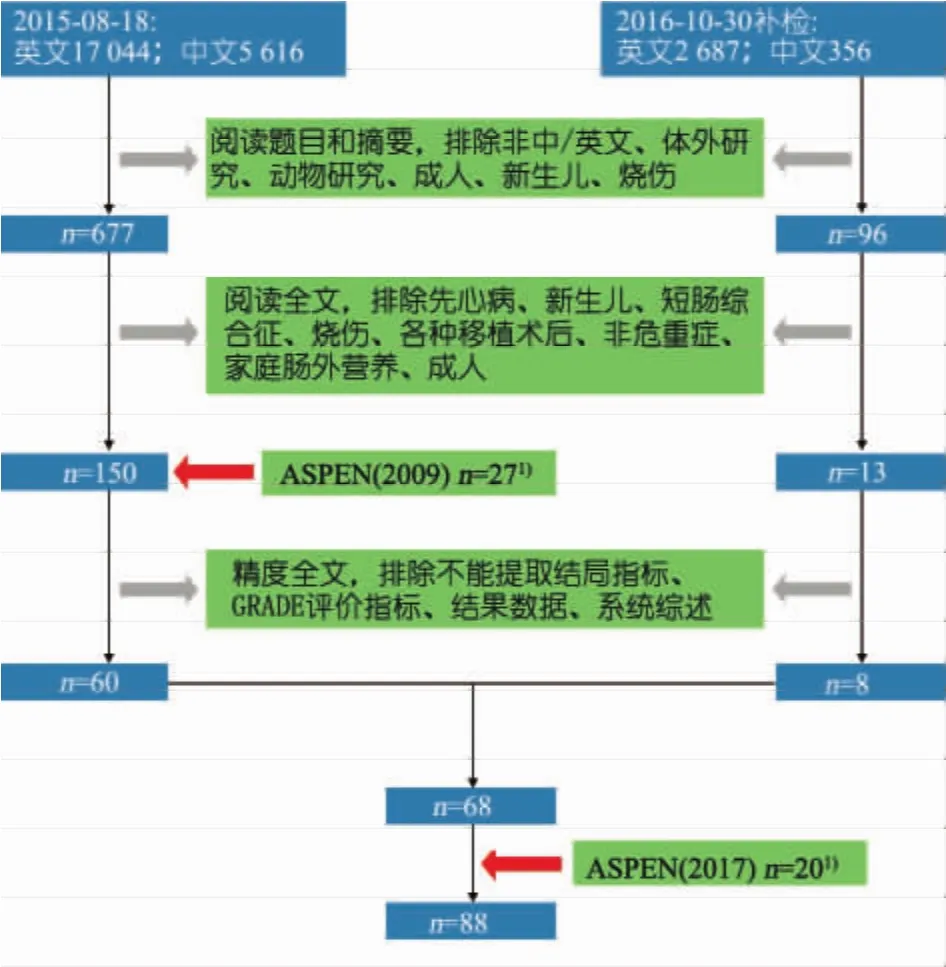
图22 文献筛选流程图
10 文献筛选
10.1 文献初筛原则 单人筛选。排除无摘要的论文;通过阅读文献题目和摘要,排除会议论文、述评、讲座、专题笔
谈、传统综述、新生儿、成人和动物实验文献。
10.2 文献再次筛选原则 单人筛选。通过阅读文献摘要,排除与所在分选题明显不相关的文献。
单人阅读全文提取数据,2人复核。诊断准确性研究,需有明确的金标准和待评价诊断工具,且能提取诊断四格表数据,计算敏感度和特异度;队列研究、病例对照研究能提取RR值、OR值或SE;横断面研究和病例系列报告能提取暴露率或发生率;干预研究(RCT、非RCT和自身前后对照),能提取结局指标数据和实际分析样本量。
11 证据评价
本指南以GRADE作为证据评价工具。GRADE将证据分为高、中、低和极低4个等级,由RCT、诊断准确性研究组成的证据体初始作为高质量证据,由观察性(队列、病例对照、横断面、病例系列报告和病例报告)研究组成的证据体初始作为低质量证据[89]。
以下5项标准为降低证据质量的因素:①研究设计和实施的局限性:根据不同的研究类型选择相应的评价工具;②效应量估计值不精确(样本量小、结局事件发生少和效应估计值置信区间宽);③研究结果不一致性(临床异质性和统计学异质性);④间接证据;⑤发表偏倚。
以下3项因素提升证据质量:①效应值很大;②明确的混杂因素降低了疗效;③存在明显的量效关系。提升证据质量仅限观察性研究,但设计和实施存在局限性的研究不再升级[90]。
GRADE证据推荐强度的主要决定因素是治疗利弊关系,同时也要兼顾文献证据质量、患儿家长及监护人价值观和意愿、医疗成本[90]。高(A):非常确信效应估计值接近真实效应值;中(B):对效应估计值有中等程度的信心,效应估计值可能接近真实效应值,但仍存在两者大不相同的可能性;低(C):对效应估计值的确信程度有限,效应估计值可能与真实效应值大不相同;极低(D):对效应估计值几乎没有信心,效应估计值很可能与真实效应值大不相同。
GRADE推荐强度的定义如下。支持和反对使用某项干预措施的强推荐和强反对(1):干预措施明显利大于弊和弊大于利;支持和反对使用某项干预措施的弱推荐或弱反对(2):干预措施可能利大于弊和可能弊大于利或利弊关系不明确。
12 资料提取并生成证据概要表
本指南对文献信息的提取由2人提取,集体讨论确认。局限性的评价先由1人评价,再由集体讨论确定。
12.1 提取纳入文献信息 一般信息(分组、作者、国家、发表年代、随访和样本量);研究信息(来源、诊断标准、纳入标准、排除标准、人口学特征、结局指标测定方法、失访、随访时间);结局指标(暴露因素及其OR,或待评价诊断标准敏感度、特异度,或干预效应量大小及其95%CI)。
12.2 文献的局限性评价工具 病例对照研究和队列研究以NOS量表作为评价工具[91],满足≥8/11项为偏倚风险低;横断面研究以AHRQ量表作为评价工具[92],满足>9/13项为偏倚风险低;干预研究以Cochrane系统评价员手册6条标准作为评价工具[93];诊断准确性研究以QUDAS2量表作为评价工具[94];病例报告以改良IHE病例系列方法学质量评价清单为评价工具[95],满足7/8条以上为偏倚风险可接受。
12.3 可以合并的证据行Meta分析。
12.4 生成证据概要表。
13 授权说明
中华医学会儿科分会急诊学组和中华医学会急诊分会儿科学组授权,在《中国循证儿科杂志》发布中文版指南的标准版和简化版,在World Journal of Pediatrics发布英文简化版。本指南制作中的全部文件,如不同选煶问题的检索词和检索式、进入初筛的文献、再次筛选的文献、进入评价的文献等文件保存于复旦大学附属儿科医院临床指南制作和评价中心备查。
14 利益关系声明
本指南制作过程中,指南工作组成员均以书面形式保证与任何药商和器械商无利益关系,亦无冲突关系。同时也注意了在危重症儿童营养评估专业不同学术观点和派别的利益冲突。
15 制作指南经费来源
本指南制作经费来源于指南制作工作组专家的课题经费和中华医学会儿科学分会危重症学组指南制作经费;经费主要用于面对面会议时的差旅和场租费以及劳务支出。
16 更新计划
本指南预计每5年更新1次。当有新证据足以改变现有推荐意见方向时,将考虑对指南进行更新。
17 致谢
本指南制作过程中的Meta分析均由复旦大学附属儿科医院薛爱娟完成,在此特别致谢。GRADE中国中心陈耀龙、四川大学华西第二医院万朝敏和罗双红作为方法学函审专家,对本指南的总体表现等环节给出了具体意见,在此深表谢意。感谢复旦大学厦门市儿童医院庄德义对指南制作中部分会务工作的支持。
18 证据概要表
见表1。
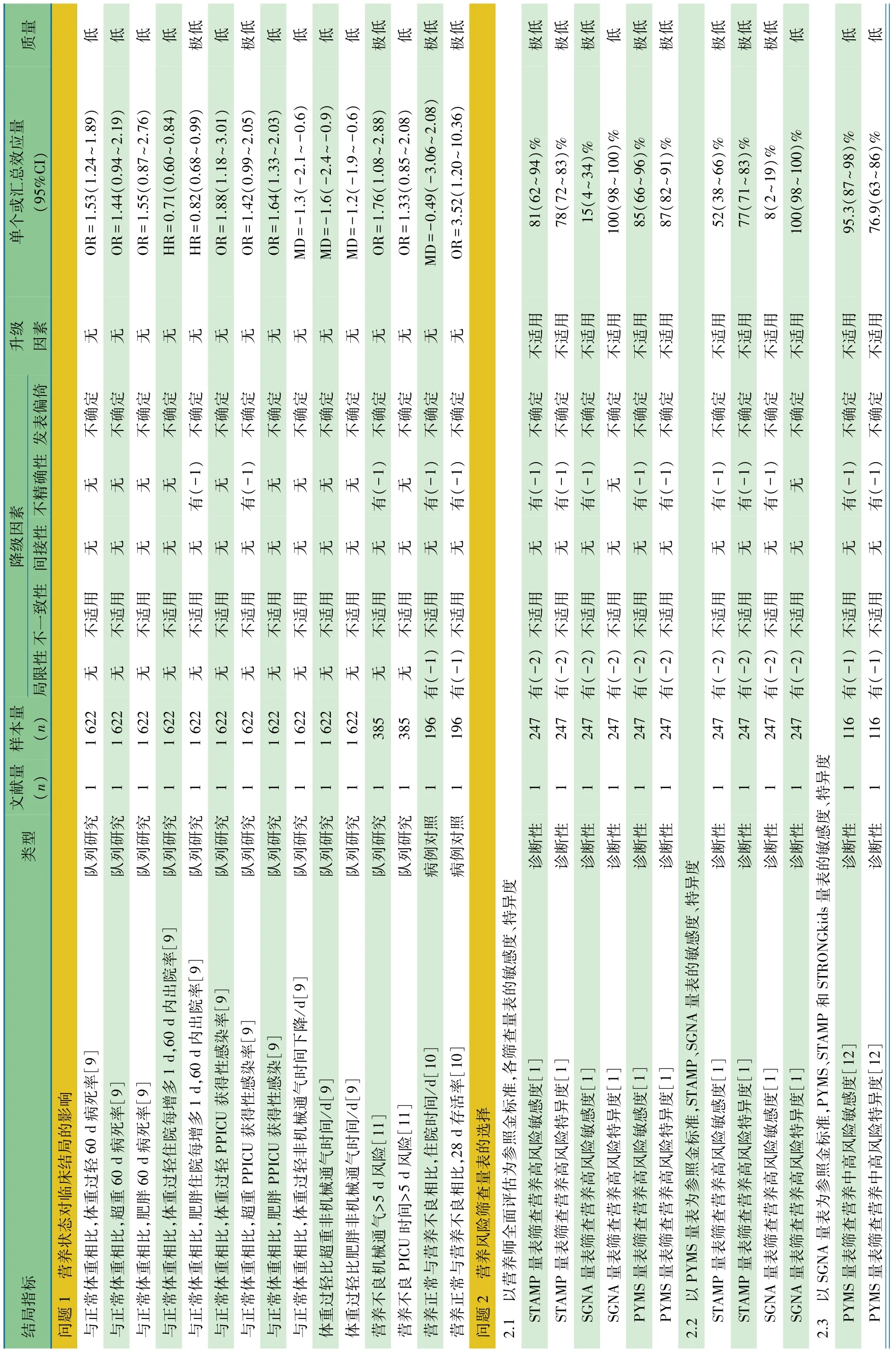
表1 危重症儿童营养支持治疗指南(中国 2018)证据概要表
续表
续表
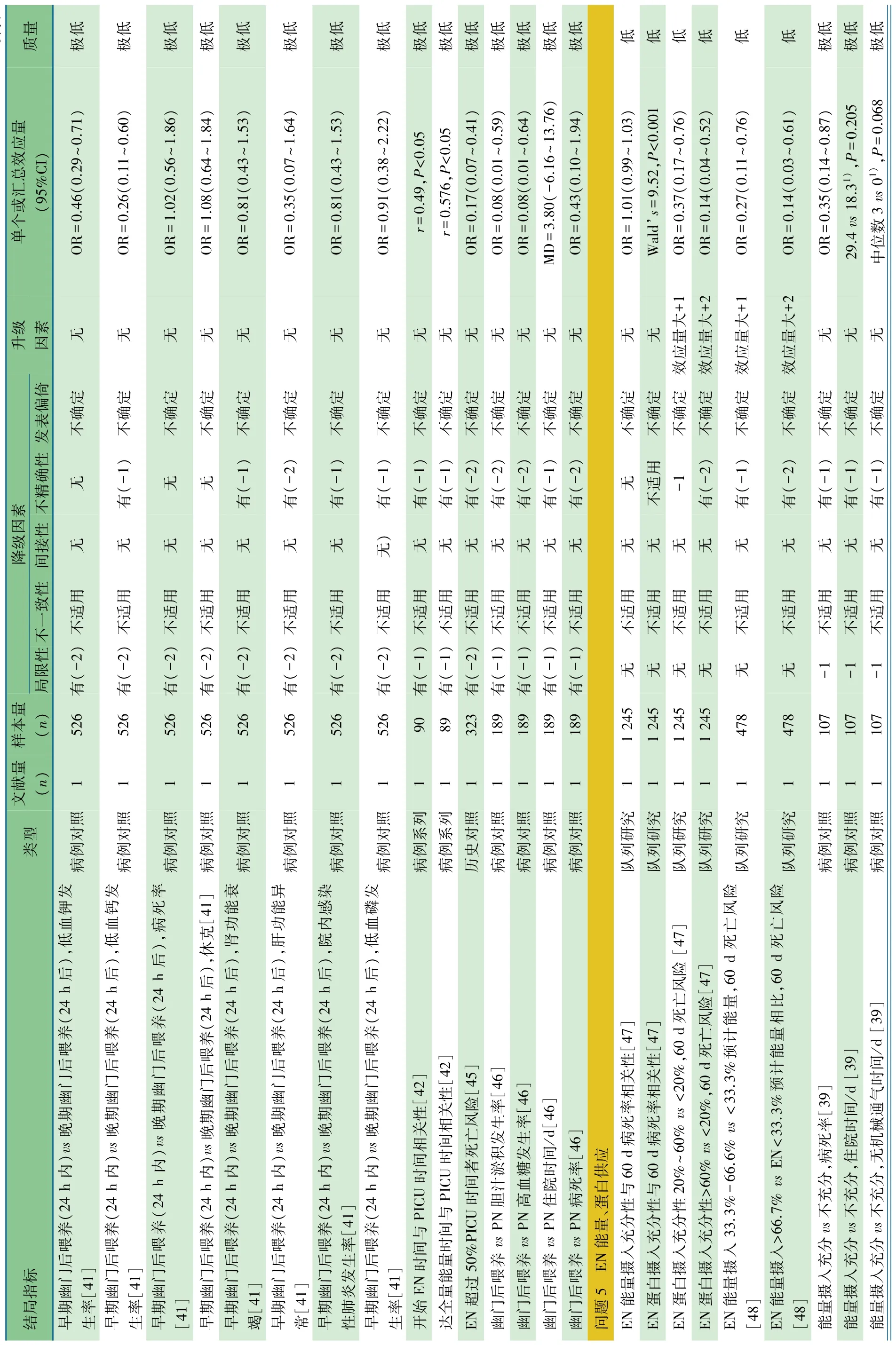
续表
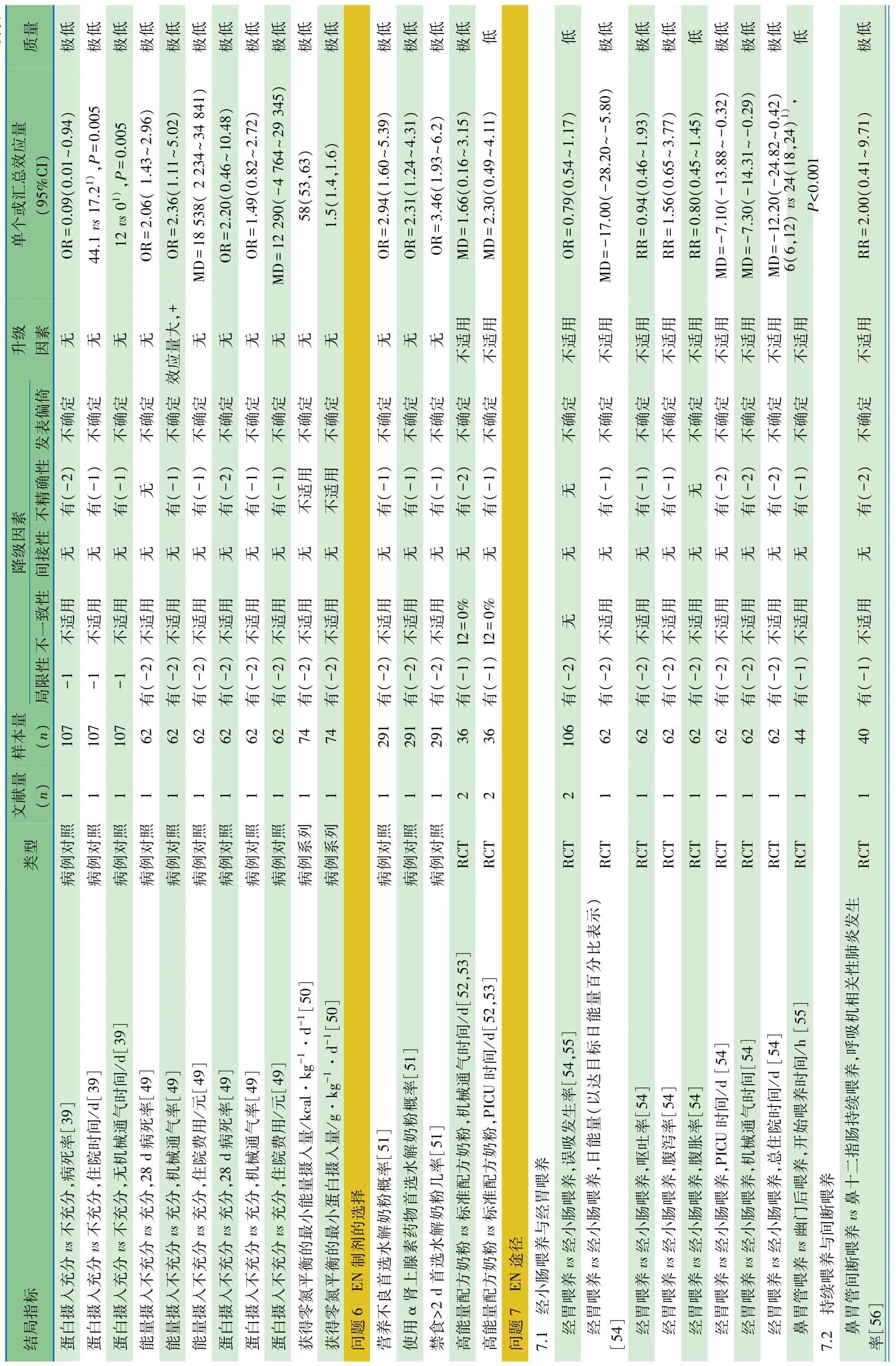
续表
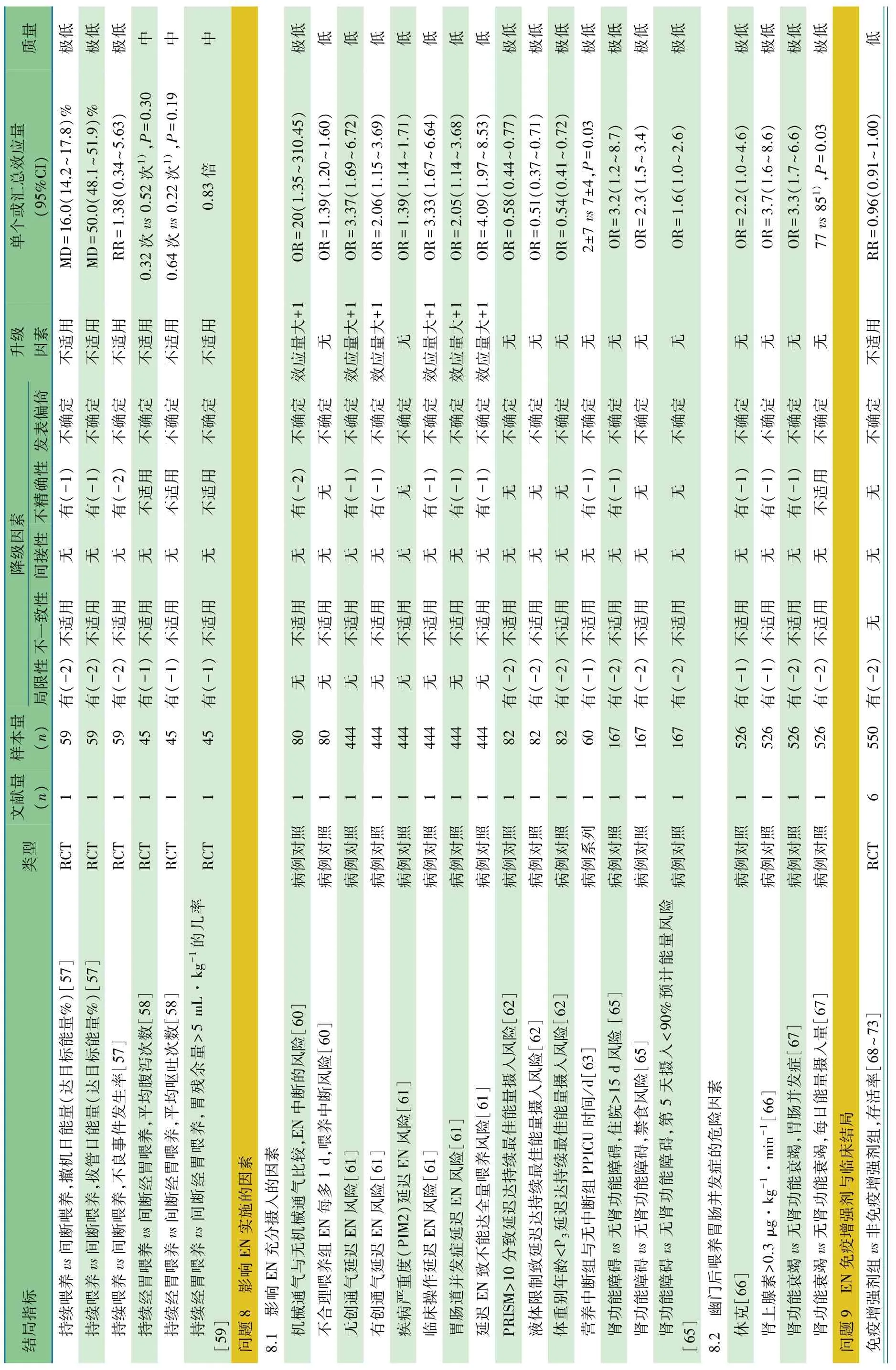
续表
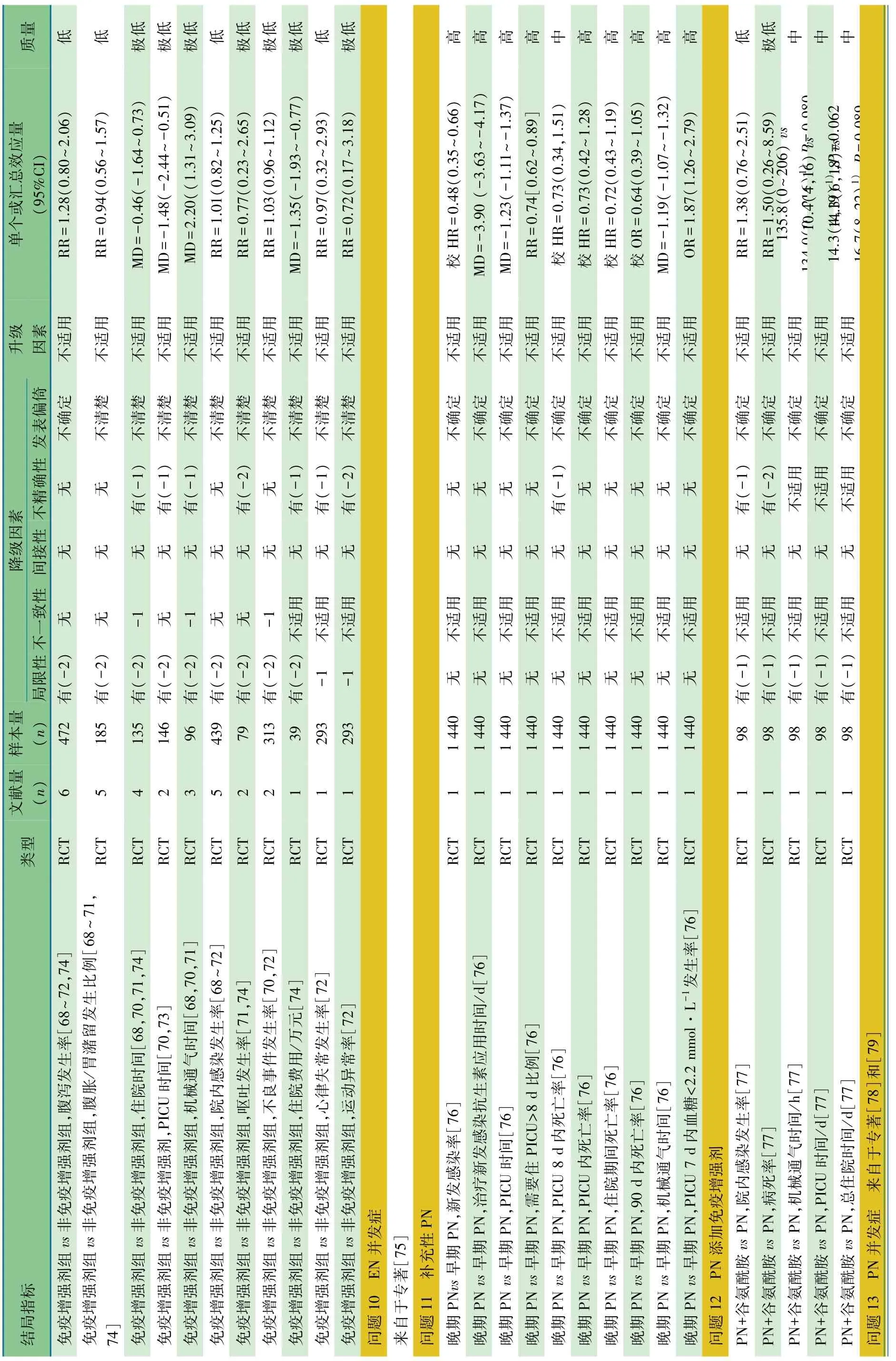
续表
续表
续表
[1] Gerasimidis K, Keane O, Macleod I, et al.A four-stage evaluation of the Paediatric Yorkhill Malnutrition Score in a tertiary paediatric hospital and a district general hospital.Br J Nutr,2010,104(5):751-756
[2] Mehta NM, Bechard LJ, Leavitt K, et al.Cumulative energy imbalance in the pediatric intensive care unit:role of targeted indirect calorimetry.JPEN J Parenter Enteral Nutr,2009,33(3):336-344
[3] Hulst JM, Zwart H, Hop WC, et al.Dutch national survey to test the STRONGkids nutritional risk screening tool in hospitalized children.Clin Nutr,29(1):106-111
[4]McCarthy H, Dixon M, Crabtree I, et al.The development and evaluation of the Screening Tool for the Assessment of Malnutrition in Paediatrics(STAMP )for use by healthcare staff.J Hum Nutr Diet,2012,25(4):311-318
[5]White M, Lawson K, Ramsey R, et al.Simple Nutrition Screening Tool for Pediatric Inpatients.JPEN J Parenter Enteral Nutr,2016,40(3):392-398
[6]Teitelbaum D, Guenter P, Howell WH, et al.Definition of terms, style, and conventions used in A.S.P.E.N.guidelines and standards.Nutr Clin Pract,2005,20(2):281-285
[7]Vazquez Martinez JL, Martinez-Romillo PD, Diez Sebastian J, et al.Predicted versus measured energy expenditure by continuous,online indirect calorimetry in ventilated,critically ill children during the early postinjury period.Pediatr Crit Care Med,2004,5(1):19-27
[8]Ross PA, Newth CJ, Leung D, et al.Obesity and Mortality Risk in Critically Ill Children.Pediatrics,2016,137(3):e20152035
[9]Bechard LJ, Duggan C, Touger-Decker R, et al.Nutritional Status Based on Body Mass Index Is Associated With Morbidity and Mortality in Mechanically Ventilated Critically Ill Children in the PICU.Crit Care Med,2016,44(8):1530-1537
[10]张哲哲,钱素云,祝益民.儿童加强监护病房患儿营养状况的调查.中华急诊医学杂志,2015,24(6):597-601
[11]de Souza Menezes F, Leite HP, Koch Nogueira PC.Malnutrition as an independent predictor of clinical outcome in critically ill children.Nutrition,2012,28(3):267-270
[12]Wonoputri N, Djais JT, Rosalina I.Validity of nutritional screening tools for hospitalized children.J Nutr Metab,2014,2014:143649
[13]Chourdakis M, Hecht C, Gerasimidis K, et al.Malnutrition risk in hospitalized children:use of 3 screening tools in a large European population.Am J Clin Nutr,2016,103(5):1301-1310
[14] Spagnuolo MI, Liguoro I, Chiatto F, et al.Application of a score system to evaluate the risk of malnutrition in a multiple hospital setting.Ital J Pediatr, 2013,39:81
[15] Huysentruyt K, Alliet P, Muyshont L, et al.The STRONG(kids)nutritional screening tool in hospitalized children:a validation study.Nutrition,2013,29(11-12):1356-1361
[16] Moeeni V1, Walls T, Day AS.Assessment of nutritional status and nutritional risk in hospitalized Iranian children.Acta Paediatr,2012,101(10):e446-451
[17]Thomas PC, Marino LV, Williams SA, et al.Outcome of nutritional screening in the acute paediatric setting.Arch Dis Child,2016,101(12):1119-1124
[18]Verhoeven JJ, Hazelzet JA, van der Voort E, et al.Comparison of measured and predicted energy expenditure in mechanically ventilated children.Intensive Care Med,1998,24(5):464-468
[19]White MS, Shepherd RW, McEniery JA.Energy expenditure in 100 ventilated,critically ill children:improving the accuracy of predictive equations.Crit Care Med,2000,28(7):2307-2312[20]Mtaweh H, Smith R, Kochanek PM, et al.Energy expenditure in children after severe traumatic brain injury.Pediatr Crit Care Med,2014,15(3):242-249
[21]Coss-Bu JA, Jefferson LS, Walding D, et al.Resting energy expenditure and nitrogen balance in critically ill pediatric patients on mechanical ventilation.Nutrition,1998,14(9):649-652
[22]de Klerk G, Hop WC, de Hoog M, et al.Serial measurements of energy expenditure in critically ill children:useful in optimizing nutritional therapy?Intensive Care Med,2002,28(12):1781-1785
[23]Joosten KF, Verhoeven JJ, Hazelzet JA.Energy expenditure and substrate utilization in mechanically ventilated children.Nutrition,1999,15(6):444-448
[24]Coss-Bu JA, Jefferson LS, Walding D, et al.Resting energy expenditure in children in a pediatric intensive care unit:comparison of Harris-Benedict and Talbot predictions with indirect calorimetry values.Am J Clin Nutr,1998,67(1):74-80[25]洪莉,沈丽媛,赵醴,等.机械通气危重患儿的连续性静息能量消耗测定.中华临床营养杂志.2015,23(1):1-7
[26]Oosterveld MJ, Van Der Kuip M, De Meer K, et al.Energy expenditure and balance following pediatric intensive care unit admission:a longitudinal study of critically ill children.Pediatr Crit Care Med,2006,7(2):147-153
[27]White MS, Shepherd RW, McEniery JA.Energy expenditure measurements in ventilated critically ill children:within-and between-day variability.JPEN J Parenter Enteral Nutr,1999,23(5):300-304
[28]Framson CM, LeLeiko NS, Dallal GE, et al.Energy expenditure in critically ill children.Pediatr Crit Care Med,2007,8(3):264-267
[29]Briassoulis G, Venkataraman S, Thompson AE.Energy expenditure in critically ill children.Crit Care Med,2000,28(4):1166-1172
[30]Taylor RM, Cheeseman P, Preedy V, et al.Can energy expenditure be predicted in critically ill children?Pediatr Crit Care Med,2003,4(2):176-180
[31]van der Kuip M, de Meer K, Westerterp KR, et al.Physical activity as a determinant of total energy expenditure in critically ill children.Clin Nutr,2007,26(6):744-751
[32]Mehta NM, Smallwood CD, Joosten KF, et al.Accuracy of a simplified equation for energy expenditure based on bedside volumetric carbon dioxide elimination measurement--a twocenter study.Clin Nutr,2015,34(1):151-155
[33]Dokken M, Rusten T, Stubhaug A.Indirect calorimetry reveals that better monitoring of nutrition therapy in pediatric intensive care is needed.JPEN J Parenter Enteral Nutr,2015,39(3):344-352
[34]Agostoni C, Edefonti A, Calderini E, et al.Accuracy of Prediction Formulae for the Assessment of Resting Energy Expenditure in Hospitalized Children.J Pediatr Gastroenterol Nutr,2016,63(6):708-712
[35]Hardy CM, Dwyer J, Snelling LK, ea al.Pitfalls in predicting resting energy requirements in critically ill children:a comparison of predictive methods to indirect calorimetry.Nutr Clin Pract,2002,17(3):182-189
[36]Meyer R, Kulinskaya E, Briassoulis G, et al.The challenge of developing a new predictive formula to estimate energy requirements in ventilated critically ill children.Nutr Clin Pract,2012,27(5):669-676
[37]Sy J, Gourishankar A, Gordon WE, et al.Bicarbonate kinetics and predicted energy expenditure in critically ill children.Am J Clin Nutr,2008,88(2):340-347
[38]Mikhailov TA, Kuhn EM, Manzi J, et al.Early enteral nutrition is associated with lower mortality in critically ill children.JPEN J Parenter Enteral Nutr,2014,38(4):459-466
[39]Wong JJ, Han WM, Sultana R, et al.Nutrition Delivery Affects Outcomes in Pediatric Acute Respiratory Distress Syndrome.JPEN J Parenter Enteral Nutr,2017,41(6):1007-1013
[40]庄睿丹,马鸣,楼金轩,等.儿童急性胰腺炎鼻空肠营养置管及肠内营养时机的探讨,中国当代儿科杂志,2014,16(11):1086-1090
[41]Sánchez C, López-Herce J, Carrillo A, et al.Early transpyloric enteral nutrition in critically ill children.Nutrition,2007,23(1):16-22
[42]Taha AA, Badr L, Westlake C, et al.Effect of early nutritional support on intensive care unit length of stay and neurological status at discharge in children with severe traumatic brain injury.J Neurosci Nurs,2011,43(6):291-297
[43]Briassoulis GC, Zavras NJ, Hatzis MD TD.Effectiveness and safety of a protocol for promotion of early intragastric feeding in critically ill children.Pediatr Crit Care Med,2001,2(2):113-121
[44]King W, Petrillo T, Pettignano R.Enteral nutrition and cardiovascular medications in the pediatric intensive care unit.JPEN J Parenter Enteral Nutr,2004,28(5):334-338
[45]Gurgueira GL, Leite HP, Taddei JA, et al.Outcomes in a pediatric intensive care unit before and after the implementation of a nutrition support team.JPEN J Parenter Enteral Nutr,2005,29(3):176-185
[46]de Lucas C, Moreno M, López-Herce J, et al.Transpyloric enteral nutrition reduces the complication rate and cost in the critically ill child.J Pediatr Gastroenterol Nutr,2000,30(2):175-180
[47]Mehta NM, Bechard LJ, Zurakowski D, et al.Adequate enteral protein intake is inversely associated with 60-d mortality in critically ill children:a multicenter, prospective, cohort study.Am J Clin Nutr,2015,102(1):199-206
[48]Mehta NM, Bechard LJ, Cahill N,et al.Nutritional practices and their relationship to clinical outcomes in critically ill children-an international multicenter cohort study.Crit Care Med,2012,40(7):2204-2211
[49]方伯梁,钱素云.PICU脓毒症及严重脓毒症患儿肠内营养摄入能量及蛋白质充分性及其与预后的关系.首都医科大学学报,2016,37(2):125-129
[50]Jotterand Chaparro C, Laure Depeyre J, Longchamp D, et al.How much protein and energy are needed to equilibrate nitrogen and energy balances in ventilated critically ill children?Clin Nutr,2016,35(2):460-467
[51]Vidigal MV, Leite HP, Nogueira PC.Factors associated with peptide-based formula prescription in a pediatric intensive care unit.J Pediatr Gastroenterol Nutr,2012,54(5):620-623
[52]de Betue CT, van Waardenburg DA, Deutz NE, et al.Increased protein-energy intake promotes anabolism in critically ill infants with viral bronchiolitis:a double-blind randomised controlled trial.Arch Dis Child,2011,96(9):817-822
[53]van Waardenburg DA, de Betue CT, Goudoever JB,et al.Critically ill infants benefit from early administration of protein and energy-enriched formula:a randomized controlled trial.Clin Nutr,2009,28(3):249-255
[54]Meert KL, Daphtary KM, Metheny NA.Gastric vs small-bowel feeding in critically ill children receiving mechanical ventilation:a randomized controlled trial.Chest,2004,126(3):872-878
[55]Kamat P, Favaloro-Sabatier J, Rogers K, et al.Use of methylene blue spectrophotometry to detect subclinical aspiration in enterally fed intubated pediatric patients.Pediatr Crit Care Med,2008,9(3):299-303
[56]Snmez Düzkaya D, Yildiz S.Effect of two different feeding methods on preventing ventilator associated pneumonia in the paediatric intensive care unit(PICU):A randomised controlled study.Aust Crit Care,2016,29(3):139-145
[57]Lyons KA, Brilli RJ, Wieman RA, et al.Continuation of transpyloric feeding during weaning of mechanical ventilation and tracheal extubation in children:a randomized controlled trial.JPEN J Parenter Enteral Nutr,2002,26(3):209-213
[58]Horn D, Chaboyer W.Gastric feeding in critically ill children:a randomized controlled trial.Am J Crit Care,2003,12(5):461-468
[59]Horn D, Chaboyer W, Schluter PJ.Gastric residual volumes in critically ill paediatric patients:a comparison of feeding regimens.Aust Crit Care,2004,17(3):98-100, 102-103
[60]Mehta NM, McAleer D, Hamilton S, et al.Challenges to optimal enteral nutrition in a multidisciplinary pediatric intensive care unit.JPEN J Parenter Enteral Nutr,2010,34(1):38-45
[61]Canarie MF, Barry S, Carroll CL, et al.Risk Factors for Delayed Enteral Nutrition in Critically Ill Children.Pediatr Crit Care Med,2015,16(8):e283-289
[62]Lambe C, Hubert P, Jouvet P, et al.A nutritional support team in the pediatric intensive care unit:changes and factors impeding appropriate nutrition.Clin Nutr,2007,26(3):355-363[63]方伯梁,钱素云,贾鑫磊,等.儿科重症监护病房内脓毒症患儿肠内营养中断现状.中国儿科杂志,2016,54(9):665-668
[64]Zappitelli M, Goldstein SL, Symons JM, et al.Protein and calorie prescription for children and young adults receiving continuous renal replacement therapy:a report from the Prospective Pediatric Continuous Renal Replacement Therapy Registry Group.Crit Care Med,2008,36(12):3239-3245
[65]Kyle UG, Akcan-Arikan A, Orellana RA, et al.Nutrition support among critically ill children with AKI.Clin J Am Soc Nephrol,2013,8(4):568-574
[66]López-Herce J, Santiago MJ, Sánchez C, et al.Risk factors for gastrointestinal complications in critically ill children with transpyloric enteral nutrition.Eur J Clin Nutr,2008,62(3):395-400
[67]López-Herce J, Sánchez C, Carrillo A, et al.Transpyloric enteral nutrition in the critically ill child with renal failure.Intensive Care Med,2006,32(10):1599-1605
[68]Briassoulis G, Filippou O, Kanariou M, et al.Comparative effects of early randomized immune or non-immune-enhancing enteral nutrition on cytokine production in children with septic shock.Intensive Care Med,2005,31(6):851-858
[69]Briassoulis G, Filippou O, Hatzi E, et al.Early enteral administration of immunonutrition in critically ill children:results of a blinded randomized controlled clinical trial.Nutrition,2005,21(7-8):799-807
[70]Jacobs BR, Nadkarni V, Goldstein B, et al.Nutritional immunomodulation in critically ill children with acute lung injury:feasibility and impact on circulating biomarkers.Pediatr Crit Care Med,2013,14(1):e45-56
[71]Briassoulis G, Filippou O, Kanariou M, et al.Temporal nutritional and inflammatory changes in children with severe head injury fed a regular or an immune-enhancing diet:A randomized, controlled trial.Pediatr Crit Care Med,2006,7(1):56-62
[72]Carcillo JA, Dean JM, Holubkov R, et al.The randomized comparative pediatric critical illness stress-induced immune suppression(CRISIS)prevention trial.Pediatr Crit Care Med,2012,13(2):165-173
[73]Al-Biltagi MA, Abo-Elezz AA, Abd-Elhafez MA,et al.Beneficial Effects of Omega-3 Supplement to the Enteral Feeding in Children With Mild to Moderate Sepsis.J Intensive Care Med,2017,32(3):212-217
[74]王跃生,张敬,李小芹,等.ω-3多不饱和脂肪酸早期肠内营养对儿童重症急性胰腺炎肠屏障功能影响的临床研究.中国小儿急救医学.2014,21(8):520-522
[75]胡亚美,江载芳.诸福棠实用儿科学.第8版.北京:人民卫生出版社,2015:2756
[76]Fivez T, Kerklaan D, Mesotten D, et al.Early versus Late Parenteral Nutrition in Critically Ill Children.N Engl J Med,2016,374(12):1111-1122
[77]Jordan I, Balaguer M, Esteban ME, et al.Glutamine effects on heat shock protein 70 and interleukines 6 and 10:Randomized trial of glutamine supplementation versus standard parenteral nutrition in critically ill children.Clin Nutr,2016,35(1):34-40
[78]胡亚美,江载芳.诸福棠实用儿科学.第8版.北京:人民卫生出版社,2015:2756
[79]Ramos-Silva V, Castello JS, da Motta LL, et al.Pulmonary lesions and total parenteral nutrition in children admitted to a pediatric intensive care unit.J Pediatr(Rio J),2005,81(2):155-161
[80]Kyle UG, Jaimon N, Coss-Bu JA.Nutrition support in critically ill children:underdelivery of energy and protein compared with current recommendations.J Acad Nutr Diet,2012,112(12):1987-1992
[81]de Oliveira Iglesias SB, Leite HP, Santana e Meneses JF,et al.Enteral nutrition in critically ill children:are prescription and delivery according to their energy requirements?Nutr Clin Pract,2007,22(2):233-239
[82]Wakeham M, Christensen M, Manzi J, et al.Registered dietitians making a difference:early medical record documentation of estimated energy requirement in critically ill children is associated with higher daily energy intake and with use of the enteral route.J Acad Nutr Diet,2013,113(10):1311-1316
[83]Kyle UG, Lucas LA, Mackey G, et al.Implementation of Nutrition Support Guidelines May Affect Energy and Protein Intake in the Pediatric Intensive Care Unit.J Acad Nutr Diet,2016,116(5):844-851
[84]Geukers VG, Neef MD, Dijsselhof ME, et al.Effect of a nursedriven feeding algorithm and the institution of a nutritional support team on energy and macronutrient intake in critically ill children.e-SPEN Journal, 2012(7):e35-e40
[85]Martinez EE, Bechard LJ, Mehta NM.Nutrition algorithms and bedside nutrient delivery practices in pediatric intensive care units:an international multicenter cohort study.Nutr Clin Pract,2014,29(3):360-367
[86]Meyer R, Harrison S, Sargent S, et al.The impact of enteral feeding protocols on nutritional support in critically ill children.J Hum Nutr Diet,2009,22(5):428-436
[87]Hamilton S, McAleer DM, Ariagno K, et al.A stepwise enteral nutrition algorithm for critically ill children helps achieve nutrient delivery goals.Pediatr Crit Care Med,2014,15(7):583-589
[88]Petrillo-Albarano T, Pettignano R, Asfaw M, et al.Use of a feeding protocol to improve nutritional support through early,aggressive, enteral nutrition in the pediatric intensive care unit.Pediatr Crit Care Med,2006,7(4):340-344
[89]Balshem H1, Helfand M, Schünemann HJ,et al.GRADE guidelines:3.Rating the quality of evidence.J Clin Epidemiol,2011,64(4):401-406
[90]Guyatt G, Oxman AD, Akl EA,et al.GRADE guidelines:1.Introduction-GRADE evidence profiles and summary of findings tables.J Clin Epidemiol,2011,64(4):383-394
[91]Wells, GA, Shea BJ, O'Connel D,et al.The Newcastle-Ottawa scale(NOS)for assessing the quailty of nonrandomised studies in meta-analyses.[2018-02-15] www.ohri.ca/programs/clinical_epidemiology/oxford.asp
[92]Rostom A,Dube C,Cranney A,et al.Celiac Disease.Rockville(MD):Agency for Healthcare Research and Quality(US);2004 Sep.(Evidence Reports/Technology Assessments, No.104.)AppendixD.Quality Assessment Forms.[2018-02-15]https://www.ncbi.nlm.nih.gov/books/NBK35156/
[93]Schunemann HJ, Oxman AD, Vist GE, et al.Chapter 12:Interpreting results and drawing conclusions.In:Green S,HigginsJPT, editors.Handbook for systematic reviews of interventions version 5.1.0.The Cochrane Collaboration, 2011.[2018-02-15] http://handbook.cochrane.org/
[94]Whiting PF, Rutjes AW, Westwood ME, et al.QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies.Ann Intern Med,2011,155(8):529-536
[95]Moga C,Guo B,Schopflocher D,et al.Development of a Quality Appraisal Tool for Case Series Studies Using a Modified Delphi Technique.Edmonton AB:Institute of Health Economics,2012
