凡纳滨对虾网格重链蛋白与WSSV结构蛋白在体外的相互作用*
2018-03-29王中一刘庆慧
王中一 刘庆慧① 黄 倢
(1. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 农业部海水养殖病害防治重点实验室青岛市海水养殖流行病学与生物安保重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2. 水产科学国家级实验教学示范中心 上海海洋大学水产与生命学院 上海 201306)
白斑综合征病毒(WSSV)是水产养殖业中主要的病原之一,不仅侵染各种野生及养殖对虾,而且侵染其他水生甲壳类如蟹类、螯虾和龙虾等。该病一旦流行,对虾在3–7 d内的死亡率可达100%,不仅给对虾养殖造成严重的损失,也给海洋生态平衡带来一定的威胁(马晓燕等, 2012)。由于WSSV基因的复杂性,针对WSSV的致病机理及WSSV侵染宿主细胞的途径尚未得到深入阐释。
网格重链蛋白(Clathrin Heavy Chain, CHC)是网格蛋白的主要成分之一,是进化上保守的大分子蛋白,迄今只在真核生物中发现,包括近端区、连接区、脚踝区、膝弯曲区、腿远端区、腿近端区和铰链区。网格重链蛋白N端有一个衔接蛋白结合结构域(TD),通过结合衔接蛋白连接要运输的物质(Teret al, 1998;Pearseet al, 2000; Zhu, 2015)。网格蛋白具有介导膜蛋白、生长因子、受体、病原体、突触等物质进行内吞的作用(Vonet al, 2011)。Royle等(2005)研究表明,在有丝分裂过程中,网格蛋白可与纺锤体结合,提高纺锤体的稳定性,促进染色体的联会。另外,网格蛋白可与微管或者微管相关蛋白直接结合来稳定着丝粒。这些研究表明,网格蛋白参与多种细胞生物学过程,对细胞生长发育、分化和环境响应具有重要的生物学功能(Royleet al, 2012)。然而,网格蛋白介导的内吞途径是 G蛋白偶联受体介导的最主要的经典内吞途径,同时也是病毒侵染细胞的主要途径之一(Liet al, 2016)。Posiri等(2015)研究表明,在敲除斑节对虾(Penaeus monodon)的网格重链蛋白基因后,延迟了感染黄头病毒(Yellow Head Virus, YHV)的斑节对虾的死亡。黄家骏等(2015)也证明,WSSV是通过网格蛋白介导的内吞途径进入造血组织细胞的。王修芳(2016)首次克隆凡纳滨对虾(Litopenaeus vannamei)网格重链蛋白基因,全长5052 bp,编码1684个氨基酸,含有 clathtin propel repeat、clathrin heavy-chain linker、clathrin-H-link、clathrin heavy chain repeat homology四个结构域,并利用RNA干扰技术可抑制CHC基因的表达,感染WSSV凡纳滨对虾的死亡率明显降低。
本研究针对凡纳滨对虾网格重链蛋白的 2个功能基因,进行重组表达并获得纯化重组蛋白,利用Far-Western技术筛选出能与这 2个功能蛋白相互作用的WSSV蛋白,为探讨网格蛋白介导WSSV的侵染提供理论依据,同时也为更加深入全面探索WSSV感染机制和防治措施奠定基础。
1 材料与方法
1.1 实验材料
WSSV结构蛋白 VP26、VP28N和 VP37,表达载体pBAD/gⅢA和凡纳滨对虾网格重链蛋白重组质粒由本实验室保存;E.coliTop10感受态细胞购自TIANGEN公司;Taq酶及DNA标准(DNA Marker DL 2000)购自TaKaRa公司;T4 DNA Ligase、限制性内切酶NcoⅠ、XbaⅠ及蛋白Marker购自Thermo公司;地高辛(DIG)购自Roche公司;氨苄青霉素(Amp+)、L-阿拉伯糖(L-Arab)、质粒小提试剂盒购自 Solarbio公司;胶回收试剂盒购自ZYMO公司。
1.2 实验方法
1.2.1 凡纳滨对虾功能基因LvCHC1和LvCHC2的克隆 根据LvCHC的2个功能结构域clathtin propel repeat(600~1350 bp、200~450 aa)和 clathrin heavy chain repeat homology(1650~2340 bp、550~780 aa),分别命名为LvCHC1和LvCHC2(图1),设计2对引物(CIH1s、CIH1a; CIH2s、CIH2a) (表1)。将 LvCHC重组载体保种液取出,在LB(Amp+, 100 μg/ml)固体培养基中划线,37℃倒置过夜培养。PCR扩增LvCHC1基因和LvCHC2基因,扩增程序:25 μl体系,94℃,预变性 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,扩增35个循环;72℃延伸7 min。扩增产物经1%的琼脂糖凝胶电泳后,分别胶回收,胶回收的方法按照ZYMO公司胶回收试剂盒进行,并用NanoDrop 2000c检测目的基因LvCHC1和LvCHC2的浓度。
1.2.2 表达载体的构建 将pBAD/gⅢA质粒和胶回收的2个片段LvCHC1、LvCHC2分别进行NcoⅠ、XbaⅠ双酶切。酶切效果用1%琼脂糖凝胶电泳观察,将电泳条带切胶回收,并测定核酸浓度。用T4 DNA ligase将目的片段与 pBAD/gⅢA载体连接;取连接产物5 µl加入到50 µl TOP 10感受态细胞中,冰浴30 min;42℃热激60 s,将重组质粒转化入感受态细胞中;加入890 µl LB液体培养基,37℃振荡培养1 h,使质粒恢复抗性;取 100 µl恢复抗性的菌液涂布在LB固体培养基(Amp+, 100 µg/ml)中,37℃倒置培养14 h。挑取单菌落加入LB液体培养基900 µl中(Amp+,100 µg/ml),培养5 h后,以菌液为模板,用pBAD/gⅢA载体通用引物进行菌落 PCR鉴定,将电泳结果正确的阳性菌液测序。
1.2.3 LvCHC1蛋白和 LvCHC2蛋白的表达 将测序正确的菌液分别按照 1%的比例加入新鲜的 LB液体培养基中(Amp+, 100 µg/ml),过夜培养。然后按照1%的比例将菌液分别加入LB液体培养基(Amp+,100 µg/ml)中扩大培养,培养5 h后,加入L-阿拉伯糖(终浓度为 0.2 g/L)诱导蛋白表达,对照组不加 L-阿拉伯糖,4 h后,菌液以10000 r/min离心5 min,用 PBS缓冲液重悬沉淀,超声破碎仪超声破碎,将诱导和未诱导菌液分别取适量的上清液和沉淀于 EP管中,沉淀用PBS缓冲液重悬,SDS-PAGE检测分析。

图1 凡纳滨对虾网格重链蛋白氨基酸序列(摘自王修芳, 2016)Fig.1 Amino acid sequence of LvCHC (By Wang, 2016)
1.2.4 钴离子柱亲和层析纯化蛋白 破碎液经10000 r/min离心30 min,弃上清液,沉淀用A液(含6 mol/L盐酸胍)溶解后,于 4℃条件下,10000 r/min离心10 min,收集上清液并分别经0.8 μm和0.45 μm滤膜过滤。将树脂装入层析柱中,先用 PBS平衡洗柱,用A液将紫外吸收峰洗至0,加入蛋白上清液,混匀后冰浴2 h,再用A液将峰值洗脱至0,然后用150 mmol/L咪唑洗脱,收集重组蛋白,在尿素梯度复性液中复性透析,之后用超滤管进行浓缩,用SDS-PAGE检验蛋白纯化效果。

表1 引物序列Tab.1 Sequence of primers
1.2.5 DIG标记LvCHC1蛋白和LvCHC2蛋白
用枪头取少量DIG粉末溶于DMSO中,分别加入纯化的 LvCHC1蛋白和 LvCHC2蛋白,旋转混合仪中混匀2 h,4℃ PBS溶液中过夜透析,去除过量的DIG。
1.2.6 Far-Western检测与 LvCHC1蛋白和 LvCHC2蛋白相互作用的WSSV蛋白 将表达纯化的WSSV重组蛋白VP26、VP28N、VP37进行15% SDS-PAGE后,转印至PVDF膜上,4℃在5% BSA中封闭过夜,PBS-T清洗后分别加入DIG标记的LvCHC1蛋白和LvCHC2蛋白,室温避光孵育2 h,PBS-T清洗3遍后加入Anti-DIG-AP (1∶3000),室温避光孵育2 h,PBS-T清洗3遍后用BCIP/NBT显色液避光显色。将显色结果扫描分析。
2 结果
2.1 LvCHC1基因与LvCHC2基因的克隆
利用设计的 ClH1s、ClH1a和 ClH2s、ClH2a两对特异性引物分别扩增LvCHC1基因和LvCHC2基因,电泳结果见图2。前面条带出现在750 bp左右,与LvCHC1基因750 bp基本相符。后面条带出现在500 bp和750 bp之间,与LvCHC2基因590 bp基本相符。
2.2 pBAD/gⅢA-LvCHC1和 pBAD/gⅢA-LvCHC2重组质粒的鉴定

图2 LvCHC1和LvCHC2基因的克隆Fig.2 Cloning of LvCHC1 and LvCHC2
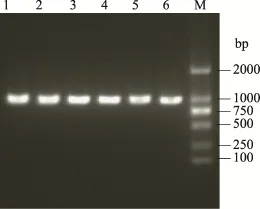
图3 重组质粒菌液PCRFig.3 PCR identification of the recombinant vector
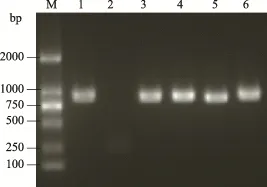
图4 重组载体菌液PCRFig.4 PCR identification of the recombinant vector
用T4 DNA Ligase将双酶切后的片段与具有相同粘性末端的pBAD/gⅢA表达载体连接,将构建好的表达载体转化到Top 10大肠杆菌感受态细胞中,经Amp+抗性筛选后,挑取单克隆,37℃培养 5 h后,进行菌液PCR鉴定,PCR产物电泳结果见图3和图4,条带大小在1000 bp左右,初步断定为阳性克隆。取阳性克隆菌液测序,经过DNAMAN软件分析,证明重组表达载体序列完全正确,无移码错配。
2.3 LvCHC1蛋白和LvCHC2蛋白的检测
将重组表达载体正确的菌液进行扩大培养,经L-阿拉伯糖诱导后,将诱导和未诱导的上清液和沉淀分别进行蛋白质凝胶电泳(图5和图6)。分析图5发现,诱导上清液和未诱导的上清液蛋白条带一致,没有诱导条带;而诱导沉淀在25~35 kDa之间比未诱导的沉淀多1条蛋白带(图中红色箭头所指),其条带大小与LvCHC1理论蛋白分子质量26.19 kDa相符,说明该条带有可能是LvCHC1蛋白。分析图6发现,诱导上清液和未诱导的上清液蛋白一致,没有出现诱导条带;而诱导沉淀在25 kDa左右比未诱导的明显多1条蛋白带(图中红色箭头所指),其条带大小与LvCHC2理论蛋白分子质量17.49 kDa相符,说明该条带有可能是LvCHC2蛋白。将符合目的蛋白的条带进行蛋白质谱分析,经验证发现,LvCHC1蛋白和LvCHC2蛋白表达正确(表2和表3)。2个功能蛋白都出现在诱导的沉淀中,说明2个蛋白为包涵体。

图5 LvCHC1蛋白的表达Fig.5 The expression of LvCHC1 protein
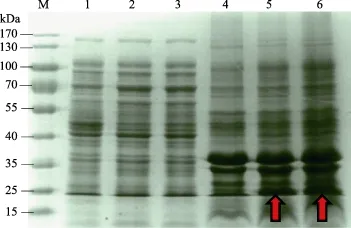
图6 LvCHC2蛋白的表达Fig.6 The expression of LvCHC2 protein
2.4 纯化蛋白检测
表达载体pBAD/gⅢA上带有6×His标签,可利用Co2+亲和层析法对其进行纯化,洗脱液经尿素梯度复性后得到正确折叠的蛋白,然后进行 SDS-PAGE检测分析,结果显示,经纯化的蛋白纯度较高,可用于进一步实验(图7)。
表2 LvCHC1质谱分析结果Tab.2 MS analysis of LvCHC1 protein
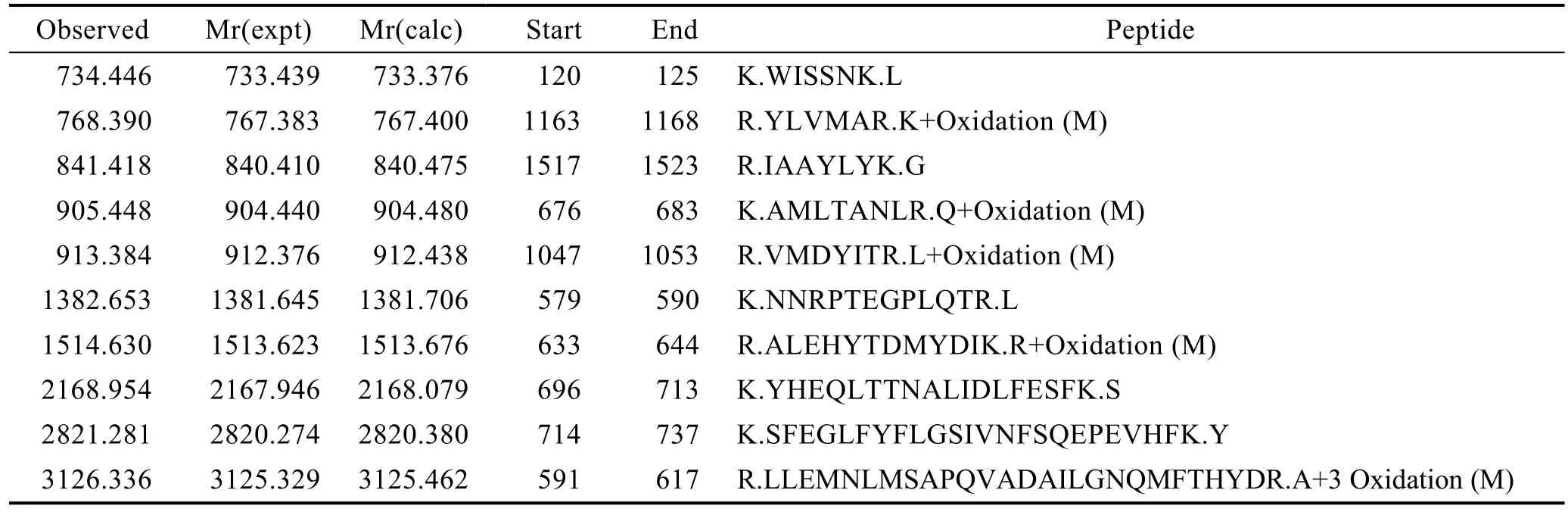
表3 LvCHC2质谱分析结果Tab.3 MS analysis of LvCHC2 protein

图7 SDS-PAGE分析纯化的LvCHC1蛋白和LvCHC2蛋白Fig.7 SDS-PAGE analysis of purified protein LvCHC1 and LvCHC2
2.5 Far-Western分析
将 VP26、VP28N、VP37和蛋白 Marker对称点样,转印于PVDF膜上,与DIG标记的LvCHC1蛋白和LvCHC2蛋白作用,图8显示,LvCHC1蛋白与VP37和VP26有结合活性,但与VP26相比,VP37处的条带结合较弱。图9显示,LvCHC2蛋白与VP37和VP26都有结合活性,但与VP26相比,VP37处的条带也较微弱。
3 讨论
网格蛋白是由三个网格重链蛋白和三个网格轻链蛋白构成的,每一个网格重链蛋白结合一个轻链蛋白为基本单位组装成三脚蛋白复合体。本研究根据凡纳滨对虾网格重链蛋白基因,分别设计2对特异性的引物,并克隆它的2个功能基因LvCHC1和LvCHC2,经过NcoⅠ、XbaⅠ双酶切后连接到pBAD/gⅢA载体并转入到 TOP10感受态细胞中,选择阳性克隆的菌落通过原核表达获得 2个功能蛋白即 LvCHC1和LvCHC2,2个蛋白分别经过钴离子柱纯化得到纯化的目的蛋白,之后应用 Far-Western研究它们分别与WSSV病毒结构蛋白VP26、VP28N和VP37的相互作用。
蛋白检测表明 LvCHC1蛋白和 LvCHC2蛋白均出现在诱导的沉淀中,属于包涵体蛋白。Far-Western结果表明,LvCHC1蛋白和 LvCHC2蛋白与 VP28N都没有相互结合的能力,但都能与VP26和VP37相互作用,而且2个蛋白与VP26的结合力强于与VP37的结合能力。VP26是WSSV中含量较高的被膜蛋白(Tsaiet al, 2006),可以与囊膜蛋白VP28、核衣壳蛋白VP51结合,起到连接作用(Changet al, 2008; Wanet al, 2008),重组表达的 VP26与中国明对虾(Fenneropenaeus chinensis)和螯虾血细胞都具有结合作用,经质谱分析,与VP26有结合作用的是β-肌动蛋白(Liuet al, 2011; Xieet al, 2005),而 β-肌动蛋白在细胞内物质和器官运输过程中起重要作用,并被报道参与到一些病毒的入侵、细胞内转运和释放等过程中,推测其主要在病毒粒子的组装中发挥作用,以及病毒进胞后促进其沿着微丝进行迁移(Gouinet al,2005)。而VP37是WSSV病毒的一个重要囊膜蛋白,它含有一个RGD位点,推测其在WSSV感染机制中发挥重要作用,研究表明,VP37与虾血细胞和鳃细胞膜蛋白结合的蛋白为ATP合酶β亚基,推测其可能为VP37在宿主细胞的受体蛋白(Huanget al, 2002;Lianget al, 2005)。根据实验结果可初步推断WSSV在入侵凡纳滨对虾的细胞时,VP26和 VP37通过与网格重链蛋白作用,介导 WSSV进入宿主细胞内,从而加快了WSSV病毒在宿主体内的传播。
虽然本研究得出网格重链蛋白能与 WSSV病毒的VP26和VP37相互作用,但关于网格重链蛋白是如何调控 WSSV入侵凡纳滨对虾等分子机制还没有阐明,仍需要进一步的研究。

图8 Far-Western-blot分析LvCHC1与VP26, VP28N及VP37的相互作用Fig.8 Far-Western-blot analysis of LvCHC1 interaction with VP26, VP28N and VP37
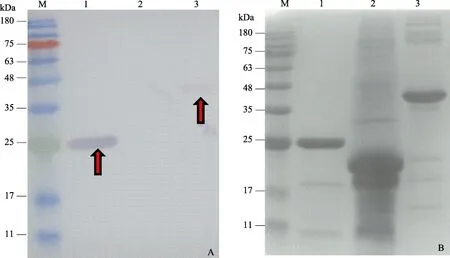
图9 Far-Western-blot分析LvCHC2与VP26,VP28N及VP37相互作用Fig.9 Far-Western-blot detection of LvCHC2 interaction with VP26, VP28N and VP37
Chang YS, Liu WJ, Chou TL,et al. Characterization of white spot syndrome virus envelope protein VP51A and its interaction with protein VP26. Journal of Virology, 2008,82(24): 12555–12564
Gouin E, Welch MD, Cossart P. Actin-based motility of intracellular athogens. Current Opinion in Microbiology, 2005,8(1): 35–45
Huang C, Zhang X, Lin Q,et al. Characterization of a novel envelope protein (VP281) of shrimp white spot syndrome virus by mass spectrometry. Journal of General Virology,2002, 83(10): 2385–2392
Huang JJ, Li F, Yang F. Cloning of clathrin light chain of crayfish,Cheraxquadricarinatus, and immunological specificity of antibodies. Journal of Applied Oceanography,2015, 35(2): 205–210 [黄家骏, 李钫, 杨丰. 红螯螯虾网格蛋白轻链的克隆及制备抗体的检测. 应用海洋学学报,2015, 35(2): 205–210]
Li S, Bai B, Chen J. Regulatory mechanisms of G protein coupled receptor about desensitization, and resensitization. Journal of Jining Medical College, 2016, 39(2): 123–127 [李胜, 白波, 陈京. G蛋白偶联受体脱敏內吞和复敏调控机制进展.济宁医学院学报, 2016, 39(2): 123–127]
Liang Y, Huang J, Song XL,et al. Four viral proteins of white spot syndrome virus (WSSV) that attach to shrimp cell membranes. Diseases of Aquatic Organisms, 2005, 66(1):81–85
Liu B, Tang X, Zhan W. Interaction between white spot syndrome virus VP26 and hemocyte membrane of shrimp,Fenneropenaeus chinensis.Aquaculture, 2011, 314(1–4):13–17
Ma XY, Li P, Yan J,et al. The summary of WSSV. Journal of Nanjing Normal University (Natural Science), 2012(4):90–100 [马晓燕, 李鹏, 严洁, 等. 对虾白斑综合症病毒的概述. 南京师范大学报(自然科学版), 2012(4): 90–100]
Pearse BM, Smith CJ, Owen DJ. Clathrin coat construction in endocytosis. Current Opinion in Structural Biology, 2000,10(2): 220–228
Posiri P, Kondo H, Hirono I,et al. Successful yellow head virus infection ofPenaeus monodonrequires clathrin heavy chain.Aquaculture, 2015, 435: 480–487
Royle SJ, Bright NA, Lagnado L. Clathrin is required for the function of the mitotic spindle. Nature, 2005, 434(7037):1152–1157
Royle SJ. The role of clathrin in mitotic spindle organization.Journal of Cell Science, 2012, 125(1): 19–28
Ter EH, Musacchio A, Harrison SC,et al. Atomic structure of clathrin: A beta propeller terminal domain joins an alpha zigzag linker. Cell, 1998, 95(4): 563–573
Tsai JM, Wang HC, Leu JH,et al. Identification of the nucleocapsid, tegument, and envelope proteins of the shrimp white spot syndrome virus virion. Journal of Virology, 2006,80(6): 3021–3029
Von KL, Stahlschmidt W, Bulut H,et al. Role of the clathrin terminal domain in regulating coated pit dynamics revealed by small molecule inhibition. Cell, 2011, 146(3): 471–484
Wan Q, Xu L, Yang F. VP26 of white spot syndrome virus functions as a linker protein between the envelope and nucleocapsid of virions by binding with VP51. Journal of Virology, 2008, 82(24): 598–601
Wang XF. Cloning and expression of prawn coat-ε, clathrin coat AP17 and clathrin heavy chain and its role in WSSV infection. Master′s Thesis of Dalian Ocean University, 2016[王修芳. 对虾Coat-ε、CCAP17和CHC的克隆、表达及其在 WSSV感染中的作用. 大连海洋大学硕士研究生学位论文, 2016]
Xie X, Yang F. Interaction of white spot syndrome virus VP26 protein with actin. Virology, 2005, 336(1): 93–99
Zhu MS. Molecular mechanisms of CHC2 in symbiotic signaling pathway inLotus japonicas. Master′s Thesis of Huazhong Agricultural University, 2015 [祝茂生. 网格重链蛋白CHC2在百脉根结瘤信号途径中功能及作用机制的研究]华中农业大学硕士研究生论文, 2015]
