短期温度胁迫对驼背鲈(♀)×鞍带石斑鱼(♂)杂交子代幼鱼抗氧化及消化酶活性的影响*
2018-03-29李炎璐陈建国李文升马文辉
刘 玲 陈 超 ① 李炎璐 刘 莉 陈建国 李文升 马文辉
(1. 上海海洋大学水产与生命学院 上海 201306;2. 农业部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所 青岛市海水鱼类种子工程与生物技术重点实验室 青岛 266071;3. 莱州明波水产有限公司 莱州 261418)
鼠龙斑是驼背鲈(Cromileptes altivelis Valenciennes♀)与鞍带石斑鱼(Epinephelus lanceolatus♂)的杂交品种。驼背鲈又称老鼠斑,分布于印太海域印度尼西亚至东澳大利亚海域,幼年时色彩靓丽,可作为观赏鱼,成年后味道鲜美,为高级食用鱼(区又君等, 1999)。鞍带石斑鱼(E. lanceolatus),俗名龙趸、龙胆石斑,是石斑鱼类中体型最大者,故也被称为“斑王”,是一种重要的经济鱼类,具有较高的食用和营养价值。鼠龙斑作为一种人工杂交的石斑鱼,与野生石斑鱼相比,具有生长快、味道鲜美、抗病性强等特点,亦可作为观赏鱼类。作为一种杂交新品种,对环境变化的适应能力及相关生理参数等都有待研究。
温度(Stéphanet al, 1995; Filhoet al, 2005)、盐度(Rocheet al, 1996)、溶氧(Pariharet al, 1995)、pH 等重要的环境因子发生变化时,会直接影响鱼体内活性氧含量及抗氧化酶的活性,使机体的自由基代谢发生紊乱,继而使鱼体产生应激反应以响应环境的改变。若机体无法适应则会长期处于应激状态,造成机体抗氧化性和免疫防御能力受损,影响鱼体代谢、生长(Martínez-Alvarezet al, 2005)。在养殖过程中,温度作为最重要环境因子之一,与鱼体的抗氧化能力以及代谢功能有密切联系(Filhoet al, 2005)。温度作为影响鱼类抗氧化酶活性的环境因素之一,主要对鱼类代谢反应速率起控制作用(柳学周等, 2004)。温度的升高会导致机体耗氧量的增加,促进氧自由基的产生,进而促进抗氧化酶活性的升高(Martínez-Álvarezet al, 2004)。鱼体在正常的新陈代谢下,体内自由基通常处于动态平衡,当受到环境胁迫后,自由基就会大量生成,过量的自由基会对机体产生一定的损伤(孙鹏等, 2014)。当鱼体长期处于适温边界则会造成胁迫,降低机体的代谢水平,这种温度胁迫与代谢水平之间具有显著的相关性(Handelandet al, 2008; Joblinget al, 1983)。鱼类在受到环境胁迫后,机体抗氧化酶会被激活应对环境变化,当机体适应环境后,抗氧化酶水平会恢复,如果胁迫超出机体适应能力,抗氧化酶水平将不可恢复。因此,在一定程度上,抗氧化酶活性恢复至正常水平的时间反映了机体对环境的适应能力(胡静等, 2015)。
鱼类抗氧化防御体系中的抗氧化酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)等,这些酶和其他的非酶类抗氧化物质共同构成了机体内的抗氧化防御体系,共同保护机体免受氧化伤害,并与体内产生的活性氧物质之间达到平衡状态(亢玉静等, 2013)。SOD是生物体内重要的抗氧化酶,广泛分布于各种生物体内,是生物体内清除自由基的首要物质,把有害的超氧自由基转化为过氧化氢,然后 CAT又立即促使过氧化氢分解为分子氧和水,使细胞免于遭受 H2O2的毒害,从而达到保护机体作用(张克烽等, 2007)。因此,SOD和CAT相互配合组成了一个防氧化链条,是存在于生物体内的非常重要的抗氧化防御性功能酶(乔秋实等, 2011)。MDA是膜脂过氧化重要的产物之一,它的产生还能加剧膜的损伤(王伟等, 2012),MDA产生数量的多少能够代表膜脂过氧化的程度,也可间接反映组织细胞受自由基攻击的严重程度。因此,MDA含量常被用来衡量水生动物机体的抗氧化能力(Viña, 2002; 刘小兵等,2008)。本文研究了急性温度胁迫与渐变升温胁迫下,鼠龙斑肝及血清中抗氧化和消化生理指标的变化,为探讨不同程度的温度变化胁迫对鼠龙斑抗氧化及消化生理的影响,从而深入了解鼠龙斑对环境改变的响应,对人工养殖驯化和生产具有重要意义。
1 材料与方法
1.1 材料
实验用鱼鼠龙斑幼鱼于2016年7月由莱州市明波水产有限公司提供,共 400尾,平均体重为(20.30±0.38) g,平均体长为(10.35±0.43) cm,实验前于水温为(26.0±0.5)℃(自然海水的温度)的水池中暂养3 d,每天分别于08:00和16:00投喂饲料(日本林兼株式会社生产的“鱼宝”牌饲料),按体重的1%~2%进行投喂,采用微流水饲养,每天清污换水1次。
1.2 养殖条件
实验水温通过冷热海水(经过电厂升温的自然海水35℃和海边井水21℃)勾兑,微流水状态保持水温,pH 为 7.5~8.0,盐度为 25~30,溶氧>5 mg/L (24 h不间断充氧)。实验在直径为60 cm、容积为120 L的圆形水槽中进行。
1.3 实验设计
实验为5个温度突变组:21℃、24℃、28℃、32℃、35℃和1个温度渐变组。每个温度组设3个平行,每个平行20尾鱼。温度突变组:将暂养3 d后的鼠龙斑直接放入已经调好温度的水槽中进行实验;温度渐变组:从26℃开始升温,每天升温1℃,连续升温7 d,达到33℃。实验开始后每天投喂2次,每次投喂时记录每组投喂量(以不再抢食、水面飘浮着多余的饲料为饱食状态,停止投喂,投喂前后对装饲料的容器进行称量,其减少量为投喂量),喂食30 min后,将残余饵料吸出、晒干(室外晾晒10~12 h)后称重,计算摄食量。每天清污换水1次,换水量为50%。参数计算公式:
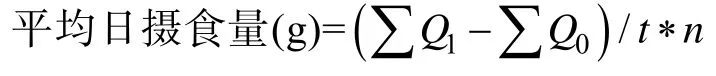
式中,Q1为饲料日平均投喂量,Q0为饲料日平均残留量,t为实验天数(d),n为鱼个体数。
1.4 取样
在实验的第0、3、7天分别对每组进行取样,每个平行取3尾鱼,利用丁香酚(200 mg/L)进行麻醉,用2 ml的一次性注射器进行尾静脉抽血,抽血前注射器先抽取少量的抗凝剂,将抽出血样于3000 r/min离心10 min,取上清液移于EP管中,投入液氮罐中保存待测。取血后迅速将鱼置于冰盘上解剖,取其肝脏、胃和肠,液氮中保存待测。
1.5 样品处理及指标检测
将血清和样品置于–20℃、4℃逐渐解冻,解冻后的组织与生理盐水按重量(g)∶体积(ml)=1∶9的比例制备组织匀浆液,在冰水浴条件下,利用组织匀浆机,制备成10%的组织匀浆,4000 r/min离心10 min,取上清液,再用生理盐水稀释成适宜浓度,4℃保存,待测。
采用南京建成生物工程研究所的试剂盒测定血清与肝脏中的SOD活力、CAT活力、MDA含量;胃中的胃蛋白酶活性,肠道中的淀粉酶、脂肪酶活性,测定步骤按试剂盒说明书进行。
1.6 数据处理
采用SPSS 22.0软件进行数据处理和分析,采用ANOVA 对实验结果进行方差分析,采用 Duncan´s法进行多重比较。实验数据用平均值±标准差(Mean±SD)表示,P<0.05为差异显著。
2 结果
2.1 温度突变与温度渐变对鼠龙斑摄食的影响
各温度组鼠龙斑幼鱼7 d内每天的摄食量变化情况见图1,21℃温度突变组的摄食量最低,与其他组差异显著(P<0.05),平均日摄食量在 0.4 g/(尾·d)左右,起伏较小。24℃、28℃和 32℃温度突变组的平均日摄食量随着实验天数的增加呈现规律上升趋势,且随着温度的升高,平均日摄食量也呈升高的趋势,这3组的变化趋势与温度渐变组的变化趋势也相似,而温度渐变组的平均日摄食量最高。35℃温度突变组的平均日摄食量在实验开始的前2 d变化不大,但远远高于其他温度组的摄食量(P<0.05),实验期间摄食量无规律。第8天,将所有温度组冷热水关闭,统一换成自然海水,温度范围为(26.0±0.5)℃,再暂养3 d,观察其摄食量的变化,除 28℃和 32℃温度突变组外,其他各温度组的摄食量均出现显著下降趋势,28℃温度突变组在下降以后第3天的摄食量略有回升,趋于平稳,32℃突变温度组在恢复自然海水温度的前 2 d摄食量平稳上升,在第3天时显著下降。
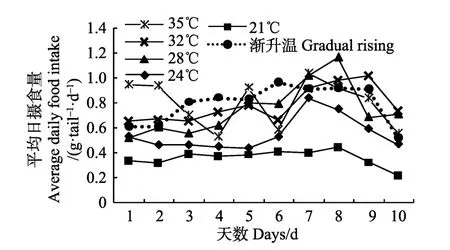
图1 温度突变与温度渐变对鼠龙斑幼鱼的平均日摄食量的影响Fig.1 Effects of temperature acute change and gradual rising on the average daily food intake of juvenile Mussaurus spot
2.2 温度对鼠龙斑血清和肝脏中抗氧化指标的影响
2.2.1 超氧化物歧化酶 21℃温度突变组血清中的SOD在3 d和7 d相对稳定,相比实验开始前显著增加(P<0.05),而肝脏中变化不明显(P>0.05),24℃和28℃血清中SOD在第3天变化不明显,在第7天时显著升高且显著高于21℃温度组(P<0.05),而肝脏中第3天升高后在第7天有所下降,32℃和35℃血清中SOD在第3天明显升高,第7天略高于第3天,肝脏中的SOD在第3天比0 d显著下降,在第7天有所上升但仍然低于0 d。温度渐变组血清中的SOD先上升后又恢复到原始值,肝脏中在第3天无显著变化,在第7天显著上升(P<0.05) (图2)。
2.2.2 过氧化氢酶 温度突变组血清中的 CAT总体呈现逐渐上升趋势,除 28℃上升趋势较小,其他各温度突变组均在第3天和第7天时比0 d显著升高(P<0.05),35℃血清中CAT上升最高,第3天显著升高达到143.82 U/ml,第7天持续升高到172.64 U/ml,显著高于其他各组(P<0.05);肝脏中24℃和28℃的趋势与血清中相似,呈现显著上升趋势(P<0.05),21℃在第3天显著升高,第7天又恢复到0 d水平,32℃和35℃肝脏中的CAT在第3天和第7天呈现显著下降的趋势(P<0.05)。温度渐变组随着温度的升高,血清中的CAT先在第3天显著升高后在第7天又显著下降,而肝脏在第3天和第7天均是显著下降(P<0.05) (图3)。
2.2.3 丙二醛 21℃和 24℃温度突变组血清中的MDA在第3天时都显著下降(P<0.05),28℃和35℃变化不明显,32℃呈显著上升在3 d时达到了64.19 nmol/ml,但在第7天时,21℃显著上升,24℃与第3天相比变化不明显,28℃、32℃和35℃均呈显著下降(P<0.05);而肝脏中的 MDA在 21℃、32℃和 35℃均呈现显著上升再下降的趋势,21℃在第3天上升显著,大于其他各组,达到3.74 nmol/mg prot,24℃第3、7天无显著差异,28℃的第3天与0 d差异不大,7 d时略下降。温度渐变组随着温度的升高,血清和肝脏中MDA变化趋势相似,均在逐渐下降,在第3天显著下降(P<0.05),在第7天略下降(图4)。
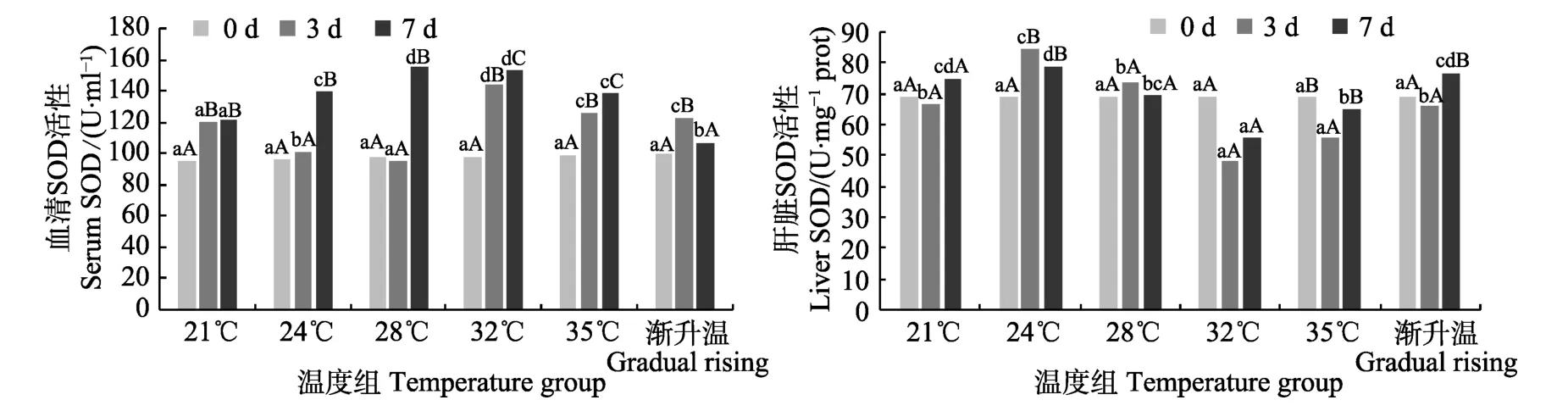
图2 温度突变与温度渐变对鼠龙斑幼鱼血清和肝脏中SOD活性的影响Fig.2 Effects of temperature acute change and gradual rising on SOD activity in serum and liver of juvenile Mussaurus spot
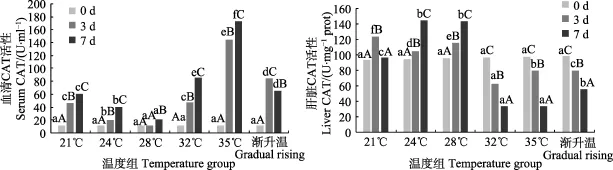
图3 温度突变与温度渐变对鼠龙斑幼鱼血清和肝脏中CAT活性的影响Fig.3 Effects of temperature acute change and gradual rising on CAT activity in serum and liver of juvenile Mussaurus spot
2.3 温度对鼠龙斑消化生理指标的影响
2.3.1 胃蛋白酶 21℃和 24℃温度突变组的胃蛋白酶变化趋势相似,第3天显著下降(P<0.05),第7天时有所升高,但比0 d时低,其他各温度突变组都逐渐上升,28℃第3天与0 d相比上升不显著(P>0.05),第7天与0 d相比显著上升(P<0.05),32℃和35℃第3、7天均显著上升且比其他各组都高,在第 7天分别达到了69.70和70.05 U/mg prot;温度渐变组,随着温度的升高,胃蛋白酶显著升高(P<0.05),在第3天,温度上升到31℃时,胃蛋白为47.13 U/mg prot,在第7天,温度上升到35℃时,达到88.33 U/mg prot(图5)。
2.3.2 脂肪酶 21℃、24℃和28℃温度突变组肠道中的脂肪酶变化不显著,21℃在第3、7天逐渐降低,24℃和 28℃第 0、3天差异不显著(P>0.05),而 7 d时 24℃略有降低,28℃有所升高,32℃和 35℃变化趋势相似,均是第3天显著上升(P<0.05),第7天显著下降(P<0.05),但35℃与32℃上升、下降变化趋势存在显著差异(P<0.05),35℃第3天高达159.61 U/g prot,与其他各温度突变组存在显著差异(P<0.05)。温度渐变组肠道脂肪酶,随着温度的上升,第3、7 d均显著上升(P<0.05),第3天为182.16 U/g prot,显著高于0 d (P<0.05),第7天为270.19 U/g prot,显著高于第 3 天(P<0.05) (图6)。
2.3.3 淀粉酶 肠道淀粉酶 21℃和 24℃温度突变组,第3天比0 d显著下降(P<0.05),第7天又显著上升(P<0.05),21℃第3、7天与0 d相比,下降幅度显著(P<0.05),24℃在7 d恢复到0 d水平,28℃和32℃总体变化起伏不大,35℃第 3、7天均显著下降(P<0.05)。温度渐变组随着温度上升第3、7天肠道淀粉酶显著上升(P<0.05) (图7)。
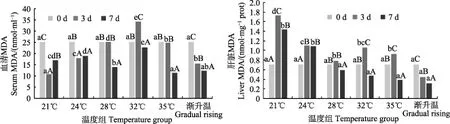
图4 温度突变与温度渐变对鼠龙斑幼鱼血清和肝脏中MDA的影响Fig.4 Effects of temperature acute change and gradual rising on MDA in serum and liver of juvenile Mussaurus spot

图5 温度突变与渐升温对鼠龙斑幼鱼胃蛋白酶活性的影响Fig.5 Effects of temperature acute change and gradual rising on pepsin of juvenile Mussaurus spot

图6 温度突变与渐升温对鼠龙斑幼鱼肠道脂肪酶活性的影响Fig.6 Effects of temperature acute change and gradual rising on intestinal lipase of juvenile Mussaurus spot

图7 温度突变与渐升温对鼠龙斑幼鱼肠道淀粉酶活性的影响Fig.7 Effects of temperature acute change and gradual rising on intestinal amylase of juvenile Mussaurus spot
3 讨论
3.1 温度突变与温度渐变对鼠龙斑摄食的影响
鱼类属于变温动物,终生生活在水体中,在适宜的温度范围内,鱼类可以正常生长和繁殖。相关研究表明,在适宜的温度范围内,随着温度的增加,鱼的生长速度加快,但超出适宜的温度范围,温度升高会有相反的影响(Jobling, 1993)。本研究中,鼠龙斑平均日摄食量随着突变温度的增加而逐渐增加,突变组35℃虽然平均摄食量比其他各组高,但随着胁迫时间延长,摄食量不稳定,结合消化酶变化,在高温下可能对机体消化作用有一定影响,32℃其摄食量与 35℃无较大差异。温度渐变组的摄食量随着温度的上升而逐渐升高,且平均摄食量比温度突变组均高(P<0.05),从实际生产养殖条件角度出发,32℃可作为鼠龙斑生产养殖的最适温度,且可通过渐变温度对鼠龙斑进行驯化达到最佳养殖温度。实验结束后,各温度组均出现了摄食量下降的趋势,这也说明温度波动较大的情况下,对鱼体影响较大。在养殖过程中,应及时关注温度变化,在温度变化较大的情况下,适当减少投喂量,避免浪费饲料。
3.2 温度突变与渐变温度对鼠龙斑抗氧化指标的影响
SOD是生物体内重要的抗氧化酶,广泛分布于各种生物体内,能消除生物体在新陈代谢过程中产生的有害物质,CAT在抗氧化机制中主要是将SOD与自由基反应生成的H2O2转化为水,因此,CAT的含量在一定程度受到SOD含量的影响。温度突变组:肝脏中的 SOD 在 21℃~28℃胁迫前后差异不显著,32℃与35℃出现先下降再回升的趋势,血清中 SOD随着胁迫时间的延长均呈显著上升趋势,说明水温变化导致机体中的自由基大量增加,机体启动肝抗氧化防御系统,生成大量 SOD,调节细胞膜通透性使肝脏中的SOD大量输送到血液中,导致血液中的SOD大量增加,随着时间延长,肝中SOD逐渐回升,21℃~32℃血清中SOD实验第7天均显著升高,且随着胁迫温度升高,SOD也逐渐升高,表明在适温范围内血清中抗氧化酶活力与水温呈正比,与李大鹏等(2008)研究结果相符。然而,在35℃时有所降低,说明 35℃已经超过适温范围。在21~28℃温度组,血清和肝脏中CAT变化趋势一致,均是逐渐增加,尤其第7天显著增加(P<0.05),说明随着胁迫时间延长,机体通过自身调节清除过量的自由基,而32℃与35℃血清与肝脏中 CAT的变化趋势完全相反,说明肝组织受到一定损伤,使细胞通透性下降,肝脏中 CAT含量下降而血清中显著升高,这与谢明媚等(2015)研究结果相似。温度渐变组:血清中的SOD和CAT均是先上升再下降,SOD在第7天时恢复至胁迫前,CAT在第7天显著高于胁迫前,肝脏中的SOD第3天与胁迫前无明显变化,在第7天时显著上升(P<0.05),而肝脏中CAT在第3、7天均显著下降,可能与肝脏中CAT大量转入血液中有关,随着温度逐渐增加,高温对机体有一定的损伤。
MDA是细胞膜脂过氧化作用的产物之一,主要在肝脏分解,所以肝脏中的脂质过氧化产物MDA含量会随着胁迫加强而升高(王奇等, 2010)。因此,通过MDA含量多少来间接判断机体受到自由基损伤的程度,一般结合SOD、CAT和MDA含量更能说明机体的抗氧化能力。温度突变组肝脏中MDA均是先增加再降低,这与潘桂平等(2016)对云纹石斑鱼低温胁迫研究中MDA变化趋势相似,说明机体在开始时产生应激反应,随着产生大量 SOD、CAT清除过量的自由基而逐渐降低,血清中MDA都是在第7天均有所降低,说明机体通过调节逐渐恢复,且恢复时间可能与应激反应时间有关,21℃、24℃肝脏与血清中MDA的变化趋势相反,肝脏中先显著上升再下降,在第7天时仍显著高于第0天(P<0.05),说明肝脏受到一定损伤,不能及时恢复,产生的大量SOD、CAT清除过量的自由基,自由基的急剧下降导致血清中的MDA在第3天显著下降,而在第7天时有所回升。温度渐变组肝脏和血清中的MDA均是逐渐下降,而血清中的 SOD、CAT均是大量增加,以此来抵抗产生的大量自由基,这与谢明媚等(2015)的研究结果相似,说明机体 SOD、CAT的抗氧化作用足以抵抗自由基的损害,使自由基处于较低状态,在第7天时可能机体肝脏受到一定损伤而不能及时恢复。本实验由于时间较短(7 d),只是探讨短期应激反应对机体的影响,若时间延长,可能会对鼠龙斑造成一定的伤害;温度渐变组中,鼠龙斑通过自身调节适应逐渐升温的状态,使机体达到新的动态平衡,应激反应与突变组相比较小,在生产过程中利于养殖驯化。
3.3 温度突变与温度渐变对鼠龙斑幼鱼消化生理指标的影响
胃蛋白酶与肠道中的脂肪酶在温度突变组21℃、24℃的变化趋势相似,呈先下降再回升的趋势,但第7天还未恢复到胁迫前状态,肠道脂肪酶有所下降,但变化都不显著(P>0.05),说明温度急性下降对鼠龙斑的消化酶活性有一定的抑制作用,这从平均日摄食量变化也能明显反映出来。28℃温度组的胃蛋白酶和脂肪酶第3天变化不明显,在第7天有所上升,淀粉酶在第 3天上升后保持平衡,说明 28℃温度组对鼠龙斑的影响较小。32℃、35℃胃蛋白酶呈逐渐上升趋势,且显著大于胁迫前的含量(P<0.05),脂肪酶先上升再下降,但胁迫前后差异显著(P<0.05),淀粉酶32℃上升趋势不显著,35℃呈下降趋势且与胁迫前存在显著差异(P<0.05),说明高温胁迫时鼠龙斑的消化酶活性增加,从而使摄食量也增加,这与施兆鸿等(2016)对银鲳(Pampus argenteus)的研究结果相似。温度渐变组的胃蛋白酶和脂肪酶都显著增加且脂肪酶的含量显著大于突变温度组,淀粉酶也呈上升趋势,只是变化幅度不显著(P>0.05),表明温度渐变能够使鼠龙斑的消化酶活性升高且保持较高的活跃状态,增加鱼体的摄食量。
通过对温度突变以及温度渐变胁迫下鼠龙斑的摄食情况、抗氧化指标以及消化生理指标等分析,温度渐变对鼠龙斑幼鱼摄食和抗氧化性具有促进作用,温度突变对鼠龙斑幼鱼抗氧化性影响明显,胁迫时间延长可能对鱼体肝脏抗氧化体系有损害作用。综上,鼠龙斑的适宜生长温度范围为24℃~32℃,在 21℃~35℃水温中均正常生长,但由于本次实验时间较短且受到实验条件的限制,导致无法测得鼠龙斑的存活温度范围,对其生理生化指标的变化规律研究还有待进一步完善。在实际养殖生产过程中,可通过渐变温度驯化达到养殖可控的温度范围,以减少对鱼体的伤害。
Filho DW, Torres MA, Zaniboni-Filho E,et al. Effect of different oxygen tensions on weight gain, feed conversion, and antioxidant status in piapara,Leporinus elongatus,(Valenciennes, 1847). Aquaculture, 2005, 244(1): 349–357
Hu J, Wu KC, Ye L,et al. Effects of acute salinity stress on catalase in juvenileAmphiprion clarkii. South China Fisheries Science, 2015, 11(6): 73–78 [胡静, 吴开畅, 叶乐, 等. 急性盐度胁迫对克氏双锯鱼幼鱼过氧化氢酶的影响. 南方水产科学, 2015, 11(6): 73–78]
Handeland SO, Imsland AK, Stefansson SO. The effect of temperature and fish size on growth, feed intake, food conversion efficiency and stomach evacuation rate of Atlantic salmon post-smolts. Aquaculture, 2008, 283(1–4): 36–42
Jobling M. Influence of body weight and temperature on growth rates of Arctic charr,Salvelinus alpinus, (L.). Journal of Fish Biology, 1983, 22(4): 471–475
Jobling M. Bioenergetics: Feed intake and energy partitioning//Fish Ecophysiology. Springer Netherlands, 1993, 457–466
Kang YJ, Lang MY, Zhao W. Antioxidant enzymes and its influencing factors in aquatic organisms research progress.Journal of Microbiology, 2013, 33(3): 75–80 [亢玉静, 郎明远, 赵文. 水生生物体内抗氧化酶及其影响因素研究进展. 微生物学杂志, 2013, 33(3): 75–80]
Liu XB, Piao JH. The bioactive substances of antioxidant capacity evaluation methods and its research progress.Chinese Journal of Food Hygiene, 2008, 20(5): 440–444 [刘小兵, 朴建华. 生物活性物质的抗氧化能力评价方法及其研究进展. 中国食品卫生杂志, 2008, 20(5): 440–444]
Li DP, Liu SY, Xie CX,et al. Effects of water temperature on active oxygen content and antioxidant defense system in Chinese sturgeons. Acta Hydrobiologica Sinica, 2008, 32(3):327–332 [李大鹏, 刘松岩, 谢从新, 等. 水温对中华鲟血清活性氧含量及抗氧化防御系统的影响. 水生生物学报,2008, 32(3): 327–332]
Liu SZ, Xu YJ, Ma AJ,et al. Effects of temperature, salinity and light on the embryonic development ofCynoglossus semilaevisand the control technology research of hatching conditions. Progress in Fisheries Science, 2004, 25(6): 1–6[柳学周, 徐永江, 马爱军, 等. 温度、盐度、光照对半滑舌鳎胚胎发育的影响及孵化条件调控技术研究. 渔业科学进展, 2004, 25(6): 1–6]
Martínez-Álvarez RM, Morales AE, Sanz A. Antioxidant defenses in Fish: Biotic and abiotic factors. Reviews in Fish Biology & Fisheries, 2005, 15(1): 75–88
Ou YJ, Li JE, Chen FH. Morphology and biological character of hunchback perch. Journal of Fishery Sciences of China,1999(1): 24–26 [区又君, 李加儿, 陈福华. 驼背鲈的形态和生物学性状. 中国水产科学, 1999(1): 24–26]
Parihar MS, Dubey AK. Lipid peroxidation and ascorbic acid status in respiratory organs of male and female freshwater catfishHeteropneustes fossilisexposed to temperature increase. Comparative Biochemistry & Physiology Part C Pharmacology Toxicology & Endocrinology, 1995, 112(3):309–313
Pan GP, Liu BW, Zhou WY. Effects of low temperature stress on antioxidant and immune indexes of juvenileEpinephelus aureus. Journal of Shanghai Ocean University, 2016, 25(1):78–85 [潘桂平, 刘本伟, 周文玉. 低温胁迫对云纹石斑鱼幼鱼抗氧化和免疫指标的影响. 上海海洋大学学报, 2016,25(1): 78–85]
Qiao QS, Xu WN, Zhu H,et al. Effects of starvation and refeeding onMegalobrama amblycephalagrowth and body composition and digestive enzymes. Freshwater Fisheries,2011, 41(2): 63–68 [乔秋实, 徐维娜, 朱浩, 等. 饥饿再投喂对团头鲂生长、体组成及肠道消化酶的影响. 淡水渔业,2011, 41(2): 63–68]
Roche H, Bogé G. Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication. Marine Environmental Research,1996, 41(1): 27–43
Shi ZH, Xie MM, Peng SM,et al. Effects of temperature stress on activities of digestive enzymes and serum biochemical indices ofPampus argenteusjuveniles, Progress in Fishery Sciences, 2016, 37(5): 30–36 [施兆鸿, 谢明媚, 彭士明, 等.温度胁迫对银鲳(Pampus argenteus)幼鱼消化酶活性及血清生化指标的影响. 渔业科学进展, 2016, 37(5): 30–36]
Sun P, Chai XJ, Yin F,et al. Responses of liver antioxidant system ofNibea japonicusunder transport stress. Marine Fisheries, 2014, 36(5): 469–474 [孙鹏, 柴学军, 尹飞, 等.运输胁迫下日本黄姑鱼肝脏抗氧化系统的响应. 海洋渔业, 2014, 36(5): 469–474]
Stéphan G, Guillaume J, Lamour F. Lipid peroxidation in turbot(Scophthalmus maximus) tissue: Effect of dietary vitamin E and dietary n-6 or n-3 polyunsaturated fatty acids.Aquaculture, 1995, 130(2–3): 251–268
Viña J. Biochemical adaptation: Mechanism and process in physiological evolution. Biochemistry & Molecular Biology Education, 2002, 30(3): 215–216
Wang W, Jiang ZQ, Meng FP,et al. Effects of acute temperature stress on survival rate, physiological and biochemical indexes of Pacific cod fish and juvenile. Journal of Fisheries Science, 2012, 31(8): 463–466 [王伟, 姜志强, 孟凡平, 等.急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响. 水产科学, 2012, 31(8): 463–466]
Wang Q, Fan CP, Chen KC,et al. Effects of three kinds of sulfa drugs on the glutathione transferase (GST) and malondialdehyde (MDA) in the liver tissues of tilapia.Ecological and Environmental Sciences, 2010, 19(5): 1014–1019 [王奇, 范灿鹏, 陈锟慈, 等. 三种磺胺类药物对罗非鱼肝脏组织中谷胱甘肽转移酶(GST)和丙二醛(MDA)的影响. 生态环境学报, 2010, 19(5): 1014–1019]
Xie MM, Peng SM, Zhang CJ,et al. Effects of acute temperature stress on antioxidant and immune indexes of juvenile silver pomfret. Marine Fisheries, 2015(6): 541–549 [谢明媚, 彭士明, 张晨捷, 等. 急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响. 海洋渔业, 2015(6): 541–549]
Zhang KF, Zhang ZP, Chen Y,et al. Advances in studies on the main antioxidant enzymes gene in antioxidant systems of animals. Chinese Journal of Zoology, 2007, 42(2): 153–160 [张克烽, 张子平, 陈芸, 等. 动物抗氧化系统中主要抗氧化酶基因的研究进展. 动物学杂志, 2007, 42(2):153–160]
