维生素D及其类似物临床应用共识
2018-03-28中华医学会骨质疏松和骨矿盐疾病分会
中华医学会骨质疏松和骨矿盐疾病分会
自20世纪初对佝偻病的研究发现维生素D以来,维生素D与钙磷代谢和骨骼健康的重要关联被不断发现。我国内分泌学先驱刘士豪教授和朱宪彝教授针对维生素D与钙磷代谢和骨软化的研究,以及由他们提出并命名的“肾性骨营养不良”得到了国际学者的广泛认可。维生素D及其相关制剂(或称类似物)的应用从根本上遏制了全球范围内佝偻病/骨软化症的广泛流行趋势。然而,维生素D缺乏和营养不足在人群中仍普遍存在,全球约有超过10亿人群的血清25羟维生素D(25 hydroxyvitamin D,25OHD)水平达不到维持骨骼肌肉健康所推荐的30 μg/L(75 nmol/L)水平,因此维生素D作为基本健康补充剂用于骨质疏松症的防治。维生素D在体内经过两步羟化后形成1,25双羟维生素D[1,25-dihydroxyvitamin D,1,25(OH)2D] ,后者是体内维生素D的主要活性形式并发挥重要的生理作用,又被称为“D激素”或“活性维生素D”。近年来,有许多与维生素D结构相似且具有活性维生素D样作用的化学物质(活性维生素D类似物)被不断开发并应用于临床,特别是用于骨质疏松症、佝偻病、慢性肾脏病和皮肤病等疾病。随着维生素D受体(vitamin D receptors,VDR)和25OHD-1α-羟化酶(1α-hydroxylase,CYP27B1)在许多骨外组织中被发现,维生素D的作用已不再囿于调节钙磷代谢和维护骨骼健康,其在肌肉、心血管疾病、糖尿病、癌症、自身免疫和炎性反应等中的作用也逐渐被关注,维生素D已成为临床及基础研究的热点。
1 维生素D概述
维生素D是一种脂溶性的开环固醇类物质,包括动物来源的维生素D3[胆骨化醇,cholecalciferol,化学名:9,10-开环胆甾- 5,7,10(19)-三烯-3β-醇]和植物来源的维生素D2[麦角固醇,ergocalciferol,化学名:9,10-开环麦角甾- 5,7,10(19),22-四烯-3β-醇],化学结构见图1。维生素D在体内经25羟化酶的催化合成25OHD,是体内的主要贮存形式,反映体内维生素D的营养状态。25OHD经过1α位羟化成为1,25(OH)2D,是体内维生素D的主要活性代谢物,与组织中广泛存在的维生素D受体结合,发挥激素样作用,又称D激素。因此,维生素D亦被看作是激素原[1]。维生素D及其代谢物的主要生理作用是促进钙和磷在肠道中吸收,并抑制甲状旁腺素(parathyroid hormone, PTH)释放,维持血钙和磷水平正常,进而保证骨骼健康和神经肌肉功能正常。维生素D的骨骼外作用包括对肌肉、心血管、代谢、免疫、肿瘤发生、妊娠和胎儿发育等多方面的影响[2]。
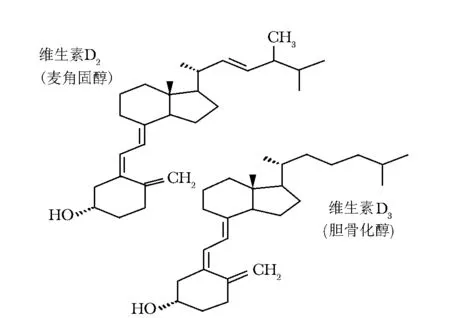
图 1 维生素D的化学结构
维生素D的发现源自1920至1930年对佝偻病的研究,维生素D缺乏、代谢异常或过量主要影响骨代谢和钙、磷稳态,D激素属于“钙调激素”之一。严重维生素D缺乏和代谢异常会导致佝偻病/骨软化症;维生素D不足与骨质疏松症及其骨折密切相关。推荐维持骨骼健康的循环25OHD水平应达到30 μg/L(75 nmol/L)以上。同时,维生素D缺乏和作用不足还与多种疾病的发生发展相关联[3]。老年人可能存在维生素D营养缺乏、活性维生素D的生成减少和作用不足,并容易并发肌少症、虚弱症和跌倒风险增加。
随着社会经济发展和生活方式变化,特别是户外生活、工作时间的减少,维生素D缺乏已经成为全球性的公共健康问题[4]。流行病学资料表明维生素D缺乏在我国人群中普遍存在[5- 6]。近年来,维生素D与骨骼健康及多种疾病的联系受到了广泛重视,维生素D检测、补充和活性维生素D及其类似物使用日趋频繁,但所采用的制剂和方法各异。为指导公众科学获得充足的维生素D营养、合理补充维生素D和规范使用维生素D类似物,中华医学会骨质疏松和骨矿盐疾病分会组织本领域的相关专家,著此共识,期作指引。
2 维生素D代谢及其生理作用
人体维生素D主要来源于表皮中的7-脱氢胆固醇,在表皮经阳光中的紫外线(波长290~315 nm)照射后转变为维生素D3前体,经温促作用转换为维生素D3[7]。维生素D的另一来源是食物,包括植物性食物和动物性食物,含维生素D2或D3的食物种类很少,植物性食物(如受阳光照射后的蘑菇)含有较丰富的维生素D2,而动物性食物(如野生多脂肪海鱼)含有较丰富的维生素D3。与外源性维生素D2或D3相比,内源性维生素D3在血液中的半衰期更长[8]。维生素D2和D3为无活性形式,两者不能互相转化,统称为维生素D。维生素D需经两次羟化才能转变为1,25(OH)2D,成为具有生物活性的D激素。第一步羟化主要在肝脏完成,维生素D通过维生素D结合蛋白(vitamin D binding protein,DBP)的运输到达肝脏,在肝细胞内经维生素D-25-羟化酶(25-hydroxylase,CYP2R1和CYP27A1)催化转变为25OHD,该过程为非限速反应[7,9]。约85%~90%的25OHD在血液循环中与DBP结合,10%~15%与白蛋白结合,游离部分不足1%。由于与白蛋白结合部分容易解离,与游离部分一起被称为生物可利用的25OHD[10]。第二步羟化主要在肾脏完成,肾小球滤液中的25OHD在DBP协助下进入肾小管细胞,在细胞内CYP27B1催化下,转变为1,25(OH)2D,该过程为限速反应,主要受PTH的调控,PTH刺激1α-羟化酶的合成[7,9]。1,25(OH)2D被DBP运输到靶器官组织,如肠道、肾脏和骨骼,与这些组织细胞内的VDR结合后,上调或下调靶基因的转录,从而发挥其经典作用,包括促进肠道内钙和磷的吸收,以及促进肾小管内钙的重吸收[7,9,11],从而有利于骨骼矿化。此外,1,25(OH)2D还直接作用于成骨细胞,并通过成骨细胞间接作用于破骨细胞,从而影响骨形成和骨吸收,并维持骨组织与血液循环中钙、磷的平衡[12]。
VDR除存在于肠道、肾脏和骨骼以外,还存在于许多其他组织,1,25(OH)2D作用于这些组织细胞内的VDR后,发挥许多非经典作用,包括抑制细胞增生、刺激细胞分化、抑制血管生成、刺激胰岛素合成、抑制肾素合成、刺激巨噬细胞内抑菌肽合成、抑制PTH合成和促进骨骼肌细胞钙离子内流等[1,13- 15]。
1,25(OH)2D在发挥这些作用的同时,还激活靶细胞内的维生素D- 24-羟化酶(24-hydroxylase,CYP24A1),使25OHD和1,25(OH)2D转变为无活性的代谢产物,这是1,25(OH)2D的一种重要自身调节机制[7,16],其目的是防止1,25(OH)2D在靶细胞内的作用过强。此外,一些肾外组织也具有产生1,25(OH)2D的能力,这些组织表达CYP27B1,能将25OHD转变为1,25(OH)2D,与来源于血液循环中的1,25(OH)2D共同调节局部组织细胞的功能[7,14](图2)。
3 维生素D缺乏及其危险因素
3.1 维生素D缺乏的诊断标准
体内可检测到的维生素D代谢物约有40多种,其中25OHD是循环中存在最多的代谢物,可反映机体维生素D的营养水平。血清25OHD水平检测已被公认为反映维生素D状态的最合理指标。目前国际、国内多数机构和专家认为:血清25OHD<20 μg/L(50 nmol/L)为维生素D缺乏(deficiency),20~30 μg/L(50~75 nmol/L)为维生素D不足(insuffici-ency),>30 μg/L(>75 nmol/L)为维生素D充足,<10 μg/L(<25 nmol/L)为严重缺乏[17]。按照该标准,全球维生素D不足或缺乏相当普遍,约占总人口的50%~80%[17- 18]。中国不同纬度城市的调查显示,人群普遍存在维生素D不足或缺乏[19- 21]。我国五大城市1436名健康人群横断面研究显示:血清25OHD平均水平为(19.87± 8.14)μg/L,其中25OHD>30 μg/L、20~30 μg/L及<20 μg/L的比例分别为11.7%、31.3%和57.0%[6]。上海地区2588名20~89岁人群中维生素D不足者男、女性分别为84%和89%,维生素D缺乏者分别为30%和46%,25OHD<10 μg/L(25 nmol/L)分别为2%和3.6%[22]。对10 038名45~75岁的兰州城市居民检测,发现维生素D缺乏人群占75.2%[23]。
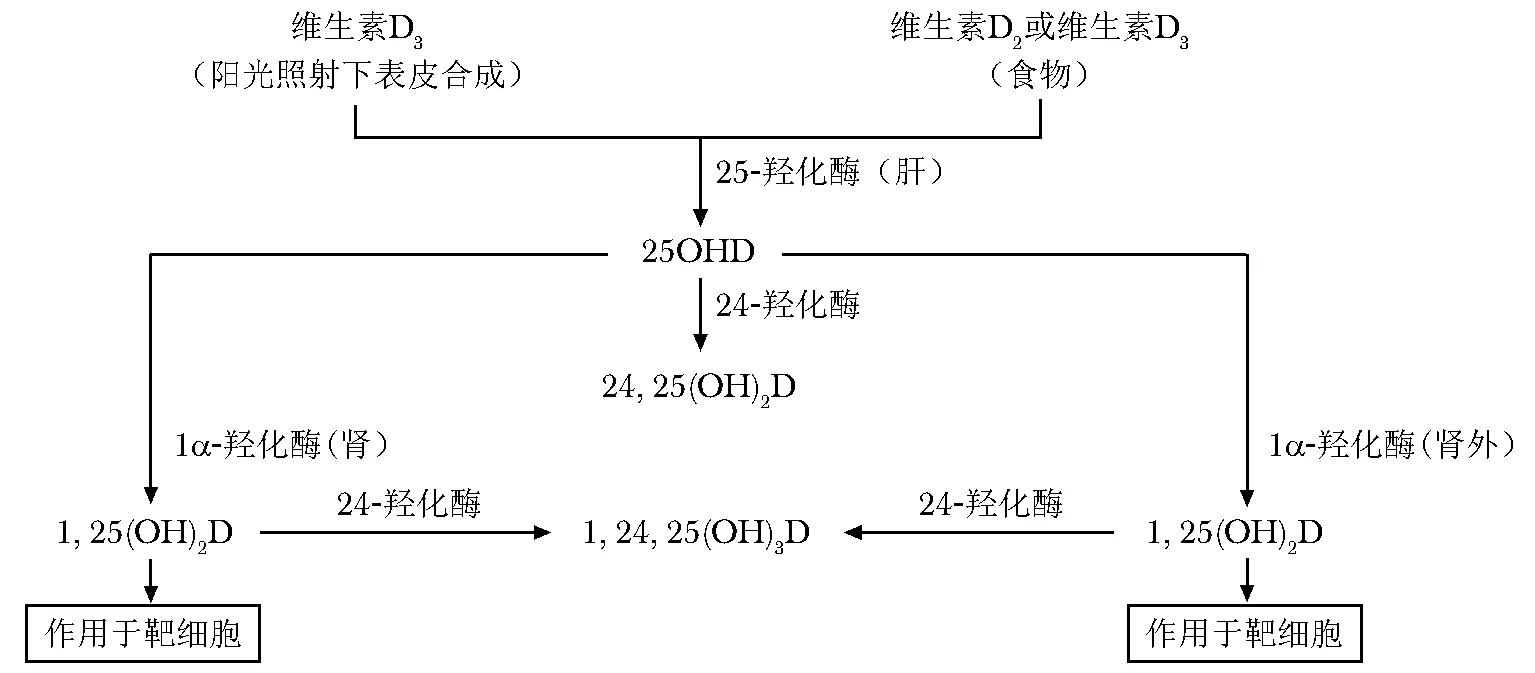
图2维生素D的代谢途径
3.2 血清25OHD测定方法
血清25OHD浓度测定最早使用氚(3H)标记的25OHD进行竞争性蛋白结合分析(competi-tive protein binding assay,CPBA),但3H标记繁杂,且需要处理放射性废物(3H的半衰期很长),故该方法已被放弃。免疫层析法及酶联免疫法都是使用25OHD的特异性抗体进行分析,前者步骤简单,可以用于快速筛查;后者所获得的抗原-抗体复合物的信号经过酶联信号放大作用,比前者提高了灵敏度。化学发光法(chemiluminescent immunoassay,CL)本质上也属于竞争性蛋白结合分析,无放射性污染,且仪器可自动化分析,避免了手工操作误差,节约成本,国内较广泛使用该方法。液相色谱与质谱串联分析(liquid chromatography-mass spectrometry/mass spectrome-try,LC-MS/MS)能够区分25OHD3、25OHD2及其他与25OHD分子结构相似的物质,该检测方法的特异性最高,且灵敏度也极高,可以认为是25OHD检测的“金”标准,但是检测耗费较大。
目前临床常用的血25OHD测定方法为化学发光法,该方法检测的成分不仅包括25OHD3,也包括25OHD2及25OHD代谢产物,但不包括1,25(OH)2D,所检测的成分能够代表体内维生素D营养状态。
3.3 维生素D缺乏风险因素和筛查
维生素D缺乏与环境和遗传因素有关。影响维生素D水平的因素很多,包括年龄、肤色、季节、地理纬度、海拔、日照时间、着装习惯、防晒措施、饮食习惯、空气污染、肥胖以及影响维生素D代谢的药物等。老年人皮肤维生素D合成量显著减少,同等程度日照合成维生素D的能力只有年轻人的30%[24],老年女性维生素D缺乏的风险比男性高1.5倍[25];黑色素通过吸收紫外线降低皮肤维生素D合成,故肤色黑的人维生素D缺乏的风险更高[26];而季节、纬度和海拔不同,紫外线的照射时间与强度差异大[27],秋冬季比春夏季维生素D合成少[28];随着海拔升高,皮肤合成维生素D会相应的增加[28]。另外,着装习惯和户外活动时间也影响皮肤维生素D的合成[29- 30]。使用防晒霜可使皮肤合成维生素D的总量明显下降[31]。食用多脂鱼可补充维生素D,且野生三文鱼维生素D的含量比人工饲养者高[28]。多项研究显示,城市对流层臭氧量高于农村,致城市居民维生素D缺乏风险明显升高[32],农村女性维生素D水平比城市女性高[33- 34]。同时,空气污染地区维生素D缺乏现象明显高于无污染地区[35- 37],若孕期暴露于污染空气,可致胎儿脐带血维生素D水平降低,导致婴儿维生素D缺乏[38]。超重和肥胖与维生素D缺乏风险存在相关性[39]。长期使用某些药物,如苯妥英钠、苯巴比妥、利福平等,可加快体内维生素D分解代谢而致维生素D缺乏[40]。
此外,遗传因素也是影响维生素D代谢的原因之一[41- 43]。通过不同人种或者地区的研究,明确了血25OHD水平的差异与维生素D结合蛋白、7脱羟胆固醇还原酶(7-dehydrocholesterol reduc-tase)和25-羟化酶的编码基因(上述蛋白质编码基因分别为GC、DHCR7和CYP2R1基因)的遗传变异具有高度相关性。已发现影响25OHD水平的3个重要风险位点,即GC基因rs2282679、DHCR7基因rs7944926和CYP2R1基因rs10741657位点;单个遗传变异位点可解释25OHD水平群体间差异的1%~4%,携带上述3个风险基因型位点的人群,更容易出现25OHD缺乏[44- 48]。此外,药物基因组学研究提示上述基因的遗传变异影响普通维生素D补充后的疗效[45]。
虽然维生素D缺乏或不足在全球人群中非常普遍,但并不主张在人群普遍筛查血25OHD水平,而推荐在具有维生素D缺乏风险及需要维持合理维生素D营养状态的人群中进行血25OHD水平的筛查(表1)。

表 1 建议筛查血25OHD水平的人群
BMI:体质量指数
4 维生素D与佝偻病/骨软化症
佝偻病(rickets)/骨软化症(osteomalacia)是生长板软骨和类骨质矿化障碍所致代谢性骨病[49]。17世纪中叶佝偻病在欧洲工业化国家广泛流行,一度成为危害儿童生命的主要原因,直到20世纪初维生素D的发现,才阐明了维生素D缺乏是佝偻病的病因[50]。在儿童时期,骨骺生长板尚未闭合,生长板软骨矿化障碍导致特征性的骨骼畸形,称为佝偻病;成年后,生长板已闭合,骨重建部位新形成的类骨质矿化障碍,骨矿物质含量减少,致使骨骼易于变形和发生骨折,称为骨软化症。佝偻病多见于6个月至2岁的婴幼儿,可出现方颅,手镯、脚镯征,肋串珠,严重时出现鸡胸、O型腿或X型腿,生长缓慢。骨软化症早期症状不明显,逐渐出现乏力、骨痛、行走困难,严重者出现四肢长骨、肋骨、骨盆和脊柱等处的病理性骨折,身高变矮,甚至卧床不起[51]。维生素D缺乏、维生素D代谢异常及作用异常是佝偻病和骨软化症的重要病因。
4.1 维生素D缺乏性佝偻病/骨软化症
维生素D缺乏和/或钙缺乏可导致佝偻病/骨软化症,又称营养性佝偻病。主要原因是患者缺少日照导致皮肤维生素D3合成不足。其他原因尚有膳食中维生素D缺乏和消化道疾患致维生素D吸收不良,如胃肠切除、小肠吸收不良,肝胆疾病,慢性胰腺炎等[7,17]。通常认为当血25OHD水平低于10 μg/L (25 nmol/L) 时,就可能引起维生素D缺乏性佝偻病/骨软化症[50]。此时,体内1,25(OH)2D相对不足,肠道钙吸收减少,血液中的离子钙水平偏低,刺激甲状旁腺素分泌[7,17,52],从而增加肠钙吸收及肾小管对钙的重吸收,但升高的甲状旁腺素抑制了肾小管对磷的重吸收,使血磷水平下降,骨骼矿化不良[53]。
4.2 维生素D代谢异常致佝偻病/骨软化症
1α-羟化酶缺陷:常见于慢性肾功能不全所致肾性骨营养不良,另外可见于假性维生素D缺乏性佝偻病Ⅰ型(pseudo-vitamin D deficiency rickets type Ⅰ,PDDR Ⅰ型),亦称维生素D依赖性佝偻病Ⅰ型(vitamin D-dependant rickets type Ⅰ,VDDR Ⅰ型),为常染色体隐性遗传疾病[54]。因编码1α-羟化酶的CYP27B1基因突变,使酶功能缺陷,导致1,25(OH)2D合成减少,肠道钙、磷吸收减少,出现低钙血症、继发性甲状旁腺功能亢进、轻微的低磷血症。血清1,25(OH)2D显著降低是该病的特征性生化改变[55]。活性维生素D对该病具有良好的治疗效果。
25-羟化酶缺乏:主要见于严重的肝功能损伤、药物诱导25-羟化酶缺乏和遗传性25-羟化酶缺乏,使25OHD生成障碍,导致佝偻病/骨软化症[56]。
4.3 维生素D作用异常致佝偻病/骨软化症
维生素D依赖性佝偻病Ⅱ型(vitamin D-dependant rickets type Ⅱ,VDDR Ⅱ型),又称遗传性维生素D抵抗性佝偻病,为常染色体隐性遗传疾病,因编码维生素D受体的VDR基因突变,导致1,25(OH)2D不能发挥正常的生理功能。血液中1,25(OH)2D显著升高,约有2/3患者并发禿发[57]。
4.4 低血磷性佝偻病/骨软化症的维生素D代谢异常
成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)相关低血磷性佝偻病/骨软化症包括遗传性低血磷性佝偻病[58]和肿瘤相关的骨软化症[59]。此类疾病患者血液循环中高水平的FGF23抑制肾小管钠磷共转运蛋白的表达和功能,使尿磷排出增加,血磷下降。同时FGF23抑制1α-羟化酶的合成与活性,使血1,25(OH)2D水平不适当降低,肠道钙磷吸收减少,加重低磷血症,导致矿化障碍,发生佝偻病/骨软化症[58]。
5 维生素D与骨质疏松症
骨质疏松症是以骨密度降低、骨组织微结构损伤,导致骨强度下降、骨折危险性增加为特征的全身性骨骼疾病[60- 61]。随着增龄,骨质疏松性骨折风险显著增加,同时易伴发肌少症,使患者的生活质量下降,甚至死亡风险增加[62- 63]。由于维生素D对骨骼和肌肉均发挥着重要的调节作用,其在骨质疏松症的发生、发展和防治中的作用不容忽视。
1,25(OH)2D是重要的钙调节激素之一,增加肠道及肾脏钙吸收,促进正钙平衡。维生素D可通过升高血钙水平或直接作用于甲状旁腺,抑制甲状旁腺素分泌,减少继发性甲状旁腺功能亢进症的发生,进而减轻后者引起的过度骨吸收[6- 7]。此外,维生素D通过结合于成骨细胞和骨细胞核的VDR,作用于维生素D反应元件,能够调节多种基因的表达,包括骨钙素、骨形态发生蛋白、FGF- 23、同源X染色体连锁的磷酸盐调节内肽酶(phosphate regulating endopeptidase homolog X-linked,PHEX)、低密度脂蛋白相关蛋白- 5(LDL receptor related protein 5,LRP- 5)等,影响骨构建、重建和矿化[64]。此外,维生素D还调节骨骼肌细胞的增生、分化、肌管的大小,对肌肉量与肌功能发挥重要影响[65- 66]。
骨质疏松症的发生,取决于年轻时获得的峰值骨量和中老年阶段的骨丢失速率。研究表明,D激素是调节骨骼生长发育的重要内分泌激素,青少年阶段,合成及摄取足量的维生素D,能够促进骨骼构建与矿化,有助于获得较高的峰值骨量[67]。此后,充足的维生素D帮助维持正钙平衡,减少骨转换失衡和骨丢失加速。多项研究显示维生素D缺乏与中老年人甲状旁腺素水平增高、骨吸收增加、骨量丢失、跌倒和骨折风险升高相关[48,68- 69]。随机安慰剂对照研究显示,补充维生素D 800~1000 IU/d,能够降低骨转换水平,减少骨丢失率,增加腰椎和髋部骨密度[70- 71]。另外,跌倒是骨质疏松性骨折的主要诱因,我国70岁以上人群,跌倒的发生率超过20%[72],每天补充700~1000 IU的维生素D,可明显降低老年人群跌倒发生[73- 74]。Meta分析表明,维生素D及钙剂联合治疗能够降低老年人群骨折风险[75]。
活性维生素D及其类似物在骨质疏松症治疗中也发挥重要作用。临床上常用阿法骨化醇(1α羟维生素D)或骨化三醇[1,25(OH)2维生素D]。由于老年人群皮肤合成维生素D能力下降,肾脏对25OHD的1α羟化能力减弱,活性维生素D尤其适用于老年患者或有肾脏疾病的患者。研究显示,骨化三醇和阿法骨化醇能够改善肌肉功能和平衡能力,降低老年人跌倒风险[76- 77]。老年人群的系统综述显示,骨化三醇和阿法骨化醇能够降低骨吸收生化指标水平,增加骨密度[78]。我国研究也显示,骨化三醇联合碳酸钙治疗,明显增加腰椎和股骨颈骨密度[79]。也有研究表明,骨化三醇和阿法骨化醇能够降低跌倒和非椎体骨折的风险[78]。
6 维生素D骨骼外作用
6.1 维生素D与2型糖尿病
人群研究表明维生素D不足与2型糖尿病(type 2 diabetes mellitus,T2DM)发生率增加有关[80- 81],维生素D缺乏是T2DM患病的潜在危险因素[82- 83]。横断面研究提示在T2DM和代谢综合征人群中,维生素D水平与胰岛素敏感性及胰岛β细胞功能具有独立相关性[84- 85]。具有较高25OHD浓度者,空腹及糖负荷后2 h血糖水平均较低[86]。纵向队列研究和Meta分析均显示较高维生素D摄入与T2DM发生风险降低存在关联性[87- 88]。观察性研究也揭示维生素D缺乏与糖尿病慢性并发症,如糖尿病性视网膜病变的发生有关[89]。
然而,目前对于补充维生素D是否能降低或预防T2DM的发生并无肯定结果。多项双盲随机对照药物试验研究表明维生素D缺乏的糖尿病前期患者,短期或长期甚至是大剂量补充维生素D均不能降低其进展为T2DM的风险[90- 92]。
有关维生素D糖调节作用的机制包括:通过直接激活VDR或通过干扰胰岛素受体启动基因区域的维生素D反应元件影响胰岛β细胞的功能[93- 94];通过增强胰岛素受体与胰岛素反应,改善胰岛素敏感性和葡萄糖转运[95- 97];诱导胰岛素原向胰岛素转换增加。此外维生素D也可通过间接调节钙稳态影响疾病的进展[98]。最新研究表明活性维生素D通过下丘脑室旁核VDR,起到减少摄食、降低体重、改善糖耐量和胰岛素敏感性的作用[99]。
6.2 维生素D与心血管疾病
心脏及血管平滑肌中表达VDR及1α-羟化酶和24-羟化酶[100],维生素D可能通过影响或调节炎性反应细胞因子[101]、血管钙化[102]、肾素-血管紧张素-醛固酮系统[103]参与心血管保护作用。维生素D可通过抑制PTH的分泌(PTH可降低脂肪分解)[104]和增加血钙水平(钙会降低肝脏三酰甘油的形成和分泌)[105]等途径改善血脂代谢。
低维生素D水平与动脉粥样硬化[106- 107]、冠状动脉疾病、心肌梗死[108]、心力衰竭[109]、卒中[110]、心血管病死率[111]和全因病死率等相关,是心血管疾病的独立危险因素[112]。而补充维生素D对于血压、人群总体的全因病死率及心血管病发病率和病死率的影响存在争议;少量随机对照临床试验表明补充维生素D可以改善心衰患者的预后[113],但需要进一步确定维生素D缺乏与冠心病、心肌梗死之间是否存在因果联系。
6.3 维生素D与肌力和跌倒
肌力下降是跌倒的诱因之一,已有研究发现补充维生素D可以改善肌力、降低跌倒风险。维生素D既可通过VDR调节靶基因的转录,直接促进肌细胞发育,又可通过快速跨膜通路促进钙离子内流,增强肌肉收缩功能[64,114- 117],也可调节血钙和磷水平间接影响肌肉的功能[118- 120]。观察性研究提示,严重维生素D缺乏者肌力下降,跌倒风险增加[72,121]。随机对照试验结果表明,适量补充维生素D可以改善肌力、降低跌倒风险,尤其是对基础维生素D水平较低的人群,若同时补充钙剂效果更显著[122],但具体剂量和疗程尚无定论。老年人群跌倒发生率高且后果严重,因此对老年人群补充适量的维生素D对改善肌力和减少跌倒更具价值[120]。
6.4 维生素D与免疫和肿瘤
1,25(OH)2D能够抑制T淋巴细胞的活化和增生,影响细胞因子的表达、诱导单核细胞的分化、增加中性粒细胞和单核细胞的抗菌肽生成、抑制树突状细胞的成熟和分化。动物实验显示1,25(OH)2D可预防1型糖尿病、自身免疫性脑脊髓炎-多发性硬化的发生[123- 125],一项来自缺乏日光照射地区的研究提示,婴儿期补充维生素D能降低今后1型糖尿病的风险[126]。补充维生素D有助于缓解系统性红斑狼疮[127]、炎性反应性肠病的病情[128]。动物实验和体外细胞培养研究均表明1,25(OH)2D促进细胞分化和抑制肿瘤细胞增生,且具有抗炎、促凋亡、抑制血管生成的特性[128]。多个对结、直肠癌患者的观察性研究表明,血清25OHD水平与癌症发生率呈负相关[129- 130]。但维生素D与肿瘤的相关性仍需要大规模的随机对照研究证实,特别是以防治肿瘤作为主要观察终点的研究。
7 维生素D临床应用
7.1 维生素D缺乏
预防维生素D缺乏的一般措施:增加日照和富含维生素D食物的摄入是预防维生素D缺乏/不足的经济有效的方法。通常,春、夏和秋季11∶00-15∶00将面部和双上臂暴露于阳光5~30 min(取决于多因素),每周3次即可达到预防目的[7,131- 132]。缺少日照时建议补充维生素D,维生素D2或维生素D3均可,二者在疗效和安全性方面无显著差别[133]。
对维生素D缺乏高危人群,维生素D摄入量的推荐见表2[17]。
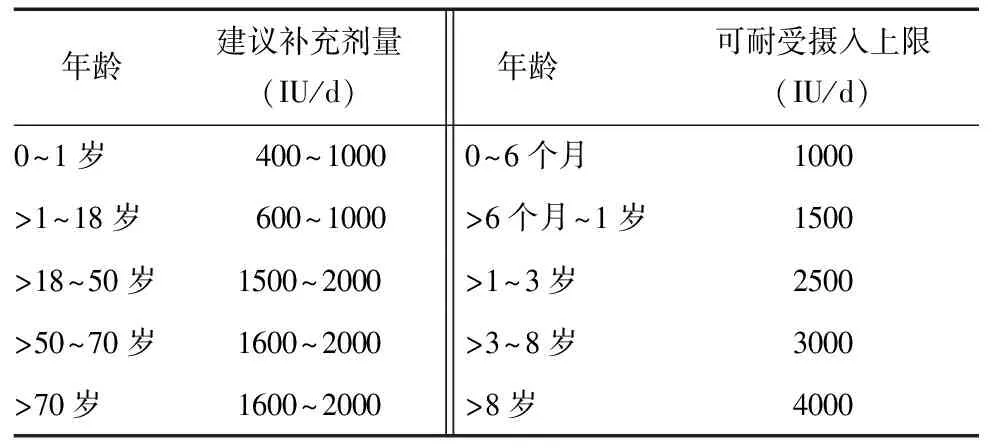
表 2 维生素D缺乏高危人群维生素D补充推荐
建议妊娠和哺乳期妇女补充维生素D 1500~2000 IU/d,而具有维生素D缺乏高风险者可耐受上限是10 000 IU/d;建议肥胖儿童和成人及用抗惊厥药、糖皮质激素、抗真菌药和抗艾滋病药物的儿童和成人至少需要同年龄段2~3倍的维生素D方能满足需要。
维生素D缺乏的防治策略[17]:对维生素D缺乏的防治,建议用普通维生素D2或D3制剂。不建议单次超大剂量补充维生素D的用法,不推荐用活性维生素D或其类似物纠正维生素D缺乏。
对0~1岁维生素D缺乏婴幼儿建议用维生素D2或D32000 IU/d或50 000 IU/周,用6周以使血清25OHD水平达到30 μg/L(75 nmol/L)以上,继而以400~1000 IU/d维持;对>1~18岁的维生素D缺乏儿童和青少年,建议用维生素D2或D32000 IU/d或50 000 IU/周,用6周以使血清25OHD水平达30 μg/L(75 nmol/L)以上,继而以600~1000 IU/d维持;对维生素D缺乏所有成年人,建议用50 000 IU/周或6000 IU/d的维生素D2或D38周以使血清25OHD水平达30 μg/L(75 nmol/L)以上,继而以1500~2000 IU/d维持;对肥胖患者、小肠吸收不良综合征患者和正在使用影响维生素D代谢药物的患者,建议用高剂量(常规剂量的2~3倍,至少6000~10 000 IU/d)的维生素D治疗维生素D缺乏,以达到血清25OHD水平在30 μg/L(75 nmol/L)以上,继而以3000~6000 IU/d维持。
在有“肾外”产生1,25(OH)2D的疾病(如结节病、结核病)的患者,用维生素D治疗期间,建议监测血清25OHD水平和血、尿钙水平,以防止高钙血症。
对有原发性甲状旁腺功能亢进症并发维生素D缺乏的患者,建议酌情考虑维生素D治疗,且建议监测血清钙水平。
启动维生素D治疗后3~6个月,再检测血清25OHD水平,以判断疗效和调整剂量。
7.2 佝偻病/骨软化症
预防营养缺乏性佝偻病/骨软化症需保证足够的维生素D与钙的营养。充足日照是预防维生素D缺乏最为安全和经济有效的办法[134]。缺乏日照时建议补充维生素D预防维生素D缺乏,补充剂量参见上节内容。
维生素D缺乏佝偻病/骨软化症患者给予充足的普通维生素D和钙剂干预后,常有显著疗效。维生素D缺乏的治疗剂量参见上节内容。胃肠吸收不良的患者口服维生素D的需要量更大,或采用肌肉注射方式。建议将25OHD水平至少提高到20 μg/L(50 nmol/L),最好达到30 μg/L(75 nmol/L)以上。应适当补充钙剂保证人体每日钙需要量。可监测血钙以及尿钙排出量,以便调整维生素D剂量。
PDDR Ⅰ型或VDDR Ⅰ型的治疗在活性维生素D及其类似物上市之前,通常用普通维生素D2万~10万IU/d,但效果不好且易导致体内大量维生素D蓄积。目前常采用阿法骨化醇0.5 ~1.5 μg/d或骨化三醇0.5~1.0 μg/d治疗,同时补充适量钙剂。活性维生素D治疗能使PDDR Ⅰ型佝偻病痊愈,患儿的生长速度趋于正常[55]。VDDR Ⅱ型患者,由于体内维生素D受体抵抗,需要更大剂量的阿法骨化醇或骨化三醇,甚至需要静脉补充钙剂维持血钙稳定[57]。
FGF23相关的低血磷性佝偻病/骨软化症的治疗需要补充磷和使用活性维生素D。采用中性磷酸盐溶液补充磷,骨化三醇剂量为儿童20~30 ng/(kg·d),成人0.50~0.75 μg/d,分两次服用[135]。如使用阿法骨化醇,其剂量约为骨化三醇的1.5倍。此类患者通常无需补充钙,除非存在显著的钙缺乏。治疗中需注意监测血钙磷、尿钙磷和血甲状旁腺素的水平。
7.3 甲状旁腺功能减退症
甲状旁腺功能减退症(hypoparathyroidism,简称甲旁减)是一种少见的内分泌疾病,因甲状旁腺素产生减少导致钙、磷代谢异常,以低钙血症、高磷血症伴PTH水平降低或在不适当的正常范围内为特征,临床上可表现为手足搐搦、癫痫发作,可并发颅内钙化及低钙性白内障等慢性并发症[136]。甲状腺手术是成年起病甲旁减的最常见病因,其经典治疗为长期口服钙剂和维生素D制剂[136- 138]。
除了每日补充元素钙1.0~3.0 g(分次服用)外,维生素D及其类似物可促进肠道的钙吸收,在甲旁减的长期治疗中具有重要地位。各种维生素D制剂在甲旁减患者中的使用剂量如下[137- 138]:
骨化三醇[1,25(OH)2D]:常用剂量为0.25~2.0 μg/d,但也有患者需要更大的剂量。由于半衰期短,剂量超过0.75 μg/d时建议分次服用;停药后作用消失也较快(2~3 d)。
阿法骨化醇[1α(OH)D3]:常用剂量为0.5~4.0 μg/d,其升高血钙的作用弱于骨化三醇,剂量大约为骨化三醇的1~2倍,半衰期长于骨化三醇,可每日一次服用;停药后作用消失约需1周。
普通维生素D(维生素D2或D3):由于PTH作用缺乏,单独用于甲旁减治疗时需要很大的剂量,且不同患者间剂量变异范围较大,治疗剂量1万~20万U/d,维生素D3作用或强于维生素D2。普通维生素D半衰期长(2~3周),使用剂量较大时可在人体脂肪组织内蓄积,停药后需要更长的时间(2周~4个月)才失效,尤需警惕高钙血症的风险。此外,对于以活性维生素D或PTH1- 84为主要治疗方案的患者,推荐每日补充普通维生素D 400~800 IU,也可根据血清25OHD维生素D水平补充普通维生素D以避免维生素D缺乏或不足[137,139]。
双氢速变固醇(dihydrotachysterol):常用治疗剂量为0.3~1.0 mg/d(每日一次),停用后作用消失时间约为1~3周。国内目前无此制剂。
钙剂和维生素D制剂的剂量应个体化,必须定期监测血钙磷水平以及尿钙排量,治疗目标为维持血钙水平轻度低于正常或位于正常低值范围,同时避免高钙尿症。噻嗪类利尿剂可以促进肾小管对钙的重吸收,减少尿钙的排出,联合低盐饮食适用于尿钙水平明显升高的患者。
7.4 骨质疏松症
普通维生素D常作为骨骼健康的基本营养补充剂,但补充普通维生素D在不同人群中增加骨密度、降低骨折和跌倒风险的作用尚存争议[70- 71,122,140- 141]。建议骨质疏松症患者接受充足的阳光照射,促进皮肤合成内源性维生素D。日照不足者可每天补充600~1000 IU的普通维生素D,也有研究表明对于维生素D缺乏患者每天补充更大剂量的维生素D(>2000 IU/d),可增加骨密度[69]。建议定期监测患者血清25OHD和甲状旁腺素水平,以指导调整普通维生素D的补充剂量[17,60],建议至少将血清25OHD浓度调整到20 μg/L(50 nmol/L),最好在30 μg/L(75 nmol/L)以上,以防止维生素D缺乏引发的继发性甲状旁腺功能亢进症和骨密度的降低[6,17,142]。部分研究显示,每天补充700~1000 IU普通维生素D,能够降低跌倒风险[74]。就骨质疏松症的防治而言,不建议患者常规单次补充超大剂量(>500 000 IU/年)的普通维生素D,有研究显示其可导致老年人跌倒风险升高[143- 144]。若患者血清25OHD浓度超过150 μg/L(375 nmol/L)则可能出现维生素D中毒[17]。
活性维生素D及其类似物是经过羟基化的维生素D类似物,属于骨质疏松症的治疗药物,推荐用于年龄在65岁以上或血清肌酐清除率小于60 ml/min者。临床应用的活性维生素D及其类似物包括骨化三醇和阿法骨化醇等[145]。活性维生素D能够增加肠钙吸收,减少继发性甲状旁腺功能亢进,抑制骨吸收,轻度增加患者骨密度、降低跌倒风险、减少椎体或非椎体骨折风险[77- 78]。活性维生素D可以与其他抗骨质疏松药物联合使用。建议骨质疏松症患者服用骨化三醇的剂量通常为0.25~0.5 μg/d,阿法骨化醇的剂量为0.25~1.0 μg/d。对于明显缺乏维生素D的骨质疏松症患者,必要时可予普通维生素D以纠正维生素D的营养缺乏,同时给予活性维生素D以发挥其对骨质疏松症的治疗作用。需要注意的是,使用活性维生素D的患者,不能根据血清25OHD浓度调整药物剂量,而可依据血清PTH水平及骨转换生化指标,评估药物的疗效。
无论使用普通维生素D,还是活性维生素D制剂,或者两者联合使用,都建议定期监测患者血清钙及24 h尿钙浓度,根据其水平调整药物剂量,以避免药物过量所引发的高钙血症或高尿钙的发生,以保证治疗的安全性[78,145]。
艾地骨化醇(eldecalcitol,ED- 71)是新型维生素D类似物,其与1,25(OH)2D相比,血清半衰期更长,抑制破骨细胞的活性更强,使骨密度增加的幅度更明显,已在国外上市用于骨质疏松症防治[146- 147]。
7.5 慢性肾脏病-矿物质和骨异常
维生素D代谢异常是慢性肾脏病-矿物质和骨异常(chronic kidney disease-mineral and bone disorder,CKD-MBD)发生机制中的关键环节。维生素D代谢异常及CKD-MBD可发生于CKD早期,并贯穿于肾功能减退全过程,其与患者并发症及病死率增加密切相关。合理应用活性维生素D及其类似物有助于治疗CKD-MBD,改善患者生存质量。
活性维生素D及其类似物在CKD-MBD的应用:活性维生素D及其类似物主要用于CKD继发甲状旁腺功能亢进症的治疗。由于CKD-MBD患者钙、磷和甲状旁腺素间关系复杂且相互影响[148],因此应用活性维生素D时,应动态观察钙、磷和PTH变化,并综合判断[149]。目前常用于CKD-MBD的维生素D制剂主要有骨化三醇、阿法骨化醇和帕立骨化醇(paricalcitol)等,应用上述药物将血PTH、钙、磷等维持在目标范围。CKD 3~5期非透析患者适宜的PTH水平目前尚不清楚,需对患者PTH水平进行早期监测和动态评估,建议将升高的血磷降至接近正常范围,且避免高钙血症[149]。CKD 5D期(5期且已透析)患者PTH水平应维持于正常上限的2~9倍。
对CKD 3~5期非透析患者,如PTH水平高于正常,建议首先积极控制高血磷、低血钙和维生素D缺乏等因素。对CKD 4~5期非透析患者,当发生严重且进展性甲状旁腺功能亢进时,可使用骨化三醇或其类似物[149]。近来研究显示帕立骨化醇对CKD非透析患者心血管事件无益,且增加高血钙风险[150- 151]。鉴于维生素D类似物缺乏随机对照研究证明其在CKD预后中的获益,且有增加高钙血症的风险,PTH水平轻中度升高可能是机体的适应性反应,故建议骨化三醇或其类似物主要用于CKD 4~5期并发重度进展性继发性甲状旁腺功能亢进者。
CKD 3~5D期患者使用活性维生素D或其类似物,建议从小剂量开始,如骨化三醇0.25 μg/d或阿法骨化醇0.25 μg/d或帕立骨化醇1.0 μg/d,并根据PTH、钙、磷水平调整剂量(增加或减少原剂量的25%~50%)。CKD 5D期患者,如PTH水平超过目标值或在目标范围内进行性升高,建议使用活性维生素D制剂,如骨化三醇0.25~0.5 μg/d或阿法骨化醇0.25~1.0 μg/d或帕立骨化醇1.0~2.0 μg/d。如使用活性维生素D并调整剂量后,PTH仍超过目标值,可间断使用较大剂量活性维生素D冲击治疗,如骨化三醇2.0~4.0 μg/次,每周2~3次,并根据PTH水平调整剂量。
使用活性维生素D制剂治疗前后应监测患者钙磷水平:CKD 3~5期非透析患者,使用活性维生素D制剂后每个月监测血钙磷水平连续3个月,以后每3个月1次;每3个月监测1次PTH水平。CKD 5D期初始或大剂量使用活性维生素D制剂者,建议第1个月每2周监测l次血钙、磷水平,以后每个月1次;全段PTH水平在开始3个月每个月监测1次,以后每3个月1次。如PTH水平低于正常上限的一半,或出现高钙、高磷血症时,建议活性维生素D制剂减量或停用。
活性维生素D与CKD-骨质疏松:CKD 3~5D期患者,容易并发骨质疏松,甚至骨质疏松性骨折,髋部、股骨颈和桡骨远端低骨密度可预测CKD 3~5D期患者的骨折风险[152- 153],故建议CKD患者重视骨密度测定,以帮助治疗决策。
并发骨质疏松和/或高骨折风险的CKD患者,可考虑使用骨化三醇或其类似物,但需结合CKD分期,并综合考虑血钙、磷和PTH水平:CKD 1~2期患者,可参照普通人群,给予钙剂联合骨化三醇或维生素D类似物;CKD 3~5期非透析患者,如PTH在正常范围,应参照骨代谢状态或骨活检结果,决定是否予活性维生素D;CKD 3~5期非透析患者,如果PTH进行性升高或高于正常值上限,建议使用活性维生素D;CKD 5D期患者,根据PTH水平,调整活性维生素D的剂量及给药方法,使PTH水平达到目标值。
7.6 维生素D类似物在皮肤疾病中的应用
人工合成的维生素D类似物卡泊三醇(calcipotriol)是一种选择性维生素D受体激动剂(vitamin D recep-tor agonist,VDRA),与VDR结合发挥一系列生物学效应,如控制炎性反应、调节免疫应答、抑制角质形成细胞过度增生、诱导表皮正常分化成熟等。其外用制剂被广泛应用于银屑病、鱼鳞病、掌跖角化病等皮肤病的治疗。卡泊三醇软膏一般用于头皮、面部、皮肤皱褶处以外部位的皮损,搽剂则主要用于头皮部位病灶。卡泊三醇治疗银屑病的使用方法是取软膏/搽剂少量涂于患处皮肤,早晚各一次。一般用药2周起效,6~8周疗效最佳,可使半数以上寻常型银屑病患者皮损完全消退或显著改善。若患者单用卡泊三醇搽剂,则每周用量应少于60 ml。当患者单用软膏,或同时使用软膏和搽剂时,每周卡泊三醇总量不应超过5 mg,按0.005%浓度计算,即100 g卡泊三醇软膏(1 ml卡泊三醇搽剂相当于1 g软膏)。
安全性方面,按照规范的方法,在合适的部位外用适当剂型、剂量的卡泊三醇不会导致高钙血症。一旦发生高钙血症,停药3 d后即可缓解[154]。并发肾功能不全、与环磷酰胺合用易导致高钙血症[155- 157],绝大多数成年患者,每周外用100 g以内的软膏或搽剂不会引起血钙升高。卡泊三醇禁用于高钙血症者。
有研究提出孕妇及哺乳期妇女外用该药应控制在3~4周、每周25~50 g以内[158]。儿童外用卡泊三醇的安全性目前尚未完全确定,故儿童外用卡泊三醇时应更为谨慎。老年患者使用剂量可参照成人水平。
8 维生素D的安全性
普通维生素D安全剂量范围宽,人群中极少会长期使用超过最大耐受剂量的维生素D,少有因普通维生素D摄入过量导致中毒的报道[17]。生理剂量补充普通维生素D导致高钙血症的风险非常小,不需常规监测血钙及尿钙。尿钙升高可能是监测维生素D过量较为敏感的指标,一般认为24 h尿钙大于7.5 mmol(300 mg)为高钙尿症[159]。尿钙受多种因素的影响,在服用维生素D的人群中,不能简单地认为尿钙升高就是维生素D中毒,典型的维生素D中毒通常表现为高血钙及其相关症状,如烦渴、多尿、呕吐、食欲下降、肾结石等[160- 162]。
通常可通过检测血清25OHD浓度判断是否存在维生素D中毒。尽管不同研究间差异很大,导致维生素D中毒的血25OHD水平常在224 μg/L(560 nmol/L)以上[163],其对应的维生素D补充剂量多超过每天30 000 IU,且应用时间较长[164]。对于健康人群,25OHD水平不宜超过150 μg/L(375 nmol/L),否则中毒风险增加。
过量补充维生素D可能导致尿钙升高,尿钙持续超过10 mmol/d(400 mg/d)可能增加肾结石和肾脏钙盐沉着的风险[165]。然而,由于普通维生素D的安全剂量范围很广,常规剂量补充普通维生素D一般不增加肾结石和肾钙盐沉着、进而损害肾功能的风险[161]。同时常规剂量补充维生素D也不增加心脑血管事件风险,甚至可能有保护作用[166- 167]。维生素D缺乏和过量都可能与血管钙化的发生相关。
活性维生素D及其类似物(骨化三醇、阿法骨化醇和帕立骨化醇等)导致高尿钙的风险明显高于普通维生素D,特别是联合补充钙剂时[168- 169]。活性维生素D剂量越大,发生高钙血症的风险越高。
活性维生素D的半衰期短,一旦发现用药期间出现高尿钙或高血钙,应立即减量或停药,特别需要注意同时减少钙剂和含钙食物的摄入,血钙水平多数能很快恢复[168]。对于需要长期使用活性维生素D治疗的患者,建议在启动治疗后的1、3及6个月分别监测尿钙磷及血钙磷水平,此后建议每年监测两次血钙磷、尿钙磷及肾功能,以确定长期治疗方案的安全性[170]。慢性肾功能不全需持续透析的患者,无法测定尿钙磷,使用活性维生素D期间需动态监测血PTH、血钙、血磷是否控制达标,并每年监测异位钙化情况,根据结果及时调整药物剂量[171- 172]。
综上所述,维生素D总体安全性好。使用常规剂量普通维生素D一般不需要监测血钙和尿钙;在长期使用活性维生素D、维生素D联合钙剂及其用于CKD患者时,则需要更加关注其安全性。
9 总结
维生素D及其类似物目前已广泛用于健康促进、疾病预防和治疗。充足日光照射是预防维生素D缺乏最安全、价廉和有效的手段。对不能充分日照或维生素D营养不足者可补充维生素D。维生素D是防治骨质疏松症的基本健康补充剂。活性维生素D及其类似物在临床上也常被用于佝偻病/骨软化症、骨质疏松症、甲旁减、CKD-MBD和皮肤疾病等。维生素D及其类似物的使用需要注意其安全性,监测血、尿钙水平,防止维生素D中毒。尽管维生素D对钙、磷代谢调节和骨骼以外的作用被不断发现,但其在糖尿病、肿瘤、免疫疾病和感染性疾病防治中所需的剂量和效果尚不确定。随着未来研究的深入,期待更多新型维生素D制剂和新的药物适应证被不断开发和应用。
《维生素D及其类似物临床应用共识》编写组名单
顾问:孟迅吾 徐 苓 廖二元 朱汉民 黄公怡
周学瀛 陶天遵
组长:夏维波
副组长:章振林 林 华 金小岚 余 卫 付 勤
秘书:李 梅 王 鸥 袁凌青
成员: (按姓氏笔画排序)
丁 悦 王 鸥 付 勤 宁志伟 邢小平
朱 梅 刘建民 刘跃华 李玉坤 李 梅
吴 文 余 卫 张克勤 陈德才 林 华
岳 华 金小岚 侯建明 姜 艳 袁凌青
袁群生 夏维波 盛志峰 章振林 董 进
程 群 谢忠建 裴 育
编写组作者单位
北京协和医院(孟迅吾、徐苓、周学瀛、夏维波、余卫、邢小平、刘跃华、李梅、袁群生、王鸥、姜艳);北京医院(黄公怡);中国人民解放军总医院(裴育);首都医科大学附属北京朝阳医院(宁志伟);上海交通大学附属第六人民医院( 章振林、岳华);复旦大学附属上海华东医院(朱汉民、程群);上海交通大学医学院附属瑞金医院(刘建民);上海同济大学附属同济医院(张克勤);南京大学医学院附属鼓楼医院(林华);成都军区总医院(金小岚);中国医科大学附属盛京医院(付勤);中南大学湘雅二医院(廖二元、谢忠建、袁凌青、盛志峰);福建省立医院(侯建明);天津医科大学总医院(朱梅);河北医科大学第三医院(李玉坤);广东省人民医院(吴文);中山大学孙逸仙纪念医院(丁悦);四川大学华西医院(陈德才);哈尔滨医科大学附属第二医院(陶天遵);山西医科大学第一医院(董进)
[1] 周学瀛,夏维波. 维生素D到底是什么?[J]. 中华骨质疏松和骨矿盐疾病杂志,2015,8:90- 92.
[2] Bikle D. Nonclassic actions of vitamin D[J]. J Clin Endocrinol Metab,2009, 94:26- 34.
[3] Holick MF. The Vitamin D solution: a 3-step strategy to cure our most common health problems[M]. New York:Plume,2011.
[4] Holick MF,Chen TC. Vitamin D deficiency: a worldwide problem with health consequences[J]. Am J Clin Nutr,2008,87:1080S-1086S.
[5] Chen J,Yun C,He Y,et al. Vitamin D status among the elderly Chinese population: a cross-sectional analysis of the 2010-2013 China National Nutrition and Health Survey (CNNHS) [J]. Nutr J,2017,16:3.
[6] Li M,Lv F,Zhang Z,et al. Establishment of a normal reference value of parathyroid hormone in a large healthy Chinese population and evaluation of its relation to bone turnover and bone mineral density[J]. Osteoporos Int,2016,27:1907- 1916.
[7] Holick MF. Vitamin D deficiency[J]. N Engl J Med,2007,357:266- 281.
[8] Haddad JG,Matsuoka LY,Hollis BW,et al. Human plasma transport of vitamin D after its endogenous synthesis[J]. J Clin Invest,1993,91:2552- 2555.
[9] DeLuca HF. Overview of general physiologic features and functions of vitamin D[J]. Am J Clin Nutr,2004,80:1689S- 1696S.
[10] Bikle DD,Gee E,Halloran B,et al. Assessment of the free fraction of 25-hydroxyvitamin D in serum and its regulation by albumin and the vitamin D-binding protein[J]. J Clin Endocrinol Metab,1986,63:954- 959.
[11] Christakos S,Dhawan P,Liu Y,et al. New insights into the mechanisms of vitamin D action[J]. J Cell Biochem,2003,88:695- 705.
[12] Eisman JA,Bouillon R. Vitamin D: direct effects of vitamin D metabolites on bone: lessons from genetic-ally modified mice[J]. Bonekey Rep,2014,3:499.
[13] Adams JS,Hewison M. Update in vitamin D[J]. J Clin Endocrinol Metab,2010,95:471- 478.
[14] Liu PT,Stenger S,Li H,et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response[J]. Science,2006,311:1770- 1773.
[15] Bouillon R,Bischoff-Ferrari H,Willett W. Vitamin D and health: perspectives from mice and man[J]. J Bone Miner Res,2008,23:974- 979.
[16] Xie Z,Munson SJ,Huang N,et al. The mechanism of 1,25-dihydroxyvitamin D(3) autoregulation in keratinocytes[J]. J Biol Chem,2002,277:36987- 36990.
[17] Holick MF,Binkley NC,Bischoff-Ferrari HA,et al. Evaluation,treatment,and prevention of vitamin D deficiency: an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab,2011,96: 1911- 1930.
[18] van Schoor N,Lips P. Global overview of vitamin D status[J]. Endocrinol Metab Clin North Am,2017,46:845- 870.
[19] Hu Y,Chen J,Wang R,et al. Vitamin D nutritional status and its related factors for Chinese Children and Adolescents in 2010-2012[J].Nutrients,2017,9: 1024.
[20] Ning Z,Song S,Miao L,et al. High prevalence of vitamin D deficiency in urban health checkup population[J]. Clin Nutr,2016 ,35:859- 863.
[21] Man PW,van der Meer IM,Lips P,et al. Vitamin D status and bone mineral density in the Chinese population: a review[J]. Arch Osteoporos,2016,11:14.
[22] Lu H,Zhang Z,Ke Y,et al. High prevalence of vitamin D insufficiency in China: relationship with the levels of parathyroid hormone and markers of bone turnover[J]. PLoS One 2012,7: e47264.
[23] Zhen D,Liu L,Guan C,et al. High prevalence of vitamin D deficiency among middle-aged and elderly individuals in northwestern China: its relationship to osteoporosis and lifestyle factors[J]. Bone,2015,71:1- 6.
[24] Vieth R,Ladak Y,Walfish PG. Age-related changes in the 25-hydroxyvitamin D versus parathyroid hormone relationship suggest a different reason why older adults require more vitamin D[J]. J Clin Endocrinol Metab,2003,88:185- 191.
[25] Touvier M,Deschasaux M,Montourcy M,et al. Determi-nants of vitamin D status in Caucasian adults: influ-ence of sun exposure,dietary intake,sociodemographic,lifestyle,anthropometric,and genetic factors[J]. J Invest Dermatol,2015,135:378- 388.
[26] Clemens TL,Adams JS,Henderson SL,et al.Increased skin pigment reduces the capacity of skin to synthesis vitamin D3[J]. Lancet,1982,1:74- 76.
[27] Grigalavicius M,Juzeniene A,Baturaite Z,et al. Biologi-cally efficient solar radiation: Vitamin D produc-tion and induction of cutaneous malignant melanoma[J]. Dermatoendocrinology,2013,5:150- 158.
[28] Holick MF,Chen TC,Lu Z,et al.Vitamin D and skin physiology: a D-lightful story[J]. J Bone Miner Res,2007,22:28- 33.
[29] Buyukuslu N,Esin K,Hizli H,et al.Clothing preference affects vitamin D status of young women[J]. Nutr Res,2014,34:688- 693.
[30] Tsur A,Metzger M,Dresner-Pollak R. Effect of different dress style on vitamin D level in healthy young Orthodox and ultra-Orthodox students in Israel[J].Osteoporos Int,2011,22:2895- 2898.
[31] Matsuoka LY,Ide L,Wortsman J,et al. Sunscreens supp-ress cutaneous vitamin D3synthesis[J]. J Clin Endocrinol Metab,1987,64:1165- 1168.
[32] Agarwal KS,Mughal MZ,Upadhyay P,et al. The impact of atmospheric pollution on vitamin D status of infants and toddlers in Delhi[J].India Arch Dis Child,2002,87:111- 113.
[33] Chen J,Yun C,He Y,et al. Vitamin D status among the elderly Chinese population: a cross-sec-tional analysis of the 2010-2013 China national nutrition and health survey (CNNHS)[J]. Nutr J,2017,16:3.
[34] Manicourt DH,Devogelaer JP. Urban tropospheric ozone increases the prevalence of vitamin D deficiency among Belgian postmenopausal women with outdoor activities during summer[J]. J Clin Endocrinol Metab, 2008,93:3893- 3899.
[35] Feizabad E,Hossein-Nezhad A,Maghbooli Z,et al. Impact of air pollution on vitamin D deficiency and bone health in adolescents[J]. Arch Osteoporos. 2017,12:34.
[36] Hosseinpanah F,Pour SH,Heibatollahi M,et al.The effects of air pollution on vitamin D status in healthy women: a cross sectional study[J]. BMC Public Health,2010,10:519.
[37] Kelishadi R,Moeini R,Poursafa P,et al. In-dependent association between air pollutants and vitamin D deficiency in young children in Isfahan,Iran[J]. Paediatr Int Child Health,2014,34:50- 55.
[38] Baïz N,Dargent-Molina P,Wark JD,et al. Gestational exposure to urban air pollution related to a decrease in cord blood vitamin d levels[J]. J Clin Endocrinol Metab,2012,97:4087- 4095.
[39] Leary PF,Zamfirova I,Au J,et al. Effect of Latitude on Vitamin D Levels[J]. J Am Osteopath Assoc,2017,117:433- 439.
[40] Leung C,Warner J,Harris M,et al. Symptomatic Hypocalcemia Secondary to Rifampicin-induced Hypovitaminosis D[J]. Pediatr Infect Dis J, 2016,35:822- 823.
[41] Hunter D,De Lange M,Snieder H,et al. Genetic contribution to bone metabolism,calcium excretion,and vitamin D and parathyroid hormone regulation[J]. J Bone Miner Res,2001,16:371- 378.
[42] Shea MK,Benjamin EJ,Dupuis J,et al. Genetic and non-genetic correlates of vitamins K and D[J]. Eur J Clin Nutr,2009,63:458- 464.
[43] Wjst M,Altmüller J,Braig C,et al. A genome-wide linkage scan for 25-OH-D(3) and 1,25-(OH)2-D3serum levels in asthma families[J]. J Steroid Biochem Mol Biol,2007,103:799- 802.
[44] Wang TJ,Zhang F,Richards JB,et al. Common genetic determinants of vitamin D insufficiency: a genome-wide association study[J]. Lancet,2010,376:180- 188.
[45] Nissen J,Vogel U,Ravn-Haren G,et al.Common variants in CYP2R1 and GC genes are both determinants of serum 25-hydroxyvitamin D concentrations after UVB irradiation and after consumption of vitamin D3-fortified bread and milk during winter in Denmark[J]. Am J Clin Nutr,2015,101:218- 227.
[47] Zhang Z,He JW,Fu WZ,et al. An analysis of the association between the vitamin D pathway and serum 25-hydroxyvitamin D levels in a healthy Chinese population[J]. J Bone Miner Res,2013,28:1784- 1792.
[48] Li SS,Gao LH,Zhang XY,et al. Genetically low vitamin d levels,bone mineral density,and bone metabolism markers: a Mendelian Randomisation study[J]. Sci Rep,2016,6:33202.
[49] Thacher TD,Fischer PR,Pettifor JM. Rickets: vitamin D and calcium deficiency[J]. J Bone Miner Res,2007,22:638.
[50] Shaw NJ,Mughal MZ. Vitamin D and child health Part 1 (skeletal aspects)[J]. Arch Dis Child,2013,98:363- 367.
[51] 孟迅吾. 骨软化症和佝偻病[M]//史轶蘩. 协和内分泌代谢学. 北京: 科学出版社,1999:1529- 1542.
[52] Lieben L,Masuyama R,Torrekens S,et al. Normocalcemia is maintained in mice under conditions of calcium malabsorption by vitamin D-induced inhibition of bone mineralization[J]. J Clin Invest, 2012,122:1803- 1815.
[53] Tiosano D,Hochberg Z. Hypophosphatemia: the common denominator of all rickets[J]. J Bone Miner Metab, 2009,27:392- 401.
[54] Kim CJ,Kaplan LE,Perwad F,et al. Vitamin D 1alphahy-droxylase gene mutations in patients with 1alpha-hydroxylase deficiency[J]. J Clin Endocrinol Metab, 2007,92:3177- 3182.
[55] Cui N,Xia W,Su H,et al. Novel mutations of CYP27B1 gene lead to reduced activity of 1α-hydroxylase in Chinese patients[J]. Bone, 2012, 51:563- 569.
[56] Thacher TD,Fischer PR,Singh RJ,et al. CYP2R1 Mutations Impair Generation of 25-hydroxyvitamin D and Cause an Atypical Form of Vitamin D Deficiency[J]. J Clin Endocrinol Metab, 2015,100:E1005-E1013.
[57] Pang Q,Qi X,Jiang Y,et al. Clinical and genetic findings in a Chinese family with VDR-associated hereditary vitamin D-resistant rickets[J]. Bone Res, 2016, 4:16018.
[58] Huang XL,Jiang Y,Xia WB. FGF23 and Phosphate Wasting Disorders[J]. Bone Res, 2013, 2: 120- 132.
[59] Jiang Y,Xia WB,Xing XP,et al. Tumor-induced osteomalacia: an important cause of adult-onset hypophosphatemic osteomalacia in China: Report of 39 cases and review of the literature[J]. J Bone Miner Res,2012,27: 1967- 1975.
[60] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊疗指南[J].中华骨质疏松和骨矿盐疾病杂志,2017,10:413- 444.
[61] WHO. Facts about ageing[EB/OL].[2018- 02- 04].http://www.who.int/ageing/about/facts/en/indexhtml.
[62] Chen W,Simpson JM,March LM,et al. Co-morbidities only account for a small proportion of excess mortality after fracture: a record linkage study of individual fracture types[J]. J Bone Miner Res, 2018. doi: 10.1002/jbmr.3374. [Epub ahead of print].
[63] Cruz-Jentoft AJ,Baeyens JP,Bauer JM,et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on sarcopenia in older people[J]. Age Ageing,2010,39:412- 423.
[64] Haussler MR,Whitfield GK,Kaneko I,et al. Molecular mechanisms of vitamin D action[J].Calcif Tissue Int,2013,92:77- 98.
[65] Olsson K,Saini A,Strömberg A,et al. Evidence for vitamin D receptor expression and direct effects of 1α,25(OH)2D3in human skeletal muscle precursor cells[J]. Endocrinology,2016,157:98- 111.
[66] Kotlarczyk MP,Perera S,Ferchak MA,et al. Vitamin Ddeficiencyis associated with functional decline and falls in frail elderly women despite supplementation[J]. Osteoporos Int,2017,28:1347- 1353.
[67] Weaver CM,Gordon CM,Janz KF,et al. The National Osteoporosis Foundation’s position statement on peak bone mass development and lifestyle factors: a systematic review and implementation recommendations[J].Osteoporos Int, 2016 ,27:1281- 1386.
[68] Seamans KM,Hill TR,Scully L,et al. Vitamin d status and indices of bone turnover in older European adults[J].Int J Vitam Nutr Res,2011,81:277- 285.
[69] Kruger MC,Kruger IM,Wentzel-Viljoen E,et al. Urbanization of black South African women may increase risk of low bone mass due to low vitamin D status,low calcium intake,and high bone turnover[J].Nutr Res,2011,31:748- 758.
[70] Ebeling PR. Vitamin D and bone health: epidemiologic studies[J]. Bonekey Rep,2014,3:511.
[71] Reid IR,Bolland MJ,Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis[J]. Lancet,2014, 11,383:146- 155.
[72] Dawson-Hughes B,Mithal A,Bonjour JP,et al. IOF position statement: vitamin D recommendations for older adults[J]. Osteoporos Int,2010,21:1151- 1154.
[73] Bischoff-Ferrari HA,Dawson-Hughes B,Willett WC,et al. Effect of Vitamin D on falls: a meta-analysis[J]. JAMA,2004,291:1999- 2006.
[74] Bischoff-Ferrari HA,Dawson-Hughes B,Staehelin HB,et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of rando-mised controlled trials[J]. BMJ, 2009,339:b3692.
[75] Chung M,Lee J,Terasawa T,et al. Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the U.S. Preventive Services Task Force[J]. Ann Intern Med, 2011,155:827- 838.
[76] Bischoff-Ferrari HA,Orav EJ,Dawson-Hughes B. Effect of cholecalciferol plus calcium on falling in ambulatory older men and women: a 3-year randomized controlled trial[J]. Arch Intern Med, 2006,166:424-430.
[77] O’Donnell S,Moher D,Thomas K,et al. Systematic review of the benefits and harms of calcitriol and alfacalcidol for fractures and falls[J].J Bone Miner Metab, 2008,26:531- 542.
[78] Liao RX,Yu M,Jiang Y,et al. Management of osteoporo-sis with calcitriol in elderly Chinese patients: a systematic review[J].Clin Interv Aging, 2014,28,9:515- 526.
[79] Zhang ZL,Liao EY,Xia WB,et al. Alendronate sodium/vitamin D3combination tablet versus calcitriol for osteoporosis in Chinesepostmenopausal women: a 6-month,randomized,open-label,active-comparator-controlled study with a 6-month extension[J].Osteoporos Int,2015,26:2365- 2374.
[80] Pittas AG,Sun Q,Manson JE,et al. Plasma 25-hydroxyvitamin D concentration and risk of incident type 2 diabetes in women[J]. Diabetes Care,2010,33:2021- 2023.
[81] Forouhi NG,Ye Z,Rickard AP,et al. Circulating 25-hydroxyvitamin D concentration and the risk of type 2 diabetes: results from the European Prospective Investigation into Cancer (EPIC)-Norfolk cohort and updated meta-analysis of prospective studies[J]. Diabetologia,2012,55:2173- 2182.
[82] Takiishi T,Gysemans C,Bouillon R,et al. Vitamin D and diabetes[J]. Rheum Dis Clin North Am,2012,38:179- 206.
[83] Palomer X,Gonzalez-Clemente JM,Blanco-Vaca F,et al. Role of vitamin D in the pathogenesis of type 2 diabetes mellitus[J]. Diabetes Obes Metab,2008,10:185- 197.
[84] Flores M. A role of vitamin D in low-intensity chronic inflammation and insulin resistance in type 2 diabetes mellitus? [J]. Nutr Res Rev,2005,18:175- 182.
[85] Martini LA,Wood RJ. Vitamin D status and the metabolic syndrome[J]. Nutr Rev,2006,64:479- 486.
[86] Mirhosseini N,Vatanparast H,Mazidi M,et al. The effect of improved serum 25-hydroxyvitamin D status on glycemic control in diabetic patients: A meta-analysis[J]. J Clin Endocrinol Metab, 2017,102:3097- 3110.
[87] Gagnon C,Lu ZX,Magliano DJ,et al. Serum 25-hydroxyvitamin D,calcium intake,and risk of type 2 diabetes after 5 years: results from a national,population-based prospective study (the Australian Diabetes,Obesity and Lifestyle study) [J]. Diabetes Care,2011,34:1133- 1138.
[88] Mitri J,Muraru MD,Pittas AG. Vitamin D and type 2 diabetes: a systematic review[J]. Eur J Clin Nutr,2011,65:1005- 1015.
[89] Luo BA,Gao F,Qin LL. The association between Vitamin D deficiency and diabetic retinopathy in type 2 diabetes: A meta-analysis of observational studies[J]. Nutrients,2017,20 : 307.
[90] de Boer IH,Tinker LF,Connelly S,et al. Women’s Health Initiative Investigators. Calcium plus vitamin D supplementa-tion and the risk of incident diabetes in the Women’s Health Initiative[J]. Diabetes Care,2008,31:701- 707.
[91] Davidson MB,Duran P,Lee ML,et al. High-dose vitamin D supplementation in people with prediabetes and hypovitaminosis D[J]. Diabetes Care,2013,36:260- 266.
[92] Jorde R,Sollid ST,Svartberg J,et al. Vitamin D 20,000 IU per week for five years does not prevent progression from prediabetes to diabetes[J]. J Clin Endocrinol Metab,2016,101:1647- 1655.
[93] Zostautiene I,Jorde R,Schirmer H,et al. Genetic variations in the vitamin D receptor predict type 2 diabetes and myocardial infarction in a community-based population: The Troms Study[J]. PLoS One,2015,10:e0145359.
[94] Li L,Wu B,Liu JY,et al. Vitamin D receptor gene polymorphisms and type 2 diabetes: a meta-analysis[J]. Archives Med Res,2013,44:235- 241.
[95] Pilz S,Kienreich K,Rutters F,et al. Role of vitamin D in the development of insulin resistance and type 2 diabetes[J]. Curr Diab Rep,2013,13:261- 270.
[96] Norman AW. Minireview: vitamin D receptor: new assignments for an already busy receptor[J]. Endocrinology,2006,147:5542- 5548.
[97] Maestro B,Campion J,Dvila N,et al. Stimulation by 1,25-dihydroxyvitamin D3of insulin receptor expression and insulin responsiveness for glucose transport in U-937 human promonocytic cells[J]. Endocr J,2000,47:383- 391.
[98] Pittas AG,Lau J,Hu FB,Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes.A systematic review and meta-analysis[J]. J Clin Endocrinol Metab,2007,92:2017- 2029.
[99] Sisley SR,Arble DM,Chambers AP,et al. Hypothalamic vitamin D improves glucose homeostasis and reduces weight[J]. Diabetes,2016,65:2732- 2741.
[100] Chen S,Glenn DJ,Ni W,et al. Expression of the vitamin D receptor is increased in the hypertrophic heart [J]. Hypertension,2008,52: 1106- 1112.
[101] Zanetti M,Harris SS,Dawson-Hughes B. Ability of vitamin D to reduce inflammation in adults without acute illness [J]. Nutr Rev,2014,72: 95- 98.
[102] Hansen D,Rasmussen K,Rasmussen LM,et al. The influence of vitamin D analogs on calcification modulators,N-terminal pro-B-type natriuretic peptide and inflammatory markers in hemodialysis patients: a randomized crossover study [J]. BMC Nephrol,2014,15: 130.
[103] Norman PE,Powell JT. Vitamin D and cardiova-scular disease [J]. Circ Res,2014,114: 379- 393.
[104] Adami S,Viapiana O,Gatti D,et al.Relationship between serum parathyroid hormone,vitamin D sufficiency,age,and calcium intake [J]. Bone,2008,42: 267- 270.
[105] Cho HJ,Kang HC,Choi SA,et al.The possible role of Ca2+on the activation of microsomal triglyceride transfer protein in rat hepatocytes [J]. Bio Pharm Bull,2005,28: 1418- 1423.
[106] Giovinazzo S,Alibrandi A,Campenni A,et al. Correlation of cardio-metabolic parameters with vitamin D status in healthy premenopausal women [J]. J Endocrinol Invest,2017,40:1337- 1343.
[107] Hao Y,Ma X,Luo Y,et al. Additional role of serum 25-hydroxyvitamin D3levels in atherosclerosis in Chinese middle-aged and elderly men[J]. Clin Exp Pharmacol Physiol,2014,41: 174- 179.
[108] Milazzo V,Metrio MD,Cosentino N,et al. Vitamin D and acute myocardial infarction [J]. World J Cardiol,2017,9: 14- 20.
[109] Gotsman I,Shauer A,Zwas DR,et al. Vitamin D deficiency is a predictor of reduced survival in patients with heart failure,vitamin D supplementation improves outcome [J]. Eur J Heart Fail,2012,14: 357- 366.
[110] Afshari L,Amani R,Soltani F,et al. The relation between serum Vitamin D levels and body antioxidant status in ischemic stroke patients: a case- control study [J]. Adv Biomed Res,2015,4: 213.
[111] Anderson JL,May HT,Horne BD,et al. Relation of vitamin D deficiency to cardiovascular risk factors,disease status,and incident events in a general healthcare popula-tion [J]. Am J Cardiol,2010,106: 963- 968.
[112] Pérez-Hernndez N,Aptilon-Duque G,Nostroza-Hernndez MC,et al. Vitamin D and its effects on cardiovascular diseases: a comprehensive review [J]. Korean J Intern Med,2016,31: 1018- 1029.
[113] Schleithoff SS,Zittermann A,Tenderich G,et al. Vitamin D supplementation improves cytokine profiles in patients with congestive heart failure: a double-blind,randomized,placebo-controlled trial [J]. Am J Clin Nutr,2006,83: 754- 759.
[114] Endo I,Inoue D,Mitsui T,et al. Deletion of vitamin D receptor gene in mice results in abnormal skeletal muscle development with deregulated expres-sion of myoregulatory transcription factors [J]. Endocrinology,2003,144: 5138- 5144.
[115] Srikuea R,Zhang X,Park-Sarge OK,et al. VDR and CYP27B1 are expressed in C2C12 cells and regenerating skeletal muscle: potential role in suppression of myoblast proliferation [J]. Am J Physiol Cell Physiol,2012,303: C396-C405.
[116] Ryan ZC,Craig TA,Folmes CD,et al. 1Alpha,25-Dihydroxyvitamin D3regulates mitochondrial oxygen consump-tion and dynamics in human skeletal muscle cells[J]. J Biol Chem,2016,291: 1514- 1528.
[117] 曾琴,谢忠建. 维生素D与骨骼肌[J]. 中华骨质疏松和骨矿盐疾病杂志,2016,9: 103- 109.
[118] Wang Y,DeLuca HF. Is the vitamin D receptor found in muscle? [J]. Endocrinology,2011,152:354- 363.
[119] Priemel M,von Domarus C,Klatte TO,et al. Bone mineralization defects and vitamin D deficiency: histomorpho-metric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients[J]. J Bone Miner Res,2010,25: 305- 312.
[120] Rosen CJ,Adams JS,Bikle DD,et al. The Nonskeletal Effects of Vitamin D: An Endocrine Society Scientific Statement[J]. Endocrine Rev,2012,33: 456- 492.
[121] Visser M,Deeg DJ,Lips P,et al. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia): the Longitudinal Aging Study Amsterdam[J]. J Clin Endocrinol Metab,2003,88: 5766- 5772.
[122] Murad MH,Elamin KB,Abu Elnour NO,et al. The effect of vitamin D on falls.A systematic review and meta-analysis[J]. J Clin Endocrinol Metab,2011,96: 2997- 3006.
[123] Mathieu C,Waer M,Laureys J,et al. Prevention of autoimmune diabetes in NOD mice by 1,25 dihydroxyvitamin D3[J]. Diabetologia,1994,37:552- 558.
[124] Koduah P,Paul F,Dör JM. Vitamin D in the prevention,prediction and treatment of neurodegenerative and neuroinflammatory diseases[J]. EPMA J,2017,8:313- 325.
[125] Rolf L,Muris AH,Hupperts R,et al. Illuminating vitamin D effects on B-cells-the multiple sclerosis perspective[J]. Immunology,2016, 147:275- 284.
[126] Hyppönen E,Läärä E,Reunanen A,et al. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study[J]. Lancet,2001,358:1500- 1503.
[127] Sakthiswary R,Raymond AA. The clinical signifi-cance of vitamin D in systemic lupus erythematosus: a systematic review[J].PLoS One,2013,8:e55275.
[128] Meeker S,Seamons A,Maggio-Price L,et al. Protective links between vitamin D,infiammatory bowel disease and colon cancer[J].World J Gastro-enterol,2016,22: 933- 948
[129] Dou R,Ng K,Giovannucci EL,et al. Vitamin D and Colorectal Cancer: Molecular,Epidemiological,and Clinical Evidence[J].Br J Nutr,2016 ,115: 1643- 1660.
[130] Song M,Nishihara R,Wang M,et al. Plasma 25-hydroxyvitamin D and colorectal cancer risk according to tumour immunity status[J].Gut,2016,65: 296- 304.
[131] Holick MF. High prevalence of vitamin D inadequacy and implications for health[J]. Mayo Clin Proc,2006,81:353- 373.
[132] Moan J,Porojnicu AC,Dahlback A,et al. Addressing the health benefits and risks,involving vitaminDor skin cancer,of increased sun exposure[J]. Proc Natl Acad Sci USA,2008,105:668- 673
[133] Holick MF,Biancuzzo RM,Chen TC,et al. Vitamin D2is as effective as vitaminD3in maintaining circulating concentrations of 25-hydroxyvitamin D[J]. J Clin Endocrinol Metab,2008,93:677- 681.
[134] Holick MF. Sunlight “D” ilemma: risk of skin cancer or bone disease and muscle weakness[J]. Lancet,2001,357:4- 6.
[135] Carpenter TO,Imel EA,Holm IA,et al. A clinician’s guide to X-linked hypophosphatemia[J]. J Bone Miner Res,2011,26: 1381- 1388.
[136] 史轶蘩. 协和内分泌代谢学[M].北京:科学出版社,1999:1478- 1486.
[137] Bollerslev J,Rejnmark L,Marcocci C,et al. European society of endocrinology clinical guideline: treatment of chronic hypoparathyroidism in adults[J]. Eur J Endocrinol,2015,173:1- 20.
[138] Brandi ML,Bilezikian JP,Shoback D,et al. Management of hypoparathyroidism: summary statement and guidelines[J]. J Clin Endocrinol Metab,2016,101: 2273- 2283.
[139] Sikjaer T,Rejnmark L,Thomsen JS,et al. Changes in 3-dimensional bone structure indices in hypoparathyroid patients treated with PTH(1- 84): a randomized controlled study[J]. J Bone Miner Res,2012,27:781- 788.
[140] Kruger MC,Chan YM,Lau LT,et al. Calcium and vitamin D fortified milk reduces bone turnover and improves bone density in postmenopausal women over 1 year[J]. Eur J Nutr,2017. doi: 10.1007/s00394- 017- 1544- 6.[Epub ahead of print].
[141] Laiz A,Malouf J,Marin A,et al. Impact of 3-monthly vitamin D supplementation plus exercise on survival after surgery for osteoporotic hip fracture in adult patients over 50 years: a pragmatic randomi-zed,partially blinded,controlled trial[J]. J Nutr Health Aging, 2017,21:413- 420.
[142] IOM.IOM dietary reference ranges for calcium and vitamin D[EB/OL].(2012- 02- 13). http://www. iom.edu/Reports/2010/DietaryReference-Intakes-for-Calcium-and-Vitamin-D.aspx.
[143] Sanders KM,Stuart AL,Williamson EJ,et al.Annual high-dose oral vitamin D and falls and fractures in older women. A randomized controlled trial[J]. JAMA,2010,303:1815- 1822.
[144] Bleicher K,Cumming RG,Naganathan V,et al. U-shaped association between serum 25-hydroxyvitamin D and fracture risk in older men: results from the prospective population-based CHAMP study[J]. J Bone Miner Res,2014,29:2024- 2031.
[145] Cianferotti L,Cricelli C,Kanis JA,et al.The clinical use of vitamin D metabolites and their potential developments: a position statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the Intern-ational Osteoporosis Foundation (IOF)[J]. Endocrine,2015,50:12- 26.
[146] Matsumoto T,Ito M,Hayashi Y,et al. A new active vitamin D3analog,eldecalcitol,prevents the risk of osteopo-rotic fractures-a randomized,active comparator,double-blind study[J]. Bone,2011,49:605- 612.
[147] Hagino H,Takano T,Fukunaga M,et al. Eldecalcitol reduces the risk of severe vertebral fractures and improves the health-related quality of life in patients with osteoporosis[J]. J Bone Miner Metab, 2013,31:183- 189.
[148] EVOLVE Trial Investigators,Chertow GM,Block GA,et al. Effect of cinacalcet on cardiovascular disease in patients undergoing dialysis[J]. N Engl J Med,2012,367: 2482- 2494.
[149] Kidney disease: improving global outcomes (KDIGO) CKD-MBD update work group. KDIGO 2017 clinical practice guideline update for the diagnosis,evalua-tion,prevention,and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD)[J]. Kidney Int Suppl,2017,7: 1- 59.
[150] Thadhani R,Appelbaum E,Pritchett Y,et al. Vitamin D therapy and cardiac structure and function in patients with chronic kidney disease: the PRIMO randomized controlled trial[J]. JAMA,2012,307: 674- 684.
[151] Li XH,Feng L,Yang ZH,et al. The effect of active vitamin d on cardiovascular outcomes in predialysis chronic kidney diseases: a systematic review and meta-analysis[J]. Nephrology (Carlton),2015,20: 706- 714.
[152] Iimori S,Mori Y,Akita W,et al. Diagnostic usefulness of bone mineral density and biochemical markers of bone turnover in predicting fracture in CKD stage 5D patients — a single-center cohort study[J]. Nephrol Dial Transplant,2012,27: 345- 351.
[153] West SL,Lok CE,Langsetmo L,et al. Bone mineral density predicts fractures in chronic kidney disease[J]. J Bone Miner Res,2015,30: 913- 919.
[154] Bleiker TO,Bourke JF,Mumford R,et al. Long-term outcome of severe chronic plaque psoriasis following treatment with high-dose topical calcipotriol[J]. Br J Dermatol,1998,139:285- 286.
[155] Hardman KA,Heath DA,Nelson HM. Hypercalcaemia associated with calcipotriol (Dovonex) treatment[J]. BMJ,1993,306:896- 896.
[156] Russell S,Young MJ. Hypercalcaemia during treatment of psoriasis with calcipotripl[J]. Br J Dermatol,1994,130:795.
[157] Kawahara C,Okada Y,Tanikawa T,et al. Severe hypercalcemia and hypernatremia associated with calcipotriol for treatment of psoriasis[J]. J Bone Mineral Metab,2004,22:159- 162.
[158] Rademaker M,Agnew K,Andrews M,et al. Psoriasis in those planning a family,pregnant or breast-feeding. The Australasian Psoriasis Collaboration[J]. Australasian J Dermatol,2017. doi: 10.1111/ajd.12641. [Epub ahead of print].
[159] Gallagher JC,Smith LM,Yalamanchili V. Incidence of hypercalciuria and hypercalcemia during vitamin D and calcium Supplementation in older women[J]. Menopause,2014,21: 1173- 1180.
[160] Vogiatzi MG,Jacobson-Dickman E,DeBoer MD. Drugs,and therapeutics committee of the pediatric endocrine society. Vitamin D supplementation and risk of toxicity in pediatrics: A review of current literature[J]. J Clin Endocrinol Metab,2014,99: 1132- 1141.
[161] Kara C,Gunindi F,Ustyol A,et al. Vitamin D intoxication due to an erroneously manufactured dietary supplement in seven children[J]. Pediatrics,2014,133: e240-e244.
[162] Hawkes CP,Schnellbacher S,Singh RJ,et al. 25-hydroxyvitamin D can interfere with a common assay for 1,25-dihydroxyvitamin D in vitamin D intoxication[J]. J Clin Endocrinol Metab,2015,100: 2883- 2889.
[163] Hathcock JN,Shao A,Vieth R,et al. Risk assessment for vitamin D[J]. Am J Clin Nutr,2007,85: 6- 18.
[164] Tripkovic L,Lambert H,Hart K,et al. Comparison of vitamin D2and vitamin D3supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis[J]. Am J ClinNutr,2012,95:1357- 1364.
[165] Wilhelm SM,Wang TS,Ruan DT,et al. The American Association of Endocrine Surgeons Guide-lines for Definitive Management of Primary Hyperparathyroidism[J]. JAMA Surg,2016,151: 959- 968.
[166] Zittermann A. The biphasic effect of Vitamin D on the musculoskeletal and cardiovascular system[J]. Int J Endocrinol,2017,2017:3206240.
[167] Al Mheid I,Patel RS,Tangpricha V,et al. Vitamin D and cardiovascular disease: is the evidence solid?[J]. Eur Heart J,2013,34: 3691- 3698.
[168] Tebben PJ,Singh RJ,Kumar R. Vitamin D-mediated hypercalcemia: mechanisms,diagnosis,and treat-ment[J]. Endocr Rev,2016,37: 521- 547.
[169] Trillini M,Cortinovis M,Ruggenenti P,et al. Paricalcitol for secondary hyperparathyroidism in renal transplantation[J]. J Am Soc Nephrol,2015,26: 1205- 1214.
[170] Shoback D. Hypoparathyroidism[J]. N Engl J Med,2008,359:391- 403.
[171] Stein EM,Shane E. Vitamin D in organ trans-plantation[J]. Osteoporos Int,2011,22: 2107- 2118.
[172] Melamed ML,Thadhani RI. Vitamin D therapy in chronic kidney disease and end stage renal disease[J]. Clin J Am Soc Nephrol, 2012,7: 358- 365.
