恩替卡韦联合百令胶囊治疗慢性乙型肝炎患者疗效初步研究
2018-03-28杨莎莎周利
杨莎莎,周利
研究表明,恩替卡韦口服吸收后对HBV DNA的合成具有竞争性抑制作用,可直接掺入到HBV DNA链中,阻断病毒基因的合成,是目前一线抗HBV药[1-4]。糖尿病肾病、高血压、蛇虫咬伤、中药等均可能引起肾功能损害(renal damage,RD),恩替卡韦主要由肾脏排泄,在有肾功能损伤及老年肾功能下降患者,应用恩替卡韦可能发生肾毒性反应[5,6]。中药制剂百令胶囊在临床上常用于肝硬化、肝炎及肾脏疾病的辅助治疗,可清除自由基,抑制脂质过氧化反应,减轻肝肾功能的损害[7,8]。我们采用恩替卡韦联合百令胶囊治疗CHB伴RD患者,取得了肯定的效果,现就治疗结果报道如下
1 资料与方法
1.1 一般资料 2014年7月~2016年7月十堰市太和医院肝病中心收治的CHB患者254例,男性130例,女性124例;年龄在18~65岁,平均年龄(46.17±7.83)岁。诊断符合文献报道的标准[7]。纳入患者血清HBeAg阳性,HBV DNA≥1×105IU/mL,血清ALT持续或反复异常超过半年。采用随机、对照、盲法原则将254例患者分为A组和B组,每组127例。两组年龄、性别、病程等临床资料比较无统计学差异(P>0.05),具有可比性。患者给出知情同意书。
1.2 治疗方法 给予A组患者恩替卡韦(江苏正大天晴药业股份有限公司,批号:H20140325)0.5 mg口服,1次/d;B组在A组治疗的基础上加用百令胶囊(杭州中美华东制药有限公司,批号:20140301807 32)4粒口服,3次/d。两组均观察48 w。
1.3 检测 使用雅培全自动生化分析仪检测肾功能(sCr、Cys C 和 BUN)和肝功能[ALT、LDH 、AST、腺苷脱氨酶(ADA),北京首医生物科技有限公司];采用雅培化学发光法检测血清 HBV标记物(雅培公司);采用荧光定量 PCR法检测血清HBV DNA载量(深圳匹基生物工程公司);采用ELISA法检测血清肌酸磷酸激酶(CPK)、丙二醛(MDA)、还原型谷胱甘肽(GSH)和超氧化物歧化酶(SOD,上海科华生物技术公司);使用LC8000高效液相色谱仪检测细胞色 素 P450 亚 型 酶 CYPIA2、CYP2C9、CYP2D6、CYP2E1和CYP3A4活性(上海天普分析仪器有限公司)[10-12]。
1.4 统计学方法 应用SPSS 19.0统计分析软件对治疗前及治疗24 w和48 w检测数据进行分析,计量资料以(±s)表示,采用t检验,两组间率的比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组肝功能指标变化的比较 在治疗24 w和48 w时,B组血清ALT、LDH 、AST、ADA水平显著降低,与A组比,差异显著(P<0.05,表1)。
2.2 两组血清学和病毒学指标变化 在治疗24 w和48 w时,两组血清HBV DNA载量无显著性差异(P>0.05),B组血清HBsAg和HBeAg滴度显著降低,与 A 组比,差异显著(P<0.05,表2)。
表1 两组肝功能指标(±s)比较
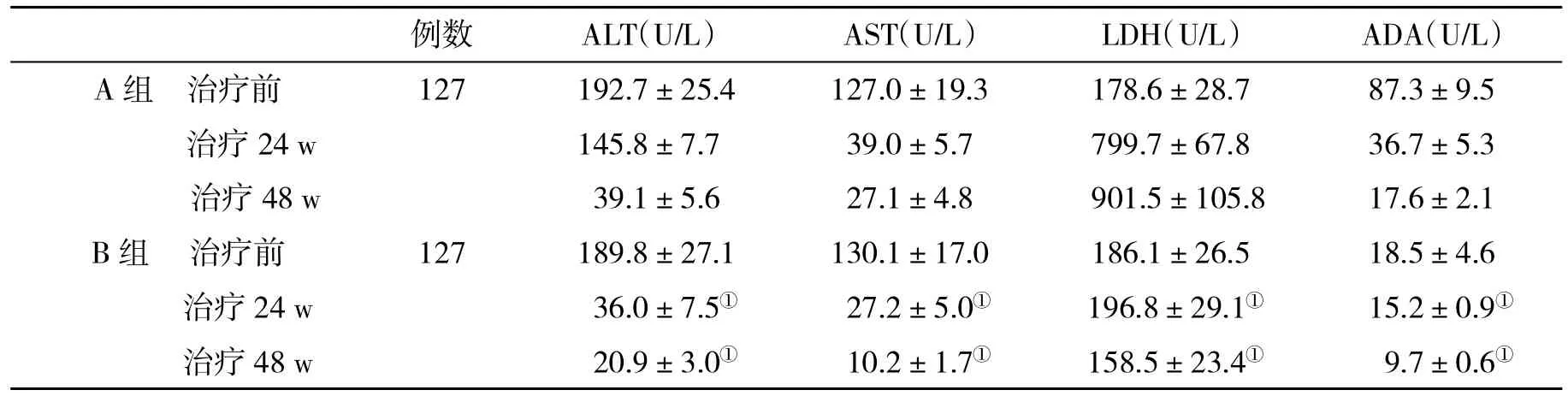
表1 两组肝功能指标(±s)比较
与A组比,①P<0.05
例数 ALT(U/L) AST(U/L) LDH(U/L) ADA(U/L)A组 治疗前 127 192.7±25.4 127.0±19.3 178.6±28.7 87.3±9.5治疗 24 w 145.8±7.7 39.0±5.7 799.7±67.8 36.7±5.3治疗 48 w 39.1±5.6 27.1±4.8 901.5±105.8 17.6±2.1 B组 治疗前 127 189.8±27.1 130.1±17.0 186.1±26.5 18.5±4.6治疗24 w 36.0±7.5① 27.2±5.0① 196.8±29.1① 15.2±0.9①治疗48 w 20.9±3.0① 10.2±1.7① 158.5±23.4① 9.7±0.6①
表2 两组血清 HBV 标志物和HBV DNA水平(±s)比较

表2 两组血清 HBV 标志物和HBV DNA水平(±s)比较
与A组比,①P<0.05
例数 HBV DNA(lg copies/mL) HBsAg(lg IU/mL) HBeAg(lg PEIU/L)A组 治疗前 127 7.2±0.6 3.9±0.6 2.2±0.3治疗24 w 5.5±0.5 3.7±0.4 1.8±0.2治疗48 w 3.8±0.3 3.6±0.5 1.6±0.3 B组 治疗前 127 7.1±0.8 3.8±0.5 2.2±0.3治疗 24 w 5.4±0.4 3.3±0.4① 1.6±0.2①治疗 48 w 3.6±0.5 3.2±0.3① 1.4±0.1①
2.3 两组肾功能的变化 在治疗24 w和48 w时,B组血清sCr、Cys C和BUN水平显著降低,与A组比,差异显著(P<0.05,表3)。
2.4 两组肝细胞色素P450亚型酶的变化 在治疗24 w 和 48 w 时,B 组 CYP2E1、CYP2C9、CYPIA2等显著降低,与A组比,差异显著(P<0.05,表4)。
2.5 两组血清氧化应激指标的变化 在治疗24 w和48 w时,B组CPK和MDA显著降低,SOD和GSH显著升高,与A组比,差异显著(P<0.05,表5)。
表3 两组肾功能(±s)比较

表3 两组肾功能(±s)比较
与A组比,①P<0.05
例数sCr(μmol/L)BUN(mmol/L)Cys C(mg/L)A组 治疗前 127 140.7±16.2 10.1±1.5 4.1±0.5治疗24 w 135.2±14.4 15.4±4.3 53.1±6.0治疗48 w 129.5±17.6 17.75±5.2 27.5±4.3 B组 治疗前 127 139.3±15.9 11.9±2.1 4.2±0.5治疗24 w 106.4±17.5① 5.8±0.7① 1.9±0.2①治疗48 w 75.1±9.9① 2.7±0.5① 1.0±0.1①
表4 两组肝细胞色素P450亚型酶(μmol/L,±s)比较

表4 两组肝细胞色素P450亚型酶(μmol/L,±s)比较
与A组比,①P<0.05
例数 CYP2E1 CYP2C9 CYPIA2 A组 治疗前 127 1.7±0.3 1.7±0.2 1.8±0.2治疗24 w 2.2±0.2 3.4±0.5 3.5±0.4治疗48 w 2.5±0.3 3.1±0.4 3.7±0.5 B组 治疗前 127 1.8±0.2 1.9±0.3 1.9±0.3治疗24 w 0.7±0.1① 1.2±0.2① 1.8±0.2①治疗48 w 0.4±0.1① 1.1±0.2① 1.7±0.2①
表5 两组血清GSH、MDA、CPK和SOD水平(±s)比较

表5 两组血清GSH、MDA、CPK和SOD水平(±s)比较
与A组比,①P<0.05
例数 SOD(U/mL) MDA(nmol/mL)A组 治疗前 127 302.4±32.9 9.5±1.4治疗24 w 239.2±27.4 12.4±1.2治疗48 w 217.4±26.2 15.5±1.9 B组 治疗前 127 310.9±35.0 10.4±0.8治疗 24 w 537.2±41.3① 3.7±0.4①治疗 48 w 589.0±45.6① 2.2±0.2①GSH(kU/g)174.9±20.1 150.8±17.3 160.7±19.3 170.5±21.7 316.1±40.5①349.6±42.4①CPK(mmol/L)924.7±80.6 1195.2±100.5 1207.2±97.9 939.5±83.1 754.8±90.7①604.8±50.7①
3 讨论
观察发现,长期服用恩替卡韦治疗CHB患者可能会造成不同程度的肾损伤现象,部分患者血清转氨酶、乳酸脱氢酶含量会迅速升高,并且治疗效果较差[13-15]。当病情发展到一定程度时会造成肝脏代谢严重异常,氧化应激产物增多(如CPK、MDA升高),从而加重甚至导致肾脏功能衰竭,故在使用恩替卡韦等核苷类药物抗病毒治疗的同时应注意对肝肾等器官功能的保护[16,17]。
我们在CHB患者治疗过程中,发现A组患者肾功能sCr和Cys C、肝细胞色素P450亚型酶中的CYP2E1 、CYP2C9、CYPIA2、LDH和 ADA 均随治疗时间延长逐渐升高,脂质过氧化产物CPK和MDA大量产生,SOD和GSH活性逐渐下降,提示长时间应用恩替卡韦时会造成相对的肝肾功能损害。B组患者在加服百令胶囊后,以上肝肾功能损害现象明显好转。从临床观察到的结果来看,B组肝肾功能损害较A组轻。这一结果应与百令胶囊的抗氧化作用有关。百令胶囊是人工制成的虫草菌糖胶囊,具有清除自由基和抑制脂质过氧化的作用,对降低肝炎、肝硬化、急性肾损伤患者MDA生成、提高SOD、增强免疫功能等有可靠的疗效[17-21]。在治疗CHB患者时,恩替卡韦直接抗HBV,减轻HBV对肝细胞的破坏,降低血清AST、ALT水平,但由于HBV在复制过程中对肝细胞的破坏和药物的副作用,LDH和ADA均随治疗时间延长逐渐升高,脂质过氧化产物CPK和MDA大量产生,SOD和GSH活性逐渐下降。百令胶囊发挥了其抗脂质过氧化、清除自由基和抑制炎症反应产生的MDA和CPK的作用,保护了肝肾免受药物治疗时产生的毒副作用的影响,故B组在治疗24 w和48 w时血清AST、ALT、LDH、ADA、sCr、Cys C和BUN明显降低,CPK和MDA明显低于A组,GSH和SOD高于A组,肝肾功能得以保护。
现代药理学研究表明,90%药物的代谢由细胞色素P450亚型酶完成。P450有很多种亚型,如CYPIA2、CYP2C9、CYP2D6、CYP2E1、CYP3A4 等 ,这些酶主要在肝脏组织表达,占肝脏P450亚型酶蛋白含量的13%以上,与许多药物代谢及药物的相互作用密切相关[22]。恩替卡韦等核苷类药物主要由 CYP2E1、CYP2C9、CYPIA2 代 谢 。 CYP2E1、CYP2C9、CYPIA2酶的活性升高代表所使用的药物恩替卡韦临床不良反应增加,疗效降低。A组CYP2E1、CYP2C9、CYPIA2升高就证实了不良反应的存在。加服百令胶囊的B组CYP2E1、CYP2C9、CYPIA2酶的活性降低,提示百令胶囊可降低恩替卡韦的临床不良反应,降低肝肾功能损伤,增强疗效。
[1]Keating GM.Entecavir:a review of its use in the treatment of chronic hepatitis B in patients with decompensated liver disease.Drugs,2011,71(18):2511-2529.
[2]赵玉倩,许杏梅,杨慧娟,等.恩替卡韦联合六味五灵片治疗慢性乙型肝炎患者疗效观察.实用肝脏病杂志,2016,l9(1):83-85.
[3]陈雅萍,张勤俭,田楠楠.恩替卡韦联合聚乙二醇干扰素治疗慢性乙型肝炎患者疗效观察.实用肝脏病杂志,2016,l9(2):208-209.
[4]左琳琳,周华娟,方红菊.恩替卡韦治疗46例失代偿期乙型肝炎肝硬化患者临床效果观察.实用肝脏病杂志,2016,19(2):217-218.
[5]张骏飞,刘波,陈从新,等.含毗咯烷生物碱的中草药致肝窦阻塞综合征研究进展. 实用肝脏病杂志,2014,17(4):445-448.
[6]Liaw YF,Sheen IS,Lee CM,et al.Tenofovir disoproxil fumarate(TDF),emtricitabine/TDF,and entecavir in patients with decompensated chronic hepatitis B liverdisease.Hepatology,2011,53(1):62-72.
[7]Papatheodoridis GV,Chan HL,Hansen BE,et al.Risk of hepatocellularcarcinoma in chronic hepatitis B:Assessmentand modification with current antiviral therapy.J Hepatol,2015,62(4):956-967.
[8]Seto WK,Hui AJ,Wong VW,et al.Treatment cessation of entecavir in Asian patients with hepatitis B e antigen negative chronic hepatitis B:a multicentre prospective study. Gut,2015,64(4):667-667.
[9]Dienstag JL,Wei LJ,Xu D,et al.Cross-study analysis of the relative efficacies of oral antiviral therapies for chronic hepatitis B infection in nucleoside-naivepatients.Clin Drug Investig,2007,27(1):35-49.
[10]Lok AS,Trinh H,Carosi G,et al.Efficacy of entecavir with or withouttenofovirdisoproxilfumaratefornucleos(t)ide-naive patients with chronic hepatitis B.Gastroenterology,2012,143(3):619-628.
[11]Cai S,Yu T,Jiang Y,et al.Comparison of entecavir monotherapy and de novo lamivudine and adefovir combination therapy in HBeAg-positive chronic hepatitis B with high viralload:48-week result.Clin Exp Med,2016,16(3):429-436.
[12]Deng CL,Song XW,Liang HJ,et al.Chronic hepatitis B serum promotes apoptotic damage in human renal tubular cells.World J Gastroenterol,2006,12(11):1752-1756.
[13]Zheng JS,Chen MM,Yang HF,et al.Stool vs.serum hepatitis B virus DNA in patients with chronic hepatitis B.Med Sci Monit,2015,21(3):3840-3846.
[14]You J,Sriplung H,Geater A,et al.Effect ofviralload on T-lymphocyte failure in patients with chronic hepatitis B.World J Gastroenterol,2008,14(7):1112-1119.
[15]Yu X,Guo R,Ming D,et al.Ratios of regulatory T cells/T-helper 17 cells and transforming growth factor-1/interleukin-17 to be associated with the development of hepatitis B virus-associated liver cirrhosis.J Gastroenterol Hepatol,2014 ,29(5):1065-1072.
[16]Yim SY,Um SH,Young Jung J,et al.Clinical significance of hepatitis B virus precore and core promoter variants in Korean patients with chronic hepatitis B.J Clin Gastroenterol,2015,49(1):61-68.
[17]Li F,Wei H,Wei H,et al.Blocking the natural killer cell inhibitory receptor NKG2A increases activity of human natural killer cells and clears hepatitis B virus infection in mice.Gastroenterology,2013,144(2):392-401.
[18]Madan K,Batra Y,Jha JK,et al.Clinical relevance of HBV DNA load in patients with chronic hepatitis B infection.Trop Gastroenterol,2008,29(2):84-90.
[19]AssyN,BeniashviliZ,Djibre A,etal.LowerbaselineALT cut-off values and HBV DNA levels better differentiate HBeAg-chronic hepatitis B patients from inactive chronic carriers.World J Gastroenterol,2009,15(24):3025-3031.
[20]蒋俊民,萧焕明,蔡高术,等.慢性乙型肝炎中医诊疗方案的优化研究. 中国中医急症,2012,21(12):1901-1904.
[21]李龙珠,刘家军,郭俐宏,等.百令胶囊对大鼠肝移植后肝肾功能影响的实验研究. 世界中医药,2016,11(1):127-130.
[22]杨娥,李小燕,杨萍,等.丹参酮ⅡA磺酸钠注射液联合百令胶囊治疗肾血管性高血压的疗效观察.现代药物与临床,2016,12(3):315-319.