硫代乙酰胺诱导的急性肝损伤大鼠肝组织Norrin/Frizzled-4表达的变化*
2018-03-28胡建鹏宋正己李玉莲寻琳婷赵雪茹张镕
胡建鹏,宋正己,李玉莲,寻琳婷,赵雪茹,张镕
急性肝损伤(acute liver injury)是指在无慢性肝病基础上,由多种病因导致肝脏细胞损伤,肝脏解毒、生物转化、合成和排泄等功能出现障碍。造成急性肝损伤的原因主要包括病毒感染、休克缺血、食物或药物中毒、放射线损伤、妊娠、酒精摄入过量以及肝外组织器官功能障碍间接造成肝损伤等。肝脏有着极强的再生和修复能力,去除急性肝损伤病因后,在短期内组织重建即可完成,组织结构恢复。Norrie病是一种先天性视网膜血管发育不全,视网膜血管扩张、血管增殖、纤维化和视网膜脱离的疾病,是由Norrin蛋白相关基因(Ndp)缺陷,正常视网膜血管发育过程中断,视网膜处于缺氧状态,启动了病理性血管新生而导致的疾病[1,2]。Norrin蛋白是一种小分子的分泌型糖蛋白质,能通过自分泌和/或旁分泌方式作用于血管内皮细胞和血管周围细胞,决定靶细胞的移行、增殖和血管网络形成等生物行为,在中枢Norrin还有促神经生长因子样作用[3,4]。在Norrin基因缺陷小鼠引入外源性Norrin基因可以恢复视网膜血管网的形成,并且所形成的视网膜血管结构,包括超微结构都是正常的,能完全恢复正常的视网膜血管网络结构和维持视网膜功能[5]。近年国外研究报道,活化的肝星状细胞(hepatic stellate cells,HSC)存在 Wnt/β-catenin 信号通路的激活,阻断该信号可抑制HSC的活化[6]。已有研究认为细胞外Norrin蛋白通过与细胞膜上特异性跨膜受体卷曲蛋白4(Frizzled-4)结合,能介导Norrin/Fri-zzled-4信号通路,调控转录过程,与血管内皮细胞和血管周围细胞的迁移、增殖和血管网络形成相关。Norrin/Frizzled-4在血管新生(angiogenesis)及发育过程中起到关键性作用[3,7,8]。近年来,有关 Norrin基因在正常血管发育中的作用研究已取得突破性进展,但Norrin/Frizzled-4信号在急性肝损伤组织血管新生和肝间质重建中的作用还鲜有报道。本研究采用硫代乙酰胺(thioacetamide,TAA)诱导大鼠急性肝损伤,观察了肝组织Norrin/Frizzled-4蛋白、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)和CD105表达的变化及其与肝组织血管新生之间的关系,以便进一步研究Norrin/Friz-zled-4信号在急性肝损伤间质重建中的作用及其调控途径。
1 材料与方法
1.1 实验动物、试剂与仪器 健康SPF级雄性SD大鼠33只,体质量200±20 g,购自成都达硕生物科技有限公司,动物合格证号SCXK(川)2013-24。在云南省中医医院中心实验室无菌动物房饲养,适应1 w后开始实验。TAA购自美国Sigma公司;Nycodenz粉剂(挪威 Axis-Shield);Hanks、D-Hanks、链蛋白酶 E(Solarbio);Collagenase Ⅳ(美国 MP原装);DNaseI(Roche);检测 VEGF 和 CD105的ELISA试剂盒(R&B公司进口分装),SDS-PAGE凝胶配制试剂盒和BCA蛋白浓度测定试剂盒(碧云天);抗 Norrin和抗 Frizzled-4(Chem Cruz)。荧光显微镜、倒置相差显微镜(德国莱卡);超低温冰箱、小型台式离心机(美国Thermo);电泳仪、小型Trans-blot转达印槽组件(美国Bio-rad);红外双色激光成像系统Odyssey Clx(美国 LICOR);Epoch连续波长酶标仪(美国Bio-Tek);漩涡混合仪(上海QT-1);SW-CJ-2F标准化超净工作台。
1.2 原代肝星状细胞的分离 取1只大鼠,正常饲养至450±50 g后,用Hanks液在体灌洗大鼠肝脏,离体后用0.05% Ⅳ型胶原酶、0.02%链蛋白酶E和0.05%DNaseI灌注、消化大鼠肝脏,经12%Nycodenz密度梯度离心,收集肝星状细胞层,洗涤、离心后,提取细胞总蛋白。
1.3 急性肝损伤动物模型的制备 将32只大鼠随机分成正常对照组(N组)8只,根据大鼠体质量给予 0.9%生理盐水5 ml·kg-1·d-1腹腔注射;TAA 诱导模型组(M组)24只,根据大鼠体质量给予TAA 250 mg·kg-1·d-1腹腔注射,1 次 /d,连续注射 3 天,诱导急性肝损伤。于开始注射TAA后的第10 d和第17 d,分别给予10%水合氯醛麻醉。在N组,处死大鼠4只,在M组,处死6只,取肝组织,经4%多聚甲醛溶液固定,石蜡包埋,切片,常规HE染色,显微镜下观察。
1.4 血清CD105和VEGF水平检测 麻醉大鼠后开腹,经心脏取血,3500 r/m离心15 min,取上清,采用ELISA法检测。根据标准曲线,求出各样品CD105和VEGF水平。
1.5 肝组织Norrin和Frizzled-4蛋白表达检测 采用Western blot法,取肝右叶最大横切面处组织100 mg,加入含1%PMSF的RIPA裂解液(增强型,P0013B)1 mL,冰上充分匀浆,离心后取上清。测定蛋白浓度,蛋白定量后计算各样品体积,确保每个蛋白样品的上样量一致。按4:1的比例加入5×SDS-PAGE Ladding buffer,混匀。沸水浴致蛋白变性10 min,冷却后,置于-70℃冰箱,待用。配制体积分数为12%SDS-PAGE分离胶和5%浓缩胶,灌胶凝固后,取Marker 8μL,蛋白样品 25 μL(50μg),依次排序上样,用恒压45 v电压,电泳时间约30 min,待Marker显示样品经过浓缩胶后将恒压调至60 v,继续电泳,确定已将目的蛋白条带分开,停止电泳。按照转膜夹阴极(黑色面)、1层海绵、2层滤纸、凝胶、PAGE膜、2层滤纸、1层海绵、转膜夹阳极(白色面)的顺序,一层层赶走气泡,夹好固定后,将转膜夹放入转膜槽,放入冰袋,盖好盒盖后,置于4℃冰箱,恒压90 v转膜90 min。转膜结束后,将目的蛋白条带剪下,放入用TBST配制的3%牛血清蛋白封闭液中,做好标记,置于摇床上,室温摇晃封闭1~1.5 h。分别加入抗Frizzled-4多克隆抗体(1:200)、抗 Norrin多克隆抗体(1:200)和抗 GAPDH 单克隆抗体(1:2000),摇床上4℃冰箱中孵育过夜。次日,用TBST洗膜3次,每次 10 min。加入相应酶标二抗(1:10000),用TBST洗膜3次,每次10 min。提前20 min打开红外双色激光成像系统,将膜放入扫描仪内,扫描成像。以Norrin/Frizzled-4条带灰度值与内参GAPDH条带灰度值的比值估计Norrin/Frizzled-4蛋白相对表达量。
1.6 统计学处理 应用Excel 2007和SPSS 18.0软件,计量资料以(±s)表示,采用方差分析及t检验,P<0.05为组间存在显著性差异,P<0.01为存在非常显著性差异。
2 结果
2.1 大鼠生长情况 对照组大鼠活动正常,毛发光泽,饮食饮水及大小便正常,饲养期间体质量稳定增加;24只TAA诱导急性肝损伤模型大鼠于开始注射 TAA 后的第 3 d、4 d、5 d、6 d,分别死亡 2只、5只、3只、1只(45.8%);给药期间动物活动减少,食欲不振,嗜睡,毛发蓬乱无光泽。在注射TAA后体质量急速下降,停止注射TAA 2 d后又缓慢上升,但始终低于对照组。
2.2 各组肝组织病理学表现 正常组动物肝小叶存在,以中央静脉为中心,肝索呈放射状排列、整齐(图1A);TAA诱导急性肝损伤1 w,大鼠肝细胞部分肿胀坏死,细胞质疏松化,细胞核内出现空泡(图1B);TAA诱导急性肝损伤2 w,大鼠肝细胞肿胀严重,排列紊乱,胞内出现大空泡,细胞核体积变小,有炎性细胞浸润(图1C)。

图1 各组大鼠肝组织病理学表现(HE,40×)
2.3 血清CD105和VEGF水平比较 与正常对照组比,急性肝损伤1 w组大鼠血清CD105和VEGF水平显著升高(P<0.05),急性肝损伤2 w组大鼠血清CD105和 VEGF 水平极显著升高(P<0.01),且 1 w组和2w组比较,血清中VEGF水平也有差异显著(P<0.05,表1)。
表1 各组血清CD105和VEGF水平(±s)比较
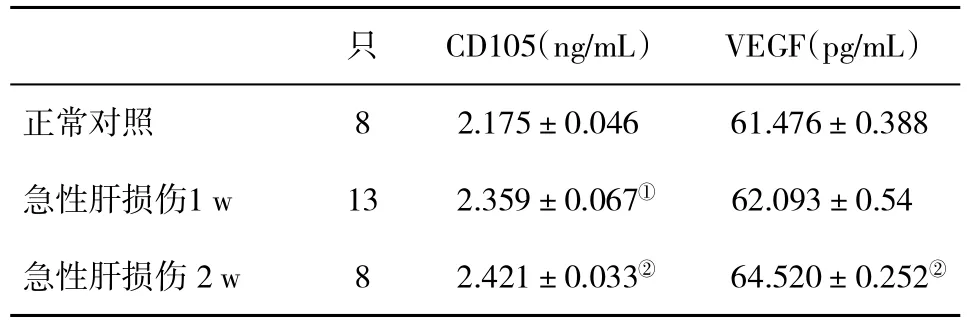
表1 各组血清CD105和VEGF水平(±s)比较
与对照组比,①P<0.05,②P<0.01
只 CD105(ng/mL) VEGF(pg/mL)正常对照 8 2.175±0.046 61.476±0.388急性肝损伤1 w 13 2.359±0.067① 62.093±0.54急性肝损伤2 w 8 2.421±0.033② 64.520±0.252②
2.4 肝组织Norrin/Frizzled-4蛋白表达情况 结果显示,原代肝星状细胞和正常肝组织不表达Norrin蛋白或Frizzled-4蛋白,或表达量很低;急性肝损伤1 w和2 w组肝组织Norrin蛋白相对表达量显著高于正常肝组织,差异有统计学意义(P<0.01,图2、图3)。急性肝损伤2 w组Norrin蛋白表达量显著低于1 w组(P<0.05),说明急性肝损伤后肝组织Norrin蛋白表达逐渐降低。正常大鼠肝组织Frizzled-4蛋白高表达,提示除HSC外肝脏内可能还存在其他间质细胞或实质细胞参与Frizzled-4蛋白的表达。急性肝损伤大鼠肝组织Frizzled-4蛋白相对表达量显著高于正常肝组织,差异有统计学意义(P<0.01,图 2、图 3)。

图2 各组肝组织Norrin/Frizzled-4蛋白相对表达量比较

图3 各组肝组织Norrin/Frizzled-4蛋白表达
3 讨论
本研究发现急性肝损伤大鼠血清CD105和VEGF水平升高,说明肝组织代偿性启动血管新生,促进肝间质重建[9]。在急性肝损伤时,库普弗细胞和内皮细胞被激活并产生 TGF-β1、PDGF、VEGF、肿瘤坏死因子(TNF)等细胞因子以及炎性介质和活性氧,促使静止的HSC活化,活化的HSC具有血管平滑肌细胞特性,能促进新生血管的构建[10-13]。
经典WNT/β-catenin信号通路是细胞外配体(WNT蛋白家族)作用于跨膜卷曲蛋白-低密度脂蛋白相关蛋白复合受体(Frizzled/LRP),使Dishevelled蛋白被激活。当β-catenin降解复合体被抑制后,β-catenin信号得以在胞浆内累积并传导至细胞核,与核内转录因子TCF/LEF1相互作用,激活下游靶基因的转录,引发生物学效应[14-16]。Norrin蛋白在结构上和Wnt蛋白无关,但也是Frizzled-4蛋白在细胞外的一种配体蛋白,能激活Norrin/Frizzled-4信号通路。Norrin/Frizzled-4和Wnt/β-catenin信号通路的协同分子和靶分子不尽相同[17],Norrin/Frizzled-4信号转导通路在血管发生和功能维护中起核心作用[3,14]。
本研究结果显示,Norrin蛋白在肝星状细胞和正常肝组织中表达量低,损伤初期其表达量上调,之后又有所下降。除HSC外,肝脏内可能还存在其他间质细胞或实质细胞参与Frizzled-4蛋白的表达[18]。文献报道Norrin/Frizzled-4信号转导通路在血管发生和功能维护中起核心作用[3,14,19]。我们还观察到Frizzled4蛋白表达与CD105和VEGF具有同步性,急性肝损伤均可显著上调其表达量,参与急性肝损伤后的血管新生,推测Norrin/Frizzled4和WNT/β-catenin信号在肝损伤血管新生和间质重建的不同时期发挥作用,而且其作用机制可能是在急性肝损伤后上调CD105和VEGF表达,促进血管新生和组织修复。
[1]Ye X,Smallwood P,Nathans J.Expression of the Norrie disease gene(Ndp)in developing and adult mouse eye,ear,and brain.Gene Expr Patterns,2011,11(1-2):151-155.
[2]Gariano RF,Gardner TW.Retinal angiogenesis in developmentand disease.Nature,2005,438(7070):960-966.
[3]Ye X,Wang Y,Nathans J.The Norrin/Frizzled4 signaling pathway in retinal vascular development and disease.Trends Mol Med,2010,16(9):417-25.
[4]Seitz R,Hackl S,Seibuchner T,et al.Norrin mediates neuroprotective effects on retinal ganglion cells via activation of the Wnt/beta-Catenin signaling pathway and the induction of neuroprotective growth factors in Müller cells.J Neurosci,2010,30(17):5998-6010.
[5]Ye X,Wang Y,Cahill H,et al.Norrin,frizzled-4,and Lrp5 signaling in endothelialcells controls a genetic program for retinal vascularization.Cell,2009,139(2):285-298.
[6]Yang MD,Chiang YM,Higashiyama R,et al.Rosmarinic acid and baicalin epigenetically derepress peroxisomal proliferator-activated receptor γ in hepatic stellate cells for their antifibrotic effect.Hepatology,2012,55(4):1271-1281.
[7]Xu Q,Wang Y,Dabdoub A,et al.Vascular development in the retina and inner ear:Control by Norrin and Frizzled-4,a high-affinity ligand-receptor Pair.Cell,2004,116(6):883-895.
[8]Luhmann UF,Lin J,Acar N,et al.Role of the Norrie disease pseudoglioma gene in sprouting angiogenesis during development ofthe retinalvasculature.InvestOphthalmolVisualSci,2005,46(9):3372-3382.
[9]Dickson MC,Martin JS,Cousins FM,et al.Defective haematopoiesis and vasculogenesis in transforming growth factor-beta 1 knock out mice.Development,1995,121(6):1845-1854.
[10]Saiman Y,Friedman S L.The role of chemokines in acute liver injury.Front Physiol,2012,3:1-12.
[11]Nath B,Szabo G.Hypoxia and hypoxia inducible factors:diverse roles in liver diseases.Hepatology,2012,55(2):622-633.
[12]Rosmorduc O,Housset C.Hypoxia:a link between fibrogenesis,angiogenesis,and carcinogenesis in liverdisease.Semin Liver Dis,2010,30(3):258-270.
[13]Taura K,De Minicis S,Seki E,et al.Hepatic stellate cells secrete angiopoietin 1 that induces angiogenesis in liver fibrosis.Gastroenterology,2008,135(5):1729-1738.
[14]StenmanJM,Rajagopal J,Carroll TJ,et al.Canonical Wnt signaling regulates organ-specific assembly and differentiation of CNS vasculature.Science,2008,322(5905):1247-1250.
[15]Daniels DL,Eklof SK,Weis WI.β-catenin:Molecular plasticity and drug design.Trends Biochem Sci,2001,26(11):672-678.
[16]Sassi N,Laadhar L,Allouche M,et al.WNT signaling and chondrocytes:from cellfate determination to osteoarthritis physiopathology.J Recept Signal Transduct Res,2014,34(2):73-80.
[17]Junge HJ,Yang S,Burton JB,et al.TSPAN12 regulates retinal vascular development by promoting Norrin-but not Wnt-induced FZD4/beta-catenin signaling.Cell,2009,139(2):299-311.
[18]Barandon L,Couffinhal T,Dufourcq P,et al.Frizzled A,a novel angiogenic factor:promises for cardiac repair.Eur J Cardiothor Surg,2004,25(1):76-83.
[19]Wang Y,Rattner A,Zhou Y,et al.Norrin/Frizzled4 signaling in retinal vascular development and blood brain barrier plasticity.Cell,2012,151(6):1332-1344.