灯盏花素改善动脉粥样硬化损伤的实验研究*
2018-03-28武迎磊
武迎磊 赵 天 李 明
(1.河北省邢台市第三医院,河北 邢台 054000;2.河北省沧州市食品药品检验所,河北 沧州061000)
动脉粥样硬化是多种心脑血管系统疾病的病理基础,其中氧化应激损伤和炎症反应是其重要的病理机制[1-2]。灯盏花素是一种具有抗炎、抗氧化、改善血液循环等多种生物学活性的黄酮类化合物[3-5],但灯盏花素是否能够通过抑制氧化应激反应和炎症反应而对动脉粥样硬化起到一定的改善作用尚未见文献报道,本实验通过建立大鼠动脉粥样硬化模型并同步给予灯盏花素进行干预治疗,研究灯盏花素对动脉粥样硬化大鼠氧化应激和炎症反应的影响并初步探讨其机制。现报告如下。
1 材料与方法
1.1 实验动物 实验用SD大鼠(清洁级,雄性,鼠龄6周龄,体质量180~220 g)购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003。
1.2 药物与试剂 灯盏花素片购自广州彼迪药业有限公司(规格:20 mg/片,生产批号:20150917);辛伐他汀片(SV)购自北京万生药业有限责任公司;氧化应激监测指标试剂盒均购自南京建成生物工程研究所;H&E试剂盒及炎症细胞因子检测试剂盒购自北京博奥森科技有限公司。
1.3 模型制备 参照周永刚等[6]报道的实验方法制备动脉粥样硬化大鼠模型:除正常对照组外,其余各组大鼠均通过喂养高脂饲料(3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料)结合腹腔注射维生素D3[给予饲料前一次性腹腔注射维生素D3(60万U/kg)]的方法建立大鼠动脉粥样硬化模型,共12周。主动脉大体解剖状况见图1。
1.4 分组与给药 选取80只模型大鼠按随机数字表法随机分为模型组、 灯盏花素 6、12、24 mg/(kg·d)组和辛伐他汀 1.8 mg/(kg·d)组,各组均 16 只,造模过程中各治疗组同步灌胃给药12周;另取同龄SD大鼠16只设为正常对照组,同步给予等体积0.9%氯化钠注射液。
1.5 标本采集与检测 1)HE染色法观察主动脉形态结构改变并进行病变分级。麻醉后剥取全长主动脉,经4%多聚甲醛液中固定、脱水、石蜡包埋、切片、常规HE染色后,通过显微镜观察主动脉形态结构改变;主动脉病变标准[7]为0级:结构正常;1级:内膜有少量泡沫细胞积聚,无明显的凸起斑块;2级:内膜可见大量泡沫细胞积聚,有明显的粥样斑块,部分斑块融合成片;3级:内膜表面几乎全被粥样斑块覆盖,斑块内可见组织坏死、钙化,斑块底部肌层萎缩变薄。2)比色法测定血清中抗氧化酶活性和丙二醛(MDA)、活性氧簇(ROS)含量。腹主动脉取血并离心取血清,采用比色法,通过紫外可见分光光度计测定各组大鼠血清中抗氧化酶[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)、过氧化氢酶(CAT)]活性和 MDA、ROS 含量。 3)血浆中炎症细胞因子含量测定。经腹主动脉取血并按照ELISA试剂盒说明书进行处理,采用比色法,通过酶标仪测定各组大鼠血浆中炎症细胞因子 [C反应蛋白(CRP)、 肿瘤坏死因子-α (TNF-α)、 白细胞介素 1β(IL-1β)、白细胞介素-6(IL-6)]含量水平。
1.6 统计学处理 应用SPSS15.0统计处理。计量资料以(±s)表示,多组间均数比较采用one-way ANOVA检验,主动脉病变分级采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 造模过程大鼠生存状态及主动脉状况 见图1。正常组大鼠生存状态良好、主动脉未见异常;而模型组大鼠呈现精神萎靡、毛发脱落等状态,主动脉呈现血管萎缩、血管壁增厚、多处钙化等病理状态。

图1 主动脉大体解剖图片
2.2 各组大鼠主动脉形态结构改变及病变分级 见图2,表1。正常对照组大鼠主动脉组织及细胞均未见异常,而模型组大鼠主动脉内皮细胞明显受损、出现慢性炎症病变、泡沫细胞形成并伴有粥样硬化斑块等明显的病理性形态结构改变。与模型组比较发现,灯盏花素 6、12、24 mg/(kg·d)组和辛伐他汀 1.8 mg/(kg·d)大鼠动脉粥样硬化病变程度呈不同程度减轻,以灯盏花素24 mg/(kg·d)组效果最为显著。评价主动脉病变分级:模型组大鼠主动脉病变2级及以上共14例(87.50%),其病变分级较正常对照组显著升高 (P<0.01);与模型组比较,灯盏花素 6、12 mg/(kg·d)组主动脉病变分级较模型组无显著差异(P>0.05),灯盏花素 24 mg/(kg·d)组和辛伐他汀 1.8 mg/(kg·d)组主动脉病变分级显著降低 (P<0.01);与辛伐他汀1.8 mg/(kg·d)组比较,灯盏花素 24 mg/(kg·d)组主动脉病变分级无显著差异(P>0.05)。
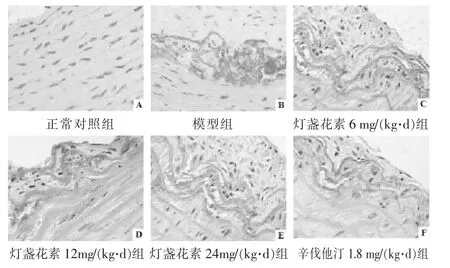
图2 各组大鼠主动脉形态结构变化(HE染色,400倍)

表1 各组大鼠主动脉病变分级结果比较
2.3 各组大鼠血清抗氧化酶活性水平比较 见表2。与正常对照组比较,模型组大鼠血清抗氧化酶(SOD、GSH-Px、CAT)活性显著降低(P<0.01);与模型组比较,灯盏花素 12、24 mg/(kg·d)组大鼠血清 SOD、CAT 活性(P<0.05 或 P<0.01)显著升高,灯盏花素 24 mg/(kg·d)组GSH-Px活性显著升高(P<0.05);灯盏花素6 mg/(kg·d)组和辛伐他汀 1.8 mg/(kg·d)组 SOD、GSH-Px、CAT活性与模型组比较无显著差异(P>0.05);与辛伐他汀 1.8 mg/(kg·d)组比较,灯盏花素 24 mg/(kg·d)组SOD、CAT 活性显著升高(P<0.05或 P<0.01),GSH-Px活性差异无统计学意义(P>0.05)。
表2 各组大鼠血清中抗氧化酶活性水平比较(U/mL,±s)

表2 各组大鼠血清中抗氧化酶活性水平比较(U/mL,±s)
组别 n C A T正常对照组 1 6 1 4.8 2±1.8 8模型组 1 6 8.6 5±1.4 9**灯盏花素 6 m g/(k g·d)组 1 6 9.3 7±1.7 6 S O D G S H-P x 4 2 1.6 9±3 4.2 1 9 2 8.5 3±5 7.5 8 2 5 1.3 0±2 6.0 3** 6 7 9.0 4±4 5.1 7**2 7 3.8 6±2 7.6 2 7 4 1.2 9±5 1.9 8灯盏花素 1 2 m g/(k g·d)组 1 6 1 1.9 2±2.1 7**3 1 8.5 1±3 0.7 5** 7 7 3.8 4±5 9.1 3灯盏花素 2 4 m g/(k g·d)组 1 6 3 6 1.4 3±3 4.6 8△△▲ 8 1 5.3 0±5 7.4 0△ 1 3.0 2±2.3 4△▲▲辛伐他汀 1.8 m g/(k g·d)组 1 6 2 8 3.0 6±3 1.2 2 7 6 3.4 8±4 9.1 5 9.8 2±1.7 3
2.4 各组大鼠血清MDA、ROS含量比较 见表3。与正常对照组比较,模型组大鼠血清MDA、ROS含量显著升高(P<0.01);与模型组,灯盏花素 12、24 mg/(kg·d)组和辛伐他汀 1.8 mg/(kg·d)组大鼠血清 MDA、ROS含量均显著降低(P<0.05或P<0.01),灯盏花素 6 mg/(kg·d)组MDA、ROS含量较模型组无显著差异 (P>0.05);与辛伐他汀 1.8 mg/(kg·d)组比较,灯盏花素 24 mg/(kg·d)组 MDA 含量显著降低(P<0.05),ROS 含量无显著差异(P>0.05)。
表3 各组大鼠大鼠血清MDA、ROS含量比较(±s)

表3 各组大鼠大鼠血清MDA、ROS含量比较(±s)
组 别 n正常对照组 1 6模型组 1 6灯盏花素 6 m g/(k g·d)组 1 6 M D A(m m o l/L) R O S(U/m L)9.5 7±0.9 2 2 0 7.4 2±2 1.9 4 4 8.0 6±6.1 8** 3 8 6.3 4±3 5.1 5**4 3.7 1±5.5 2 3 5 1.9 0±3 2.9 8灯盏花素 1 2 m g/(k g·d)组 1 6 2 9.7 6±4.6 1△△ 2 8 4.7 1±2 8.3 7△灯盏花素 2 4 m g/(k g·d)组 1 6 2 5.1 3±4.1 7△△▲ 2 4 0.0 8±2 1.9 2△△辛伐他汀 1.8 m g/(k g·d)组 1 6 3 4.6 2±4.8 4△ 2 8 7.5 4±3 0.7 8△
2.5 各组大鼠血浆中炎症细胞因子含量比较 见表4~表5。与正常对照组比较,模型组大鼠血浆中炎症细胞因子 CRP、TNF-α、IL-1β、IL-6 含量显著升高 (P<0.01),炎症细胞因子 IL-10含量显著降低(P<0.01);与模型组比较, 灯盏花素 12、24 mg/(kg·d) 组 CRP、TNF-α、IL-1β、IL-6 含量显著降低 (P<0.05 或 P<0.01),灯盏花素 24 mg/(kg·d)组 IL-10 含量显著升高(P<0.01);灯盏花素 6 mg/(kg·d)组 CRP、TNF-α、IL-1β、IL-6、IL-10 含量较模型组均无显著差异(P>0.05);辛伐他汀 1.8 mg/(kg·d)组 TNF-α 含量较模型组显著降低 (P<0.05),CRP、IL-1β、IL-6、IL-10 含量无显著差异(P>0.05);与辛伐他汀 1.8 mg/(kg·d)组比较,灯盏花素 24 mg/(kg·d) 组 CRP、IL-6 含量显著降低且IL-10 显著升高(P<0.05),TNF-α、IL-1β 含量无显著差异(P>0.05)。
表4 各组大鼠血浆中CRP、TNF-α含量比较(±s)

表4 各组大鼠血浆中CRP、TNF-α含量比较(±s)
组 别 n正常对照组 1 6模型组 1 6灯盏花素 6 m g/(k g·d)组 1 6 C R P(m g/L) T N F-α(μ g/L)4.6 2±1.0 8 1.5 2±0.4 1 1 8.7 5±3.9 0** 3.0 2±0.7 2**1 7.6 2±3.8 1 2.5 8±0.6 2灯盏花素 1 2 m g/(k g·d)组 1 6 1 4.0 2±3.1 6△ 2.3 3±0.7 9△灯盏花素 2 4 m g/(k g·d)组 1 6 1 1.4 9±2.5 8△△▲ 1.9 2±0.4 8△辛伐他汀 1.8 m g/(k g·d)组 1 6 1 7.2 6±4.0 3 2.0 3±0.4 1△
表5 各组大鼠血浆中 IL-1β、IL-6、IL-10 含量比较(pg/mL,±s)
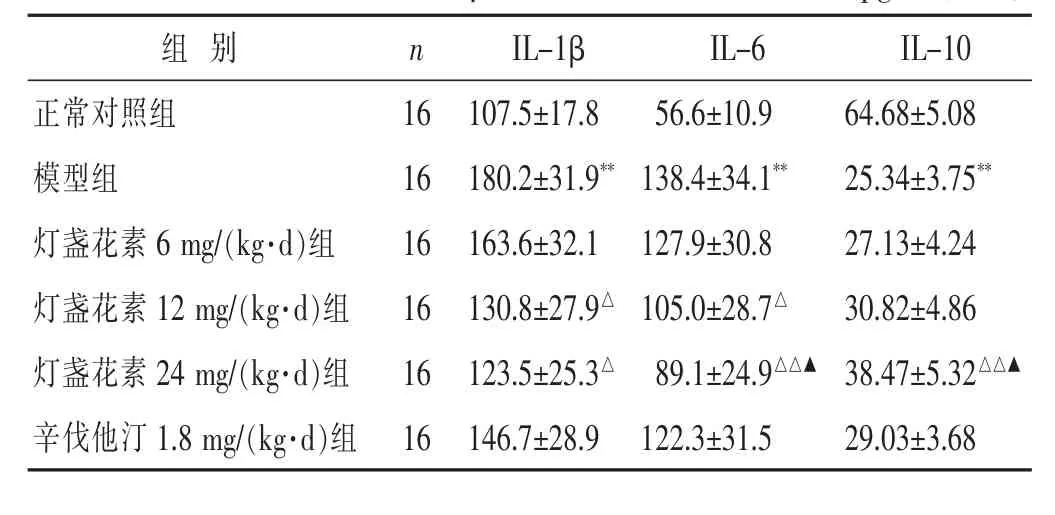
表5 各组大鼠血浆中 IL-1β、IL-6、IL-10 含量比较(pg/mL,±s)
组别 n正常对照组 1 6模型组 1 6灯盏花素 6 m g/(k g·d)组 1 6 I L-6 I L-1 0 5 6.6±1 0.9 6 4.6 8±5.0 8 1 3 8.4±3 4.1** 2 5.3 4±3.7 5**1 2 7.9±3 0.8 2 7.1 3±4.2 4灯盏花素 1 2 m g/(k g·d)组 1 6 1 3 0.8±2 7.9△ 1 0 5.0±2 8.7△ 3 0.8 2±4.8 6灯盏花素 2 4 m g/(k g·d)组 1 6 1 2 3.5±2 5.3△ 8 9.1±2 4.9△△▲ 3 8.4 7±5.3 2△△▲辛伐他汀 1.8 m g/(k g·d)组 1 6 1 4 6.7±2 8.9 1 2 2.3±3 1.5 2 9.0 3±3.6 8 I L-1 β 1 0 7.5±1 7.8 1 8 0.2±3 1.9**1 6 3.6±3 2.1
3 讨 论
随着病理生理学研究的深入,有研究发现氧化应激损伤和炎症反应是动脉粥样硬化发生发展的重要病理机制[8-9]。 Considine MJ 等[10]研究发现 ROS 生成的活性氧和NO将破坏血管壁的光滑性,形成斑块,斑块破裂形成血栓。生理状态下ROS的产生与还原清除处于动态平衡状态,其中体内抗氧化酶SOD、GSH-Px、CAT在维持ROS平衡中发挥着重要的作用[11-12];抗氧化酶活性低下将导致ROS清除能力下降,进而ROS蓄积而引发动脉血管的过氧化损伤;此外,脂质过氧化终产物MDA的含量也能够间接反映动脉血管氧化应激损伤程度。本实验研究发现,经灯盏花素12~24 mg/(kg·d)干预治疗能够明显改善动脉粥样硬化大鼠SOD、GSH-Px、CAT活性并降低MDA、ROS含量,提示灯盏花素具有抑制动脉粥样硬化大鼠氧化应激损伤的作用。并且,灯盏花素 24 mg/(kg·d)组 SOD、CAT 活性显著高于辛伐他汀 1.8 mg/(kg·d) 组且 MDA、ROS 含量显著低于辛伐他汀 1.8 mg/(kg·d)组(P<0.05 或 P<0.01),提示灯盏花素抗氧化作用优于辛伐他汀。
炎症反应可以通过多种途径促进动脉粥样硬化的发生和发展[13],Ovsepyan VA 等[14-15]研究发现,动脉粥样硬化斑块病灶将促进巨噬细胞促炎症细胞因子CRP、TNF-α、IL-1β、IL-6 大量释放、 同时抑制抑炎症因子IL-10的分泌,进而介导炎症反应的发生,诱导平滑肌细胞的凋亡、促进动脉粥样硬化发展。本实验研究发现,灯盏花素 24 mg/(kg·d)组 CRP、IL-6 含量显著低于辛伐他汀 1.8 mg/(kg·d)组,且 IL-10显著高于辛伐他汀 1.8 mg/(kg·d)组(P<0.05),提示灯盏花素抑制炎症反应作用优于辛伐他汀。
总之,灯盏花素能够通过抑制氧化应激损伤和炎症反应而对动脉粥样硬化起到一定改善作用,并且灯盏花素对动脉粥样硬化的改善作用优于辛伐他汀。
[1] Landmesser U,Spiekermann S,Dikalov S,et al.Vascular oxidative stress and endothelial dysfunction in patients with chronic heart failure:role of xanthine-oxidase and extracellular superoxide dismutase[J].Circulation,2002,106(24):3073-3078.
[2] Qiang G,Wenzhai C,Huan Z,et al.Effect of Sancaijiangtang on plasma nitric oxide and endothelin-1 levels in patients with type 2 diabetes mellitus and vascular dementia:a single-blind randomized controlled trial[J].J Tradit Chin Med,2015,35(4):375-380.
[3] 丁宁.灯盏花素注射液对痛风患者抗氧化能力的影响研究[J].中国现代药物应用,2016,10(10):150-151.
[4] 李军,吴立友,王朝阳.灯盏花素注射液对2型糖尿病早期肾病患者相关炎症因子的影响[J].中药药理与临床,2011,27(3):110-112.
[5] 金桂兰,覃慧林,石孟琼,等.灯盏花素对小鼠局灶性脑缺血损伤的保护作用及与脑组织P-糖蛋白表达研究[J].中药药理与临床,2015,31(1):76-79.
[6] 周永刚,蓝晓红,李祥,等.动脉粥样硬化大鼠实验模型的建立与评价[J].解放军药学学报,2011,27(5):399-403.
[7] 王伟,杨滨,王岚,等.丹参山楂药对对大鼠动脉粥样硬化的影响[J].中国中药杂志,2011,36(6):784-789.
[8] 王爽,陈潇,孟国梁,等.灵芝多糖对动脉粥样硬化大鼠氧化应激的影响[J].中药药理与临床,2011,27(6):38-42.
[9] 沈建飞,盛一梁,徐丹,等.降脂丸对动脉粥样硬化大鼠模型炎症因子表达的影响[J].中国医院药学杂志,2013,33(19):1600-1603.
[10] Considine MJ,Sandalio LM,Foyer CH.Unravelling how plants benefit from ROS and NO reactions,while resisting oxidative stress[J].Ann Bot,2015,116(4):469-473.
[11] Lartigue A,Burlat B,Coutard B,et al.The megavirus chilensis Cu,Zn-superoxide dismutase: the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[12] Li X,Zhao L,Yue L,et al.Evidence for the protective effects of curcumin against oxyhemoglobin-induced injury in rat cortical neurons[J].Brain Res Bull,2016,120:34-40.
[13] Ross R.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[14] Ovsepyan VA, Gabdulkhakova AKh,Shubenkiva AA,et al.Role of interleukin-10 gene promoter region polymorphism in the development of chronic lymphoid leukemia[J].Bull Exp Biol Med,2015,160(2):275-277.
[15]张安邦,高杰,李令根,等.相关炎症因子与动脉粥样硬化的关系[J].中国中西医结合外科杂志,2014,20(5):563-566.
