芪棱汤对2型糖尿病并发脑梗死患者内脂素及糖脂代谢的影响*
2018-03-28邓世芳蒋红玉
邓世芳 陈 威 卞 伟 蒋红玉
(暨南大学第二临床医学院,广东省深圳市人民医院,广东 深圳 518000)
近年来随着人们生活方式的改变,2型糖尿病的发病率不断上升,导致多种并发症的发生率也同时升高,其中脑梗死是常见的并发症及主要致死原因之一。动脉粥样硬化是2型糖尿病并发脑梗死的病理基础[1]。国内外的许多研究发现,内脂素与缺氧、内皮功能紊乱、血管增生和炎症等密切相关,它通过糖脂代谢、胰岛素抵抗、炎症及免疫调节等多种机制参与动脉粥样硬化的发生和发展,内脂素有可能成为治疗2型糖尿病并发脑梗死的新靶点,目前西医在这方面的研究较多,但中医相关研究尚欠缺。笔者以益气养阴活血作为理论基础,长期应用芪棱汤治疗脑梗死取得较好的临床疗效。本临床研究从内脂素入手,观察芪棱汤对2型糖尿病并发脑梗死患者内脂素水平及糖脂代谢的影响,并探讨其作用机制。现报告如下。
1 资料与方法
1.1 病例选择 所选病例均符合《中国2型糖尿病防治指南(2010 年版)》有关 2 型糖尿病的诊断标准[2]及1995年全国第4届脑血管病学术会议制定的《各类脑血管疾病诊断要点》中符合动脉粥样硬化性脑梗死的诊断标准[3],且脑梗死发病后24 h至1月内就诊,并经头颅CT或MRI确诊,年龄46~80岁。均排除1型糖尿病、糖尿病酮症酸中毒、自身免疫性疾病、脑出血、心源性脑栓塞、先天发育异常所致脑梗死(包括血管畸形和动脉瘤等)、严重肝肾功能不全、感染及恶性肿瘤患者。
1.2 临床资料 选取2014年10月至2017年5月深圳市人民医院中医科住院治疗2型糖尿病并发脑梗死患者160例,按就诊先后顺序编号,再按随机数字表法随机分为芪棱汤组和对照组两组各80例。芪棱汤组男性 41 例,女性 39 例;平均年龄(60.15±13.76)岁;体质量指数(BMI)(24.82±4.63) kg/m2。 对照组男性 43 例,女性 37 例;平均年龄(61.74±11.65)岁;BMI(24.43±4.81)kg/m2。两组年龄、性别、病程、病情等方面比较,差异均无统计学意义(均P>0.05)。
1.3 治疗方法 两组均予2型糖尿病及急性脑梗死常规对症治疗[4]。芪棱汤组在对照组常规治疗方案的基础上,加用芪棱汤免煎颗粒(黄芪30 g,研三棱10 g,桑椹 10 g,天花粉 10 g,莪术 10 g,水蛭 5 g,枳壳 10 g),冲水至200 mL,分早晚2次口服,建议患者在饭后30 min服用,疗程为30 d(住院期间未够30 d的患者,则在出院后继续口服芪棱汤免煎颗粒至疗程结束)。
1.4 观察指标 1)血清内脂素及糖脂代谢相关的指标检测:分别于治疗前1 d和治疗结束后第1日,禁食12 h后清晨空腹,采集静脉血,送至本院检验科采用全自动生化分析仪检测两组患者空腹血糖 (FPG)、餐后2 h血糖 (2 h PBG)、总胆固醇 (TC)、三酰甘油(TAG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)的水平;采用高效液相色谱仪检测糖化血红蛋白(HbA1c)的水平;采用酶联免疫吸附法(ELISA)测定血清内脂素的水平。2)NIHSS评分:采用美国国立卫生研究院卒中量表(NIHSS)[5]对患者神经功能缺损程度进行评估。NIHSS评分:0~5分为轻度神经功能缺损;6~13分为中度神经功能缺损;≥14分为重度神经功能缺损。于治疗前及治疗30 d后各进行1次评分,根据评分减少程度进行疗效判定。基本痊愈:NIHSS减少90%~100%,病残程度0级,患者肌力基本恢复至5级。显著进步:NIHSS减少46%~89%,病残程度1~3级,患者肌力恢复至4级。进步:NIHSS减少18%~45%。无变化:NIHSS减少或者增加18%以内或恶化或死亡。基本痊愈、显著进步及进步均视为有效。
1.5 统计学处理 应用SPSS13.0统计软件。计量资料以(±s)表示,组间比较采用t检验,非正态分布或方差不齐采用秩和检验,计数资料用构成比率表示。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后血清内脂素水平比较 见表1。治疗前,两组血清内脂素水平差别不大(P>0.05)。治疗后,两组血清内脂素水平均低于治疗前(均P<0.01),且治疗后芪棱汤组血清内脂素水平较对照组明显下降(均 P<0.05)。
表1 两组治疗前后血清内脂素水平比较(ng/mL,±s)

表1 两组治疗前后血清内脂素水平比较(ng/mL,±s)
与本组治疗前比较,*P<0.05,**P<0.01;与对照组治疗后比较,△P<0.05,△△P<0.01。 下同。
组 别 n 治疗前 治疗后芪棱汤组 8 0 4.5 8±0.5 7 3.5 9±0.4 6**△对照组 8 0 4.6 2±0.5 8 4.0 2±0.4 3**
2.2 两组治疗前后糖脂代谢相关指标的比较 见表2,表3。治疗前,两组 FPG、2 h PBG、HBA1C、TAG、TC、LDL及HDL的水平差别均不大(均P>0.05)。治疗后,两组 FPG、2 h PBG、HbA1c、TAG 及 LDL 水平较治疗前均明显降低(均P<0.01),且芪棱汤组治疗后FPG、2 h PBG、HbA1c、TAG 及 LDL 水平均低于对照组(P<0.05),而两组TC、HDL水平则均无明显变化(均P>0.05)。
表2 两组治疗前后糖代谢相关指标比较(mmol/L,±s)
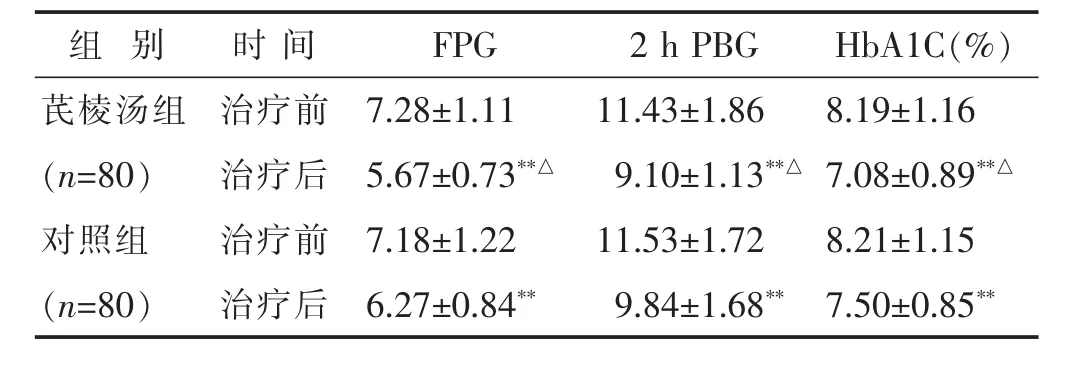
表2 两组治疗前后糖代谢相关指标比较(mmol/L,±s)
组 别 时 间 H b A 1 C(%)F P G 2 h P B G芪棱汤组 治疗前 8.1 9±1.1 6(n=8 0) 治疗后 7.0 8±0.8 9**△对照组 治疗前 8.2 1±1.1 5 7.2 8±1.1 1 1 1.4 3±1.8 6 5.6 7±0.7 3**△ 9.1 0±1.1 3**△7.1 8±1.2 2 1 1.5 3±1.7 2(n=8 0) 治疗后 7.5 0±0.8 5**6.2 7±0.8 4** 9.8 4±1.6 8**
表3 两组治疗前后脂代谢相关指标比较(mmol/L,±s)
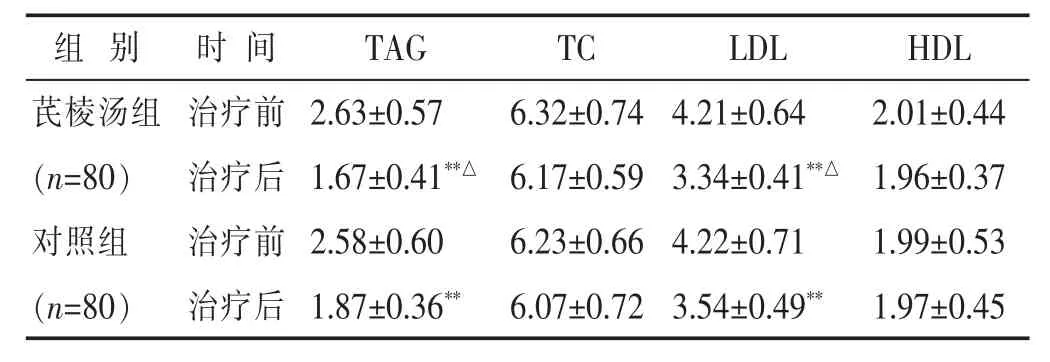
表3 两组治疗前后脂代谢相关指标比较(mmol/L,±s)
组别 时间T A G T C L D L H D L芪棱汤组 治疗前(n=8 0) 治疗后对照组 治疗前2.6 3±0.5 7 6.3 2±0.7 4 4.2 1±0.6 4 2.0 1±0.4 4 1.6 7±0.4 1**△ 6.1 7±0.5 9 3.3 4±0.4 1**△ 1.9 6±0.3 7 2.5 8±0.6 0 6.2 3±0.6 6 4.2 2±0.7 1 1.9 9±0.5 3(n=8 0) 治疗后1.8 7±0.3 6** 6.0 7±0.7 2 3.5 4±0.4 9** 1.9 7±0.4 5
2.3 两组神经功能缺损临床疗效比较 见表4。芪棱汤组神经功能缺损疗效的总有效率高于对照组 (P<0.05)。

表4 两组神经功能缺损临床疗效比较(n)
3 讨 论
研究发现,糖尿病患者发生脑梗死的机率明显高于正常人,随之与脑梗死有关的痴呆和卒中复发的危险均明显增高[6-9],这些危险性是健康人的3~5倍,且预后不良。糖尿病患者长期处于高血糖状态会损伤血管内皮细胞,降低血管壁弹性,同时使血小板活性增强,脂质代谢紊乱,循环中纤维蛋白原升高,造成血液呈高凝高黏度状态,氧自由基增多[10],进而导致微循环淤滞,组织缺氧,最终形成动脉粥样硬化,而动脉粥样硬化是脑梗死发病的基础。因此要改善糖尿病性脑梗死的预后,必须积极控制高血糖、血脂代谢紊乱、高血压及肥胖等相关危险因素。
内脂素是由日本科学家Fukuhara等[11]于2005年发现的脂肪因子,其在内脏脂肪组织中高度表达,持续高血糖状态可促进内脂素的过度表达。高水平的内脂素可能通过以下机制促进糖尿病患者动脉粥样硬化的形成,从而发展成为脑梗死:一是内脂素可影响血脂代谢,促进糖尿病患者动脉粥样硬化的形成[12];二是高血糖可使内脂素表达水平增高,内脂素又与白介素-1、白介素-6及肿瘤坏死因子-α等多种炎症因子存在交互作用,加速血管内皮细胞功能受损[13]。三是内脂素可能增加胰岛素抵抗的风险,从而促进动脉粥样硬化的形成[14];四是内脂素还可通过依赖烟酰胺腺嘌呤二核苷酸途径促进血管平滑肌细胞成熟及延长其寿命,参与并促进纤维帽形成,促进动脉粥样硬化斑块形成[15]。因此作为引起动脉粥样硬化的独立危险因子的内脂素,其在糖尿病并发脑梗死的发生、发展中具有一定的作用。基于以上发现,笔者采用芪棱汤对2型糖尿病并发脑梗死患者进行干预,并以内脂素作为观察指标,结果发现对照组通过调脂稳斑等基础治疗虽可降低内脂素水平,但联合应用芪棱汤后,对内脂素水平有更明显的抑制作用,提示芪棱汤可通过有效抑制内脂素水平,改善动脉粥样硬化程度,从而阻止损伤的进一步扩大,而芪棱汤对内脂素的抑制机制尚需进一步研究。
糖尿病并发脑梗死在中医学上应当属消渴病合并中风范畴。两者虽然属于不同类型的疾病,但关系密切,如《素问·通评虚实论》中明确提出“凡治消瘅、仆击、偏枯、痿厥、气满发逆,甘肥贵人则高粱之疾也”,说明消瘅、偏枯均与肥甘厚味等因素有关。至金元以后,有些医家也逐渐意识到,消渴病久之,会导致中风偏枯或为风痱等疾。目前对糖尿病并发脑梗死的病机仍没有统一的认识,但多数医家均认为消渴病久,气阴两虚,痰浊瘀血痹阻,发为中风是本病的主要病机,当以益气养阴,活血通络为法,芪棱汤即在益气活血的基础上,结合“增液行舟”理论所创立,该方由黄芪、三棱、水蛭、天花粉、桑葚等组成,在笔者前期大量的临床及实验研究中,发现芪棱汤对脑梗死有较好的临床疗效。
本研究通过测定2型糖尿病并发脑梗死患者糖脂代谢相关指标,发现联合芪棱汤治疗较常规治疗能更好抑制与糖脂代谢相关的内脂素高表达,从而降低FPG、2 h PBG、HbA1c、TAG 及 LDL 水平, 说明芪棱汤可能通过抑制内脂素水平改善糖脂代谢紊乱,延缓或降低动脉粥样硬化的程度,改善脑梗死患者的临床症状、证候积分及预后,为临床用药提供了新的选择。
[1] Shen Jianmin.Latest progress of drugs used in Type-2 Diabetes Mellitus Treatment[J].Chin J Mod Appl Pharm,2011,28(4):311-314.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010 年版)[J].中国医学前沿杂志:电子版,2011,3(6):54-109.
[3] 中华医学会.全国第4届脑血管病学术会议.各类脑血管疾病的诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[4] 中华医学会神经病学分会.2014年中国急性缺血性脑卒中诊治指南[J].中华神经科杂志,2015,48(4):246-257.
[5] 全国第4次脑血管病学术会议.脑卒中患者临床神经功能缺损程度评分标准[J].中国实用内科杂志,1997,15(5):313.
[6] 王学群,胡燕明,李强,等.新诊断2型糖尿病患者血浆内脂素水平变化研究[J].实用心脑肺血管病杂志,2010,18(9):1212-1213.
[7] Sarwar N,Gao P,Seshasai SR,et al.Diabetes mellitus,fasting blood glucose concentration,and risk of vascular disease:a collaborative meta-analysis of 102 prospective studies [J].Lancet,2010,375(9733):2215-2222.
[8] Beckman JA,Creager MA,Libby P.Diabetes and atherosclerosis:epidemiology, pathophysiology, and management[J].JAMA,2002,287(19):2570-2581.
[9] Akomolafe A,Beiser A,Meigs JB,et al.Diabetes mellitus and risk of Developing Alzheimer disease:Results from the Framingham Study[J].Arch Neurol,2006,63(11):1551-1555.
[10]Barthel P,Bauer A,Muller A,et al.Reflex and tonic autonomic markers for risk stratification in patients with type 2 diabetes surviving acute myocardial infaraction[J].Diabetes Care,2011,34(8):1833-1837.
[11]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mimics the effects of insulin[J].Science(New York,N.Y),2005,307(5708):426-430.
[12]刘蓉.血清内脂素水平与2型糖尿病患者动脉粥样硬化关系探讨[J].淮海医药,2013,31(6):480-482.
[13] Jee-Young Kim,Bae YH,Bae MK,et al.Visfatin through STAT3 activation enhances IL-6 expression that promotes endothelial angiogenesis[J].Biochim Biophys Acta,2009,1793(11):1759-1767.
[14] Nourbakhsh Mitra,Nourbakhsh Mona,Gholinejad Zafar,et al.Visfatin in obese children and adolescents and its association with insulin resistance and metabolic syndrome[J].Scand J Clin Lab Invest,2015,75(2):183-188.
[15] Yin H,van der Veer E,Frontini MJ.Intrinsic directionality of migrating vascular smooth muscle cells is regulated by NAD(+)biosynthesis[J].Journal of Cell Science,2012,125(23):5770-5780.
