三种乳源生物活性肽的二肽基肽酶-IV抑制活性研究
2018-03-26陈静李婉如李阜烁汪超范梦珠占东升李锡安张少辉
陈静 ,李婉如,李阜烁 ,汪超,范梦珠 ,占东升,李锡安,张少辉 ,2
(1.上海交通大学农业与生物学院,上海200240;2.浙江辉肽生命健康科技有限公司,浙江温州325800;3.浙江熊猫乳业集团股份有限公司,浙江温州325800)
0 引言
乳蛋白是通过降解成多肽而发挥降血糖作用,因此乳源多肽具有潜在的治疗二型糖尿病研究价值[1-3]。二型糖尿病是胰岛素相对缺乏引起的慢性代谢疾病[4]。肠促胰岛素能够促进胰岛素分泌,抑制胰高血糖素释放,刺激β细胞增殖,并维持体内葡萄糖平衡[5]。但是肠促胰岛素中的胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性促胰岛素肽(glucose-dependent insulinotropic peptide,GIP)是内源二肽基肽酶-IV(DPP-IV;EC 3.4.14.5;CD 26)的底物[6]。因此,抑制DPP-IV活性可以保护肠促胰岛素,刺激胰岛素分泌,从而治疗二型糖尿病。
本文建立了体外DPP-IV筛选模型,研究了三种乳源多肽的DPP-IV抑制活性及其半抑制浓度(IC 50),并对DPP-IV抑制肽的抑制类型进行研究。同时探讨了复合肽的抑制作用,为乳源多肽的降血糖功能食品开发奠定了基础。
1 实验
1.1 材料与试剂
人克隆结肠腺癌细胞(Caco-2细胞);合成肽LPLP、QEPV、DELQ和IPI(纯度>95%;对硝基苯胺(4-Nitroaniline);甘氨酰-脯氨酰-对硝基苯胺-对甲苯磺酸盐(Gly-Pro-p-nitroanilidep-to luenesulfonate salt)。
1.2 仪器与设备
二氧化碳恒温培养箱;超声细胞破碎仪;超净工作台;酶标仪;高速冷冻离心机;倒置显微镜;电子天平;移液枪。
1.3 方法
1.3.1Caco-2细胞培养和DPP-IV提取
将Caco-2细胞用含10%、1%非必需氨基酸、1%谷氨酰胺的DM EN高糖培养基配制成1.5×105个细胞/mL浓度的细胞悬浮液,并将细胞悬浮液以1mL/孔接种于6孔板中。将接种好细胞的6孔板于37℃,5%二氧化碳含量和90%湿度条件下的二氧化碳恒温培养箱中培养,隔天换液一次。于倒置显微镜下观察,待细胞铺满培养板面积90%左右,每天换液,再继续培养15 d。培养结束后,用移液枪小心吸出培养液,并用PBS溶液清洗细胞层2~3次。用细胞刮刀刮下细胞层,将细胞收集于灭过菌的离心管中,并用pH值为8.3的T ris-HC l溶液清洗两次,将清洗液一并收集于装有细胞的离心管中。
将收集的细胞用超声破碎仪于冰浴下进行破碎,破碎条件为超声时间3 s,间歇时间6 s,超声90次,超声功率为250 kW。将超声破碎液于4℃、10 000 g条件下离心10 min。离心后取上清液即DPP-IV提取液,待用。
DPP-IV灭活处理:取细胞破碎液于90℃水浴、20 min灭活处理。灭活后,将细胞破碎液于4℃、10 000 g条件下离心10 min,取上清备用。
1.3.2DPP-IV酶活力测定
1个酶活力单位(1U)定义为在37℃下,pH值为8.3时,底物GLy-Pro-pNA浓度为500μm ol/L,1 min内能产生浓度1μm o l/L对硝基苯胺(pNA)的DPP-IV用量。
在96孔板各孔中分别加入浓度梯度为0,0.08,0.16,0.24,0.32 mm ol/L和0.40 mm ol/L的pNA溶液,每个浓度设置6个复孔。37℃孵育30 min后于405 nm处测定吸光度(OD405nm),然后以pNA浓度为横坐标,以OD405nm为纵坐标绘制标准曲线。
96孔板各孔中分别加入 10,20,30,40μL和50μL DPP-IV提取液,每个浓度设置4个复孔,再向各孔加入50μL浓度为500μm o l/L的GLy-Pro-pNA溶液,并用pH值为8.3的T ris-HC l溶液补充各孔溶液体积至125L(空白对照用Tris-HC l溶液代替DPP-IV提取液)。37℃孵育30 min后于405 nm处测定吸光度(OD405nm),并根据标准曲线计算酶活力。
1.3.3单一生物活性肽DPP-IV抑制率测定
向96孔板各孔中加入50μL DPP-IV提取液,再分别加入25μL质量浓度为0.0625,3.91,7.81,15.63,31.25,46.88μg/mL和62.50μg/mL的IPI溶液,每个质量浓度设置4个复孔,再加入50 L浓度为500μm o l/L的GLy-Pro-pNA溶液(空白对照用pH值为8.3的T ris-HC l溶液代替IPI溶液;阴性对照组加入灭活DPP-IV提取液),37℃孵育30 min后于405 nm处测定吸光度(OD405nm)。根据以下公式计算抑制率,即抑制率=[(阴性对照组OD405nm-空白对照组OD405nm)-(抑制剂OD405nm-抑制剂空白对照组OD405nm)]/(阴性对照组OD405nm-空白对照组OD405nm)×100%。
向96孔板各孔加入50μL DPP-IV提取液,再分别加入25 L质量浓度为0.5 mg/mL、1.0 mg/mL、2.5mg/mL和6.25mg/mL的LPLP溶液、QEPV溶液和DELQ溶液,每个质量浓度设置4个复孔,最后加入50μL浓度为500μm o l/L的GLy-Pro-pNA溶液(空白对照用pH值为8.3的T ris-HC l溶液代替多肽溶液;阴性对照组加入灭活DPP-IV提取液)。37℃孵育30 min后于405 nm处测定吸光度(OD405nm),按照上述公式计算抑制率。
1.3.4单一生物活性肽的DPP-IV抑制类型的测定
用pH 8.3的T ris-HC l溶液将GLy-Pro-pNA配制成浓度为25,50,100,250,500μm ol/L和1 000μm ol/L溶液,将多肽LPLP和QEPV分别配制成质量浓度为0.5,1.0,2.5 mg/mL和6.25 mg/mL溶液,将所有溶液冰浴30 min。
向96孔板各孔中加入50 L DPP-IV提取液,再分别加入50 L各个浓度的底物GLy-Pro-pNA,每个底物浓度设置4个复孔,最后每孔加入50μL一种质量浓度多肽。对所配置的不同质量浓度的多肽重复上述加样过程。加样完成后,立即于405 nm测定OD值,设置孵育温度为37℃,前30min内,每5min测定一次OD值。根据所得OD值计算酶反应产物pNA浓度c,并以反应时间为横坐标,产物浓度为横坐标作图,用积分法计算反应初速度(V=d[c]/dt|t=0)。
对不同底物浓度时反应的初始速度[V]和各对应的初始底物浓度[S]作倒数,并以l/[V]为纵坐标,以1/[S]为横坐标作回归曲线,并拟合回归方程,根据Line weaver-Burk双倒数作图法公式l/[V]=K’m/V’max×1/[S]+1/Vmax即可计算得到K’m和 Vmax值。判断各个多肽的相应的抑制类型。
1.3.5复合生物活性肽的DPP-IV抑制活性的评价
配制两种肽混合溶液(LPLP∶QEPV=LPLP IC50∶QEPV IC50=0.8414∶14.4524),其中LPLP的终质量浓度分别为0.0263,0.0526,0.1052,0.2104,0.4207mg/mL和0.8414mg/mL,按混合比例加入QEPV。
向96孔板各孔加入50μL DPP-IV提取液,再分别加入25μL复合多肽溶液,每个质量浓度肽溶液设置4个复孔,最后加入 50μL的500μm ol/LGLy-Pro-pNA溶液(空白对照用Tris-HC l溶液代替多肽溶液;阴性对照组加入灭活DPP-IV提取液)。37℃孵育30min后于405 nm处测定OD值,计算两种多肽联合抑制率。
1.4 数据统计与分析
实验结果用平均值±标准差形式来表达,并用O riginPro9.2软件对多肽的DPP-IV抑制率进行回归分析。两种多肽的复合抑制作用采用Calcusyn2.0软件进行分析。
2 结果与分析
2.1 酶活力的测定结果
GLy-Pro-pNA在践行条件下被DPP-IV水解,产生在405 nm处具有强吸收峰的反应产物pNA[7]。DPP-IV提取物的体积用量与DPP-IV酶活力呈线性相关,R2=0.9968。如图1所示,细胞破碎液的用量的改变可以引起酶活力的改变,二者间的改变呈线性相关。可以根据实验结果,用Tris-HCl将DPP-IV提取液稀释为0.0015 U/mL。
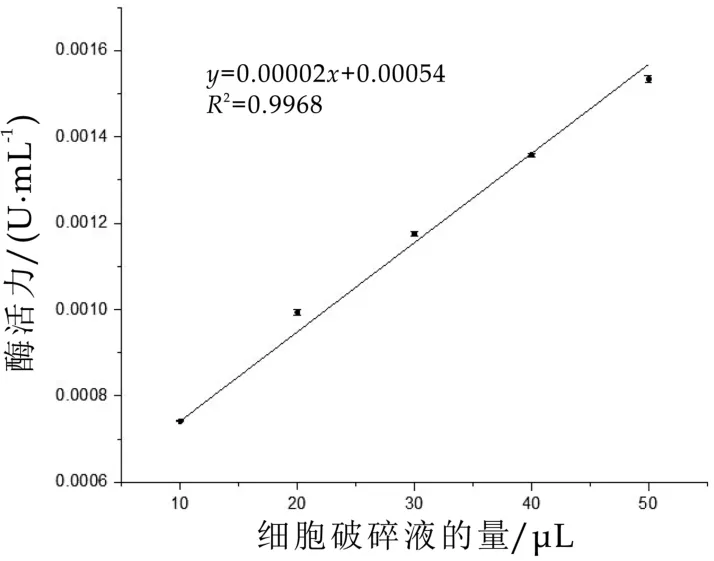
图1 细胞破碎液体积-酶活力相关性曲线
2.2 模型验证
IPI是DPP-IV的一种抑制剂,本课题用IPI来作为验证DPP-IV抑制剂筛选模型的阳性对照药物[8]。以IPI浓度为横坐标,抑制率为纵坐标,作回归曲线,并拟合得到回归方程。如图2显示,DPP-IV抑制率随着IPI浓度的增加而增加。根据回归方程计算IPI IC50值为(31.51±1.51)μg/mL,与文献报道[9]的一致。因此,该模型可以应用于DPP抑制剂的筛选以及DPP-IV抑制剂动力学研究。
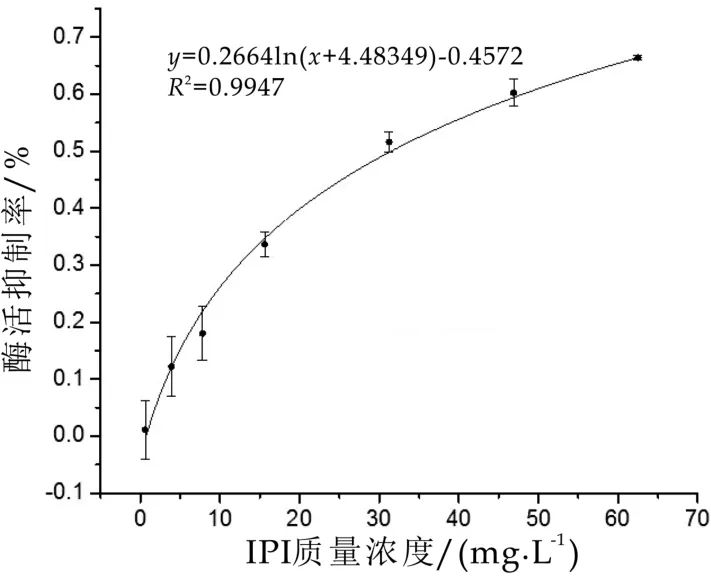
图2 IPI对DPP-IV的抑制活性剂量效应曲线
2.3 LPLP,QEPV和DELQ抑制活性的测定
根据所建立模型的方法,测定各个质量浓度多肽所对应的抑制率,以多肽质量浓度为横坐标,抑制率为纵坐标,作回归曲线,并拟合得到回归方程。如图3,根据回归方程计算LPLP和QEPV的IC50值分别为(0.84±0.06)mg/mL和(14.45±1.07)mg/mL。如图3,根据回归方程计算得DELQ的IC50值大于100 mg/mL,即DELQ对DPP-IV抑制作用不明显。有研究结果表明多数多肽链氮末端倒数第二位含有脯氨酸的多肽可以作为DPP-IV酶的底物[10]。多肽链碳末端倒数第一位含有脯氨酸的二肽是DPP-IV抑制剂,实验证明具有同样构造的部分三肽和四肽也是DPP-IV抑制剂[11]。本实验结果与文献一致,肽链氮末端第二位或者氮末端第一位含有脯氨酸的LPLP和QEPV对DPP-IV具有抑制作用。
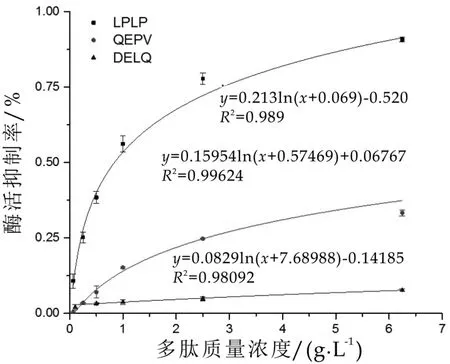
图3 三种生物活性肽对DPP-IV抑制作用的剂量效应曲线
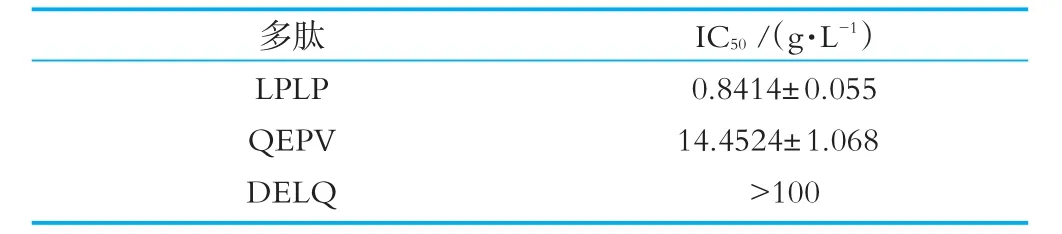
表1 生物活性肽对DPP-IV抑制活性的IC50
2.4 LPLP和QEPV抑制类型
动力学层面,酶抑制类型主要可以分成竞争性抑制、非竞争性抑制、无竞争抑制和混合抑制四种类型[12]。根据实验所得不同浓度的底物[s]与所对应的加了不同质量浓度多肽的DPP-IV水解底物速度[v],采用Linew eaver-Burk双倒数作图法,得到如图6和图7所示LPLP和QEPV对DPP-IV抑制作用的动力学曲线。结合米氏方程y=Km/Vmax×x+1/Vmax[13]
和Linew eaver-Burk双倒数图计算得到如表2所示的米氏常数(Km)和Vmax。Vmax是底物浓度达到最大时的反应速率,而Km是与底物结合酶的亲和力成反比的值[13]。无论反应中是否有多肽存在Km的变化没有显著性差异(P≥0.05),而Vmax值随着多肽质量浓度的增加呈现显著减小。Vmax随着抑制剂浓度的增加显著减小而K m没有随着浓度的变化呈现显著的变化,则该抑制剂在反应中的抑制类型是非竞争性抑制[14],所以根据实验结果表明LPLP和QEPV对DPP-IV的抑制类型是非竞争性抑制作用。实验结果说明LPLP和QEPV并非是通过与DPP-IV与底物作用的活性中心结合,而是在DPP-IV活性部位以外的部位与DPP-IV结合使得酶-底物-抑制剂复合物不能释放出产物,从而达到抑制DPP-IV活性的目的。
2.5 复合生物活性肽的DPP-IV抑制活性的评价
采用周氏中效原理[15]并用Calcusyn2.0软件对单一四肽LPLP、QEPV和复合多肽的DPP-IV抑制效果进行分析。如图7所示,对DPP-IV的活性抑制作用受到LPLP和QEPV剂量的影响,且据图可以计算出LPLP和QEPV混合肽对DPP-IV抑制活性的IC50值。观察到在相同剂量下,单一多肽和复合的抑制效率从大到小依次为混合肽(LPLP∶QEPV=LPLP IC50:QEPV IC50)>LPLP>QEPV。用等效应法分析两种酶
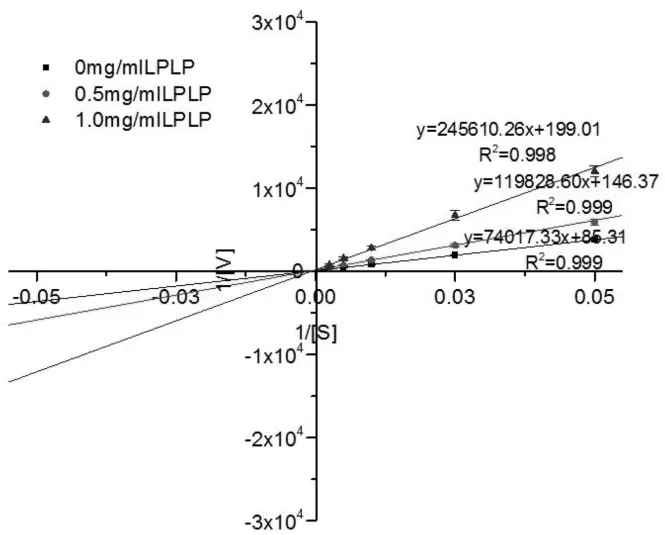
图5 LPLP抑制DPP-IV的双倒数图(Line weaver-Burk plots)
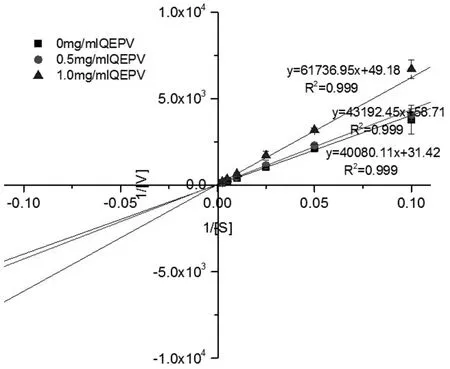
图6 QEPV抑制DPP-IV的双倒数图(Lineweaver-Burk plots)
抑制剂的联合作用,将两种酶抑制的ED 50、ED 75和ED 90坐标轴的横纵坐标上的端点,将对应的ED 50、ED 75或ED 90两点间以直线相连,再将联用后的酶抑制剂的ED 50、ED 75和ED 90作为横纵坐标描点,若所描的联合作用的点位于直线下方则为两种酶抑制剂间为协同作用;若位于直线上则两种酶抑制剂间为加和作用;若在直线上方则二者为拮抗作用[16]。图8所示,ED 50、ED 75和ED 90处两种多肽复合作用的点均在LPLP和QEPV单独作用的等效直线下方,说明LPLP和QEPV联合作用于DPP-IV是协同作用。药物联合指数(CI,Combination Index)的大小可以判定药物联合的相互作用,C I<1表示两种药物之间的相互作用是协同作用;C I=1,,表示两种药物之间的相互作用是加和作用;CI>1,表示两种药物之间的相互作用是拮抗作用[17]。表3中,两种多肽联合作用在ED 50、ED 75和ED 90处的 C I分别为 0.68024、0.74039和0.81724,均小于1,说明LPLP和QEPV作为DPP-IV竞争性抑制剂协同作用于DPP-IV并非简单的相加抑制作用,而是协同作用。因此,两种多肽的协同作用的效果优于单一多肽的作用效果。
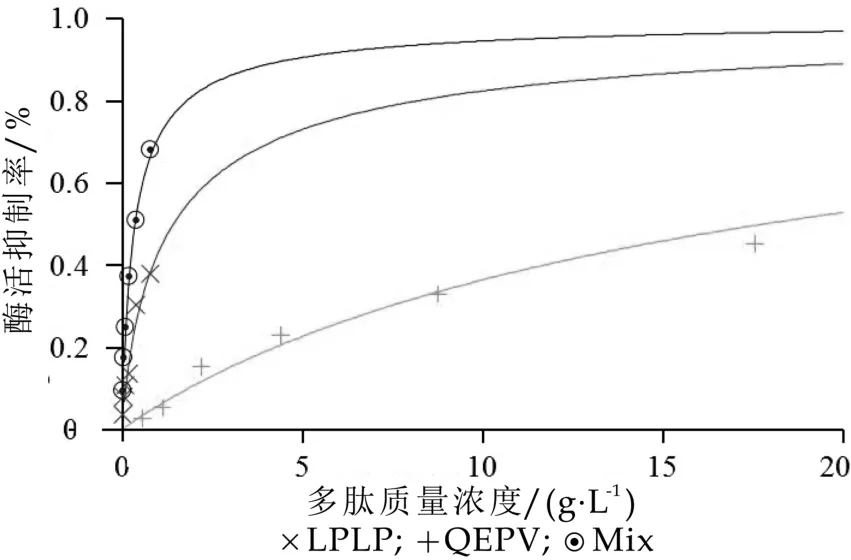
图7 单一肽(LPLP、QEPV)及混合肽对DPP-IV抑制作用的剂量效应曲线
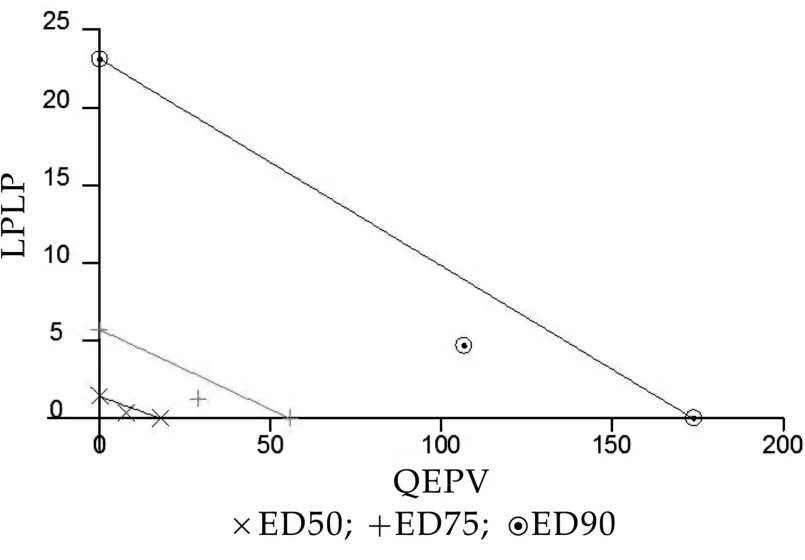
图8 LPLP和QEPV相互作用的等效曲线
3 结论
目前关于DDP-IV抑制剂的体外筛选主要采用纯化的DPP-IV进行,而本实验直接采用的细胞破碎液DPP-IV粗提物能够模拟细胞内复杂的环境,并验证了阳性对照物IPI对DPP-IV抑制作用,成功地建立了DPP-IV抑制剂体外筛选模型。然后采用建立的DPP-IV抑制剂筛选模型测定了三种多肽LPLP、QEPV和DELQ的DPP-IV抑制活性,并对实验结果

表2 LPLP和QEPV抑制DPP-IV酶动力学参数K m和 V max
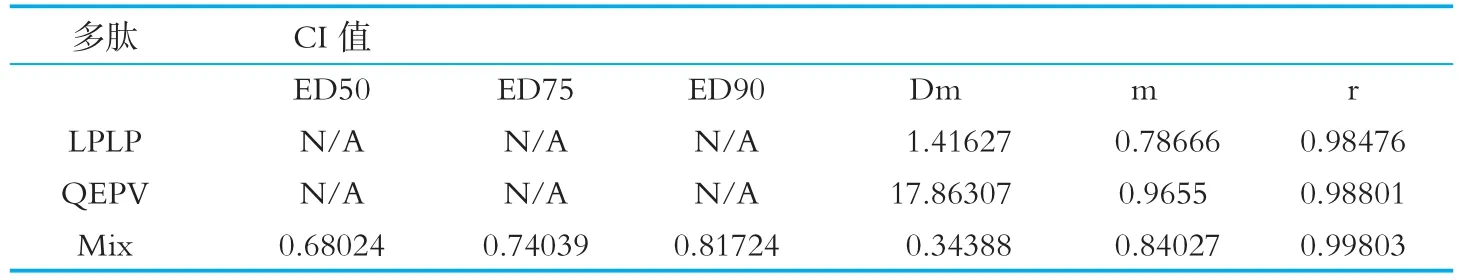
表3 单一肽和多肽复合的剂量效应关系
中具有DPP-IV抑制活性的LPLP和QEPV的抑制动力学进行研究,发现LPLP和QEPV是通过与DPP-IV活性部位结合达到抑制其活性的作用。而这两种多肽的肽链上均含脯氨酸,由此推断,含脯氨酸的多肽的构型与DPP-IV活性抑制相关。采用周氏中效原理对两种多肽联用对DPP-IV抑制活性进行研究,发现复合多肽的作用效果高于单一活性肽对DPP-IV活性的抑制作用,从而达到有效抑制DPP-IV活性的目的。本文为开发生物活性肽在DPP-IV抑制活性和降血糖方面的应用奠定了基础。然而,生物活性肽进入体内后的环境更为复杂,所以需要进一步开展动物实验研究生物活性肽的体内DPP-IV活性抑制作用和降血糖效果。
参考文献:
[1]REZAEIM,SANAGOO A,JOUYBAR IL,et al.The Effect of Probiotic Yogurt on Blood Glucose and cardiovascular Biomarkers in Patients with Type II Diabetes:A Randomized Controlled Trial[J].Evidence Based Care,2017,6(4):26-35.
[2]DIAZ-LOPEZ A,BULLO M,MARTINEZ-GONZALEZ M A,et al.Dairy product consumption and risk of type 2 diabetes in an elderly Spanish Mediterranean population at high cardiovascular risk[J].European Journal of Nutrition,2016,55(1):349-360.
[3]POWER O,NONGONIERMA A B,JAKEMAN P,et al.Food protein hydrolysatesasa source of dipeptidyl peptidase IV inhibitory peptides for the management of type 2 diabetes[J].Proceedingsof the Nutrition Society,2014,73(01):34-46.
[4]LImg E,BRUBAKER P L.Glucagon-like peptide1 secretion by the L-cell[J].Diabetes,2006,55(Supplement2):S70-S77.
[5]DRUCKER D J.The biology of incretin hormones[J].Cell Metabolism,2006,3(3):153-165.
[6]LACROIXIM E,LI-CHAN E C Y.Isolation and characterization of peptides with dipeptidyl peptidase-IV inhibitory activity from pepsin-treated bovinewhey proteins[J].Peptides,2014,54:39-48.
[7]DUKE-COHAN JS,MORIMOTO C,ROCKER JA,etal.A novel form of dipeptidylpeptidase IV found in human serum.Isolation,characterization,and comparison with Tlymphocytemem brane dipeptidylpeptidase IV(CD26)[J].Journalof Biological Chemistry,1995,270(23):14107-14114.
[8]TULIPANO G,SIBILIA V,CAROLIA M,et al.Whey proteins as source of dipeptidyl dipeptidase IV(dipeptidyl peptidase-4)inhibitors[J].Peptides,2011,32(4):835-838.
[9]YOGISHA S,RAVEESHA K A.Dipeptidyl Peptidase IV inhibitory activity ofMangifera indica[J].JNat Prod,2010,3:76-79.
[10]NONGON IERMA A B,FITZGERALD R J.Susceptibility ofm ilk protein-derived peptidesto dipeptidylpeptidase IV(DPP-IV)hydrolysis[J].Food Chemistry,2014,145:845-852.
[11]NONGONIERMA A B,FITZGERALD R J.Inhibition of dipeptidyl peptidase IV(DPP-IV)by proline containing casein-derived peptides[J].Journal of Functional Foods,2013,5(4):1909-1917.
[12]SUBRAMAN IAN M,TRACY T S.Drug–Drug Interactions1:Inhibition[J].Encyclopedia of Drug Metabolism and Interactions.
[13]BLOKH D,AFR IMZON E,STAMBLER I,et al.Breast cancer detection by Michaelis–Menten constants via linear programming[J].Computer Methods and Programs in Biomedicine,2007,85(3):210-213.
[14]NONGONIERMA A B,FITZGERALD R J.Dipeptidyl peptidase IV inhibitory and antioxidative properties of milk protein-derived dipeptides and hydrolysates[J].Peptides,2013,39:157-163.
[15]CHOU T C,TALALAY P.Quantitative analysisof dose-effect relationships:the combined effects of multiple drugsor enzyme inhibitors[J].Advancesin Enzyme Regulation,1984,22:27-55.
[16]PANDITA A,KUMAR B,MANVATIS,etal.Synergistic combination of gemcitabine and dietary molecule inducesapoptosis in pancreatic cancer cells and down regulates PKM 2 expression[J].PloS One,2014,9(9):e107154.
[17]CHOU T C.Theoretical basis,experimental design,and computerized simulation of synergism and antagonismin drug combination studies[J].Pharmacological Reviews,2006,58(3):621-681.
